Smad3基因剔除的骨髓细胞移植对小鼠的影响
2010-09-11陈静沈红赵勇
陈静,沈红,赵勇
(1.北京农学院动物科学技术系,北京 102206;2.中国科学院动物研究所生物膜与膜生物工程国家重点实验室,北京 100101)
研究报告
Smad3基因剔除的骨髓细胞移植对小鼠的影响
陈静1,2,沈红1,2,赵勇2
(1.北京农学院动物科学技术系,北京 102206;2.中国科学院动物研究所生物膜与膜生物工程国家重点实验室,北京 100101)
目的 通过小鼠骨髓细胞剔除Sm ad3基因,观察小鼠病理变化以及免疫T细胞状态。方法将Sm ad3基因剔除Sm ad3-/-)的小鼠骨髓细胞和野生型(Sm ad3+/+)小鼠骨髓细胞分别移植给60Co射线照射GFP小鼠。观察骨髓移植后GFP小鼠体征变化,第6周处死小鼠,取肠道固定,HE染色观察其病理变化,流式细胞技术检测淋巴结中T细胞变化。结果移植Sm ad3-/-骨髓细胞的GFP小鼠逐渐消瘦,大肠出现炎症;淋巴结中活化型的CD 4+CD 62LloT细胞增多。结论骨髓细胞TGF-β信号受阻,可导致小鼠患炎症疾病,引起免疫T细胞活化。
Sm ad3基因剔除-;骨髓细胞;T细胞活化;移植
Sm ad3基因调控S MAD 3表达,S MAD 3是转化生长因子-β(transfor m ing grow th factor-β,TGF-β)受体的底物之一,将TGF-β与其受体结合后产生的信号从细胞质转导到细胞核内[1]。哺乳动物体内, TGF-β有3种亚型:TFG-β1、TFG-β2和TFG-β3[2]。TFG-β1主要在免疫系统表达,调节T细胞的发育、稳定、活化以及耐受等[3,4],TGF-β2与TGF-β3在免疫系统表达不稳定[5]。细胞表面TGF-β受体有三种亚型,即TGF-βI型受体、TGF-βII型受体和TGF-βIII型受体,TGF-βI型和II型受体是TGF-β信号通路必须的[6]。TGF-β首先与II型受体结合形成复合物,这种复合物使I型受体聚集并磷酸化,然后TGF-βI型受体胞内区使S MAD2或S MAD 3磷酸化并形成复合物,然后这种复合物与Sm ad4蛋白结合,进入细胞核,调节特定靶基因的转录[7]。研究发现Sm ad3基因剔除(Sm ad3-/-)小鼠由于免疫缺陷在1~8个月内死亡,通过表型分析发现Sm ad3-/-小鼠发生渐进性的白细胞增多症、牙周炎、胃炎、肠炎以及黏膜表面形成脓肿,通过分析淋巴结T细胞免疫表型发现T细胞活化[8]。本实验试图通过在小鼠骨髓细胞剔除Sm ad3基因,观察小鼠是否也会出现疾病症状,T细胞是否也被活化,以便探讨Sm ad3基因剔除(Sm ad3-/-)与发病的相关性。
1 材料与方法
1.1 动物
6~8周Sm ad3-/-小鼠和Sm ad3+/+小鼠(H-2d,♀),体质量18~20g,购于军事医学科学院实验动物中心(STXK(京)2008-0012);8~10周GFP小鼠(H-2d,♀),体质量20~24g,购于上海实验动物中心(SYXK(沪)2007-0005);小鼠全为SPF级,饲料和垫料均经60Co辐照处理,饮用水经高压灭菌处理,所有小鼠饲养于中国科学院动物研究所SPF级动物房。
1.2 主要试剂与仪器
PE-Cy5-CD 4 mAb,PE-CD 8 mAb,PE-CD 62L mAb均购自BD B iosciences Phar m ingen公司。FASCalibu r流式细胞仪(Becton D ickinson),台式冷冻离心机(德国Heraeus),光学显微镜(日本O lympus)XG-1型照相机(M inolta日本)。
1.3 嵌合体小鼠模型的建立
1.3.1 GFP小鼠预处理:移植前4~5 h,正常GFP小鼠接受60Co全身照射7.5 Gy,剂量率为1 Gy/m in。
1.3.2 骨髓细胞制备:分别取Sm ad3-/-小鼠及Sm ad3+/+小鼠,颈椎脱臼致死,无菌剥取胫骨、股骨和髂骨,收集骨髓细胞,1600 r/m in,离心6 m in,弃上清,加红细胞裂解液消化,1640培养液洗3次,计数,将骨髓细胞调为7.2×106个/m L。
1.3.3 骨髓移植:取经照射处理的GFP小鼠,静脉注射骨髓细胞7.2×106个/只。
1.3.4 实验分组:分为2组,每组4只。对照组为Sm ad3+/+骨髓细胞移植给照射后GFP小鼠,实验组为Sm ad3-/-骨髓细胞移植给照射后GFP小鼠。
1.4 观察小鼠临床表现
观察GFP鼠移植骨髓细胞后精神状态、毛发、体重、活动等。
1.5 病理学检查
第6周小鼠颈椎脱臼致死,剖开腹腔取小鼠的盲肠、横结肠、直肠,用10%中性福尔马林固定,制成石蜡切片(厚5μm),HE染色,光镜下观察小鼠盲肠、结肠、直肠的组织学变化。
1.6 T细胞检测
骨髓移植后第6周小鼠颈椎脱臼致死,取小鼠淋巴结制备单细胞悬液,加入FACS缓冲液(PBS+ 0.1%BSA+0.2%Na3N),将细胞稀释成4×106个/mL;取100μL悬浮的细胞,加入不同荧光标记的抗体各10μL,混匀,4°C孵育30 m in;加FACS缓冲液,1700 r/m in,离心5 m in,洗去游离抗体;重悬细胞,上流式细胞仪检测,CellQuest softw are进行结果分析。
1.7 统计学分析
2 结果与分析
2.1 骨髓移植后小鼠临床表现
骨髓移植后对照组小鼠开始出现精神萎靡、嗜睡、活动及进食减少症状,7d左右精神与活动逐渐恢复,所有小鼠6周内生存状况良好。实验组小鼠骨髓移植第1周表现与对照组相似。第2周以后小鼠逐渐出现毛发杂乱,失去光泽,背部脱毛;弓背;耳朵溃烂;部分小鼠有软便甚至腹泻,粪便颜色发黑。
2.2 骨髓移植后小鼠体重变化
移植骨髓细胞后小鼠每周称重,结果用移植后小鼠体重占最初体重的百分比表示,结果见图1。由图1知,对照组小鼠体重百分比变化不大,体重基本稳定。实验组小鼠从第1周开始体重逐渐减轻,至第6周时体重百分比从100%下降至77.5%,平均减轻22.5%。
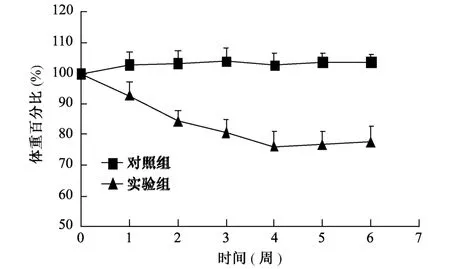
图1 骨髓移植后小鼠体质量变化F ig.1 The changes of bodyweight in the m ice after transfusion of bone m arrow cells.
2.3 骨髓移植后小鼠肠道剖检变化
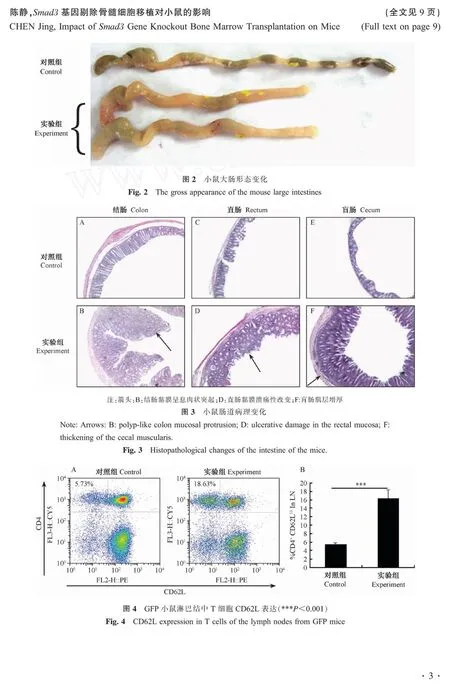
骨髓移植后第6周处死所有小鼠,剖开小鼠腹腔,取出肠道,肉眼观察肠道变化,发现对照组小鼠小肠未见异常,盲肠到直肠也为出现明显病变(图2上);实验组小鼠小肠无明显病变,盲肠到直肠水肿,充血,肠壁增厚,结肠肠管变形缩短(图2下)。图2见彩插3。
2.4 骨髓移植后小鼠肠道组织病理变化
HE染色小鼠肠道,组织病变结果见图3。由图3知,对照组小鼠盲肠、结肠、直肠都未发生明显病变(A、C、E)。实验组小鼠结肠、直肠、盲肠都发生明显病变,肠道病变主要集中在上皮,表现为上皮腺体层增厚,黏膜层有大量的炎性细胞浸润(B、D、F);结肠黏膜形成息肉状突起(B箭头所示),直肠黏膜有溃疡(D箭头所示);盲肠肠道肌层增厚(F箭头所示)。图3见彩插3。
2.5 骨髓移植后小鼠淋巴结中T细胞变化
GFP小鼠细胞均表达绿色荧光蛋白,Sm ad3小鼠来源的细胞不表达绿色荧光蛋白,所以试验分析GFP小鼠淋巴结中GFP阴性T细胞,即供者骨髓细胞发育成熟的T细胞,流式细胞仪分析结果显示GFP小鼠淋巴结细胞中GFP阴性细胞的比例是98%±1%(数据没有显示)。用抗小鼠PE-CY5-CD4抗体和PE-CD62L抗体对淋巴结细胞染色的结果见图4A,左上象限的一群细胞是CD 4+CD 62LloT细胞,从图中可以看出实验组小鼠淋巴结细胞中CD4+CD62LloT细胞的比例明显增大(图4B)。图4见彩插3。
3 讨论
Sm ad3蛋白是TGF-β信号转导细胞内信号分子,Sm ad3蛋白缺失,TGF-β/Sm ad3信号通路就被阻断了[8]。Sm ad3-/-小鼠体内所有类型的细胞内均不表达Sm ad3蛋白,即所有细胞TGF-β/Sm ad3信号通路都被阻断。GFP小鼠经60Co射线全身照射7.5 Gy以后,损伤骨髓、脾和淋巴结等生成血细胞的造血器官,骨髓细胞基本被清除,血液中的白细胞液急剧减少。本实验把Sm ad3-/-小鼠的骨髓细胞移植给经60Co射线清髓处理的GFP小鼠,来源于Sm ad3-/-小鼠的骨髓细胞在GFP小鼠体内生长、发育、分化,重建GFP小鼠的造血系统。实验观察到移植了Sm ad3-/-骨髓细胞的GFP小鼠1周以后渐渐出现弓背、脱毛、腹泻、体重下降等症状;组织病理检查发现大肠出现炎症,说明GFP小鼠重建的TGF-β/Sm ad3信号缺失的造血系统导致小鼠患病。
研究TGF-β1信号分子在造血和免疫系统中的作用,主要针对3类靶分子进行基因干预:TGF-β (使内源性分泌缺失)、TGF-β受体(使细胞对TGF-β的反应性消失)和胞内信号分子Sm ads(使信号传递受阻)。在胚胎干细胞敲除Tgfb1(TGF-β1 gene),出生的小鼠体内没有内源性TGF-β1,2~3周内正常发育,但随后很快出现消耗、衰竭症状,3~4周内死亡,组织学分析发现小鼠心脏、胃、肝、肺、胰腺、唾液腺等多系统有不同程度的混合炎性细胞浸润和组织坏死,而皮肤、胸腺、骨髓没有明显的炎症累及,同时检测到大量的T细胞活化扩增[9,10]。由于TGF-β1可调节多种类型的细胞,不能确定小鼠疾病是免疫功能紊乱引起的。后来的研究利用显性负效转基因技术,使发育正常的小鼠在成体水平特异性在T细胞上缺失TGF-βII型受体(T细胞上仍然表达TGF-βII型受体,只是受体胞内区不起作用),小鼠发生淋巴细胞增殖综合征和免疫病理变化,病变主要发生在黏膜器官,例如肺和结肠,与Tgfb1-/-小鼠相比,这些小鼠的疾病症状时间上明显延迟出现,并且这些病症没有特征,例如心肌炎、血管炎和肝炎[11]。又有研究在T细胞上条件性敲除Tgfbr2(TGF-βrecep ter II gene),小鼠患有与Tgfb1-/-小鼠组织受损程度相似的同样严重的自身免疫疾病,肺脏、胃、肝脏、胰脏、心脏和血管是受影响较大的组织,在肉眼可见和组织学水平,受损都相当严重[3,12]。基因干预TGF-β细胞内信号分子Sm ads蛋白,已有的研究主要是在胚胎干细胞敲除Sm ad2、Sm ad4和Sm ad3基因。Sm ad2或Sm ad4基因敲除,导致小鼠在胚胎期死亡[13,14]。Sm ad3基因剔除小鼠可以活到成年,但是也发生多器官炎症,在1~8月内死亡[8]。本研究观察到移植了Sm ad3-/-骨髓细胞的GFP小鼠1周以后渐渐出现弓背、脱毛、腹泻、体重下降等症状,并且伴有肠炎,这些症状与Sm ad3基因剔除小鼠的症状相似,并且再一次证明Sm ad3基因剔除,容易导致结肠炎[15];与Tgfb1-/-小鼠症状相似都出现消耗衰竭症状,与TGF-β受体缺失小鼠的症状也相似,都出现结肠发生炎症。
CD 62L是一种粘附分子,静息的淋巴结T细胞上高表达CD 62L(CD 62Lhigh,CD 62Lhi),T细胞活化以后CD62L的表达降低(CD 62Llow,CD 62Llo),淋巴结中具有CD 4+CD 62Llo表型的T细胞增多,提示了淋巴结CD 4+T细胞活化,这种T细胞表型与Sm ad3-/-小鼠淋巴结T细胞的表型变化一致。活化的T细胞浸润肠道黏膜,很可能是造成结肠炎的原因[16]。
(本文图2~4见彩插3。)
[1] Shi Y,M assague J.M echanism s of TGF-beta signaling from cell membrane to the nucleus[J].Cell,2003.113(6):685-700.
[2] Derynck R,Zhang YE.Smad-dependent and Smad-independent pathways in TGF-beta fam ily signalling[J].Nature,2003.425 (6958):577-584.
[3] L iMO,Sanjabi S,Flavell RA.Transform ing grow th factor-beta contro ls developm ent,hom eostasis,and to lerance of T cells by regu lato ry T cell dependent and independent m echanism s[J]. Imm unity,2006.25(3):455-571.
[4] L iMO,FlavellRA.TGF-beta:a m aster of all T cell trades[J]. Cell,2008.134(3):392-404.
[5] Gorelik L,Flavell RA.Transform ing grow th factor-beta in T-cell bio logy[J].Nat Rev I mm uno l,2002.2(1):46-53.
[6] ten D ijke P,H ill CS.New insigh ts into TGF-beta-Sm ad signalling[J].TrendsB iochem Sci,2004.29(5):265-273.
[7] Held in CH,M iyazono K,ten D ijke P.TGF-beta signalling from cell m em b rane to nucleus through S MAD p roteins[J].Nature, 1997.390(6659):465-471.
[8] Yang X,Letterio JJ,Lech leider RJ,et al.,Targeted disrup tion of S MAD 3 resu lts in impaired m ucosal imm unity and d im inished T cell responsiveness to TGF-beta[J].Em bo J,1999.18(5): 1280-1291.
[9] Shu llMM,O r m sby I,Kier A,et al.Targeted disrup tion of the mouse transform ing grow th fac tor-β1 gene resu lts in m u ltifocal inflamm atory disease[J].Nature 1992,359:693-699.
[10] Kulkarni AB,Huh CG,Becker D,et al.Transfor m ing grow th factor beta 1 nu llm utation in m ice causes excessive inflamm atory response and early death[J].Proc NatlA cad SciU SA,1993. 90(2):770-774.
[11] Gorelik L,Flavell RA.Abrogation of TGFbeta signaling in T cells leads to spontaneous T cell differentiation and autoimm une disease[J]. Immunity,2000,12(2):171-181.
[12] M arie JC,L iggittD,Rudensky AY.Cellu larm echanis m sof fatal early-onset au toimm unity inm icew ith the T cell-specific targeting of transfo rm ing grow th factor-βrecep tor[J]. Imm unity,2006, 25:441-454.
[13] Sirard C,de la Pompa JL,Elia A,et al.The tumor supp resso r gene Sm ad4/Dpc4 is required for gastru lation and later fo r anterior developm ent of the mouse em bryo[J].Genes Dev, 1998.12(1):107-119.
[14] W ald rip WR,B ikoff EK,Hood less PA,et al.Sm ad2 signaling in extraem bryonic tissues determ ines an terior posterior po larity of the earlymouse em bryo[J].Cell,1998,92(6):797-808.
[15] Zanninelli G,Vetuschi A,Sferra R,et al.Sm ad3 knock-out m ice as a usefu lmodel to study intestinal fibrogenesis[J].W o rld J Gastroen tero l,2006.12(8):1211-1218.
[16] Becker C,Fantini MC,Neurath M F.TGF-beta as a T cell regu lator in co litis and co lon cancer[J].Cytokine Grow th Fac to r Rev,2006,17(1-2):97-106.
I m pact of Sm ad3 Gene Knockou t BoneM arrow Tran sp lan ta tion on M ice
CHEN Jing1,2,SHEN Hong1,2,ZHAO Yong2
(1.Departm ent ofAnim al Science and Techno logy;BeijingUniversity of Agricu lture,Beijing 102206,China; 2.State key Laboratory ofB iom em brane andM em brane B iotechno logy,Institute of Zoo logy, Chinese A cadem y of Sciences,Beijing 100101)
O b jective To investigate the changes of T cells and disease developm ent in the m ice w ith Sm ad3 deficiency in the bone m arrow cells.M ethods Bone m arrow cells obtained from Sm ad3 nu ll(Sm ad3-/-)m ice and w ild type(Sm ad3+/+)m ice were in jected to Co60-irradiated GFP m ice,respectively.The general states of the bone m arrow recip ientswere observed.Them icewere sacrificed at the sixthweek and the histopatho logical changes in the intestineswere exam ined.The changes of T cells from lymph nodes were detected by flow cytom etry.ResultsSm ad3-/-bone m arrow recip ientm ice appeared a wasting synd rom e and intestinal inflamm ation.The amount of CD4+CD 62LloT cells in lymph nodeswas significantly increased.ConlusionThese resu lts indicate that the m ice w ith Sm ad3 deficiency in the bone m arrow cells p resen t an inflamm ato ry d iso rder and their T cells are activated.
Sm ad3-/-;bone m arrow;A ctivated T cells;Transp lantation,bone m arrow;Mouse
R457.7
A
1005-4847(2010)01-0009-04
2009-03-20
国家自然科学基金重点项目(No.30630060);北京市教委资助项目(K M 200910020006)。
陈静(1982-),女,河南省巩义市人,硕士研究生。
沈红,E-m ail:shenhong912@sina.com;赵勇,E-m ail:zhaoy@ioz.ac.cn
