大鼠肝移植术后腹腔细菌感染模型的建立与评价
2010-09-11丁隆杨宇董家鸿
丁隆,杨宇,董家鸿
(1.佳木斯大学附属第一医院普外二科,佳木斯 154003;2.佳木斯大学基础医学院局部解剖教研室,佳木斯 154007; 3.中国人民解放军总医院肝胆外科,北京 100853)
研究报告
大鼠肝移植术后腹腔细菌感染模型的建立与评价
丁隆1,杨宇2,董家鸿3
(1.佳木斯大学附属第一医院普外二科,佳木斯 154003;2.佳木斯大学基础医学院局部解剖教研室,佳木斯 154007; 3.中国人民解放军总医院肝胆外科,北京 100853)
目的 建立大鼠肝移植术后腹腔感染的模型。方法构建DA大鼠到LEW大鼠的肝移植模型,采用腹腔内细菌注射的方法建立感染模型,通过对大鼠肝功、血气、血细胞计数等各项指标的检测对模型进行综合评价。结果肝移植术后5 d注射细菌,大鼠死亡率高,不利后续研究;术后3 d注射细菌,并选定5×105cfu/mL为最终注射浓度,感染后大鼠的7d存活率累计可达到37.5%左右,随之感染的加重,大鼠状态逐渐变差,直肠温度不断升高,WBC计数也随之增加,pH下降,大鼠出现代谢性酸中毒,肝功能损害进行性加重,肝实质的损害重于胆道的损伤,大约在感染5 d左右相继死亡,多器官病理分析表明,大鼠死亡原因为肝损害,不并发肺脏、肾脏损害。结论采用的腹腔内大肠埃希菌注射建立肝移植术后腹腔细菌感染的模型是比较成功的,可用于相关领域的研究。
肝移植;细菌感染,腹腔;免疫抑制;大鼠
大鼠原位肝脏移植(orthotop ic liver transp lantation in rat,ROLT)是研究肝移植免疫的理想模型。细菌感染是肝移植术后常见的并发症,发病率较高,受到临床广泛关注。但目前针对这方面的基础研究有限,考虑与技术原因有较大关系,肝移植模型的建立要求有较为成熟的技术,另外在器官移植排斥的基础上建立细菌感染模型有一定的困难,动物死亡率高,模型的重复性差。本研究中我们以DA大鼠为供体,LEW大鼠为受体,在改良的Kam ada“二袖套”基础上[2],以腹腔内注菌的方法建立大鼠肝移植术后腹腔细菌感染的模型。
1 材料与方法
1.1 动物模型的建立
成年雄性近交系DA和LEW大鼠,各174只,体质量200~220 g,分别购于哈尔滨医科大学动物中心【SCXK(黑)2002-0002】和北京维通利华实验动物有限公司【SCXK(京)2006-0009】,并按实验动物使用的3R原则给予人道的关怀。供、受体体重差≤10 g。手术以DA大鼠为供体,LEW大鼠为受体,采用改良的Kam ada双袖套法建立大鼠肝移植动物模型,共174只。细菌购于第三军医大学军流教研室,为国标大肠埃希菌(Escherichia co li)8099。
行原位肝移植术,术后随机分为2个注射时间点:术后3d和5d给予腹腔注射细菌,每个时间点依据注射浓度不同,随机分成5个感染组,1个对照组(生理盐水注射组):G1组:注射浓度为105cfu/mL,注射量为5 m L;G2组:注射浓度为105cfu/mL,注射量为2 mL;G3组:术后3 d或5 d,腹腔内生理盐水注射2 mL;G4组:注射浓度为108cfu/mL,注射量为2 mL;G5组:注射浓度为107cfu/mL,注射量为2 mL;G6组:注射浓度为106cfu/mL,注射量为2 mL。
设菌液注射前1 d,注射后1 d、3 d、5 d、7 d共5个时相点,每个时相点6只动物,进行感染严重程度的判定;另外设8只大鼠观察感染后一般情况和受体的存活时间。
1.2 主要检测指标
1.2.1 一般情况:实验对每个自然存活组的8只受体大鼠进行一般状态观察,主要是精神状态、活动情况、饮食状况、体重增减、尿液颜色及巩膜有无黄染等现象的观察,同时记录每只大鼠的生存时间。
1.2.2 感染严重程度的判定:①直肠温度测定:大鼠处死前使其处于自然状态下测体温。将室内温度应控制在18~20℃,用胶皮管套在温度计上方约2.0 cm处,在同一时间点将体温计插入大鼠直肠内,深度为1.5~2.0 cm,3 m in后读数,连续测量3次,取平均值。②生化指标的检测:按上述采动脉血2 mL,用生化自动分析仪、血常规计数仪、血气分析仪分别检测白细胞计数(WBC);TCO2、HCO、 pH;ALT、TB等指标。③组织器官的病理学检测:各组织块以中性福尔马林溶液中固定24 h,常规石蜡包埋切片,HE染色,观察实质细胞的变化,炎性细胞的浸润。光镜下阅片。
1.2.3 感染的鉴定:动物处死后分别取腹腔沾液做细菌培养。
1.3 数据处理及统计学分析
所有数据分析均通过SAS 6.0软件进行。各组间均数的比较采用双因素方差分析进行检验,P< 0.05为相差显著,P<0.01为相差十分显著。生存时间采用软件绘制成Kap lan-M eier曲线,比较采用对数秩和检验(Log-rank)。
2 结果
2.1 一般情况观察
肝移植术后5 m in左右大鼠即清醒、站立,30 m in后能饮水;第2天各组大鼠的精神较差,有少量饮食,活动较少;第3天精神状态、活动等有所好转。
2.1.1 术后3 d注菌组:各组大鼠注菌后,精神状态明显变差,体重有不同程度下降,体温升高,被毛杂乱,无光泽,食欲差;G1组5 d左右部分鼠可出现口鼻少量出血,呈嗜睡状态,并有死亡鼠;感染后7 d大鼠生存率为37.5%(3/8),最长生存时间为感染后8 d,平均生存时间(9.25±1.24)d;G2组大鼠巩膜黄染、尿黄呈进行性加重,多于术后12 d(感染后9 d)死亡,平均生存时间(12.88±1.61)d,与G1组比差异存在显著性;G4组、G5组和G6组大鼠在细菌注射后12~48 h之内相继死亡,死亡组解剖见:腹腔内无明显腹水,肝脾肿大显著,与周围组织粘连较重,部分肝叶坏死,双肺出血。
2.1.2 术后5 d注射细菌组:G1组大鼠在术后巩膜渐进性黄染,口鼻眼角不同程度的出血,体重明显下降,体温升高,呼吸急促,活动减少,聚集成团,饮水量增加,48 h后相继死亡,平均生存时间(8.00 ±1.33)d;G2组注菌后精神差,皮毛杂乱、无光泽,眼睛周围明显充血,尿色逐渐加深,注菌72 h后,大鼠相继进入嗜睡状态,最长生存时间为术后10 d,感染后5 d,平均生存时间(8.63±1.48)d,与G1组比较有统计学意义,P<0.01。G4组、G5组和G6组大鼠在细菌注射后12~24 h之内相继死亡,存活时限较短。见图1。
G3组于术后精神状态尚可,6 d左右出现巩膜黄染,体重逐渐下降,食欲、活动均下降,多于术后13 d左右死亡,平均生存时间为(12.75±1.5)d。
从上面结果观察到:术后5 d腹腔注射组感染后大鼠存活时间较短,不利于进一步研究,因此在后续的研究中舍去。
Log-Rank卡方值=11.566;P=0.005,G1与G3组的生存时间有显著统计学差异。
2.2 体温观察
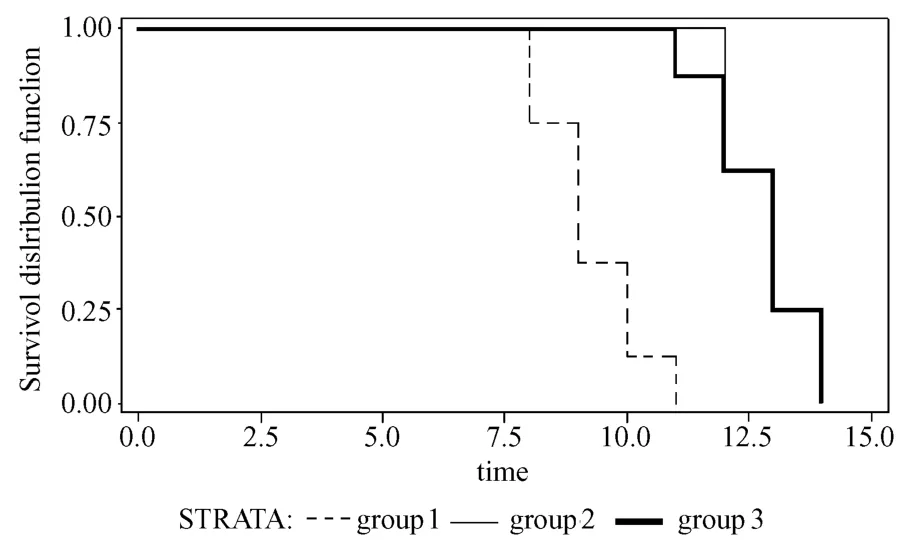
图1 术后3 d注菌组大鼠术后(感染后)生存曲线F ig.1 Survival curves of the groups w ith in jection of bacteria on day 3 after transp lantation
G1、G2组大鼠感染后体温逐渐升高,直至死亡,两组相比在术后第4天、第8天和第10天相比差异显著;G3组术后第2天,体温略有升高(与G1组相比无统计学差异),随后逐渐下降,至术后第6天左右再次升高,与G1、G2组比较有统计学差异。在组内3个实验组的各时间点与前一时间点相比均有统计学意义。见表1。
表1 术后3d腹腔细菌注射大鼠直肠温度变化比较(±s,n=8,℃)Tab.1 Comparison of the changes of rectal temperature in the ratswith injection of bacteria on day 3 after transplantation(±s,n=8,℃)
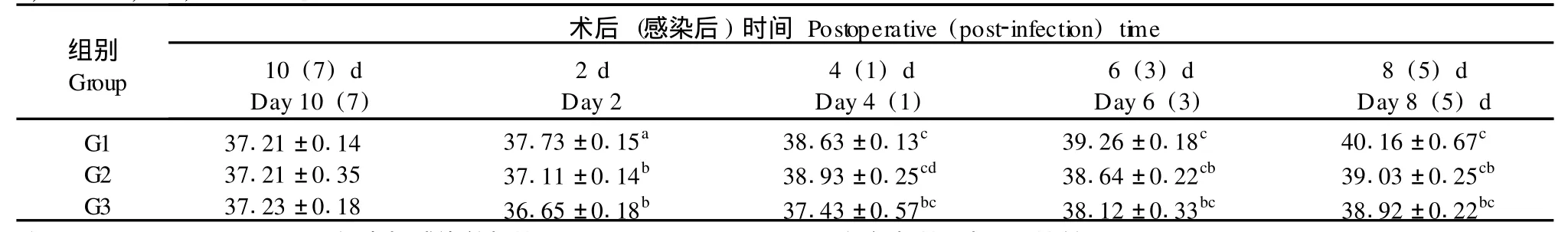
表1 术后3d腹腔细菌注射大鼠直肠温度变化比较(±s,n=8,℃)Tab.1 Comparison of the changes of rectal temperature in the ratswith injection of bacteria on day 3 after transplantation(±s,n=8,℃)
注:a:P<0.05;c:P<0.01,组内与感染前相比;b:P<0.01;d:P>0.05,组间相比(与G1比较)。Note:a:P<0.05;c:P<0.01,Compared w ith that before infection in the same group;b:P<0.01,d:P>0.05,Compared between groups(w ith group G1).
组别Group术后(感染后)时间Postoperative(post-infection)time 10(7)d Day 10(7) 2 d Day 2 4(1)d Day 4(1) 6(3)d Day 6(3) 8(5)d Day 8(5)d G1 G2 G3 37.21±0.14 37.21±0.35 37.23±0.18 37.73±0.15a37.11±0.14b36.65±0.18b38.63±0.13c38.93±0.25cd37.43±0.57bc39.26±0.18c38.64±0.22cb38.12±0.33bc40.16±0.67c39.03±0.25cb38.92±0.22bc
2.3 血常规检查
G1组大鼠术后WBC持续升高,感染后各时间点与G3组相比均有统计学差异,与G2组相比在感染3 d后各时间点相比有差异;G2组WBC在感染后先升高,感染后5 d下降,但与前一时间点及G3组相比无统计学意义;G3组则表现出先下降后升高的变化,与前一时间点相比虽无意义,但术后6、8、10 d与术后4 d相比,均有统计学差异(表2)。
表2 大鼠外周血白细胞计数比较(±s,n=8,×109/L)Tab.2 Comparison of peripheralw hite b lood cell counts in the rats(±s,n=8,×109/L)
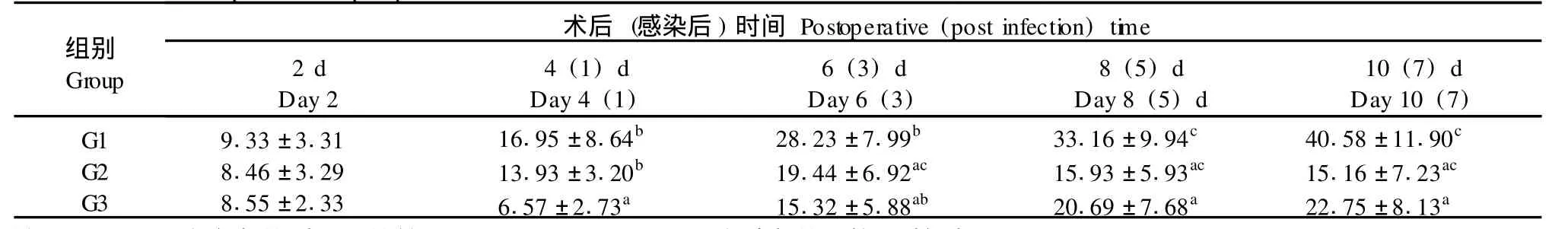
表2 大鼠外周血白细胞计数比较(±s,n=8,×109/L)Tab.2 Comparison of peripheralw hite b lood cell counts in the rats(±s,n=8,×109/L)
注:a:P<0.05,组间相比(与G1比较);b:P<0.05;c:P>0.05组内相比(前一时间点)。No te:a:P<0.05,Compared betw een groups(w ith group G1);b:P<0.05,c:P>0.05 Compared w ith that of p revious tim e pointw ithin the sam e group.
组别Group术后(感染后)时间Postoperative(post infection)time 2 d Day 2 4(1)d Day 4(1) 6(3)d Day 6(3) 8(5)d Day 8(5)d 10(7)d Day 10(7) G1 G2 G3 9.33±3.31 8.46±3.29 8.55±2.33 16.95±8.64b13.93±3.20b6.57±2.73a28.23±7.99b19.44±6.92ac15.32±5.88ab33.16±9.94c15.93±5.93ac20.69±7.68a40.58±11.90c15.16±7.23ac22.75±8.13a
2.4 血气结果
G1组大鼠在感染后的前3 d pH值有显著升高,随后下降,组内各时间点相比均有统计学意义; TCO2及HCO始终呈下降趋势,提示感染后因过度通气而导致呼吸性碱中毒,随着感染加重,出现代谢性酸中毒。HCO在组内每一时间点与前一时间点相比无差异,但与感染前相比均有意义(P< 0.01);TCO2与前一时间点相比均有意义。
G3组三种指标在组内任一时间点与前一时间点相比均无意义(P>0.05),但术后8、10 d各指标与术后2 d比较有差异,与G1相比在术后第6天各指标均有明显的统计学差异(见表3)。
2.5 肝功结果
G1组ALT、TB在术后和感染后持续上升,组内各时间点与前一时间点相比均有显著的统计学意义;G2组变化趋势类似于G1组,与G1组相比,ALT的变化无统计学意义,TB高于G1组,术后8、10 d有差异;G3组ALT、TB在术后先下降后上升,ALT的变化值低于G1组,与之相比有统计学意义,TB值则表现出高于G1组,并有明显的统计学差异(P <0.05),(见表4)。
表3 大鼠主动脉血血气的变化(±s,n=8)Tab.3 The changes of arterial b lood gas concen tration(±s,n=8)
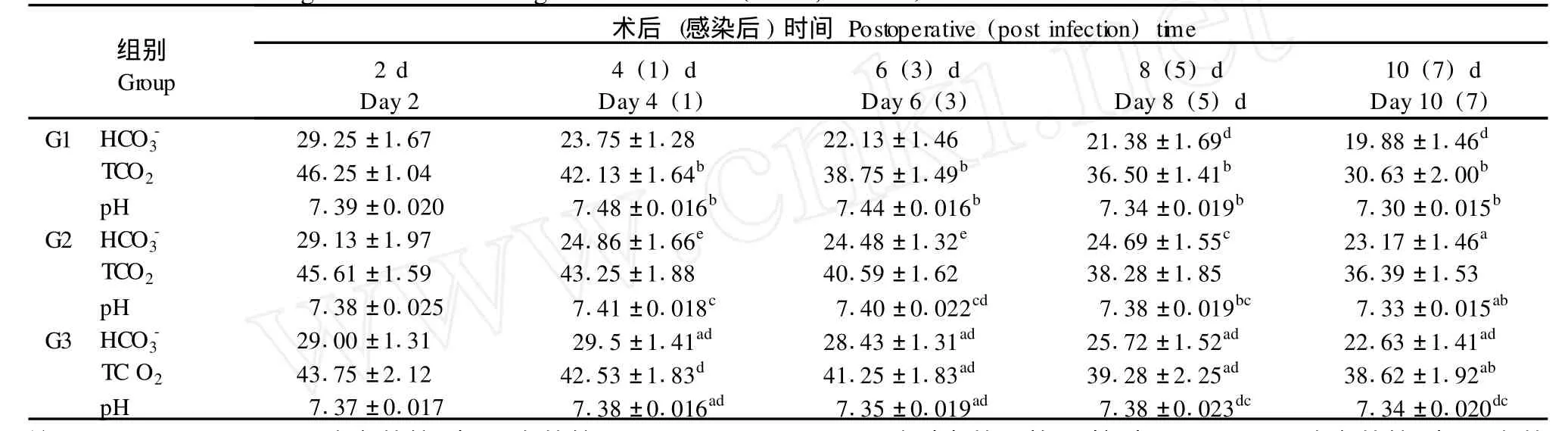
表3 大鼠主动脉血血气的变化(±s,n=8)Tab.3 The changes of arterial b lood gas concen tration(±s,n=8)
注:a:P<0.01;c:P<0.05,组间比较(与G1组比较);b:P<0.05;d:P>0.05组内相比,(前一时间点);e:P<0.05,组间比较(与G3组比较)。Note:P<0.01,c:P<0.05,Compared between two groups,(compared w ith group G1);b:P<0.05,d:P>0.05,Compared w ith that of p revious time point in the same group;e:P<0.05,Compared between two group s(compared w ith group G3).
表4 各组肝功能变化比较(±s,n=8,U/L,m g/mL)Tab.4 Comparison of the changes of liver function(±s,n=8,U/L,m g/mL)

表4 各组肝功能变化比较(±s,n=8,U/L,m g/mL)Tab.4 Comparison of the changes of liver function(±s,n=8,U/L,m g/mL)
注:a:P<0.05,b:P>0.05组间比较(与G1相比);c:P<0.05,组内比较(前一时间点)。Note:a:P<0.05,b:P>0.05,Compared between two groups(comparedw ith group G1);c:P<0.05,Comparedw ith thatofp revious time pointw ithin the same group.
组别Group术后(感染后)时间Postoperative(post-infection)time 2 d Day 2 4(1)d Day 4(1) 6(3)d Day 6(3) 8(5)d Day 8(5) 10(7)d Day 10(7) G1 ALT 203.75±58.59 279.75±93.33c413.62±137.16c864.00±173.17c1077.25±296.46cTB 37.55±6.13 65.58±12.26b96.63±10.15 147.26±16.51 203.18±22.97 G2 ALT 197.00±24.73 239.38±39.58bc390.5±53.18bc776.62±121.22bc967.62±89.94cTB 37.13±17.03 48.43±14.26a103.08±33.75 189.36±26.83a274.98±50.47aG3 ALT 247.8±33.92 105.67±42.18a352.43±98.36b693.55±137.29a826.15±105.74bTB 30.29±11.38 27.46±5.77a98.25±26.81 213.94±47.53a368.35±21.32a
2.6 多器官病理学改变
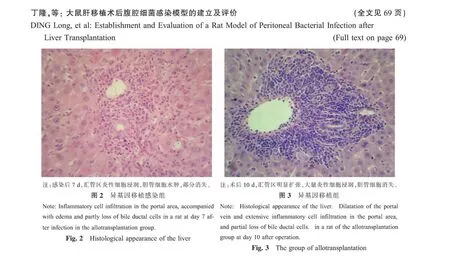
G1肺脏和肾脏未见明显的组织病理学改变。G1组随着感染逐渐加重,大鼠肝脏汇管区部分受累、扩大,炎性细胞浸润逐渐增多,胆管细胞水肿,排列紊乱,极性消失;无明显的中央静脉炎,肝实质细胞水肿坏死,间质水肿(见图2,彩插7);G2组在感染后第5天除汇管区有炎细胞浸润,中央静脉周围有明显的淋巴细胞浸润;G3组随着术后3d汇管区仅有少量的淋巴细胞浸润,随着术后时间的延长,汇管区和中央静脉周围的淋巴细胞浸润显著增多(见图3,彩插7)。
2.7 感染的鉴定
G1组各时间点腹水沾洗液培养24 h后均可见培养皿上散布的单克隆菌落生长,与我们复苏培养的菌落形态一致;G2组在感染后第3天培养单克隆菌落数明显减少,5 d后培养不再有菌落生长;G3组各时间点培养均未见有明显的菌落生长。
3 讨论
目前国际上通用的大鼠肝移植急性排斥研究的动物是近交系DA→LEW大鼠,平均术后5 d左右出现黄疸,表现出免疫排斥的病理改变。本研究以DA大鼠为供体,LEW大鼠为受体,采用改良的Kam ada“双袖套”法建立肝移植模型[2]。
据现有的文献报道[3-5],腹腔感染的方法有多种,所致的感染严重程度也不一样。目前常用的方法主要有盲肠结扎(CL)、盲肠结扎加穿孔(CLP)、腹腔内自身粪便注射或活菌注射等。采用前二种方法建立的动物模型感染较重,往往需要在感染后行肠道手术和营养支持,而且72 h死亡率较高,感染严重程度不易控制,很难行二次干预。肝移植术后在临床感染发生中,感染部位主要是腹腔、胆道、外科伤口、肺和血流等[1]。因我们研究的感染模型是建立在免疫排斥反应的基础上,为尽可能的接近临床感染,并使感染的严重程度便于控制,提高模型制作的可重复性,减少创伤,降低死亡率,我们最终选择用活细菌注射的方法,建立肝移植术后腹腔感染模型,并选取临床上相对比较常见的大肠埃希菌作为诱导感染菌[6]。
细菌浓度注射及术后何时注射细菌是本模型制作的又一难点。临床上细菌感染的发生时间大多在术后2周内,从2 d到90 d不等,而移植排斥反应则发生在术后5~30 d[6]。为尽量模拟临床感染特点,实验中采用术后5 d注射细菌,但由于免疫排斥反应和急性感染的双重作用,此时间点注射细菌大鼠的存活率低,仅为25%,故无法达到我们预期的实验目标。根据大鼠术后的恢复情况及上述相关的因素,我们选择了术后3 d腹腔内细菌注射,经观察,感染后大鼠的7 d存活率累计可达到37.5%左右,因此我们最终选择在术后3 d给予腹腔细菌注射。
在实验过程中我们摸索了4个细菌浓度,5个注射量,结果显示:过高的细菌浓度动物早期死亡率(12~48 h)较高,无法完成后续的实验;在G2组(即2×105cfu/mL),感染后1~3d大鼠的精神较差,体温和WBC计数逐渐升高,呈现出感染的状态,同时腹腔沾液细菌培养阳性,也证实了感染的存在,但随着病情的发展,大鼠的各项指标接近于G3组,尤其是在肝功方面,表现为TB的升高加快, ALT的变化与G1组比较虽然没有统计学意义,但各个时间点的值均低于G1组,并且腹腔细菌培养呈现阴性。这些提示我们:低浓度虽然可提高大鼠的生存时间,但机体可依赖于自身的免疫反应而抗感染,因而为了达到实验要求,在免疫排斥模型上,最终选定了5×105cfu/m L这个浓度,该浓度在不给予其他人为干预的情况下,感染可逐渐加重,并能达到较为理想的存活时间。
G1组大鼠在感染制模后第1天,表现出呼吸急促,易惊、行动迟缓;直肠温度、动脉血WBC和pH值轻度的升高,TCO2和HCO3-下降,提示我们感染模型已成功建立,并因过度通气出现呼吸性碱中毒;随着感染天数的延长,大鼠状态逐渐变差,直肠温度不断升高,WBC计数也随之增加,pH下降,大鼠出现代谢性酸中毒;G1组大鼠的肝功能损害进行性加重,且肝实质的损害重于胆道的损伤(与G2、G3组比较)。大约在感染5 d左右部分大鼠出现口鼻或眼角出血,毛无光泽,蓬乱,并相继死亡。解剖大鼠可见:无明显腹水,肝脾明显肿大,质地较硬;胃肠充血水肿,显著胀气;双肾及肺脏未见明显改变。人为处死大鼠的腹腔沾液培养可见有散在的单克隆菌落生长。从组织病理切片中我们观察到,感染后第1天,肝脏汇管区有少量炎性细胞浸润,汇管区扩大不明显,但随着感染的加重,上述改变逐渐加重,并有肝实质的坏死,淋巴细胞浸润,胆管细胞水肿,但始终未见明显的中心静脉炎。肺脏及肾脏未见有病理损害。这些结果提示我们:该模型未造成其他脏器的损害,大鼠的死亡原因系由于肝功能异常及重症感染所致,在进行相关研究时可排除非实验因素的干扰。
本模型具有以下几个特点:①可重复性强,无需二次手术,减少了动物创伤,提高了存活率;②无多器官脏器的损害,便于排除其他器官因素的作用,受损因素单一,有利于目的研究;③模型的建立尚有不足之处,因模型建立在免疫排斥反应的基础上,动物死亡率较高,存活时间相对较短,不利于长期观察。
(本文图2,3见彩插7。)
[1] Toniutto P,Fumo,Caldato M,et al.Favourab le ou tcom e of adefovir-d ip ivoxil treatm ent in acute de novo hepatitisB after liver transp lantation[J].Transp lantation,2004,77:472-473.
[2] Kam adaN,Calne RY.O rthotop ic liver transp lantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage[J].Transp lantation,1979,28(1):47-50
[3] W ittman DH.Intra-abdom inal infection-introduction[J].W orld J Surg,1990,14:145-147.
[4] Ryan NT,B lackburn Gl,C lowes HA,et al.D ifferential tissue sensitivity to elevated endogenous insu lin levels during experimental peritonitis in rats[J].M etabolism,1974,23(11): 1081.
[5] Nakatani T,Sato T,M arzella L,et al.Hepatic and system ic metabo lic responses to aerobic and anaerobic intra-abdom inal abscesses in a highly rep roducib le chronic rat model[J]. Circu lator Shock,1984,13(3):271.
[6] 张栋,张忠涛,刘建,等.肝移植术后的细菌感染[J].中华肝胆外科杂志,2004,10(5):297-300.
Estab lishm en t and Eva lua tion of a Ra tM odel of Per itonea l Bacter ia l In fection a fter L iver Tran sp lan ta tion
D INGLong1,YANG Yu2,DONG Jia-hong3
(1.Depar tm ent of General Surgery,The FirstA ffiliated Hosp ital of Jiam usiUniversity,Jiam usi 154000,China; 2.Departm ent of RegionalAnatom y,Co llege ofBasicM edicine of Jiam usiUniversity,Jiam usi 154002; 3.Departm ent of Hepato-B iliary Surgery,A ffiliated Hosp ital of General Hosp ital of the Chinese Peop le’s L iberation A rm y,Beijing 100853)
O b jective To establish a rat model of peritoneal bacterial infection after liver transp lantation. M ethod s To construct a dark Agou ti rat-to-Lew is(DA-to-LEW)rat model of liver transp lan tation.Peritoneal bacterial infection in the ratswas induced by intraperitoneal in jection of bacterial suspension.The liver function,b lood gas,b lood cell count and other indicators of the rat models were detected.ResultsThere was a high mortality rate in rats w ith bacterial injection at day 5 after liver transp lantation,therefore unfavorable for the fo llow ing study.It was better to inject the bacteria in an amountof 5×105cfu/m L at day 3 after liver transp lantation.The cum ulative 7-day survival rate of those rats after infection reached up to 37.5%.The infection becam e increasingly severe,the general conditionswereworsening, the rectal temperaturewas rising,theWBC countwas increased,the pH was decreased,liver dysfunctionwasp rogressively increased,and m etabo lic acidosis occurred in the rats.L iver parenchym al dam age was mo re p ronounced than that of bile ductal in juries,and the rats died one after another at about 5 days after infection.Patho logical exam ination of m u ltip le o rgans showed that the m ain cause of death of the ratswas liver dam age,w ithout accompanying lung and kidney dam ages. Conc lusion The resu lts of this study suggest that it is a successful m ethod to estab lish a rat model of peritoneal bacterial infection after liver transp lantation,and thismodel can be used in related experim ental researches.
L iver transp lantation; Imm uno logical sensitization;Bacterial infection,peritoneal;Rat
R-33
A
1005-4847(2010)01-0069-05
2009-07-21
丁隆(1978--),女,博士,主治医师。E-m ail:d inglongjm s@126.com
董家鸿
