重组粘质沙雷氏菌几丁质酶C的纯化及酶学性质
2010-09-07刘嘉贺淹才施腾鑫李梓君王珍珠
刘嘉,贺淹才,施腾鑫,李梓君,王珍珠
(华侨大学化工学院,福建泉州362021)
重组粘质沙雷氏菌几丁质酶C的纯化及酶学性质
刘嘉,贺淹才,施腾鑫,李梓君,王珍珠
(华侨大学化工学院,福建泉州362021)
为从已构建的重组大肠杆菌p ET-22b-chiC获得高纯的几丁质酶C,通过降低培养温度,提高粘质沙雷氏菌几丁质酶C的可溶性表达.表达产物经镍柱亲和层析(IMAC)和Phenyl-Sepharose疏水层析(H IC)分离纯化后,得到电泳纯的几丁质酶.酶学性质研究表明,纯化的几丁质酶C为单体蛋白,相对分子质量为51.8 ku;最适p H值为5.0,最适温度为55℃,在55℃的条件下保温4 h后仍有90%以上的酶活力.研究结果还表明,Cu2+,Hg2+,Co2+,M g2+对酶活力均有明显抑制作用,而Fe2+,Zn2+,Sn2+,Ba2+对酶活力有一定促进作用,M n2+对酶活力明显促进作用.
粘质沙雷氏菌;重组;几丁质酶C;分离纯化;酶学性质
几丁质酶(EC 3.2.1.14)可以催化水解自然界中最为丰富的生物高聚物几丁质的β-1,4-糖苷键,生成几丁寡糖.在经典的基于氨基酸序列相似性的糖基水解酶分类系统中,几丁质酶主要为第18,19两个家族.绝大多数的微生物几丁质酶属于第18家族,而第19家族主要是植物几丁质酶,其中在链霉菌属中也有19家族几丁质酶[1].粘质沙雷氏菌是降解几丁质的细菌中最有效的菌株之一,它的chiA,chiB, chiC 3个基因分别编码18家族几丁质酶A,B和C.几丁质酶A,B已经从不同的粘质沙雷氏菌中克隆表达,并且获得3-D结构图[2],几丁质酶C也从粘质沙雷氏菌2170,KCTC2172[3],A TCC14041[4]中克隆表达.几丁质酶C是粘质沙雷氏菌中唯一具有纤连蛋白Ⅲ型结构域(Fibronection TypeⅢDomain)的几丁质酶,其结构不同于几丁质酶A,B[5-6].到目前为止,仍然没有得到几丁质酶C的晶体结构,而且对其酶学性质的了解还不多.本文从已经构建并能表达粘质沙雷氏菌几丁质酶C的重组大肠杆菌中分离、纯化得到该酶,并对其进行初步酶学性质的研究.
1 材料与方法
1.1 材料
构建带有粘质沙雷氏菌(Serratia m arcescens A TCC 14041)几丁质酶基因ChiC的重组大肠杆菌E.coli BL21(DE3)p ET-22b(+)-chiC,胶体几丁质,HisTrap HP亲和层析柱,Phenyl Sepharose FF (Low Sub)层析柱,A KTA purifier 10/100,异丙基硫代半乳糖苷(IPTG)等.
1.2 菌种的培养与粗酶液制备
挑取重组菌接种于5 mL的Luria-Bertani(LB)液体培养基(含100 mg·L-1氨苄青霉素(Amp))中,于220 r·m in-1,37℃下过夜培养.收集菌体抽提质粒并进行酶切鉴定[7].
取过夜活化的重组菌,按1%的接种量接种于新鲜的LB液体培养基中,于220 r·min-1,37℃下继续培养至菌液的光密度值D(600)为0.5~0.6时(约2.5 h),向培养基中加入IPTG,使IPTG的终浓度为1.0 mmol·L-1;调整培养温度为25℃,继续诱导表达8 h后,收获菌体.
将诱导后的菌液于离心机(4℃,8 000 r·min-1)离心5 min,收集菌体,弃上清液;用4~5倍体积的20 mmol·L-1磷酸盐缓冲液(PBS,预冷,p H=7.0)洗涤菌体,离心收集菌体,重复3次.菌体沉淀按1 g湿菌体加入10 m L的PBS重悬,冰浴超声破碎菌体(250 W,2 s,90次);于4℃,12 000 r·m in-1下离心10 min,上清液即为粗酶液.
1.3 分离与纯化方法
(1)镍柱亲和层析.将粗酶液上样至预先用缓冲液Ⅰ(20 mmol·L-1的磷酸盐缓冲液,500 mmol· L-1氯化钠,20 mmol·L-1咪唑,p H=7.0)充分平衡的HisTrap HP亲和层析柱,后用缓冲液Ⅱ(20 mmol·L-1的磷酸盐缓冲液,500 mmol·L-1氯化钠,500 mmol·L-1咪唑,p H=7.0)进行洗脱,收集各峰,检测酶活力.
(2)Phenyl-Sepharose疏水层析.将上述收集组分对缓冲液Ⅲ(20 mmol·L-1Tris-HCl,1 mmol· L-1ED TA,0.5 mol·L-1硫酸铵,p H=8.0)进行透析,所得酶液上样至预先用缓冲液Ⅲ充分平衡的Phenyl-Sepharose疏水层析柱,后用缓冲液Ⅳ(20 mmol·L-1Tris-HCl,1 mmol·L-1EDTA,4%异丙醇,p H=8.0)进行洗脱[8],收集各峰,检测酶活力,经十二烷基磺酸钠-聚丙烯酰胺凝电泳胶(SDSPAGE)确认几丁质酶的纯度.
1.4 测定方法
(1)几丁质酶蛋白质浓度测定.按照Tsaffrir Zor方法[9]并稍作修改,进行蛋白质浓度测定,以牛血清白蛋白为标准蛋白质.
(2)酶活力测定.采用3,5-二硝基水杨酸(DNS)法[10].在2 m L的Eppendorf管中,加入0.25 m L纯化后的酶液、0.25 m L胶体几丁质、0.5 m L的M cllvaine’s缓冲液(0.2 mol·L-1Na2HPO4溶液与0.1 mol·L-1柠檬酸溶液按一定比例混合,p H=5.5),50℃反应1 h,煮沸10 min.冷却后,加入0.75 mL DNS,煮沸10 min;冷却后,于室温下离心(4 000 r·min-1)10 min,取上清液,测定波长为540 nm的吸光度值.以已知浓度的N-乙酰氨基葡萄糖(NAG)做标准对照.
(3)相对分子质量测定.将样品及已知相对分子质量的标准蛋白进行SDS-PAGE电泳,然后采用Quantity one凝胶成像分析软件进行几丁质酶相对分子质量测定.
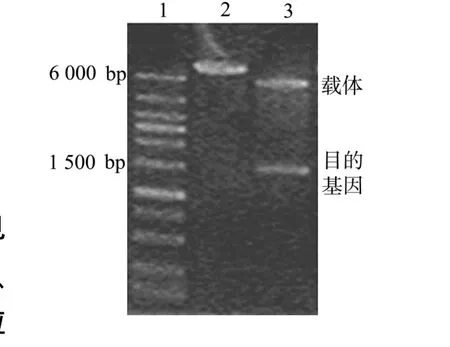
图1 几丁质酶C重组质粒p ET-22b-chiC的电泳验证Fig.1 Electropho resis identification of recombinant p lasmid p ET-22b-chiC of chitinase C
2 实验结果
2.1 菌种的鉴定
含p ET-22b-chiC质粒的重组菌经抽提、酶切之后,进行琼脂糖凝胶电泳,结果如图1所示.图1中,泳道1,2,3分别为DNA相对分子质量HindⅢ单酶切产物,以及HindⅢ和XhoⅠ双酶切产物.显然,重组质粒p ET-22b-chiC是由5 490 bp的载体和约1 500 bp的目的条带ChiC基因片段组合而成[4].
2.2 几丁质酶分离与纯化
利用HisTrap HP柱(镍柱)纯化几丁质酶,其色谱峰和对应的酶活力曲线,如图2所示.从图2可明显看到,第1个峰是流出液(即未结合到HisTrap HP柱上,直接流出的组分,其峰较高,为方便观察,故只截取局部),尽管蛋白含量很高,但酶活力很低,说明主要是杂蛋白;第2个峰为咪唑的洗脱峰,虽然峰值低但酶活力相应较高.从两个峰值的大小看,表达的可溶性目的蛋白含量较低.
利用Phenyl Sepharose FF(Low Sub)疏水层析,进一步纯化几丁质酶,如图3所示.疏水层析过程中共出现2个峰,流出液形成第1个小峰,洗脱之后出现的第2个峰含有较高的几丁质酶活性.收集具有较高酶活性部分的洗脱液,连同收集的镍柱纯化蛋白进行SDS-PA GE确认纯度.
将HisTrap HP柱纯化的几丁质酶与疏水柱纯化的几丁质酶进行SDS-PSGE,其结果如图4(a)所示.图4(a)中,泳道1,2,3,4分别为蛋白相对分子质量、疏水柱纯化产物、HisTrap HP柱纯化产物及粗酶液.从泳道3可以看出,样品中目标蛋白含量较高,经凝胶成像系统进行分析显示目的蛋白质量分数约为89.1%,而泳道2即疏水纯化产物经凝胶成像系统分析,除了目的蛋白外,没有其他条带,说明得到了电泳纯的目的蛋白.

图2 几丁质酶C的金属螯合层析柱图谱Fig.2 Chromatography of chitinase C on IMAC
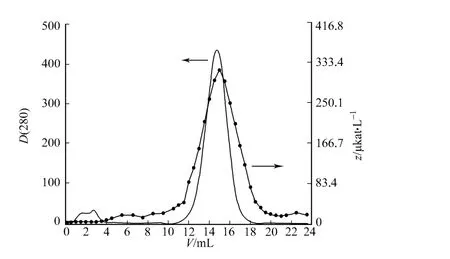
图3 几丁质酶C的Phenyl Sepharose层析柱图谱 Fig.3 Chromatography of chitinase C on Phenyl Sepharose
2.3 几丁质酶的酶学性质
2.3.1 相对分子质量 经两步纯化得到的几丁质酶C的SDS-PAGE,结果如图4(b)所示.图4(b)中,泳道1为还原状态的几丁质酶C(即添加了DTT),泳道2为非还原状态的几丁质酶C(没有添加D TT),泳道3为蛋白相对分子质量.图4(b)中,经凝胶成像系统分析,泳道1,2显示在还原及非还原状态下的几丁质酶的相对分子质量均为51.8 ku,表明纯化得到的几丁质酶为单体蛋白.
2.3.2 最适反应p H值及p H值稳定性 分别以0.1 mol·L-1柠檬酸钠缓冲液(p H值为3.0~6.0),0.1 mol· L-1M cllvaine’s缓冲液(p H值为6.0~7.5),0.1 mol·L-1Tris-HCl(p H值为7.5~9.0),0.1 mol· L-1NaHCO3-KOH缓冲液(p H值为9~11)配制底物.经纯化的几丁质酶在不同p H值(3.0~11.0)下进行酶促反应以测定酶活力,结果如图5(a)所示.从图5(a)可以看出,几丁质酶随反应液p H值的变化而变化,其在p H值为4.5~7.0之间,酶活力较高,相对酶活力均在80%以上;在p H值为5.0时,酶活最高;而在p H值小于4.5时,酶活力迅速下降.
将酶液置于不同p H值的缓冲液中3 h,然后测定酶活力,几丁质酶对p H稳定性的结果如图5(b)所示.从图5(b)可以看出,几丁质酶在p H值为4.5~6.5之间酶较为稳定,孵育3 h后,其相对酶活力均保持在80%以上.当p H值低于4.5或者高于7时,酶活力受到较大影响.
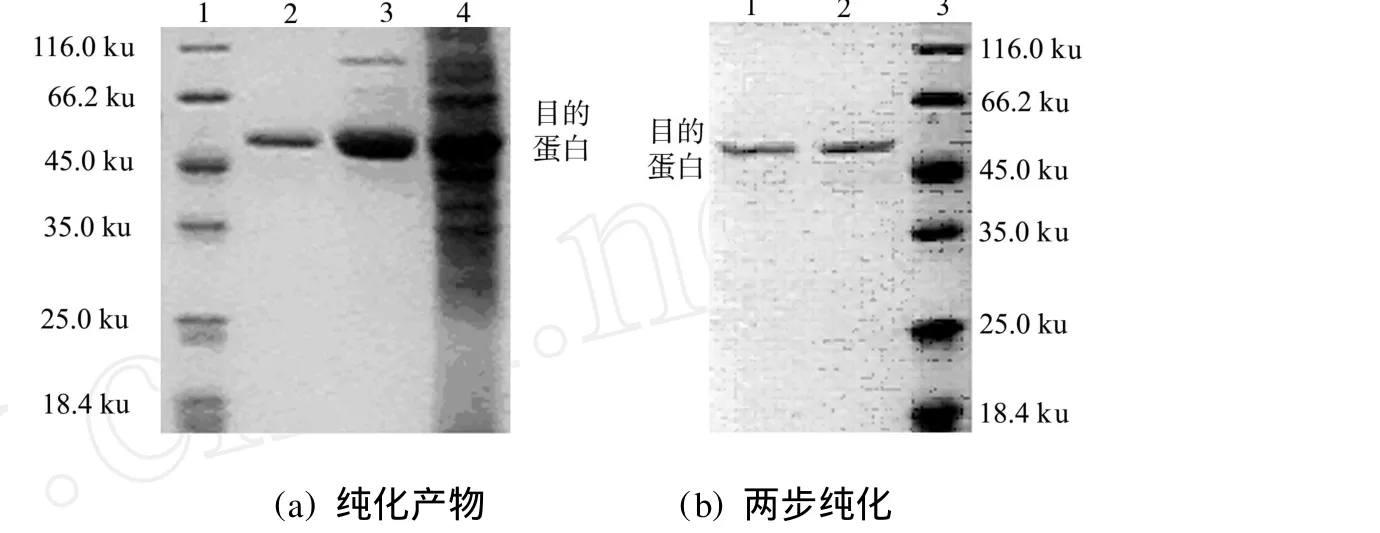
图4 几丁质酶C的SDS-PAGE电泳Fig.4 SDS-PAGEof chitinase C
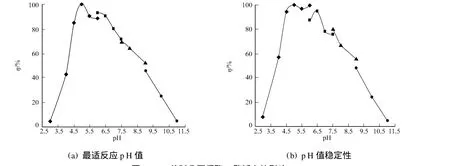
图5 p H值对几丁质酶C酶活力的影响Fig.5 Effect of p H on chitinase C activity
2.3.3 最适反应温度及温度稳定性 在不同温度下,进行几丁质酶酶活力的测定,结果如图6(a)所示.几丁质酶酶活力随温度升高而逐渐增加,在45~55℃之间酶活力较高,相对酶活力均在80%以上;在55℃时,酶活力达到最大;而当温度超过55℃时,酶活力急剧下降.
将酶液置于30,50,55,60℃的水浴锅中保温0.5,1.0,2.5,4.0 h后测定酶活力,结果如图6(b)所示.从图6(b)可知,几丁质酶酶在60℃时失活较快,大约1 h仅剩60%的酶活力;但在55℃下保温4 h,仍具有90%以上的酶活力;在30,50℃保温条件下,其酶活力几乎没有下降,有很好的温度稳定性.
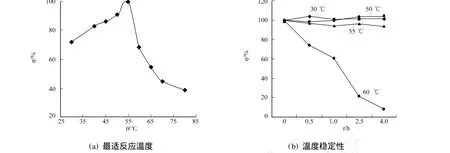
图6 温度对几丁质酶C酶活力的影响Fig.6 Effect of temperature on chitinase C activity
2.3.4 金属离子对酶活力的影响 以M cllvaine’s配制含20 mmol·L-1一价﹑二价金属离子缓冲液,使其终浓度为10 mmol·L-1,再以该溶液代替酶活测定时所加的M cllvaine’s测定酶活力.以不添加离子的酶样活性(100%)作为对照,考察金属离子对酶活力的影响,结果如图7所示.从图7可知, Cu2+,Hg2+,Co2+,M g2+对酶活力均有明显抑制作用;Fe2+,Zn2+,Sn2+,Ba2+对酶活力均有一定促进作用;M n2+对酶活力明显促进作用.
3 讨论
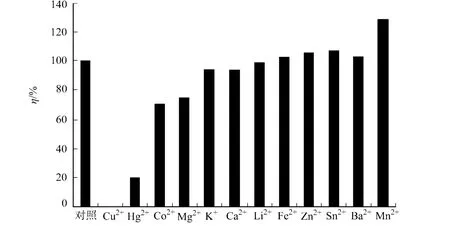
图7 金属离子对几丁质酶C活力的影响Fig.7 Effect of metal ions on chitinase C activity
采用Phenyl Sepharose FF(Low Sub)疏水层析柱分离、纯化几丁质酶C.当第1组分流出后,在未进行洗脱目的蛋白的情况下,目的蛋白随后会流出,但D(280)曲线上升缓慢.这可能由于苯基作为取代基的层析柱疏水性仍不够,需要换疏水性更强的层析柱才不会使得目的蛋白流出.纯化得到的几丁质酶C相对分子质量约为51.8 ku,为单一亚基蛋白质,同文[3,5]得到的几丁质酶C相对分子质量大小相近.
由于采取的纯化策略不同,实验未得到由几丁质酶C蛋白水解而来的ChiC2.经两步纯化得到的几丁质酶C,其最适反应p H值为5.0,最适反应温度为55℃,与文[3]报道的最适反应p H值为5.5仅相差0.5单位,但与其报道的最适反应温度45℃相比高出10℃[3];与Suzuki等[1]报道的最适反应p H值为4.5也相差0.5单位,而最适反应温度却较之低10℃;Synstad等[8]报道的几丁质酶C最适反应p H值为4.0.
在诸多报道中,几丁质酶C的最适反应p H均偏酸性,Synstad等[11]采用定点突变,将粘质沙雷氏菌BJL 200-ChiB 215位点氨基酸突变为天冬酰胺,使得该酶的最适p H值向酸性偏移.酸性范围内的差异,可能是由于蛋白序列中个别氨基酸的改变所引起.不同来源的几丁质酶存在较大的性质差异,可能与不同菌株所产生酶的性质不同相关,也可能与分离纯化条件相关[10].
目前,还没有粘质沙雷氏菌几丁质酶C的晶体结构的报道,粘质沙雷氏菌几丁质酶C更多的性质还需要进一步研究.
[1] SUZU KI K,SUGAWARA N,SUZUKIM,et al.Chitinase A,B,and C1 of Serratia marcescens 2170 p roduced by recombinant Escherichia coli:Enzymatic p roperties and synergism on chitin degradation[J].Biosci Biotechnol.Biochem,2002,66(5):1075-1083.
[2] BRURBERGM,SYNSTAD B,KLEMSDAL S S,et al.Chitinases from Serratia marcescens[EB/OL].[2000-08-09].http://davapc1.bioch.dundee.ac.uk/pdf/chirev.pdf.
[3] GAL SW,CHO IY J KIM Y C,et al.Cloning of the 52-kDa chitinase gene from Serratiamarcescens KCTC2172 and its p roteolytic cleavage into an active 35-kDa enzyme[J].FEMSM icrobiology Letters,1998,160(1):151-158.
[4] 魏巍,贺淹才,方柏山,等.粘质沙雷氏菌几丁质酶(ChiC)基因克隆及其生物信息学分析[J].江西农业大学学报, 2006,28(3):444-448.
[5] SUZU KI K,TA IYOJIM,SUGAWARA N,et al.The third chitinase gene(chiC)of Serratia m arcescens 2170 and the relationship of its p roduct to other bacterial chitinases[J].Biochem J,1999,343(3):587-596.
[6] 贺淹才,刘爱花,张荣奎,等.嗜麦芽窄食单胞菌产生的几丁质酶的特性[J].华侨大学学报:自然科学版,2008,29 (2):245-249.
[7] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].黄培堂,等译.3版.北京:科学出版社,2002.
[8] SYNSTAD B,VAAJE-KOLSTAD G,CEDERKV IST F,et al.Exp ression and characterization of endochitinase C f rom Serratia m arcescens BJL200 and its purification by a one-step general chitinase purification method[J].Biosci Biotechnol Biochem,2008,72(3):715-723.
[9] TSAFFRIR Z,ZV IS.Linearization of the bradfo rd p rotein assay increases its sensitivity:Theo retical and experimental studies[J].Analytical Biochemistry,1996,236(2):302-308.
[10] 唐亚雄,赵建,丁诗华,等.产气肠杆菌几丁质酶的分离纯化及性质研究[J].微生物学报,2001,41(1):82-86.
[11] SYNSTAD B,GASEIDNES S,AAL TEN D M F,et al.M utational and computational analysis of the role of conserved residues in the active site of a family 18 chitinase[J].Eur JBiochem,2004,271(2):253-262.
Purification and Enzyme Properties of Recombinan t Ser ratiama rcescens Chitinase C
L IU Jia,HE Yan-cai,SH I Teng-xin, L IZi-jun,WANG Zhen-zhu
(College of Chemical Engineering,Huaqiao University,Quanzhou 362021,China)
To obtain high pure chitinase C from constructed recombinant E.coli p ET-22b-chiC,we decreased culture temperature to increase soluble exp ression of Serratiam arcescens chitinase C.The exp ressed p roductwas purified to electropho retic homogeneity by immobilized metal ion affinity chromatography(IMAC)and Phenyl-Sepharose hydrophobic interaction chromatography(H IC).The enzyme p roperties research indicated that the purified chitinase Cwasamonomeric p rotein w ith a molecular weight of 51.8 ku.The op timum p H was 5.0 and the op timum temperature was 55℃.And its activity still kep t above 90%after 1 h at 55℃.Results also showed that the activity of chitinase was significantly inhibited by Cu2+,Hg2+,Co2+,M g2+,w hile p romoted by Fe2+,Zn2+,Sn2+,Ba2+and also significantly p romoted by M n2+.
Serratia m arcescens;recombinant;chitinase C;isolation and purification;enzyme p roperties
TQ 920.6;TQ 929+.2
A
(责任编辑:黄晓楠 英文审校:刘源岗)
1000-5013(2010)05-0552-05
2009-02-22
贺淹才(1949-),男,教授,主要从事生物化学与分子生物学的研究.E-mail:yche@hqu.edu.cn.
福建省自然科学基金资助项目(C04010011)
