牛凝乳酶全长cDNA的克隆及其原核表达载体的构建
2010-08-27张莉姜媛媛张健杨贞耐
张莉, 姜媛媛, 张健, 杨贞耐
(吉林省农业科学院农产品加工研究中心,吉林长春 130033)
牛凝乳酶全长cDNA的克隆及其原核表达载体的构建
张莉, 姜媛媛, 张健, 杨贞耐*
(吉林省农业科学院农产品加工研究中心,吉林长春 130033)
从小牛皱胃中提取凝乳酶(Chymosin)总RNA,经过RT-PCR获得凝乳酶cDNA,纯化后与pMD-18T载体连接,转化大肠杆菌JM109,通过双酶切和序列测定,获得了凝乳酶全长基因序列。序列测定表明,凝乳酶全长核苷酸长度为1 143 bp,编码381个氨基酸。与GenBank上已发表序列NM_180994进行比较,核苷酸同源性为99.56%。将该基因片段克隆到原核表达载体pET-22b中,构建重组质粒pET-22b/Chymosin,所获重组质粒经过酶切、测序鉴定,证实含有目的片段,且连接、构建正确,为凝乳酶的进一步表达奠定了基础。
凝乳酶;克隆;原核表达载体;构建
凝乳酶(Chymosin)是从未断奶的小牛皱胃中提取的一种天冬氨酸蛋白酶,其主要的生物学功能是水解牛乳中κ-酪蛋白的Phe105-Met106键,导致牛乳凝结,因此被广泛用于干酪制造业。随着世界范围内干酪产量的巨增及全球性小牛短缺,使得天然凝乳酶供应不足,应用基因工程技术可以使凝乳酶基因在微生物中高效表达,从而为实现工业化生产打下良好的基础。
牛凝乳酶通常在小牛第四胃,即皱胃中合成为一个含有381个氨基酸的前体聚肽——凝乳酶原前体(Preprochymosin),凝乳酶原前体在分泌过程中去掉16个信号肽形成含有365个氨基酸的凝乳酶原(Prochymosin)。凝乳酶原没有活性,它在酸性p H下通过多步的自动催化过程,去掉N末端42个氨基酸形成有活性的含有323个氨基酸的蛋白质——凝乳酶成熟肽(Chymosin)。在一定条件下,凝乳酶原可以通过去除N末端27个氨基酸形成另一种酶,假凝乳酶(Pesudochymosin)。凝乳酶和假凝乳酶都具有凝乳活性。凝乳酶蛋白结构见图1。

图1 牛凝乳酶蛋白质结构Fig.1 Protein structure of bovine chymosin
牛凝乳酶的基因组DNA是由8个内含子分开的9个外显子组成[2]。牛凝乳酶有3个主要的形态:A,B和C,凝乳酶B的含量最高[3]。凝乳酶A和B只有1个氨基酸位置不同:凝乳酶A在243位(胃蛋白酶编码)上是Asp,而凝乳酶B在这个位置是Gly。凝乳酶C是凝乳酶A降解后,去掉3个残基Asp244-Phe246后的产物[4]。
作者根据GenBank上发表的凝乳酶B基因(NM_180994)设计引物,从小牛皱胃中提取凝乳酶总RNA,经过RT-PCR获得牛凝乳酶全长cDNA,构建原核表达载体,为凝乳酶的工业化制备奠定基础。
1 材料与方法
1.1 实验材料
皱胃粘膜取自未断奶的荷斯坦小牛第四胃,大肠杆菌JM109,表达载体pET-22b;作者所在实验室保存。
限制性内切酶,DNA回收试剂盒,T4 DNA连接酶:购于MBI,Trizol Reagent;RT-PCR试剂盒:购于Invitrogen;pMD-18T,DL2000,DL15000,Ex-Taq,dNTP:购于Ta KaRa公司。
1.2 仪器与设备
PCR扩增仪:Eppendorf公司制造;高速冷冻离心机:Thermo公司制造;超低温冰箱:Thermo公司制造;电泳仪:Bio-rad公司制造;凝胶成像系统:Alpha公司制造;紫外可见分光光度计:Varian公司制造。
1.3 实验方法
1.3.1 引物设计与合成 应用Primer(Version 5.0)基因分析软件,参照GenBank发表的凝乳酶(NM_180994)基因序列设计一对引物,并且在上游引物中加入Nco I酶切位点,下游引物中加入Xho I酶切位点。该对引物理论跨幅包括凝乳酶CDS序列1 143 bp,引物由上海生工公司合成。

1.3.2 凝乳酶总RNA的提取 无菌采取小牛皱胃,液氮保存。凝乳酶总RNA的提取按照Invitrogen Trizol的说明书,-70℃保存。取5μL进行琼脂糖凝胶电泳检测RNA的完整性。
1.3.3 RT-PCR体外扩增目的基因片段
1)合成cDNA:取1μL提取的总RNA于灭菌的0.5 mL离心管中,置于冰上,再加入DEPC水8μL,1μL 50μmol/L Oligo(dT)20,于65℃水浴保温5 min后立即置于冰上,加入5×cDNA Synthesis Buffer 4μL,0.1 mol/L DTT 1μL,1μL 40 U/μL RNase OU TTM,DEPC水1μL,15 U/μL Thermoscript RT 1μL,混匀后于50℃反应60 min,之后于85℃反应5 min终止反应。加1μL RNase H,37℃、20 min去除RNA模板。取2μL进行PCR反应,剩余物于-20℃贮存。
2)PCR反应:反应体系为10×PCR Buffer Minus Mg 5μL,50 mmol/L MgCl21.5μL,10 mmol/L dNTP Mix 1μL,20μmol/L sense primer 0.5μL,20μmol/L antisense primer 0.5μL,5 U/μL Platium tag DNA polymerase 0.4μL,cDNA 2μL,DEPC-treated Water 39.1μL。
反应条件为:94℃预变性5 min,然后94℃变性30 s,52℃退火30 s,72℃延伸90 s,72℃延伸10 min,30次循环。产物用0.8 g/dL琼脂糖凝胶电泳进行检测。
1.3.4 PCR产物TA克隆 将电泳回收产物与pMD18-T载体进行连接反应,16℃连接1 h后,将连接产物转化JM109感受态细胞,在含有X-gal、IPTG和Amp的LB琼脂平板培养基上培养12 h,挑取白斑菌落接种于含有Amp的LB液体培养基中,37℃振荡培养12~16 h。提取质粒,进行酶切鉴定。选择酶切鉴定正确的质粒送上海生工公司进行序列测定。
1.3.5 表达载体的构建 将含有目的基因的质粒和pET-22b同时用Nco I和Xho I酶切,分别回收后用T4 DNA连接酶连接,构建重组表达质粒pET-22b/Chymosin。再将连接产物转化JM109感受态细胞,在含有Amp的LB琼脂平板培养基上培养16 h,挑取阳性菌落,接种于含有Amp的LB液体培养基中,37℃振荡培养12~16 h。按质粒提取试剂盒说明提取重组质粒,再进行PCR及酶切电泳检测鉴定。选择酶切和PCR鉴定为重组阳性的质粒,送上海生工公司进行序列测定,验证重组质粒读码框的正确性。
2 结 果
2.1 凝乳酶总RNA鉴定
通过琼脂糖凝胶电泳检测RNA,28S、18S和5S条带明亮、清晰,因此,提取的RNA可用于后续试验,见图2。

图2 Chymosin总RNA琼脂糖凝胶电泳图谱Fig.2 Agarose gel electrophoresis of total RNA of Chymosin
2.2 RT-PCR扩增产物鉴定
以提取的总RNA为模板,使用反转录试剂盒进行RT-PCR反应,琼脂糖电泳检测扩增结果见图3,扩增的DNA片段与预期大小一致,约为1 200 kb。
2.3 PCR扩增产物的连接和筛选
用DNA回收试剂盒对凝乳酶cDNA RT-PCR扩增产物进行纯化回收,然后与pMD-18T进行TA连接,转化大肠杆菌JM109感受态细胞。蓝白筛选挑取白色菌落扩培后,进行碱变性法提取质粒,用Nco I和Xho I双酶切及PCR鉴定,选出阳性克隆,命名为JM109/18T/Chymosin。
2.4 克隆质粒测序
将上述阳性克隆质粒送上海生工,进行正反两个防线的序列测定,报告的核苷酸序列为1 257 bp,除去两端引物中的多余碱基,得到全长为1 143 bp的核苷酸序列,含有一个完整的阅读框,编码381个氨基酸,见图4。此序列已经提交到GenBank,收录号为FJ768675。与GenBank数据库中凝乳酶基因NM_180994序列进行比对分析,核苷酸同源性为99.56%。结果显示有5个碱基变异,第44 bp (以ATG为1计)由A→G,第431 bp由A→G,第687 bp由A→G,第816 bp由T→C,第1 007 bp由A→G,其编码的氨基酸序列中有1个不一致,第229位氨基酸由N(Asn)→D(Asp)(见粗体下划线)。
2.5 重组质粒的构建
将18T/Chymosin及表达载体pET-22b经Nco I和Xho I双酶切后,纯化回收后构建重组质粒,转化JM109后挑选白色菌落,提取质粒后酶切及PCR扩增,经琼脂糖电泳鉴定在约1 200 bp处有特异条带,经Nco I和Xho I双酶切后电泳出现两条带,其中一条为载体质粒,约5 500 bp,另一条带为所克隆的Chymosin基因片段,约1 200 bp,见图5。测序结果表明,该转化菌的质粒中确实含有目的基因片段,且读码框正确,重组质粒pET-22b/ Chymosin构建成功。

图4 重组凝乳酶的核苷酸序列及其编码的氨基酸Fig.4 The nucleotide sequence and deduced amino acids of recombinant chymosin
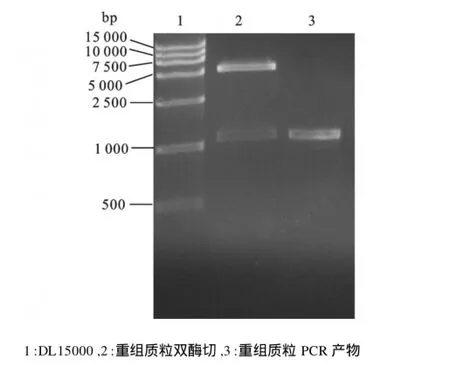
图5 重组表达质粒PCR和酶切鉴定图Fig.5 Identification of recombinant plasmid by digested (Nco I+Xho I)and PCR
3 结 语
作者所研究的凝乳酶B基因,经过比对,发现克隆的凝乳酶基因与GenBank上NM_180994核苷酸序列有5个碱基变异,但其中有4个变异的碱基并不影响编码的氨基酸,所以氨基酸序列只有229位的Asn(N)突变为Asp(D)。
通过比对分析发现,本研究得到的凝乳酶氨基酸序列与目的序列NM_180994相差一个氨基酸(箭头指示处),但是与Protein Data Bank上登录的凝乳酶蛋白质结构4CMS的氨基酸序列完全一致[5],见图6。通过进一步分析GenBank上登录的凝乳酶A和C的氨基酸序列[6-7],根据Danley等人(1988)对凝乳酶的描述,凝乳酶A,B和C在此位点的氨基酸序列应该是一致的。进而与另外两种反刍动物,绵羊[8]及骆驼[9]的凝乳酶氨基酸序列进行比对,发现其第229位上的氨基酸序列与本研究所得到的氨基酸序列一致,所以不能确定此位点是否为突变,有可能是GenBank上登录的NM_ 180994序列有误。通过以上分析可以判断,不论此位点是否为突变,对凝乳酶的功能没有影响,克隆的凝乳酶基因可用于下一步的实验。
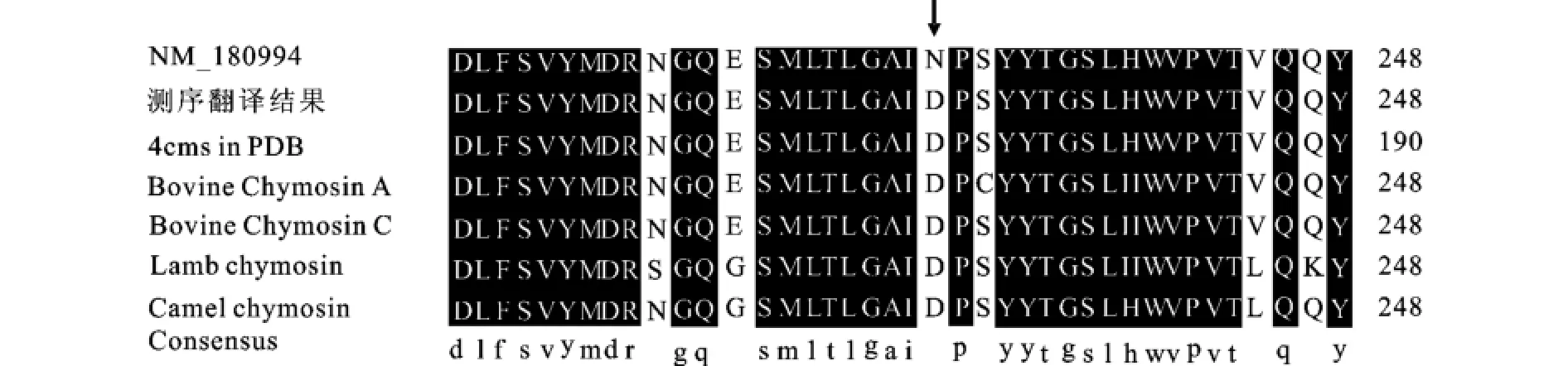
图6 氨基酸序列比对结果Fig.6 Alignment of the peptide sequences
凝乳酶作为乳凝固用酶广泛应用于干酪的工业化生产。我国干酪生产所用凝乳酶主要依赖于进口,利用生物工程技术生产凝乳酶,可以减少对进口产品的依赖,降低干酪生产成本,促进我国干酪产业的发展。
pET系统是在E.coli中克隆表达重组蛋白的首选,pET系列载体是利用大肠杆菌T7噬菌体转录系统进行表达的载体。将凝乳酶基因片段克隆到原核表达载体pET-22b中,构建重组质粒pET-22b/Chymosin,所获重组质粒经过酶切、测序鉴定,证实含有目的基因片段,且连接、构建正确,为凝乳酶的工业化生产奠定了基础。
[1]Mohanty A K,Mukhopadhyay U K,Grover S,et al.Bovine chymosin:production by rDNA technology and application in cheese manufacture[J].Biotechnology Advances,1999,17(4):205-217.
[2]Chitpinityol S,Crabbe M J C.Chymosin and aspartic proteinases[J].Food Chemistry,1997,61(4):395-418.
[3]Harris T,Lowe P A,Lyons A,et al.Molecular-cloning and nucleotide-sequence of cDNA coding for calf preprochymosin[J].Nucleic Acids Research,1982,10(7):2177-2187.
[4]Danley D E,Geoghegan K F.Structure and mechanism of formation of recombinant-derived chymosin C.[J].Journal of Biological Chemistry,1988,263(20):9785-9789.
[5]Newman M,Safro M,Frazao C,et al.X-ray analyses of aspartic proteinases IV.structure and refinement at 2.2Åresolution of bovine chymosin[J].Journal of Molecular Biology,1991,221(4):1295-1309.
[6]Moir D,Mao J,Schumm J W,et al.Molecular-cloning and characterization of double-stranded cDNA coding for bovine chymosin[J].G ene,1982,19(1):127-138.
[7]Nishimori K,Kawaguchi Y,Hidaka M,et al.Nucleotide sequence of calf prorennin cDNA cloned inEscherichia coli.[J]. Journal of Biochemistry,1982,91(3):1085-1088.
[8]Pungercar J,Strukelj B,Gubensek F,et al.Complete primary structure of lamb preprochymosin deduced from cDNA[J]. Nucleic Acids Research,1990,18(15):4602.
[9]Kappeler S R,Van Den Brink H J,Rahbek-Nielsen H,et al.Characterization of recombinant camel chymosin reveals superior properties for the coagulation of bovine and camel milk[J].Biochemical and Biophysical Research Communications, 2006,342(2):647-654.
(责任编辑:李春丽)
Cloning and Prokaryotic Expression Vector Construction of Bovine Chymosin
ZHANG Li, J IANG Yuan-yuan, ZHANGJian, YANG Zhen-nai*
(Center of Agro-Food Technology,Jilin Academy of Agricultural Sciences,Changchun,130033,China)
In this study,the total RNA of chymosin was extracted from absomum of calf and its cDNA was obtained by RT-PCR.The purified RT-PCR products and pMD-18T vector were ligated and transformed into host strainE.coliJM109.The full length of Chymosin gene is consist of 1 143 bp,and encodes 381 amino acids.The homology of the nucleotides with NM_ 180994 is 99.56%.The aim gene was expression on the prokaryotic expression vector pET-22b and a recombinant plasmid pET-22b/Chymosin was constructed successfully.
chymosin,cloning,prokaryotic expression vector,construction
Q 785
:A
1673-1689(2010)02-0271-05
2009-02-27
国家863计划项目(2006AA10Z306);吉林省科技厅重点项目(20060219、20080228);现代农业产业体系专项资金项目。
*通信作者:杨贞耐(1965-),男,江西广丰人,博士,研究员,主要从事乳品工艺及生物技术方面的研究。Email: zyang@cjaas.com
