超声波对麦胚蛋白性质及其酶解物ACE抑制活性的影响
2010-08-27赵伟睿马海乐贾俊强李云亮杨会丽
赵伟睿, 马海乐*,2,3, 贾俊强, 李云亮, 杨会丽
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.河南科技大学食品与生物工程学院,河南洛阳 471039;3.江苏省农产品生物加工与分离工程技术研究中心,江苏镇江 212013)
超声波对麦胚蛋白性质及其酶解物ACE抑制活性的影响
赵伟睿1, 马海乐*1,2,3, 贾俊强1, 李云亮1, 杨会丽1
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.河南科技大学食品与生物工程学院,河南洛阳 471039;3.江苏省农产品生物加工与分离工程技术研究中心,江苏镇江 212013)
为了提高麦胚分离蛋白酶解产物的降血压活性,采用超声波处理麦胚分离蛋白。研究了超声波功率对麦胚分离蛋白的溶解度、表面疏水性、荧光光谱、巯基含量变化、水解度和酶解产物对血管紧张素转换酶(ACE)相对抑制活性的影响。结果表明:经超声波处理后,小麦胚芽球蛋白的荧光光谱和巯基含量均发生了显著的变化。麦胚分离蛋白的溶解度和表面疏水残基含量随着超声波功率的增加而提高,但当超声功率达到800 W后,增幅趋于平缓。经超声波前处理后,ACE抑制活性明显提高,而麦胚分离蛋白的酶解产物水解度没有明显变化,因此ACE抑制活性的提高是由于蛋白结构的变化造成的。在超声功率800 W时,酶解产物的ACE相对抑制活性提高了41.09%。
超声波处理;麦胚蛋白;结构;ACE抑制活性;酶解
在食品的加工与消化过程中,蛋白质通过蛋白酶的作用会释放出血管紧张素转换酶(ACE)抑制肽,它通过抑制血管紧张素转换酶活性,阻碍有升高血压作用的血管紧张素Ⅱ的生成,同时抑制具有降血压作用的血管舒缓激肽的分解,从而起到降血压作用[1]。由于食物源ACE抑制肽因其安全性高,副作用小,易吸收等特点,使酶解蛋白质制备ACE抑制肽成为了生物活性肽研究的热点[2-3]。
通过物理场作用可以使蛋白质结构发生改变,使蛋白质的结构发生改变,从而改变蛋白质的加工性能,降解性能以及暴露[4]。超声波作为一种物理强化手段,可在瞬间产生高温和几千个大气压的高压,并伴有强大的冲击波或射流[7]。因此,超声波会使媒质的状态、组成、结构和功能等发生变化。本研究通过超声前处理麦胚分离蛋白,在研究超声波处理对小麦胚芽分离蛋白结构的影响的基础上,研究了超声波前处理麦胚蛋白对制备麦胚蛋白降血压肽活性的影响,为超声波强化制备小麦胚芽分离蛋白降血压肽提供了一定的理论和参考。
1 材料与方法
1.1 材料
脱脂小麦胚芽:河南漫天雪面粉厂产品;中温淀粉酶480L(527.50KNU/g):Novo公司;Alcalase2.4LFG蛋白酶(2.670AU/g):Novo公司产品;血管紧张素转换酶(ACE)、1–苯胺基–8–萘磺酸盐(ANS)、5,5’–二硫代–2–硝基苯甲酸(DTNB),Sigma公司产品;N-(3[2-Furyl]Acryloyl)-Phe-Gly-Gly(FAPGG),Fluka公司产品;其余试剂均属国产分析纯。
1.2 仪器
WFJ 7200型可见分光光度计:尤尼柯(上海)仪器有限公司产品;HH-6数显恒温水浴锅:江苏金坛市富华仪器有限公司产品;酶标仪:Thermo公司生产。GA99-ⅡD超声细胞粉碎机:(该设备超声的频率为20kHz),无锡上佳生物科技公司产品; Avanti J–25高速冷冻离心机:美国Beckman公司生产;Cary Eclipse荧光分光光度计:美国Varian公司生产。
1.3 方法
1.3.1 麦胚分离蛋白的提取 采用文献[8]的a-淀粉酶法提取麦胚分离蛋白(DWGP),略有改动。将脱脂后小麦胚芽用粉碎机粉碎后过100目筛,将脱脂小麦胚芽粉按照质量分数为10%加入蒸馏水中,按1 g/dL加入NaCl,搅拌30 min,用1mol/L的NaOH溶液调制p H值9.0下搅拌30 min,5 000 r/ min离心20 min,获得上清液用1mol/L的HCl溶液调节p H值到6.5,采用中温淀粉酶在70℃下酶解180 min,加酶量为3 g/dL;酶法降解淀粉后,调节p H到4,得到沉淀,用水溶解,调节p H值至7.0,喷雾干燥。
1.3.2 麦胚分离蛋白的超声处理 配置1 g/dL的麦胚蛋白溶液,并控制样品溶液初始温度在15℃。分别用80 mL的麦胚蛋白溶液在不同超声功率处理20 min。对处理后的样品分别进行理化性质和功能性质分析。
1.3.3 麦胚分离蛋白的酶解 将处理与未处理的麦胚蛋白溶液在50℃水浴中平衡至50℃,加入20 μL Alcalase2.4LFG蛋白酶,在p H为9.0的条件下酶解60 min,在沸水域中灭酶10 min,冷却到室温。12 000 r/min离心10 min,移取全部上清,定溶至100 mL。
1.3.4 肽液浓度的测定方法 肽液浓度测定采用福林酚法[9]。
1.3.5 麦胚分离蛋白溶解度的测定 溶解性是蛋白质的最基本的物理性质,是影响蛋白质深度加工与应用的重要指标。将超声处理前后的麦胚分离蛋白溶液在转速10 000 r/min下离心10 min,用Folin–酚法测定上清液中蛋白含量[10],以可溶性蛋白含量表示溶解度的变化。
1.3.6 麦胚分离蛋白的表面疏水性的测定 表面疏水性采用Kato and Nakai的ANS荧光测定法[11],荧光强度与蛋白的表面疏水残基含量成正相关。测定方法:将超声波处理与未处理的蛋白样品用0.1 mol/L的磷酸氢二钠–磷酸二氢钠(p H7.0)缓冲液稀释到0.50 mg/mL,取稀释样品4 mL,加入20μL 1–苯胺基–8–萘磺酸盐(ANS)溶液(0.01 mol/L),在激发波长为390 nm(狭缝宽度为5nm),发射波长为400~650nm(狭缝宽度为10 nm)测其荧光值,扫描速度为5nm/s。
1.3.7 荧光光谱扫描 将超声波处理与未处理的蛋白样品用0.1 mol/L的磷酸氢二钠–磷酸二氢钠(p H7.0)缓冲液稀释到0.50 mg/mL分别用荧光分光光度计扫描,扫描条件为激发波长280 nm,发射波长400~800 nm,激发缝宽为2.5 nm,发射缝宽为5 nm。同时用未经超声波处理的蛋白样品作对照。
1.3.8 麦胚分离蛋白游离巯基含量的测定 游离巯基(SHF)含量采用Beveridge,Toma,and Nakai (1974).的测定方法[12],略有改动:取1 g/dL的麦胚蛋白溶液样品2 mL,加入到6 mL含有8 mol/L尿素的p H 8.0的Tris–Gly缓冲液(0.086 mol/L Tris、0.09 mol/L glycine、0.004 mol/L EDTA)中,搅拌溶解1h,10 000 r/min离心10 min。取2 mL上清液加入80μL Ellman’s试剂,立即混匀,5 min后测定412 nm吸光度。以不加样品,而加Ellman’s试剂为空白。
以Ellman’s试剂–SH的摩尔吸光系数为1.36×104计算游离巯基(SHF)的含量,SHF的计算公式如下:
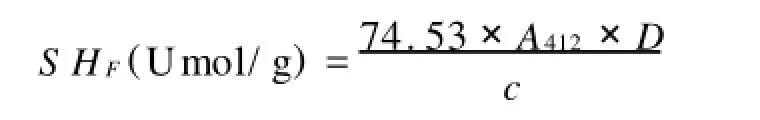
式中 A412为412nm吸光度;c为样品蛋白质(mg/ mL).D为稀释倍数。
1.3.9 水解度(DH)测定方法 水解度定义为产物中非蛋白氮含量与反应底物蛋白质质量的比值[13]。非蛋白氮是通过在反应样品中加入6 g/dL的三氯乙酸,震荡5min,12 000 r/min离心10min制备,用福林酚法测定其浓度。底物蛋白质含量由微量凯式定氮法测定。
1.3.10 ACE抑制活性的测定 采用FAPGG作为ACE的底物[14-15],按表1添加各反应组分,用酶标仪测定样品的ACE抑制活性。测定波长为340 nm。设空白孔的初始吸光度为a1,样品孔的初始吸光度为b2,在37℃的环境中反应30 min后再次测定在340 nm的吸光度,反应后空白孔的吸光度为a2,样品孔的吸光度为b2,空白的吸光度减少值A=a1-a2,样品的吸光度减少B=b1-b2,抑制率I=(A-B)/A。样品相应抑制率的质量浓度为c(mg/ mL),样品的相对抑制活性为W=I/C,单位为mL/mg。

表1 ACE抑制活性的测定Tab.1 Determination of the ACE inhibition activity
2 结果与讨论
2.1 超声处理对麦胚分离蛋白溶解度的影响
溶解度是蛋白质物化性质的指标之一,并且和蛋白质的起泡性,凝胶性和乳化性相关[16]。不同超声功率对麦胚分离蛋白溶解度的变化如图1所示。

图1 不同超声功率对麦胚分离蛋白溶解度的影响Fig.1 Effect of ultrasound power on the isolated soy protein solubility
由图1结果表明,超声处理可显著提高蛋白质的溶解度。当超声波功率低于800 W时,随着超声波功率的增加,小麦胚芽蛋白的溶解度迅速增加;超声波功率大于800 W时,小麦胚芽蛋白的溶解度增幅变缓。分析原因可能是:首先超声产生的空化效应和机械效应打开蛋白聚集体同时打断了蛋白质分子的四级结构,释放出小分子的亚基,蛋白分子部分展开,形成溶于水的非共价键分子,与溶剂水的相互作用力加强,使其溶解度增加[17],说明麦胚分离蛋白质的结构在经超声处理后放生了改变。但随着超声处理功率增大,在考察范围内的超声波能量不能进一步将分子进一步打断,所以溶解度变化不大[18]。
2.2 超声处理对麦胚分离蛋白表面疏水性的影响
表面疏水性(H0)是评价蛋白质构象改变和相关功能性质的重要结构参数,超声功率对麦胚分离蛋白H0(以荧光强度表征)的影响如图2所示,H0开始随着超声功率的增大而增大,当超声功率超过800 W时H0就不在增大,几乎保持不变,在800 W时H0比未超声提高了22.39%。这与溶解度的变化趋势是一直的。说明超声处理可以使麦胚分离蛋白分子展开,破坏蛋白质分子之间的疏水相互作用,使蛋白分子内部的疏水残基和集团暴露在蛋白质分子表面,从而使H0提高。同样当处理功率达到一定程度后,在考察范围内的超声波所具有的能量不能进一步将分子打断[18],所以不能使H0进一步提高。
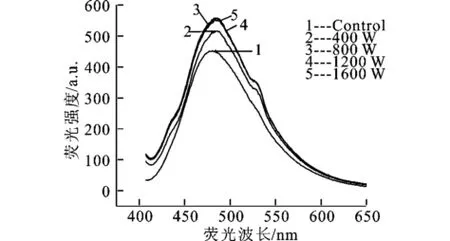
图2 超声功率对麦胚分离蛋白ANS荧光光谱的影响Fig.2 Effect of ultrasound power on the isolated DWPGANS fluorescence intensity
随着超声波功率的增加,麦胚分离蛋白表面疏水性开始增加,蛋白的溶解度也持续平稳增加, Yingqiu Li等在研究脉冲电场对大豆分离蛋白物理化学性质的影响时也出现了这种现象[10]。出现这种现象的原因可能归因于以下两个方面:①蛋白质中的自由氨基群能和邻近羧基群发生静电引力,使蛋白分子聚集,溶解度下降;超声波处理能够打断自由氨基群和邻近羧基群之间的联系,阻止蛋白分子聚集,使蛋白溶解度得到提高[19]。②小麦胚芽蛋白中谷氨酸、天冬氨酸和丝氨酸含量较高,当小麦胚芽球蛋白经超声波处理后,其分子发生了伸展,使较多的谷氨酸、天冬氨酸和丝氨酸充分暴露,这些氨基酸的暴露对蛋白溶解度的提高具有重要作用[20]。
2.3 超声波处理对小麦胚芽分离蛋白荧光光谱的影响

图3 超声波功率对小麦胚芽球蛋白荧光光谱的影响Fig.3 Effect of ultrasonic power on the fluorescence spectra of wheat germ globulin
分别对不同超声波功率处理的小麦胚芽球蛋白进行荧光扫描,扫描条件为激发波长380 nm,发射波长300~700 nm。荧光光谱截图如图3所示。从图3可以看出,在超声波前处理麦胚芽分离蛋白的激发荧光强度在发射波长340 nm附近明显高于对照组,且荧光峰移动了10 nm;而不同超声处理下蛋白激发荧光强度和荧光峰位置差异不大。蛋白具有内源荧光,蛋白激发荧光强度的改变或者发射波长的改变都可以说明蛋白分子结构发生了改变[21]。
2.4 超声处理对麦胚蛋白游离巯基含量的影响
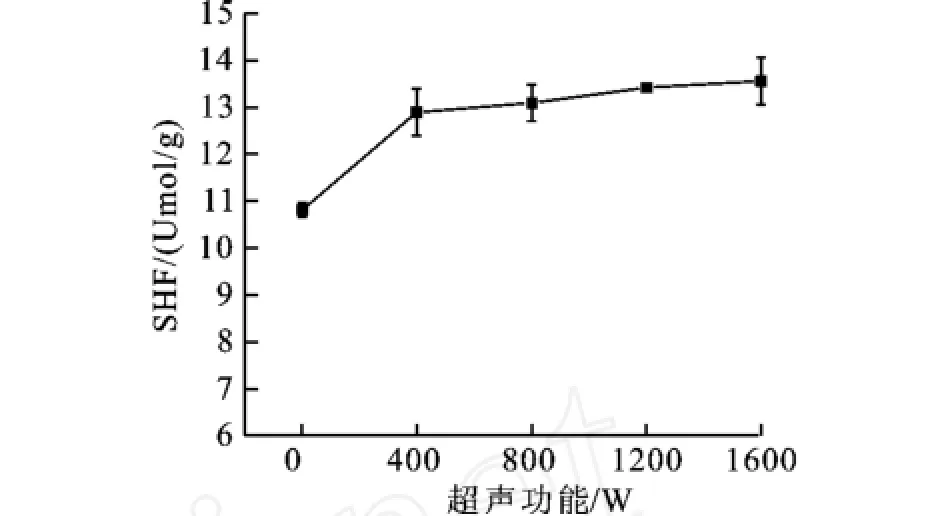
图4 不同超声处理功率对麦胚分离蛋白SHF含量的影响Fig.4 Effect of ultrasound treatment power on the SHF content of the isolated DWPG
不同超声功率对麦胚分离蛋白巯基含量SHF的影响如图4所示,从图4可以看出,在超声波功率低于400 W时,随着超声波功率的增加,小麦胚芽球蛋白巯基含量迅速增加,在超声波功率低于400 W时超声处理的麦胚分离蛋白的游离巯基含量增加幅度较小。蛋白分子中巯基的减少意味着蛋白分子的折叠,相反则说明蛋白分子发生了伸展[10,22]。本研究中,巯基的变化说明小麦胚芽分离蛋白经超声波处理后空间结构发生了变化,蛋白分子发生了伸展。
2.5 超声处理对麦胚水解度的影响
不同超声功率前处理对Alcalase酶解相应处理小麦胚芽分离蛋白样品水解度的影响如图5所示。从图5中可以看出超声处理并没有对水解度产生影响,因此超声处理没有促使更多的肽键被水解。
2.6 超声处理对酶解制备麦胚分离蛋白ACE抑制肽活性的影响
不同超声功率下前处理对制备小麦胚芽分离蛋白酶解产物ACE抑制活性的影响如表2所示。由结果表明,超声波前处理可以有效提高ACE的相对抑制活性,ACE相对抑制活性在800W处理后就几乎不在增加。这与超声处理对麦胚分离蛋白表面疏水性影响的变化规律是一致的。因此在测定条件下采用800W,前处理20min麦胚分离蛋白就可以有效提高酶解产物的ACE抑制活性,使相对抑制活性提高41.09%。
图5 不同超声功率对麦胚分离蛋白水解度的影响Fig.5 Effect of ultrasound power on the hydrolysis degree of the isolated DWPG
由于Alcalase酶解超声处理麦胚分离蛋白时与未处理之间的水解度没有变化,可以推断出相对ACE抑制活性的提高不是由于水解产生了更多肽造成的。而超声波处理对麦胚分离蛋白表面疏水集团的含量,溶解度和游离巯基含量的影响可以看出,当超声波功率低于800 W时,随着超声波功率的增加,麦胚芽分离蛋白的结构变化迅速;超声波功率大于800 W时,麦胚分离蛋白的结构变幅变缓。而相应超声处理的麦胚分离蛋白酶解产物的相对ACE抑制率变化与结构变化趋势基本相同。因此,超声前处理麦胚分离蛋白的酶解产物ACE抑制活性提高是由于超声处理使麦胚蛋白结构发生变化暴露了新的酶切位点。具体表现为麦胚蛋白表面疏水性著显提高,疏水残基和集团外露,而肽段C端为疏水性氨基酸是高活性ACE抑制肽的重要条件,Alcalase可作用的疏水性位点增多,促进了末端疏水性多肽的释放,产生了相对较多的高活性的ACE抑制肽。
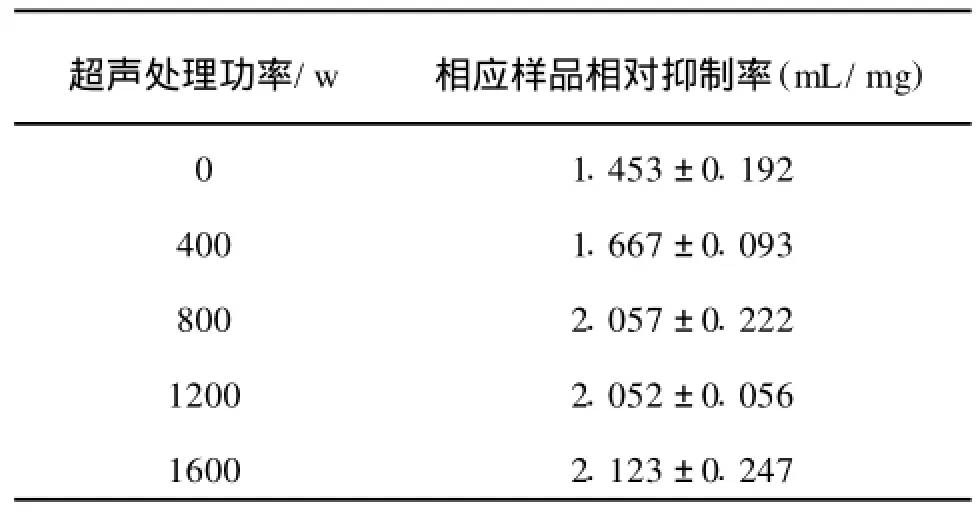
表2 超声波功率对制备小麦胚芽分离蛋白ACE抑制肽活性的影响Tab.2 Effect of ultrasound power on the ACE inhibitory activity of DWGP hydrolysis protein
4 结 语
1)超声波处理麦胚蛋白的物理化学性质分析表明:超声波处理可以提高麦胚分离蛋白的表面疏水性和麦胚分离蛋白的溶解度,游离巯基含量以及超声波处理后麦胚分离蛋白的荧光光谱发生变化,说明超声处理前后麦胚分离蛋白处理前后结构发生了改变。
2)超声波前处理麦胚分离蛋白可以提高制备的麦胚分离蛋白ACE抑制肽的抑制活性;在测定条件下采用800W,前处理20min麦胚分离蛋白就可以有效提高酶解产物的ACE相对抑制活性,达41.09%。这是由于超声处理显著提高了麦胚分离蛋白表面的疏水活性,疏水残基和集团外露(C端疏水性氨基酸是高活性ACE抑制肽的重要条件), Alcalase能作用的疏水性位点增多,促进了末端疏水性氨基酸的释放,产生了相对较多的高活性的ACE抑制肽导致的。
[1]Ondetti MA,Rubin B,Cushman DW.Design of specific inhibitors of angiotensin I-converting enzyme:new class of orally active antihypertensive agents[J].Science,1977,196:441-444.
[2]Chiang,Wen-Dee,Tsou,et al.Angiotensin I-converting enzyme inhibitor derived from soy protein hydrolysate and produced by using membrane reactor[J].Food Chemistry,2006,98(4):725-732.
[3]于娅,杨瑞金,王璋.牡蛎功能短肽的制备及ACE抑制活性.无锡轻工大学学报,2004,23(2):49-66.
YU Ya,YANG Rui-jin,WANG Zhang.Preparation of oyster functional oligopeptides and its ACE activity inhibiton capabitivty[J].Journal of Wuxi University of Light Industry,2004,23(2):49-66.(in Chinese)
[4]Bonomi F,Fiocchi A,Frokiaer H,et al.Reduction of immunoreactivity of bovine b-lactoglobulin upon combined physical and proteolytic treatment[J].Journal of Dairy Research,2003,70:51-59.
[5]Ana Quiro s,Rosa Chichon,Isidra Recio,et al.The use of high hydrostatic pressure to promote the proteolysis and re-lease of bioactive peptides from ovalbumin[J].Food Chemistry,2007,104:1734-1739.
[6]Blanca Hern andez-Ledesma,Mercedes Ramos,Isidra Recio,Lourdes Amigo.Effect ofβ-lactoglobulin hydrolysis with thermolysin under denaturing temperatures on the release of bioactive peptides[J].Journal of Chromatography A,2006,11 (16):31-37.
[7]杨瑛,李全禄,姬艳红,等.超声波处理在生物工程中的应用及展望[J],安徽农业科学,2008,4:1284-1285.
YANG Ying,LI Quan-lu,J I Yan-hong,et al.Application of ultrasonic technique in ergonomics-actuality and prospect[J]. Journal of Anhui Agricultural Sciences,2008,4:1284-1285.
[8]马海乐,辛志宏,吴守一.采用碱提酸沉与淀粉酶解复合法制备小麦胚芽蛋白的试验研究[J],农业工程学报,2004,20 (6):178-180.
MA Haile,XIN Zhihong,WU Shou-yi Preparation of wheat germ protein by combining alkali dissolution-acid deposition withα-amylase hydrolysis[J].Transactions of the Chinese Society of Agricultural Engineering,2004,20(60):178-180(in Chinese)
[9]陈俊辉,陶力,李俊,等.生物化学实验[M],第二版,北京,科学出版社,2004:244-249.
[10]YINGqiu Li,ZHENGxing Chena,Haizhen Moc.Effects of pulsed electric fields on physicochemical properties of soybean protein isolates[J].LWT,2007,40:1167-1175.
[11]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probe methods and its correlation with surface properties of proteins[J].Biochimicaet Biophysica Acta,1980,624:13-20.
[12]Beveridge T,Toma S J,Nakai S.Determination of SH and S–S groups in some food proteins using Ellman’s reagent [J].Journal of Food Science,1974,39:49-51.
[13]VanessaVermeirssen,Arie van der Bent,JohnVan Camp,et al.A quantitative in silico analysis calculates the angiotensin I converting enzyme(ACE)inhibitory activity in pea and whey protein digests[J].Biochimie,2004,86:231-239.
[14]Murray B A,Walsh D J,FitzGerald R J.Modification of the furanacryloyl-L-phenylalanylglycylglycine assay for determination of angiotensin-I-converting enzyme inhibitory activity[J].Journal of Biochemical and Biophysical Methods,2004 (59):127-137.
[15]刘志国,王亚林.米糠蛋白降血压肽(ACE抑制肽)的制备方法:中国200410012953.6[P].2005-01-12.
[16]Molina E,Papadopoulou A,Ledward D A.Emulsifying properties of high pressure treated soy protein isolate and7Sand11S globulins[J].Food Hydrocolloids,2001,15:263-269.
[17]Chin C L,Angela M,Tellez G M.Physical and mechanical properties of peanut protein films[J].Lebensm,2004,37:731 -738.
[18]刘国琴,李琳,李冰,等.超声和超高压处理对大豆分离蛋白特性影响的研究[J],河南工业大学学报:自然科学版, 2006,26(3):1-4.
Liu Guo-qin,Li Lin,Li Bing,et al.Study on the effect of power ultrasound and high pressure on solubility and forming properties of soybean protein isolate and mechanism[J].Journal of Zhengzhou Institute of Technology,2005,26(3):1-4. (in Chinese)
[19]Trevino S,Scholtz J M,Pace C N.Amino acid contribution to protein solubility:Asp,Glu,and Ser contribute more favorably than the other hydrophilic amino acids in rNase sa[J].J Mol Biol,2007,366:449-460.
[20]Cornec M.,Kim D A,NarsimhanG,et al.Adsorption dynamics and interfacial properties ofα-lactalbumin in native and molten globule state conformation at air-water interface[J].Food Hydrocolloids,2001,15:303-313.
[21]吴丹,徐桂英.光谱法研究蛋白质与表面活性剂的相互作用[J].物理化学学报,2006,22(2):254-260.
WU Dan,XU Gui-Ying.Study on protein-surfactant interaction by spectroscopic methods[J].Acta Physico-Chimica Sinica,2006,22(2):254-260(in Chinese)
[22]Arolas J L,Aviles F X,Chang J Y,et al.Folding of small disulfide-rich proteins:clarifying the puzzle[J].TRENDS in Biochemical Sciences,2006,31(5):292-301.
(责任编辑:杨萌)
Effect of Ultrasound Treatment on the Defatted Wheat Germ Protein Properties and its ACE Inhibition Activity
ZHAO Weirui1,MA Haile*1,2,3, J IA Junqiang1, LI Yunliang1, Yang Huili1
(1.College of Food and Biological Engineering,Jiangsu University,Zhenjiang,212013,China;2.College of Food and Biological Engineering,University of Science and Technology,Luoyang 471039,China;3.Jiangsu Provincial Research Center of Bio-processing and Separation Engineering of Agri-products,Zhenjiang 212013,China)
The aim of this study is to enhance the anti-hypertension activity of defatted wheat germ protein(DWGP)hydrolysate,for this,ultrasound was employed.The effects of ultrasonic power on the different indexes have been carefully investigated and an obvious difference on free sulfhydryl and fluorescence spectra of DWGP after ultrasound treatment was observed but the DWPG hydrolysis degree did not affectby the ultrasound treatment.The solubility and hydrophobicity of wheat germ globulin increase with the increasing of ultrasonic power(less than 800w).Furthermore,the relative ACE inhibitory activity of the hydrolysate was increased by 41.09%when treated by 800w ultrasound,due to the structure change of DWPG.
ultrasound treatment,defatted wheat germ protein isolate,structure,ACE inhibitoryactivity,enzymolysis
文献标识码:A
1673-1689(2010)02-0177-06
2009-04-11
国家863计划项目(2007AA10Z321);江苏省普通高校研究生科研创新计划资助(CX07B-183z)。
*通信作者:马海乐(1963-),男,陕西咸阳人,工学博士,教授,博士生导师,主要从事食品生物技术以及生物能源方面的研究。Email:mhl@ujs.edu.cn
