富血小板血浆联合钙化诱导对骨髓间充质干细胞增殖和成骨活性的影响
2010-08-09马信龙孙晓雷马剑雄王志钢张华峰
马信龙,孙晓雷,马剑雄,王志钢,张华峰
富血小板血浆联合钙化诱导对骨髓间充质干细胞增殖和成骨活性的影响
马信龙1,2,孙晓雷2,马剑雄1,王志钢1,张华峰1
目的:观察富血小板血浆与地塞米松、维生素C、β-甘油磷酸钠联合应用对体外培养的MSCs增殖和诱导成骨的影响。方法:应用密度梯度离心联合贴壁筛选法从兔髂骨骨髓中分离、纯化骨髓间充质干细胞(MSCs),取第3代MSCs随机分为3组,空白对照组加入含10%血清DMEM培养基,钙化诱导组利用含有钙化诱导剂0.1 μmol/L的地塞米松、50 mg/L的维生素C、10 mmol/Lβ-甘油磷酸钠的DMEM培养基,联合诱导组加入含有1%PRP及钙化诱导剂的DMEM培养基,诱导培养8 d。结果:MSCs传至第3代细胞多呈长梭多角形。诱导培养5 d后,空白对照组碱性磷酸酶染色弱阳性,钙化诱导组碱性磷酸酶染色为阳性,联合诱导组碱性磷酸酶染色为强阳性。诱导培养21 d,两诱导组钙结节茜素红染色均呈阳性,MTT法显示诱导培养第2~5 d联合诱导组细胞增殖明显高于钙化诱导组(P<0.05)。碱性磷酸酶定量测定显示,联合诱导组于第3 d、5 d和7 d,OD值均高于钙化诱导组(P<0.05)。结论:富血小板血浆(PRP)与地塞米松、维生素C、β-甘油磷酸钠联合应用于MSCs的成骨诱导,优于单纯钙化诱导方法,且诱导的成骨细胞具有更好的增殖及成骨活性。
富血小板血浆;骨髓间充质干细胞;诱导成骨
近年对自体富血小板血浆(platelet-rich plasma, PRP)在骨髓间充质干细胞(bone mesenchymal stem cells,MSCs)诱导成骨中的作用逐渐受到重视,但对于各诱导方法所诱导的成骨细胞增殖及分化能力报道不一。如何改善诱导方法来促进MSCs增殖,并提高诱导成骨细胞的分化能力,是一个值得深入研究的问题。本实验旨在观察一种联合诱导的方法对MSCs增殖及诱导成骨细胞分化的影响。
1 材料和方法
1.1 主要试剂与仪器 DMEM培养基、优级胎牛血清、胰蛋白酶(中国医学科学院生物医学工程研究所);地塞米松、维生素C、β-甘油磷酸钠(sigma公司);碱性磷酸酶染色试剂盒、碱性磷酸酶定量检测试剂盒(南京建成生物工程研究所);噻唑蓝、对硝基苯磷酸二钠盐、二甲基亚砜、茜素红(天津市光复精细化工研究所);培养瓶、96孔板(Corning,美国);超净工作台(SW-CJ-1F型,苏州)倒置相差显微镜(COIC,重庆);CO2培养箱(Thermo,美国),酶标测试仪(safire-2,北京);恒温离心机(Heraeus,德国)。721分光光度计(上海)。
1.2 实验动物 健康雄性新西兰大白兔1只(3月龄,2.5 kg,中国医学科学院放射研究所),实验动物级别为清洁级,实验过程中对动物处置符合动物伦理学标准。许可证号:SCXK(冀)2003-1-003)。
1.3 方法
1.3.1 MSCs的分离和培养[1]将大白兔使用20%乌拉坦肌肉注射麻醉下,16号骨髓穿刺针抽取髂骨骨髓5 mL,肝素抗凝,与等体积的PBS混匀,按1∶1的比例缓慢加入Percoll分离液(密度为1.073 g/mL)中。以1 500 r/min离心10 min,小心吸取交界处的白膜层上下约5 mL,加入等量PBS重悬细胞,1 000 r/min离心5 min,共2次。离心后弃上清加入L-DMEM培养液(含15%胎牛血清、100 U/mL青霉素、100 U/mL链霉素)重悬细胞,接种于50 mL培养瓶内,置于37℃、5%CO2培养箱中。第3 d首次换液,以后隔天换液,当细胞融合80%后,胰蛋白酶消化按1∶2传代细胞至第3代备用。
1.3.2 富血小板血浆的制备 严格无菌的条件下,用装有0.5 mL、10%枸橼酸钠的10 mL注射器,从兔耳中央静脉抽取6 mL血,采用landesberg法[2],第1次1 500 r/min离心10 min,吸取全部上清液至交界面下约3 mm,于另一离心管2 000 r/min二次离心10 min,此时分为2层。弃掉大部分上清液,余即为PRP约1 mL,将1 mL PRP加入98 mL DMEM液中,同时加入1 mL含l 000 U凝血酶的l0%CaCl2溶液,搅拌5 min,0.2滤膜过滤,即为1%PRP条件培养基,-20℃冰箱冻存[3]。
1.3.3 MSCs的分组诱导 取第3代MSCs按2.0× 104每孔接种于7个12孔板内,先以L-DMEM培养基(含100 U/mL青霉素、100 U/mL链霉素)培养1 d使各组同步化,弃去培养液PBS清洗两次。随机将每块12孔板分成2组,每组6孔。钙化诱导组加入含有钙化诱导剂0.1 μmol/L的地塞米松、50 mg/L的维生素C、10 mmol/Lβ-甘油磷酸钠的DMEM培养基,联合诱导组加入含有1%PRP及钙化诱导剂的DMEM培养基,诱导培养8 d,空白对照组加入含10%血清DMEM培养基。于第3、5、7 d每天取两组进行ALP定量测定。
1.3.4 MSCs诱导成骨细胞的鉴定 取第3代MSCs以1×104个/mL接种于4个50 mL培养瓶,瓶底放置无菌盖玻片,分别加入含钙化诱导液和联合诱导液的DMEM液。设空白对照组加入常规DMEM培养液(含15%胎牛血清、100 U/mL青霉素、100 U/mL链霉素),隔天换液培养7 d后取出盖玻片,PBS冲洗2遍,95%酒精固定10 min,以ALP试剂盒使用说明进行碱性磷酸酶组织化学染色。同上诱导培养18 d,进行钙结节茜素红染色。
1.3.5 细胞增殖测定(MTT法) 取第3代MSCs以2×104/mL细胞接种于96孔板,每孔体积200 μL,常规DMEM培养24 h使各孔细胞同步化后,随机按联合诱导组加入联合诱导DMEM培养液,钙化诱导组加入钙化诱导DMEM培养液,空白对照组加入含10%血清DMEM培养基,隔天换液。每天3组各取10孔进行增殖测定,共7 d。测定前4 h,PBS冲洗后换无血清DMEM 100 μL,加入MTT(5 mg/mL)20 μL,37℃孵育4 h,弃培养液,每孔加150 μL二甲基亚砜,震荡10 min,充分溶解后,于酶标仪上测定492 nm波长吸光度OD值。
1.3.6 碱性磷酸酶定量测定 取第3代MSCs以5× 104/mL细胞接种于24孔板,每孔为1 mL,24 h后弃培养液和未贴壁细胞,PBS洗2次,随机分组,每组24孔。以联合诱导组加入联合诱导DMEM培养液,钙化诱导组加入钙化诱导DMEM培养液。分别于第1、3、5、7 d两组各取6孔,弃培养液,PBS洗2遍,加入0.2%TritonX-100裂解液1 mL,震荡10 min,按碱性磷酸酶试剂盒(磷酸苯二钠法)说明进行操作,于分光光度计测定520 nm波长吸光度A值,计算ALP活性。
2 结果
2.1 MSCs形态学观察 细胞接种3 d后第1次换液弃去大部分不贴壁造血系细胞,可见少数圆形单核细胞贴壁,7 d后细胞开始增殖并向多种细胞形态分化,逐渐形成分散的细胞集落。约10 d后细胞集落相互融合成单层,传至第1代后细胞形态多为星形、多角形,细胞胞体较前为大且增殖加快,见图1。
2.2 细胞增殖测定结果 联合实验组与钙化对照组测定的OD值见表1,诱导培养第2~5 d联合诱导组细胞增殖均高于钙化诱导组,差异有统计学意义(P<0.05),且联合诱导组于第4 d进入平台期,早于钙化诱导组。
2.3 碱性磷酸酶钙钴染色 两诱导组碱性磷酸酶染色均呈强阳性,胞质内可见灰黑色沉着,见图2。倒置显微镜观察两组无明显差异,空白对照组诱导培养5 d后ALP染色弱阳性,胞质内见少量黑色沉着,见图3。
2.4 钙结节茜素红染色 两组诱导培养18 d后,倒置显微镜观察可见白色钙结节生成,两组无明显差异,空白对照组未见钙结节形成。经茜素红染色后,空白对照组染色为弱阴性.两诱导组均呈强阳性反应,见图4。
表1 钙化组与联合组骨髓基质干细胞的增殖情况OD值)
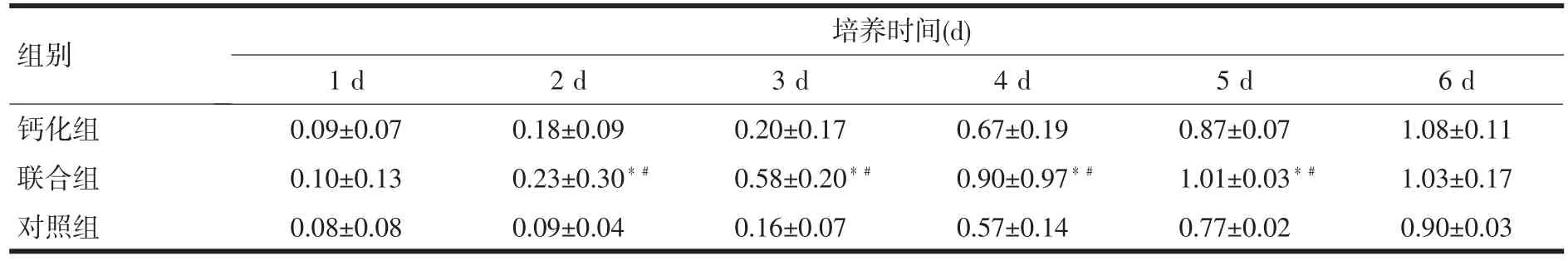
表1 钙化组与联合组骨髓基质干细胞的增殖情况OD值)
注:与钙化组比较,*P<0.05;与对照组比,﹟P<0.05
组别钙化组联合组对照组1 d 0.09±0.07 0.10±0.13 0.08±0.08 2 d 0.18±0.09 0.23±0.30*﹟0.09±0.04培养时间(d) 3 d 0.20±0.17 0.58±0.20*﹟0.16±0.07 4 d 0.67±0.19 0.90±0.97*﹟0.57±0.14 5 d 0.87±0.07 1.01±0.03*﹟0.77±0.02 6 d 1.08±0.11 1.03±0.17 0.90±0.03
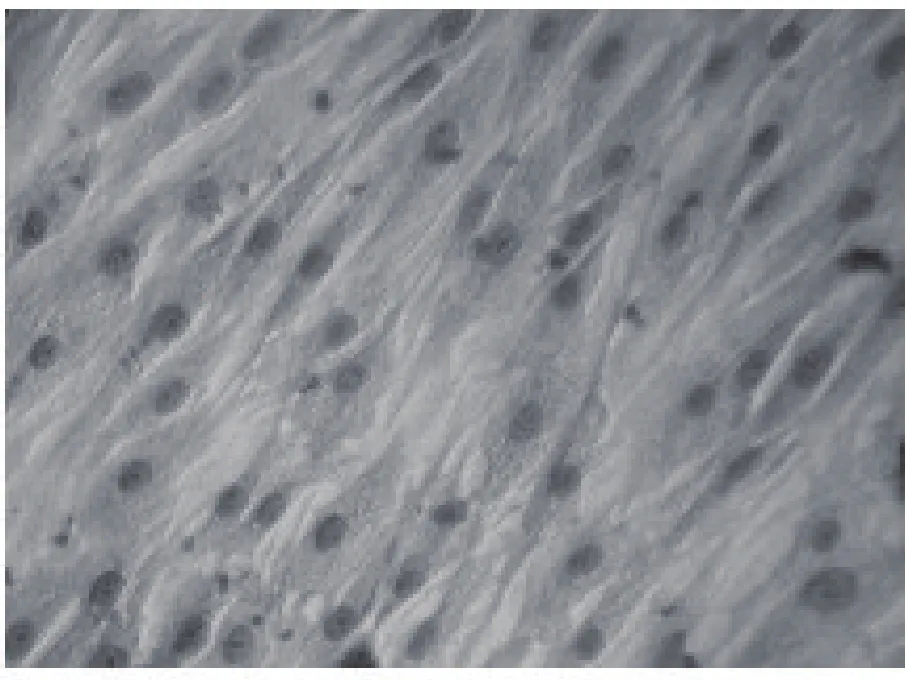
图1 第3代MSCs多呈多角形生长(HE×40)
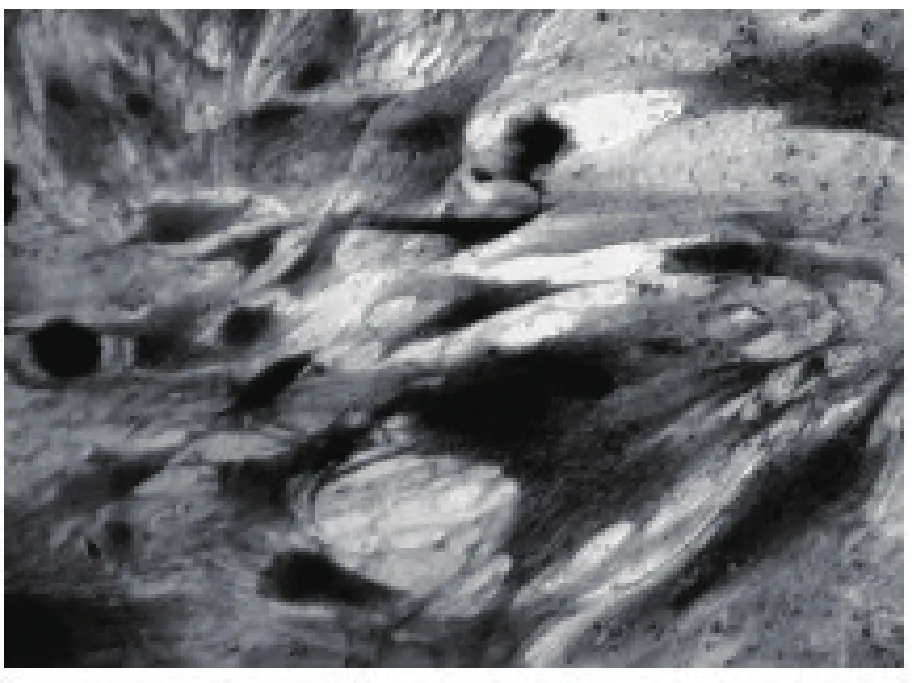
图2 联合诱导培养5 d后ALP染色强阳性,胞质内见大量黑色沉着(×100)
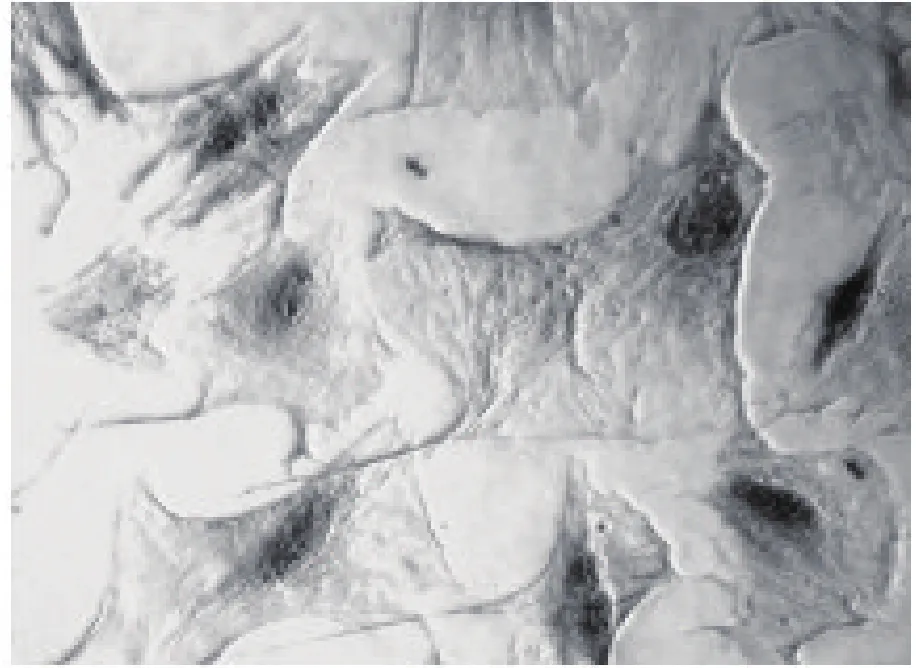
图3 钙化诱导组诱导培养5 d后ALP染色阳性,胞质内见少量黑色沉着(×100)

图4 联合诱导培养18 d后钙结节染色阳性(×40)
2.5 碱性磷酸酶定量测定 碱性磷酸酶定量测定结果,见表2。联合诱导组OD值于第3、5、7 d分别为(9.02±3.21)、(12.65±2.87)和(15.43±1.75),OD值均高于钙化诱导组,且两组差异均具有统计学意义(P<0.05),联合诱导组MSCs的ALP的表达活性有明显的增强。
表2 钙化组与联合组骨髓基质干细胞ALP的活性测定OD值)
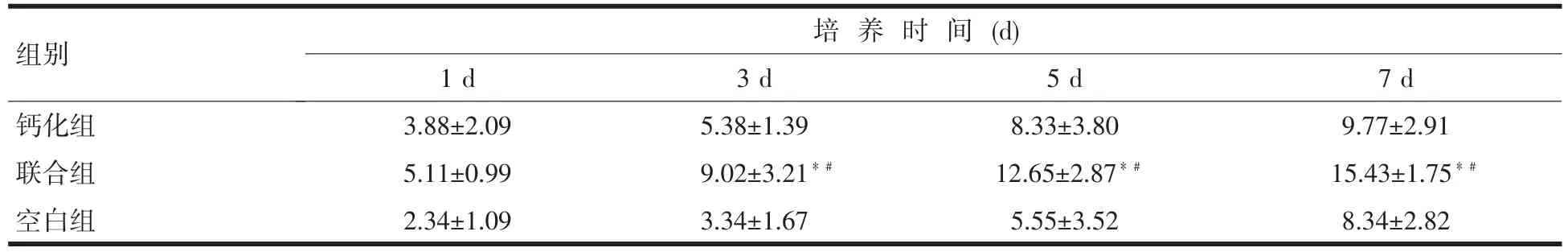
表2 钙化组与联合组骨髓基质干细胞ALP的活性测定OD值)
注:与钙化组比较,*P<0.05;与对照组比,﹟P<0.05
组别钙化组联合组空白组1 d 3.88±2.09 5.11±0.99 2.34±1.09培 养 时 间 (d) 3 d 5.38±1.39 9.02±3.21*﹟3.34±1.67 5 d 8.33±3.80 12.65±2.87*﹟5.55±3.52 7 d 9.77±2.91 15.43±1.75*﹟8.34±2.82
3 讨论
种子细胞的选择是组织工程骨的构建中关键的基础。近年来,MSCs因其取材方便、损伤小及成骨能力确切[4],正逐渐成为组织工程中较理想的种子细胞。MSCs作为多能干细胞具有多种分化潜能,但其定向成骨分化不是完全自发的过程,应用何种诱导方法,如何在较短时间内体外获得大量的种子细胞,是组织工程骨构建的关键任务之一。
目前报道已知的诱导MSCs向成骨细胞分化的因子,主要有地塞米松、维生素C、β-甘油磷酸钠等,并已成为经典诱导方法,对其诱导机制及诱导结果报道已很多。地塞米松在促进MSCs向成骨细胞分化的同时提高ALP的活性,促进细胞外基质胶原合成。维生素C的作用是促进培养的细胞合成胶原,形成钙化,并能调节ALP和非胶原基质蛋白的合成。β-甘油磷酸钠在培养液中迅速被ALP水解,产生大量磷酸离子,促进生理性钙盐的沉积和钙化,是MSCs发生钙化结节沉积的必要条件。
1984以来,对于自体富血小板血浆(platelet-rich plasma,PRP)在MSCs诱导成骨中的作用,已逐渐受到重视,为一种更优的成骨定向诱导法[5]。PRP是自体全血经过梯度离心、分离得到的血小板浓缩物,血小板含量丰富,PRP具有来源于自体、无免疫排斥、对机体损伤小等优点[6],当血小板激活时,能释放多种生长因子,其中以血小板衍生生长因子(platelet-derived growth factor,PDGF)和转化生长因子(transforming growth factor-β,TGF-β)最为重要,各生长因子的比例与体内正常比例相似,并具有最佳的协同作用[7]。
本实验将经典诱导方法和最新报道的PRP诱导方法联合起来,作为一种新的成骨诱导方法,来证实这种联合方法能够协同发挥诱导MSCs增殖与成骨定向分化的作用,并初步的探讨其可能的影响机制。在本实验中,MTT细胞增殖检测显示于细胞对数增长期,联合诱导组细胞增殖率高于传统钙化诱导组(P<0.05)。证实PRP与经典矿化诱导方法联合应用,对MSCs的增殖有着确切的协同促进作用[8],但其确切的机制有待进一步证实。应用ALP及钙结节染色的方法,证实此联合诱导的方法与传统钙化诱导方法有着相似的阳性结果,说明联合诱导同样能诱导MSCs向成骨细胞分化。为了进一步证实两组ALP表达有无差异,本实验亦进行了ALP的定量检测。
ALP是成骨细胞分化成熟的标志性酶之一[9],能够反映成骨细胞合成I型胶原、形成骨基质的能力,故ALP表达的高低能客观的反映出诱导MSCs向成骨细胞的效果[10]。在本实验中,碱性磷酸酶定量测定显示联合诱导组于第3、5、7 d,OD值均高于钙化对照组,证实此联合诱导方法能够对诱导MSCs定向分化为成骨细胞起到协同作用,比对照组有更大的成骨促进作用。其原因可能为:一是PRP中TGF-β可增强MSCs转化为成骨细胞的数量和活性;同时成骨细胞可通过自分泌和旁分泌TGF-β,刺激MSCs向成骨细胞转化[11]。二是PRP与地塞米松、维生素C、β-甘油磷酸钠均有促进MSCs的增殖的作用,尤其地塞米松的作用最为重要,可转化的MSCs细胞数量的增加亦使ALP的表达增加。三是可能因为PRP内各种因子间协同作用促进MSCs向成骨细胞转化。另外,有地塞米松、维生素C、β-甘油磷酸钠,则能提高已转化的成骨细胞表达ALP的活性,尤其以β-甘油磷酸钠作用为主。但是联合诱导时,多种因子之间确切的协同作用还有待进一步的研究证实。
[1]Pittenger M F,Mackay AM,Beck SC,et a1.Multilineage potential of adult human mesenchymal stem cells[J].Science,l999,284(54l1):l43.
[2]Landesberg R,Roy M,Glickman RS.Quantification of growth fac⁃tor levels using a simplified method of platelet-rich plasma gel preparation[J].J Oral Maxillofac Surg,2000,58(3):297.
[3]Enrico L,Amira B,Davide D,et al.Platelet-derived growth factors enhance proliferation of human stromal stem cells[J].Biomateri⁃als,2003,24(3):95.
[4]Catelas I,Sese N,Wu BM,et al.Human mesenchymal stem cell proliferation and osteogenic differentiation in fibrin gels in vitro[J]. Tissue Eng,2006,12(8):2385.
[5]Kovacs K,Velich N,HuszarT,et a1.Mistomorphometric and densi⁃tometric evaluation of the effects of platelet-rich plasma on the re⁃modeling of beta-tricalcium phosphate in beagle dogs[J].J Cranio⁃fae Surg,2005,16(1):l5O.
[6]Lucarelli E,Beccheroni A,Donati D,et al.Platelet-derived growth factors enhance proliferation of human stromal stem cells[J].Bioma⁃terials 2003,24(18):3095.
[7]FuerstG,Reinhard G,TanglS,et al.Effect of platelet-released growth factors and collagen type I on osseous regeneration of mandibular defects[J].J Clin Periodontol,2004,31(9):784.
[8]Kilic E,Ceyhan T,Cetinkaya DU.Evaluation of differentiation poten⁃tial of human bone marrow-derived mesenchymal stromal cells to cartilage and bone cells[J].Acta Orthop Traumatol Turc,2007,41(4): 295.
[9]Lin HT,Tarng YW,Chen YC,et al.Using human plasma supple⁃mented medium to cultivate human bone marrow-derived mesen⁃chymal stem cell and evaluation of its multiple-lineage potential[J]. Transplant Proc,2005,37(10):4504.
[10]Kanno T,Takahashi T,Tsujisawa T,et al.Platelet-rich plasma en⁃hances human osteoblast-like cell proliferation and differentiation [J].J Oral Maxillofac Surg,2005,63(3):362.
[11]Miyanishi K,Trindade MC,Lindsey DP,et al.Effects of hydrostatic pressure and transforming growth factor-beta 3 on adult human mesenchymal stem cell chondrogenesis in vitro[J].Tissue Eng,2006, 12(6):1419.
(收稿:2009-02-02 修回:2009-11-16)
(责任编辑 刘洪斌 田在善)
Effect of Platelet-rich PlasmaCombined with Calcifying Inductors on Proliferation and Osteogenetic Activity of Bone Mesenchymal Stem Cells
Ma Xinlong,Sun Xiaolei,Ma Jianxiong,et al. Dept.of Bone, Tianjin Medical University,Tianjin(300052),China
Objective To observe the effect of the combined inductors of platelet-rich plasma(PRP)and vitamin C,dexamethasone and β-sodium glycerophosphate on the proliferation mesenchymal stem cells of MSCs and osteoblastic induction in vitro. Methods The MSCs were cultured by density gradient centrifugation and adherence screening from rabbit flank bone.The 3rd MSCs was randomly divided into 3 groups.In the blank group the DMEM medium was used including 10%FCS.In calcifying control group the calcifying DMEM medi⁃uim was used including 0.1 μmol/L dexamethasone,50 mg/L vitamin C and 10 mmol/Lβ-sodium glycerophos⁃phate.In the combined inductors group the DMEM medium was used including 1%PRP and calcifying induc⁃tors,by 8 days of induction. Results The 3rd MSCs mainly showed polygon and whirlpool-like growth.After cultured for 5 days,the alkaline phosphatase staining of the black group showed weak positive,the alkaline phos⁃phatase staining of the two other groups showed positive.Cultured 21 days later,the calcium node staining showed positive.The MTT assay showed the cell proliferation of calcifying control group was significantly higher than combined inductors group on the 2nd to 5th days(P<0.05).ALP quantitative assay showed the OD of the combined inductors group were higher than calcifying control group in 3,5 and 7th d(P<0.05). Conclusion The combined inductors methods using 1%PRP and dexamethasone,vitamin C and β-sodium glycerophosphate is much better than that using calcifying inductors.The proliferation and osteogenetic activity of the induced os⁃teoblast are superior.
platelet-rich plasma,bone mesenchymal stem cells,osteogenetic activity
R681.2
A
1007-6948(2010)02-0195-05
天津医科大学科学基金(2005ky53)
1.天津医科大学总医院骨科(天津300052)
2.天津医院骨研所(天津300211)
孙晓雷,Tel:022-60362062,E-mail:sunden815@yahoo.cn
