醛固酮对3T3-L1前脂肪细胞与脂肪细胞内脂素表达和分泌的影响*
2010-08-02张少玲
王 川,张少玲,严 励,程 桦
(中山大学附属第二医院内分泌科,广东 广州 510120)
不适当升高的醛固酮水平可引起心血管损害[1]。与同等血压的原发性高血压患者相比,原发性醛固酮增多症患者心血管损伤发生早、程度重,且这种现象不能单用醛固酮引起水钠潴留和血压升高等效应来解释[2],因此还存在其它机制导致高醛固酮血症对机体的损害。醛固酮和脂肪细胞间存在交互作用:醛固酮可促进脂肪细胞的分化,而脂肪细胞分泌的某些因子可促进醛固酮的合成和分泌[3,4]。内脂素是脂肪细胞分泌的一种因子,它参与炎症、氧化应激和内皮损伤等多种生理病理反应[5],而且2型糖尿病患者内脂素水平与醛固酮水平呈负相关[6],这些研究提示醛固酮可能通过调节脂肪细胞内脂素的表达和分泌,参与高醛固酮血症对心血管的损伤。本实验体外培养3T3-L1前脂肪细胞和脂肪细胞,研究醛固酮对内脂素基因表达和蛋白分泌的影响及其可能机制。
材料和方法
1 细胞与试剂
3T3-L1前脂肪细胞(ATCC)、DMEM高糖培养基(Gibco)、醛固酮、安体舒通、3-异丁基-1-甲基黄嘌呤、油红 O(Sigma),Trizol(Invitrogen),SYBR PrimeScriptTMRT-PCR试剂盒(TaKaRa),PCR引物(宝生物工程有限公司设计并合成),内脂素检测试剂盒(USCN&LIFE)。
2 细胞培养和诱导分化
3T3-L1前脂肪细胞按1.5×105cells/cm2密度接种于6孔板,用含10%胎牛血清(fetal bovine serum,FBS)、25 mmol/L DMEM高糖培养液进行培养。置于37℃、5%CO2细胞培养箱中,每2 d更换培养液1次,细胞接触抑制2 d后,换用含0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、1.7 μmol/L胰岛素、1 μmol/L地塞米松和10%FBS的高糖DMEM培养液培养2 d,再换用1.7 μmol/L胰岛素和10%FBS的高糖DMEM培养液培养2 d,以后用10%FBS的高糖DMEM培养液继续培养直到细胞分化为成熟脂肪细胞。每天在倒置显微镜下观察细胞生长分化情况,诱导后约6-8 d细胞分化成熟。此时可行油红O染色进行脂肪细胞鉴定。
3 实验分组
实验分为5组,分别为:(1)对照组(control):含25 mmol/L葡萄糖的DMEM高糖培养;(2)低醛固酮组(low aldosterone,LA);(3)高醛固酮组(high aldosterone,HA):分别含10-8和10-6mol/L 醛固酮;(4)低醛固酮+安体舒通组(low aldosterone plus spironolactone,LA+SP);(5)高醛固酮+安体舒通组(high aldosterone plus spironolactone,HA+SP):分别含10-8和10-6mol/L醛固酮加10-6mol/L盐皮质激素受体拮抗剂-安体舒通。每组再分为2亚组:3T3-L1前脂肪细胞和脂肪细胞组,前脂肪细胞选择细胞融合80%左右的进行干预,脂肪细胞为成脂诱导第6 d的细胞,此时大约有80%的前脂肪细胞诱导分化成熟,每组分别处理24 h和48 h,重复3次。
4 实时RT-PCR检测内脂素和盐皮质激素受体(mineralocorticoid receptor,MR)mRNA的水平
用Trizol分别提取每组总RNA,紫外分光光度法测定RNA浓度和纯度。实时RT-PCR按SYBR PrimeScriptTMRT-PCR kit的操作说明进行,首先1 μg总RNA为模板,反应体积20 μL进行逆转录,反应条件为37℃ 15 min,85℃ 5 s。再以RT产物为模板,用SYBR green染料法进行实时PCR(ABI PRISM 7000实时PCR仪)扩增目的片段,测定内脂素和MR mRNA表达,18S作为内参照。引物序列如下:内脂素正向5'-TACTGTGGCGGGAATTGCTCTAA -3',反向5'-CCACAGACACAGGCACTGATGA-3';MR正向5'- CTTCAGTTCGTGCGGCTTCA -3',反向 5'-AGAACCTCTGCCAACTCTGTCCA-3';18S正向5'-CAACACGGGAAACCTCACC-3',反向 5'-CAGACAAATCGCTCCACCAA -3',引物浓度 10 μmol,反应体积20 μL。PCR采用两步法,第一步95℃预变性10 s,第二步95 ℃ 5 s,60 ℃ 31 s,共40 个循环,目标基因与18S mRNA进行比较,用ΔΔCt法计算相对量。反应结束后确认扩增曲线和溶解曲线。
5 酶联免疫法检测内脂素水平
取细胞培养上清液100 μL,按试剂盒说明书测量内脂素的浓度。每孔均设3个复孔,用酶标仪在450 nm波长测量各孔吸光度值,根据样品的吸光度值由标准曲线得出相应的浓度(μg/L)。
6 统计学处理
结 果
1 细胞形态及内脂素基因表达和分泌变化
随着3T3-L1前脂肪细胞向脂肪细胞分化,细胞由梭型或不规则型逐渐变圆变大,胞内可见串珠状可被油红O染成鲜红的脂滴,见图1。

Figure1.3T3-L1 adipocytes stained with oil red O(×200).图1 油红O染色后的3T3-L1脂肪细胞
随着3T3-L1前脂肪细胞向脂肪细胞分化,内脂素mRNA的表达增加,诱导第6 d和第7 d较前脂肪细胞对照分别增加了4.3倍和7.3倍(P<0.05)。
3T3-L1前脂肪细胞培养液中内脂素浓度低,无法测到,但脂肪细胞培养液中内脂素浓度随诱导时间延长明显增高,诱导第6 d和第7 d分别为(70.02±9.28)μg/L和(95.20±8.17)μg/L。
2 醛固酮对前脂肪细胞内脂素基因表达和蛋白分泌的影响
醛固酮作用前脂肪细胞24 h,LA和HA组内脂素mRNA的表达较同一时间对照组分别减少48.0%和52.0%,P<0.05;作用48 h,分别减少49.4%和46.6%,P<0.05,但与醛固酮浓度无关(LA vs HA,P>0.05)。联用安体舒通48 h,LA+SP内脂素mRNA表达高于LA,P<0.05,但仍低于对照组(P<0.05),见图2。无论有无联用安体舒通,醛固酮干预后,3T3-L1前脂肪细胞培养液中内脂素浓度仍未测到。
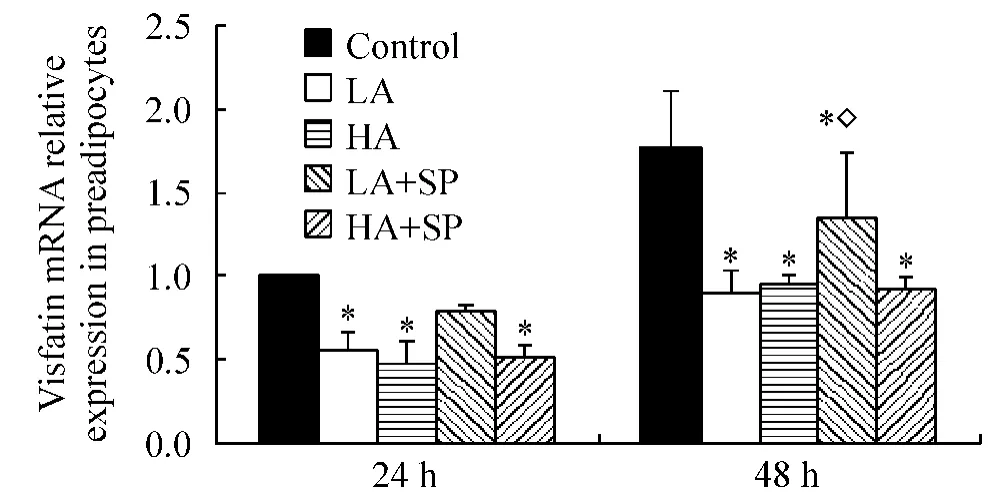
Figure2.The expression of visfatin mRNA in 3T3-L1 preadipocytes after aldosterone treatment for 24 h and 48 h..n=3.*P<0.05 vs control at the same time;◇P <0.05 vs LA at the same time.图2 醛固酮作用24 h和48 h 3T3-L1前脂肪细胞内脂素mRNA表达变化
3 醛固酮对脂肪细胞内脂素基因表达和蛋白分泌的影响
醛固酮作用脂肪细胞24 h,LA和HA组内脂素mRNA的表达较对照组分别降低43.5%和51.2%,P<0.05,培养液中脂联素浓度分别减少48.4%和47.1%,P<0.05;作用48 h,内脂素mRNA的表达降低39.7%和48.6%,P<0.05,脂联素浓度分别减少57.7%和56.1%,P<0.05,以上变化均与醛固酮的浓度无关(LA vs HA,P >0.05),见图3、4。
联用安体舒通,LA+SP的内脂素mRNA的表达以及培养液中蛋白浓度均高于LA(P<0.05),其中蛋白浓度仍然低于同一时间对照组(P<0.05);HA+SP的内脂素mRNA的表达以及蛋白浓度低于同一时间对照组(P<0.05),但与HA比较差异无显著。
4 醛固酮对前脂肪细胞和脂肪细胞MR基因表达的影响
3T3-L1脂肪细胞MR基因表达较前脂肪细胞降低,诱导第6 d和第7 d分别降低30%和55%,P <0.05。
醛固酮作用前脂肪细胞48 h,LA的MR mRNA表达高于同一时间对照组(P<0.05),见图5;作用于脂肪细胞无论24 h还是48 h,LA和HA的MR mRNA表达均高于同一时间对照组(P<0.05),见图6。
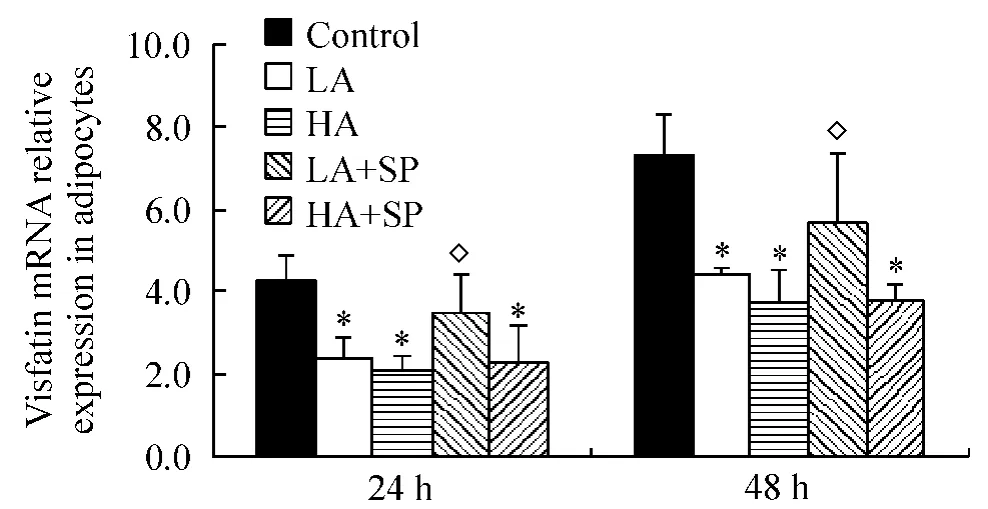
Figure3.The expression of visfatin mRNA in 3T3-L1 adipocytes after aldosterone treatment for 24 h and 48 h..n=3.*P<0.05 vs control at the same time;◇P<0.05 vs LA at the same time.图3 醛固酮作用24 h和48 h脂肪细胞内脂素mRNA表达变化
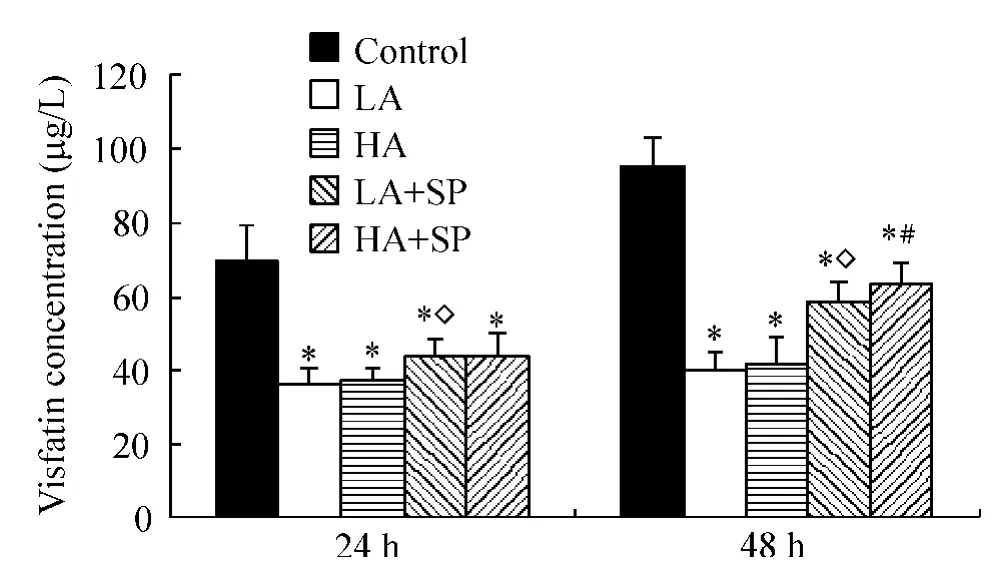
Figure4.The visfatin concentration in 3T3-L1 adipocytes after aldosterone treatment for 24 h and 48 h..n=3.*P<0.05 vs control at the same time;◇P<0.05 vs LA at the same time;#P<0.05 vs HA at the same time.图4 醛固酮作用24 h和48 h脂肪细胞内脂素浓度变化
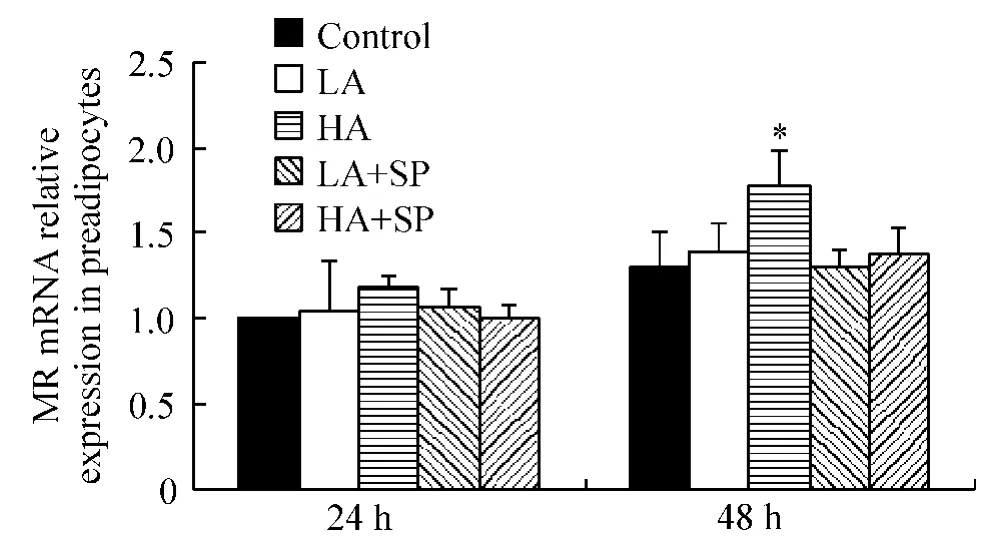
Figure5.The expression of MR mRNA in 3T3-L1 preadipocytes after aldosterone treatment for 24 h and 48 h..n=3.*P<0.05 vs control at the same time.图5 醛固酮作用24 h和48 h 3T3-L1前脂肪细胞MR mRNA表达变化
联用安体舒通,无论前脂肪细胞还是脂肪细胞,LA+SP和HA+SP的MR mRNA表达与对照组比差异无显著(P>0.05)。
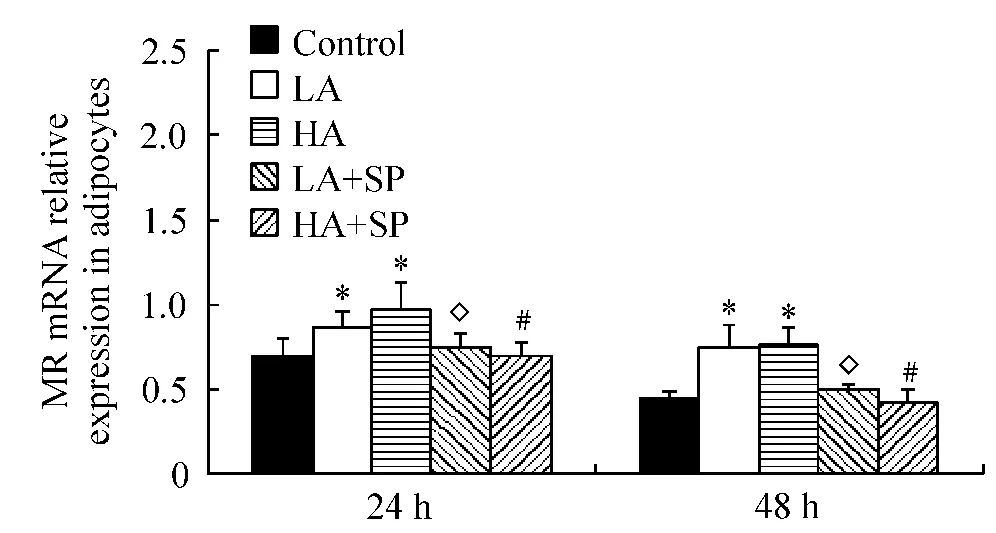
Figure6.The expression of MR mRNA in adipocytes after aldosterone treatment for 24 h and 48 h..n=3.*P<0.05 vs control at the same time;◇P<0.05 vs LA at the same time;#P <0.05 vs HA at the same time.图6 醛固酮作用24 h和48 h脂肪细胞MR mRNA表达变化
讨 论
本研究用10-8和10-6mol/L醛固酮干预3T3-L1脂肪细胞24 h和48 h,内脂素基因表达降低,同时培养液中的蛋白浓度下降,由此可见醛固酮可抑制脂肪细胞内脂素的基因表达和分泌。
醛固酮和脂肪细胞间存在交互作用:醛固酮可促进脂肪细胞的分化,而脂肪细胞分泌的某些因子可促进醛固酮的合成和分泌[3,4]。在超重的原发性高血压患者中体重指数与血醛固酮水平呈正比;体重减轻后,醛固酮水平下降[7]。此外,Wada 等[8]观察到醛固酮作用于3T3-L1脂肪细胞可抑制胰岛素诱导的葡萄糖摄取。结合本研究结果可见无论体内还是体外,醛固酮均可影响脂肪细胞的功能。
内脂素是一种由脂肪细胞分泌的脂肪细胞因子,与炎症、氧化应激、血管内皮损伤和心肌纤维化等有着密切的联系。2型糖尿病患者醛固酮水平与内脂素水平呈负相关[6],而安体舒通可增加糖尿病肾病患者内脂素水平[9]。细胞实验显示血管紧张素Ⅱ可抑制体外培养的人脂肪细胞内脂素mRNA表达,而血管紧张素转化酶抑制剂可增加内脂素mRNA表达[10]。因此我们推测醛固酮抑制脂肪细胞内脂素的基因表达和分泌,可能参与了其对心肾等脏器损害。
本实验还观察到醛固酮促进MR基因表达,而安体舒通可对抗醛固酮这种作用。醛固酮可与MR特异结合,醛固酮水平的变化能引起细胞内MR数量的改变,并且不同疾病状态和不同细胞MR变化趋势不一致。醛固酮可降低大鼠循环中单核细胞MR的数量,而对B和T淋巴细胞MR的数量无影响。在糖尿病患者中,低醛固酮水平伴随着单核细胞MR表达的上升;相反,在妊高征的患者中,低醛固酮血症却降低单核细胞MR的表达[11]。而本研究中醛固酮促进了脂肪细胞MR基因的表达。
MR是核受体家族的一员,近年来,MR的作用日益受到重视。MR不仅维持水钠平衡,还与心血管重构、行为认知以及脂肪分化等病理生理反应有关。细胞内MR数量的变化可引起功能的改变,在小鼠前脑选择性地敲除MR,会损伤小鼠的空间学习能力;相反,在前脑选择性地过表达MR,会导致小鼠应激后焦虑样行为的减少[12]。在小鼠心肌细胞上过度表达MR可引起离子通道重建,心室复极延长,导致严重室性心律失常[13]。激活MR可促进前脂肪细胞分化为成熟的脂肪细胞[14]。此外,MR拮抗剂-安体舒通可增加肥胖糖尿病小鼠脂肪组织[15]和糖尿病肾病患者[9]内脂素水平。结合本研究结果:联用安体舒通,醛固酮对3T3-L1脂肪细胞内脂素基因表达和分泌的抑制作用减弱,提示MR与脂肪细胞的功能有着密切联系。
总之,本研究显示醛固酮可抑制3T3-L1脂肪细胞内酯素的基因表达和分泌,提示脂肪细胞及其分泌的内脂素可能参与了高醛固酮对机体的损伤,这为我们治疗高醛固酮血症带来的危害提供了一种新的思路,但体内情况如何尚需进一步研究。
[1]田晓虹,曲 鹏,夏稻子,等.Goldblatt大鼠心肌组织和血浆醛固酮变化及其valsartan对左室肥厚和心功能的影响[J].中国病理生理杂志,2000,16(10):950.
[2]Bochud M,Nussberger J,Bovet P,et al.Plasma aldosterone is independently associated with the metabolic syndrome[J].Hypertension,2006,48(2):239 -245.
[3]Jeon JH,Kim KY,Kim JH,et al.A novel adipokine CTRP1 stimulates aldosterone production[J].FASEB J,2008,22(5):1502 -1511.
[4]Schinner S,Willenberg HS,Krause D,et al.Adipocyte-derived products induce the transcription of the StAR promoter and stimulate aldosterone and cortisol secretion from adrenocortical cells through the Wnt-signaling pathway[J].Int J Obes(Lond),2007,31(5):864 - 870.
[5]Sommer G,Garten A,Petzold S,et al.Visfatin/PBEF/Nampt:structure,regulation and potential function of a novel adipokine[J].Clin Sci(Lond),2008,115(1):13-23.
[6]Takebayashi K,Suetsugu M,Wakabayashi S,et al.Association between plasma visfatin and vascular endothelial function in patients with type 2 diabetes mellitus[J].Metabolism,2007,56(4):451 -458.
[7]Dall'Asta C,Vedani P,Manunta P,et al.Effect of weight loss through laparoscopic gastric banding on blood pressure,plasma renin activity and aldosterone levels in morbid obesity[J].Nutr Metab Cardiovasc Dis,2009,19(2):110-114.
[8]Wada T,Ohshima S,Fujisawa E,et al.Aldosterone inhibits insulin-induced glucose uptake by degradation of insulin receptor substrate(IRS)1 and IRS2 via a reactive oxygen species-mediated pathway in 3T3-L1 adipocytes[J].Endocrinology,2009,150(4):1662 -1669.
[9]Matsumoto S,Takebayashi K,Aso Y.The effect of spironolactone on circulating adipocytokines in patients with type 2 diabetes mellitus complicated by diabetic nephropathy[J].Metabolism,2006,55(12):1645 -1652.
[10]Storka A,Vojtassakova E,Mueller M,et al.Angiotensin inhibition stimulates PPAR gamma and the release of visfatin[J].Eur J Clin Invest,2008,38(11):820 -826.
[11]Wacker J,E -Mistry N,Bauer H,et al.Mineralocorticoids and mineralocorticoid receptors in mononuclear leukocytes in patients with pregnancy-induced hypertension[J].J Clin Endocrinol Metab,1992,74(4):910 -913.
[12]Kolber BJ,Wieczorek L,Muglia LJ.Hypothalamic- pituitary-adrenal axis dysregulation and behavioral analysis of mouse mutants with altered glucocorticoid or mineralocorticoid receptor function[J].Stress,2008,11(5):321-338.
[13]Ouvrard-Pascaud A,Sainte-Marie Y,Benitah JP,et al.Conditional mineralocorticoid receptor expression in the heart leads to life - threatening arrhythmias[J].Circulation,2005,111(23):3025 -3033.
[14]Caprio M,Feve B,Claes A,et al.Pivotal role of the mineralocorticoid receptor in corticosteroid-induced adipogenesis[J].FASEB J,2007,21(9):2185 -2194.
[15]Guo C,Ricchiuti V,Lian BQ,et al.Mineralocorticoid receptor blockade reverses obesity-related changes in expression of adiponectin,peroxisome proliferator-activated receptor- gamma,and proinflammatory adipokines[J].Circulation,2008,117(17):2253-2261.
