野生型p53基因转染U14细胞增强肿瘤抗原的免疫原性*
2010-08-02黄永红徐方云王红梅徐优慧温淦升
黄永红,徐方云△,王红梅,徐优慧,温淦升
(1南昌大学医学院病理生理学教研室,2江西中医学院,江西 南昌 330006)
p53基因是肿瘤抑制基因的一种,其表达的正常蛋白少量存在于胞核内。p53基因突变存在于大约50%以上的人类各种恶性肿瘤中[1,2]。p53基因的突变通常会导致肿瘤细胞中P53蛋白的过度表达。来源于过度表达P53蛋白的肽可由主要组织相容性抗原(major histocompatibility antigen,MHC)Ⅰ类分子提呈,于肿瘤相关表位发挥作用,诱导产生P53特异性的细胞毒性T淋巴细胞(cytotoxicity T lymphocyte,CTL)反应;一系列实验表明10%-20%的人类肿瘤患者血清中均存在抗P53抗体[3]。说明机体存在针对P53的B细胞和T细胞免疫反应。因此,P53蛋白可以作为肿瘤抗原成为肿瘤免疫治疗的靶标。本研究采用p53基因修饰小鼠宫颈癌U14细胞,观察经p53修饰U14细胞瘤苗能否增强小鼠脾细胞对U14细胞的细胞毒作用,为进一步探讨宫颈癌的疫苗治疗提供实验基础和理论依据。
材料和方法
1 材料
1.1 动物 昆明种(Kunming,Km)处女鼠,5-6周龄,体重18-22 g,南昌大学医学院动科部提供。实验期间,全价营养颗粒饲料喂养,自由饮水。
1.2 肿瘤细胞 小鼠宫颈癌U14细胞株,U14细胞系Km小鼠异位诱发的可移植性宫颈未分化鳞状细胞癌。在本研究室采取细胞悬液Km小鼠腹腔接种已传代多年。
1.3 主要试剂 质粒pC53-SN3、阳离子脂质体Lipofectin均为本教研室贮存产品;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、λDNA/HindⅢ购自华美生物工程公司;小牛血清购自杭州四季青生物工程材料研究所;G418购自北京博大泰克生物基因;RPMI-1640干粉培养基购自Gibco;小鼠抗人P53单抗(sc-126)购自北京中杉生物试剂公司;辣根过氧化物酶(horse radish peroxidase,HRP)标记羊抗小鼠IgG购自华美生物工程公司。
2 方法
2.1 质粒的提取纯化及鉴定 将含pC53-SN3质粒的大肠杆菌进行扩增,参照质粒提取纯化试剂盒说明进行提取纯化质粒,再用HindⅢ酶切、电泳鉴定。
2.2 p53基因的转染和筛选 收集处于对数生长期的U14细胞,将其分为U14细胞对照组和p53-U14细胞组。基因转染采用脂质体转染方法,转染方法及筛选步骤见参考文献[4]。
2.3 转染克隆的鉴定 采用链霉菌亲生物素蛋白-过氧化物酶连接法(streptavidin peroxidlase coiliugateti method,SP法)检测抗性细胞中P53蛋白的表达,设立未转染细胞组和空白对照组。
2.4 细胞瘤苗的制备 用磷酸缓冲溶液(phosphate buffer solution,PBS)(pH7.2)将p53-U14细胞和U14细胞浓度调整为1×1011cells/L,然后细胞经-80℃/37℃条件下反复冻融4次,将冻融物于4000 r/min离心5 min,收集上清于13000 r/min离心60 min,再将上清经滤膜过滤除菌,分装,-80℃冻存备用。
2.5 细胞毒作用的测定 制备效应细胞悬液:取9只Km处女鼠,随机分成3组即:p53-U14细胞瘤苗组、U14细胞瘤苗组、空白对照组,每组3只动物,分别腹腔注射p53-U14细胞瘤苗、U14细胞瘤苗和PBS各0.2 mL(细胞总数为2×107cells/mouse)进行免疫,间隔7 d,再同法免疫1次,7 d后将各动物颈椎脱臼处死。无菌条件下取脾脏,用眼科剪将其剪碎,用注射器针芯轻轻压磨剪碎的脾脏后过200目滤网。PBS漂洗1次,Tris/NH4Cl处理5 min去红细胞,再用PBS漂洗3次,台盼蓝拒染实验确定细胞活力(>95%),重悬于含10%小牛血清的RPMI-1640完全培养液中,调整细胞浓度为5×109cells/L。制备靶细胞悬液:将U14细胞重悬于含10%小牛血清的RPMI-1640完全培养液中,调整细胞浓度1×109cells/L。实验分3组:p53-U14细胞瘤苗组、U14细胞瘤苗组和空白对照组(PBS组)。在96孔细胞培养板中各孔按效靶比20∶1和40∶1分别加入效应细胞和靶细胞,每孔设3个平行孔,置于37℃、5%CO2培养箱培养20 h。实验终止前4 h,加入MTT 10 μL/well继续培养4 h后;用10%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-0.01 mol/L HCl溶液100 μL/well振荡器上振荡至颗粒完全溶解。过夜,酶标仪测570 nm波长处吸光度(absorbance,A)值,求出3孔A值平均值。按下列公式计算各组细胞杀伤率:
杀伤率=[1-(实验孔A均值-效应细胞孔A均值)/靶细胞孔A均值]×100%。
3 统计学处理
结 果
1 p53质粒的鉴定及基因转染与转染克隆的筛选
将提取的质粒DNA进行酶切检测。pC53-SN3用核酸限制性内切酶HindⅢ切割,设立未用HindⅢ酶切的pC53-SN3作为对照。酶切产物于0.8%琼脂糖凝胶电泳,电泳完毕后于紫外检测仪下观测,可见相应条带出现,显示所提取的质粒DNA大小正常,含p53质粒DNA。转染后72 h用选择性培养基进行筛选,筛选后10 d,未转染细胞全部死亡,维持选择培养4周,可见抗G418克隆出现,取少量抗性细胞到新培养瓶进行扩大培养,命名为p53-U14细胞。
2 抗性细胞基因表达的检测
p53-U14细胞组可见P53表达,主要表现为胞核着棕黄色,染色深浅不一,有部分细胞可见很深的黄染,而U14细胞组和阴性对照组细胞胞核未见着棕黄色。
3 细胞毒作用的测定
MTT比色法检测表明,p53-U14细胞瘤苗组脾细胞杀伤活性最高,U14细胞瘤苗组脾细胞杀伤活性次之,空白对照组最低,见表1。经统计学分析,在效靶比为20∶1和40∶1时,各组与p53-U14细胞组比较有极显著差异(P<0.01)。
表1 MTT法测定不同效靶比时效应细胞杀伤活性Table1.The cytotoxicity of effector cells at the different ratios by MTT(.n=3)
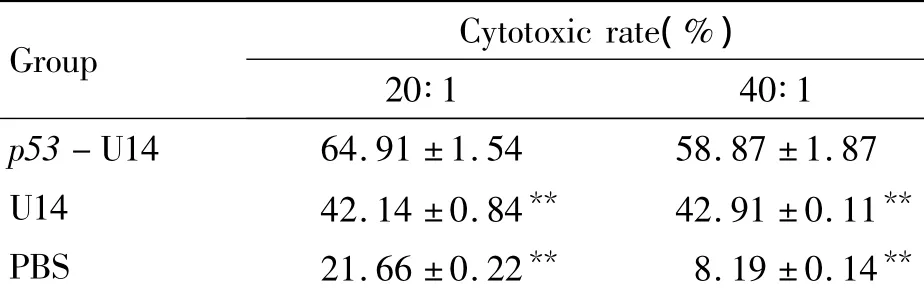
表1 MTT法测定不同效靶比时效应细胞杀伤活性Table1.The cytotoxicity of effector cells at the different ratios by MTT(.n=3)
**P <0.01 vs p53-U14 group.
Group Cytotoxic rate(%)20∶1 40∶1 p53-U14 64.91±1.54 58.87±1.87 U14 42.14 ±0.84** 42.91 ±0.11**PBS 21.66±0.22** 8.19±0.14**
讨 论
大量研究证实,肿瘤免疫的中心问题是肿瘤抗原问题。肿瘤抗原肽曾被认为是最有希望的瘤苗,但实践证明,它并不一定能激发机体抗肿瘤免疫应答。原其因可能是多方面的,其中一个重要原因在于肿瘤细胞可表达多种肿瘤抗原,针对某个或某些表位产生的免疫应答不能有效抑制肿瘤细胞的生长。全细胞瘤苗可表达多种肿瘤抗原,故不失为一种好方法。但由于肿瘤细胞本身免疫原性相对较弱,因此对其进行修饰增强其免疫原性成为肿瘤免疫治疗的一种新途径。许多研究表明[5],肿瘤细胞中P53蛋白的表达较正常细胞明显上调,因此认为P53抗原是一种肿瘤相关抗原,可以成为免疫系统识别的靶标。使用突变和野生P53抗原肽进行免疫以及过继性转移野生P53特异性T细胞均可使肿瘤消退[6-9]。
在本实验研究中采用全长野生型P53基因对肿瘤细胞瘤苗进行修饰,瘤苗通过腹腔途径多次免疫小鼠,经MTT比色法证实经该细胞瘤苗免疫后的小鼠脾细胞能更有效地杀伤相应的肿瘤细胞。
对于P53抗原如何诱导免疫应答的问题,目前认为由于P53蛋白是细胞内蛋白,主要通过MHC-Ⅰ类分子途径进行提呈。P53抗原在胞浆内被蛋白酶体降解为短肽,通过抗原处理相关转运蛋白(transporters associated with antigen processing,TAP)转运至内质网,具有特定基序结构的肽段和内质网中的MHC-Ⅰ类分子结合,经高尔基体提呈于肿瘤细胞表面。在提呈过程中,蛋白酶体对肿瘤抗原的降解以及TAP对抗原肽的转运均有利于MHC-Ⅰ类分子与抗原肽的结合。含有LMP2和LMP7活性单位的蛋白酶体有选择地在疏水性或碱性氨基酸残基下游肽键对肿瘤抗原进行切割,切割出8-10个氨基酸肽段,TAP选择性地转运8-10个氨基酸的抗原肽段,这种长度正是MHC-Ⅰ类分子肽结合槽所能容纳的最适长度。提呈于肿瘤细胞表面的肿瘤抗原肽/MHC-Ⅰ类复合物与T细胞受体(T-cell receptor,TCR)互补结合,提供初始(naïve)CD8+T细胞活化所需的抗原识别信号。CD8+T细胞在识别P53抗原的同时获得B7/CD28、CD40/CDL等共刺激分子提供的协同刺激信号才能活化,活化的CD8+T细胞增殖并分化为功能性CTL细胞还需CD4+T细胞分泌的IL-2的辅助,才可以达到最优的免疫效能。
[1]Hollstein M,Sidransky D,Volgelstein B,et al.p53 mutations in human cancers[J].Science,1991,253(5015):49-53.
[2]李辰生,李乐平,李 卫,等.48例广西结直肠癌p53基因突变分析[J].中国病理生理杂志,2009,25(4):792-794.
[3]Crawford LV,Pim DC,Bulbrook RD.Detection of antibodies against the cellular protein p53 in sera from patients with breast cancer[J].Int J Cancer,1982,30(4):403-408.
[4]黄永红,徐方云,王红梅,等.稳定表达外源性p53基因U14细胞系的建立及鉴定[J].江西医学院学报,2006,46(5):27-28.
[5]Theobald M,Biggs J,Dittmer D,et al.Targeting p53 as a general tumor antigen[J].Proc Natl Acad Sci USA,1995,92(26):11993-11997.
[6]Nikitina EY,Chada S,Muro-Cacho C,et al.An effec-tive immunization and cancer treatment with activated dendritic cells transduced with full length wild type p53[J].Gene Ther,2002,9(5):345-352.
[7]Sirianni N,Ha PK,Oelke M,et al.Effect of human papillomavirus-16 infection on CD8+T cell recognition of a wild type sequence p53264-272 peptide in patients with squamous cell carcinoma of the head and neck[J].Clin Cancer Res,2004,10(20):6929-6937.
[8]Tokunaga N,Murakami T,Endo Y,et al.Human monocyte derived dendritic cells pulsed with wild type p53 protein efficiently induce CTLs against p53 overexpressing human cancer cells[J].Clin Cancer Res,2005,11(3):1312-1318.
[9]Leffers N,Lambeck AJ,Gooden MJ,et al.Immunization with a P53 synthetic long peptide vaccine induces P53-specific immune responses in ovarian cancer patients,a phase II trial[J].Int J Cancer,2009,125(9):2104-2113.
