草酸共沉淀法合成的LiNi0.5Mn1.5O4的性能
2010-07-05赵巧丽叶乃清
赵巧丽,叶乃清,李 龙
(有色金属及材料加工新技术教育部重点实验室,桂林理工大学材料科学与工程学院,广西桂林 541004)
LiCoO2、LiMn2O4、LiNiO2及 LiFePO4等正极材料的电压都低于4 V(vs.Li)[1],限制了电池的工作电压和输出功率。向LiM n2O4中掺入一定量的过渡金属元素(M)后,材料除了在4 V处有一个放电平台外,在5 V附近还会有一个较大的放电平台,放电比容量可达130~150 mAh/g[2]。4 V处的平台对应的是LiMxMn2-xO4中Mn3+/Mn4+电对的氧化-还原过程,而4.5 V以上的平台对应 M3+(或M2+)/M4+电对的氧化-还原过程[3]。LiMxMn2-xO4(M=Ni、Co、Cr或 Fe)的容量和电压平台,取决于M 的种类和用量[4]。
LiNi0.5Mn1.5O4具有良好的循环性能、较高的放电容量和近乎单一的4.7 V放电平台,成为5 V锂离子电池正极材料的研究热点。合成LiNi0.5Mn1.5O4的方法可分为固相法、液相法两类。固相法简单易行,但当合成温度高于650℃时,氧缺陷严重,材料的组成会偏离化学计量比,容易出现LizNi1-zO等杂质[5];同时存在能耗高、粉体颗粒尺寸较大、形貌不规则和团聚严重等问题[6]。液相法主要包括溶胶-凝胶法、微乳液法、水热合成法和共沉淀法等[7]。共沉淀法的最大优点是反应过程较易控制。以碳酸铵(或碳酸氢铵)为沉淀剂,可合成LiNi0.5Mn1.5O4[8]。该方法可得到粒度较细的含镍碳酸锰,但镍锰的转化率不高,对母液过滤时易造成金属离子的损失,母液须回收,增加了工艺步骤。
用草酸为沉淀剂,原料价廉、易得,能使过渡金属离子快速沉淀,镍锰转化率较高;在共沉淀工序后采用直接烘干工艺,将合成的含镍草酸锰前驱体和母液一起在干燥箱中直接烘干,可得到含镍草酸锰前驱体,避免了过滤时造成的离子损失,简化了工艺步骤。本文作者以草酸为沉淀剂,用共沉淀法合成了尖晶石结构的正极材料LiNi0.5M n1.5O4,并分析了煅烧温度、煅烧时间及锂过量对产物电化学性能的影响。
1 实验
1.1 LiNi0.5Mn1.5O4的合成
按物质的量比 0.5∶1.5将 Ni(CH3COO)2◦4H2O(汕头产,AR)、Mn(CH3COO)2◦4H2O(汕头产,AR)配成总金属离子浓度为 2 mol/L的混合溶液;将草酸 H2C2O4◦H2O(汕头产,AR)配制成2 mol/L的溶液;按 n(NH3)∶n(Ni+Mn)=5∶1量取氨水NH3◦H2O(汕头产,AR)。将镍锰混合溶液、络合剂氨水和沉淀剂草酸溶液通过瞬间反应滴加方式,滴入盛有少量水的反应器中,水浴温度为50℃,体系的pH值约为8,使它们发生共沉淀,大约10 min滴加完成,得到含镍草酸锰前驱体。滴加时,3种溶液的出口绑在一起,混合溶液和氨水的出口在上,草酸溶液的出口在下,使混合溶液先与氨水反应,形成络合溶液,再与草酸反应。
将合成的含镍草酸锰前驱体和母液一起在120℃下干燥24 h,再在500℃下预烧8 h。冷却、研磨后,过100目筛,与 LiOH◦H2O(汕头产,AR)按 n(Li)∶n(Ni+Mn)=1.00∶2.00、1.05∶2.00(锂过量 5%)、1.10∶2.00(锂过量 10%)或1.15∶2.00(锂过量 15%)混匀,再在马弗炉中,750 ℃、800℃、850℃、900℃或 950℃下煅烧 12 h、16 h或20 h。随炉冷却、研磨后,过300目筛,得到正极材料 LiNi0.5Mn1.5O4。
1.2 合成产物的结构和形貌分析
用X′pert PRO型X射线衍射仪(荷兰产)对合成产物的物相和结构进行分析,采用CuKα辐射,Ni滤波器,步长为0.02°、扫描速率为15(°)/min。用JSM-6380SV型扫描电子显微镜(日本产)观察合成产物的形貌。
1.3 电池的组装及电化学性能测试
将质量比为 85∶10∶5的产物 LiNi0.5Mn1.5O4、乙炔黑(宁夏产,99.99%)和聚偏氟乙烯(江苏产,99.9%)与溶剂1-甲基-2-吡咯烷酮(上海产,AR)混匀,制成浆料并均匀涂覆在16 μ m厚的铝箔(佛山产,99.7%)上。在 120℃下真空(真空度为-0.1 MPa)干燥24 h以上,用专用冲具冲成厚度约为0.1 mm、直径约为16 mm,含85%活性物质的工作电极。
以直径约为16 mm的金属锂箔(北京产,电池级)为负极,Celgard 2400膜(美国产)为隔膜,1 mol/L LiPF6/EC+DEC+DMC(体积比2∶2∶1,张家港产,AR)为电解液,在充满高纯氩气的手套箱中组装2015型扣式电池。
用CT3008W-5V-10mA-S4型锂离子电池测试系统(深圳产)测定电池的充放电容量。恒流充放电电流为0.1 C,充放电电压范围为3.5~4.9 V。
2 结果与讨论
2.1 合成产物的结构和形貌
锂过量10%,在850℃下煅烧16 h合成的产物的XRD图见图1。
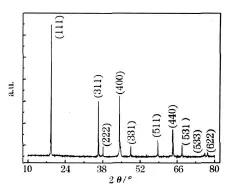
图1 在850℃下煅烧16 h合成的产物(锂过量10%)的XRD图Fig.1 XRD pattern of products synthesized by calcining at 850℃for 16 h(excess 10%lithium)
从图1可知,合成产物的衍射峰可按尖晶石结构指标化,衍射数据与 LiNi0.5Mn1.5O4标准衍射数据(PDF卡号:080-2162)几乎吻合,表明合成产物为尖晶石结构的 LiNi0.5Mn1.5O4。合成产物的衍射峰尖锐,说明结晶良好。
从图 1可知,在衍射峰(222)、(400)和(440)的左侧几乎没有杂质峰,说明制备了近乎纯相的LiNi0.5Mn1.5O4。
锂过量10%,在850℃下煅烧16 h合成的产物的 SEM图见图2。

图2 在850℃下煅烧16 h合成的产物(锂过量10%)的SEM图Fig.2 SEM photographs of product synthesized by calcining at 850℃for 16 h(excess 10%lithium)
从图2可知,合成产物结晶很好,晶型发育完善,具有清晰的八面体晶形,颗粒大小较均匀,平均粒径为1~2 μ m。
2.2 煅烧温度对产物电化学性能的影响
对锂过量10%,在不同温度下煅烧16 h合成的LiNi0.5Mn1.5O4进行充放电测试,结果见图3。
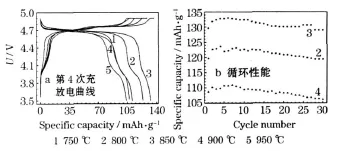
图3 在不同温度下煅烧16 h合成的产物(锂过量10%)的充放电性能Fig.3 Charge-discharge performance of products synthesized by calcining at different temperature for 16 h(excess 10%lithium)
从图 3可知,在750℃、800℃、850℃、900℃和 950℃下煅烧合成的产物,最高放电比容量分别为107.3 mAh/g、123.6 mAh/g、133.0 mAh/g、110.9 mAh/g 和 103.8 mAh/g。在800℃、850℃和900℃下煅烧合成的产物,第30次循环时的放电比容量分别为 119.4 mAh/g、129.0 mAh/g和106.2 mAh/g,与最高放电比容量相比,容量保持率分别为96.6%、97.1%和95.8%。在850℃下煅烧合成的产物,放电比容量、容量保持率最高,说明850℃为最佳煅烧温度。煅烧温度过高,容易出现LizNi1-zO杂质;同时,锂在高温下挥发严重,会造成缺锂[9];煅烧温度过低,离子扩散速度较慢,需要更长的时间才能形成高度有序的尖晶石结构。
2.3 煅烧时间对产物电化学性能的影响
锂过量10%,在850℃下煅烧不同时间合成产物的第4次充放电曲线见图4。
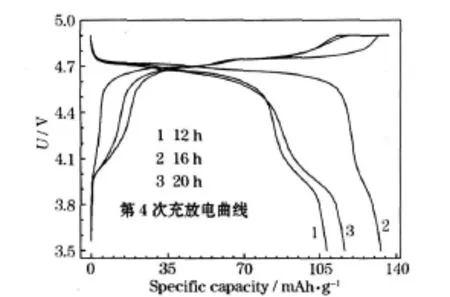
图4 在850℃下煅烧不同时间合成的产物(锂过量10%)的充放电曲线Fig.4 Charge-discharge curves of products synthesized by calcining at 850℃for different time(excess 10%lithium)
从图4可知,在850℃下煅烧16 h的合成产物,放电比容量最高,4 V平台几乎消失,说明最佳煅烧时间为16 h。通过离子扩散形成高度有序的尖晶石结构需要一定时间,煅烧时间过短,不能形成高度有序的尖晶石结构;煅烧时间过长,锂在高温下挥发严重,会造成缺锂。
2.4 补锂量对产物电化学性能的影响
在实际的合成反应中,由于锂在高温下挥发,要在原料中添加过量的锂加以弥补。在850℃下煅烧16 h,不同锂过量合成的产物的第4次充放电曲线见图5。
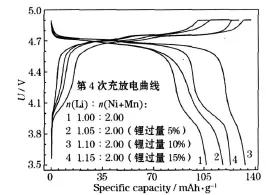
图5 在850℃下煅烧16 h合成的锂过量不同的产物的充放电曲线Fig.5 Charge-discharge curves of products with different excess lithium amount synthesized by calcining at 850℃for 16 h
锂过量过少,仍会有锂的不足;锂过量过多,会导致n(Li)∶n(Ni+Mn)偏离化学计量比,可能会产生较多的杂质。从图5可知,适当的锂过量对弥补高温下挥发造成的缺锂是必要的,当补锂量的化学计量比达到 n(Li)∶n(Ni+Mn)=1.10∶2.00(即锂过量10%)时,产物的电化学性能最好。
3 结论
以 LiOH◦H2O、Ni(CH3COO)2◦4H2O 和 Mn(CH3COO)2◦4H2O为原料,H2C2O4◦H2O为沉淀剂,NH3◦H2O为络合剂,合成了几乎不含杂质、具有尖晶石结构的锂离子电池正极材料LiNi0.5Mn1.5O4。合成产物的结晶良好,具有清晰的八面体晶形。含镍草酸锰的前驱体预烧后,与LiOH◦H2O混合,制备的最佳条件是:在850℃下煅烧16 h,锂过量10%。在此条件下合成的产物,首次放电比容量为133.0 mAh/g,第30次循环时的放电比容量为129.0 mAh/g,与最高放电比容量 133.0 mAh/g相比,容量保持率为97.1%。
[1]Liu G Q,Wang Y J,Qi L,et al.Synthesis and electrochemical performance of LiNi0.5Mn1.5O4spinel compound[J].Electrochim Acta,2005,50(9):1 965-1 968.
[2]CHEN Li-quan(陈立泉).锂离子电池正极材料的研究进展[J].Battery Bimonthly(电池),2002,32(1):6-8.
[3]Alca′ntara R,Jaraba M,Lavela P,et al.Optimizing preparation conditions for 5 V electrode performance and structural changes in Li1-xNi0.5Mn1.5O4spinel[J].Electrochim Acta,2002,47(11):1 829-1 835.
[4]Park S H,Sun Y K.Synthesis and electrochemical properties of 5 V spinel LiNi0.5Mn1.5O4cathode materials prepared by ultrasonic spray pyrolysis method[J].Electrochim Acta,2004,50(2-3):434-439.
[5]Yi T F,Shu J,Zhu Y R,et al.Structure and electrochemical performance of Li4Ti5O12-coated LiMn1.4Ni0.4Cr0.2O4spinel as 5 V materials[J].Electrochem Commun,2009,11(1):91-94.
[6]Oh S H,Jeon S H,Cho W II,et al.Synthesis and characterization of the metal-doped high-voltage spinel LiNi0.5Mn1.5O4by mechanochemical process[J].J Alloys Compd,2008,452(2):389-396.
[7]Ito A,Li D C,Lee Y S.Influence of Co substitution for Ni and Mn on the structural and electrochemical characteristics of LiNi0.5Mn1.5O4[J].J Power Sources,2008,185(2):1 429-1 433.
[8]Fan Y K,Wang J M,Ye X B,et al.Physical properties and electrochemical performance of LiNi0.5Mn1.5O4cathode material prepared by a co-precipitation method[J].Mater Chem Phys,2007,103(1):19-23.
[9]T IAN Hua(田华),YE Nai-qing(叶乃清),WANG Jian(王建),et al.锂离子电池正极材料 LiNi1/3Co1/3Mn1/3O2的低温燃烧合成[J].Chemistry Online(化学通报),2007,(11):857-860.
