吡格列酮对动脉粥样硬化大鼠核因子-κ B表达的影响
2010-06-08王慧敏陈还珍
王慧敏,陈还珍
动脉粥样硬化(AS)的发病率在逐年上升,严重影响了人们的健康。研究表明,炎症反应对AS的形成起关键性的作用[1]。核因子-kappaB(nuclear factor-kappaB,NF-κ B)是调节基因转录的关键性因子,并参与了许多与炎症反应有关的基因表达调控。新近研究发现,NF-κ B也存在于血管内皮细胞、血管平滑肌细胞中,并且与动脉粥样硬化的发生与发展有关,NF-κ B激活后,将导致炎症相关因子的过度表达,引起明显的炎症反应[2]。吡格列酮是一种合成的过氧化物增殖物激活型受体γ(PPARγ)激动剂,PPAR激动剂不仅调节代谢,而且能抑制血管的炎症反应,具有抗 AS作用。本研究采用吡格列酮观察对核因子-κ B表达的影响,从而为 PPARγ激动剂抗动脉粥样硬化的作用提供理论依据。
1 材料与方法
1.1 主要试剂和仪器 吡格列酮(艾可拓,日本武田药品工业株式会社生产,天津武田药品有限公司分装);胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(LDL-C)试剂盒、低密度脂蛋白(LDL-C)试剂盒(中生北控生物科技股份有限公司);抗鼠NF-κ B的亚基(NF-κ Bp65)抗体(北京中杉金桥生物有限公司);胆酸钠、胆固醇等均为国产分析纯;离心机(科大创新股份有限公司中佳分公司);石蜡切片机(上海市医疗器械工业公司);图像分析仪、摄像仪(上海精密科学仪器有限公司)。
1.2 动物和分组 30只重量为(110±10)g的健康雄性Wistar大鼠(由山西医科大学实验动物中心提供),随机分为3组,正常饮食组、高脂饮食组及高脂饮食加吡格列酮干预组。随机取其中10只作为正常对照组,给予普通饲料喂养 12周;20只作为高脂饮食组,予以高脂饲料喂养12周。6周后随机取10只作为高脂饮食加吡格列酮干预组,在高脂饮食基础上给予吡格列酮10 mg/(kg◦d)口服。
1.3 血脂和脂蛋白测定 实验结束时,经鼠尾取血,禁置后,3 000 r/min离心10 min制备血清,按照试剂盒要求测定3组大鼠的血脂。
1.4 病理及免疫组化切片
1.4.1 取材 25%乌拉坦腹腔注射麻醉动物,切开胸腹,游离胸腹主动脉全长,剥离外膜脂肪组织,取一段胸腹主动脉3 cm~5cm,生理盐水冲洗,置于10%中性缓冲甲醛(pH=7.2)中固定。
1.4.2 病理切片图像分析 取胸主动脉5 mm,脱水并透明15 h,常温下石蜡包埋,冷冻后切片。光镜下观察照相,用 Image Tool图像分析仪测量内膜和肌层厚度。
1.4.3 免疫组化染色 取上述普通切片,参照免疫组化试剂盒说明书进行,由北京中杉金桥生物有限公司提供抗鼠 NF-κ B的亚基 NF-κ Bp65免疫细胞化学染色,光镜初步观察,各组取3张切片,400倍镜下每张切片随机选取5个视野,采用H-SCORE法计算阳性细胞所占的比率。NF-κ Bp65阳性染色以细胞核染色为主,细胞质也有染色,呈棕黄色。
1.5 统计学处理 采用SPSS 13.0软件包进行统计,对主要指标进行正态性检验。两样本比较采用t检验,3组间比较采用One-WayANOVA分析。数据用均数±标准差(±s)表示。
2 结 果
2.1 体重测定 实验前 30只大鼠体重为 110 g±10 g,6周后,给予高脂饮食的大鼠,体重升至310 g±12 g;正常饮食的大鼠,体重为 205 g±10 g(P<0.05)。12周时高脂饮食组体重增加至390g±35g显著高于正常饮食大鼠(270g±12g,P<0.05)。吡格列酮组体重增至332 g±20 g,与高脂正常饮食组相比有统计学意义(P<0.05)。
2.2 血脂测定 实验前各组血脂水平无明显差别;12周末高脂饮食组 TC、LDL-C、TG和HDL-C均明显高于正常对照组(P<0.01);吡格列酮干预后 TC、TG、LDL-C下降,HDL-C升高,与高脂饮食组比较有统计学意义(P<0.05)。详见表1。
表1 各组血脂水平变化(±s)mmol/L
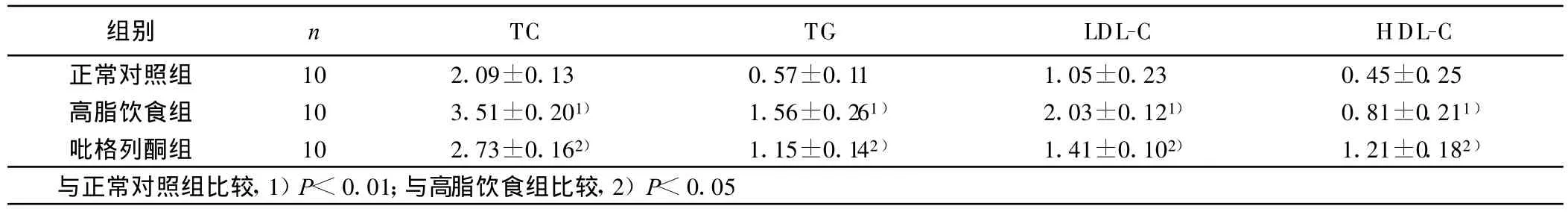
表1 各组血脂水平变化(±s)mmol/L
组别 n TC TG LDL-C HDL-C正常对照组 10 2.09±0.13 0.57±0.11 1.05±0.23 0.45±0.25高脂饮食组 10 3.51±0.201) 1.56±0.261) 2.03±0.121) 0.81±0.211)吡格列酮组 10 2.73±0.162) 1.15±0.142) 1.41±0.102) 1.21±0.182)与正常对照组比较,1)P<0.01;与高脂饮食组比较,2)P<0.05
2.3 病理切片内膜及肌层厚度对比 高脂组的主动脉内膜及 肌层厚度明显高于正常对照组(P<0.01),也明显高于吡格列酮组(P<0.01),与正常对照组相比,吡格列酮组内膜及肌层增厚,也具统计学意义(P<0.01)。详见表2。
表2 各组病理切片内膜及肌层厚度的对比(±s)μ m
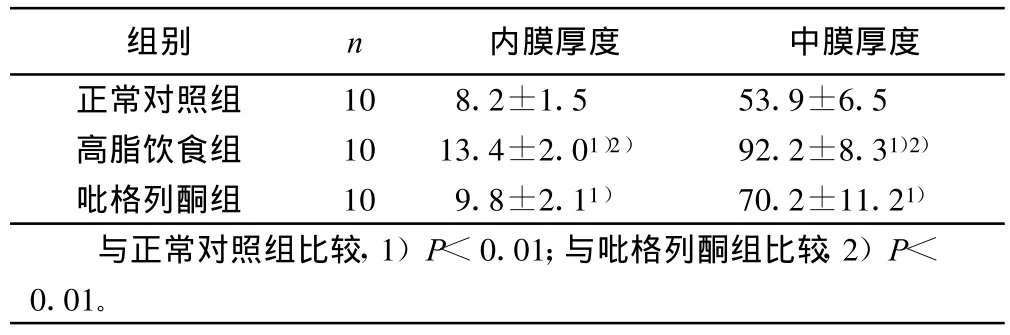
表2 各组病理切片内膜及肌层厚度的对比(±s)μ m
组别 n 内膜厚度 中膜厚度正常对照组 10 8.2±1.5 53.9±6.5高脂饮食组 10 13.4±2.01)2) 92.2±8.31)2)吡格列酮组 10 9.8±2.11) 70.2±11.21)与正常对照组比较,1)P<0.01;与吡格列酮组比较,2)P<0.01。
2.4 主动脉壁 NF-κ Bp65表达阳性率比较 正常对照组动脉壁 NF-κ Bp65阳性率明显低于高脂饮食组(P<0.05),也低于吡格列酮干预组(P<0.05);与高脂饮食组相比,吡格列酮组动脉壁 NF-κ Bp65阳性率明显降低(P<0.001)。详见表3。
表3 各组间动脉壁 NF-κ Bp65含量(±s)%

表3 各组间动脉壁 NF-κ Bp65含量(±s)%
组别 n NF-κ Bp65阳性率正常对照组 10 5.9±0.4高脂饮食组 10 76.1±1.01)吡格列酮组 10 20.1±1.21)2)与正常对照组比较,1)P<0.05;与高脂饮食组比较,2)P<0.001
3 讨 论
近年来,大量的实验证据提示炎症机制在动脉粥样硬化发生发展过程中起着非常重要的作用[3-5]。核因子-κ B又名核转录因子,是一种重要的转录因子,它对多种促炎症细胞因子、黏附分子、趋化因子和生长因子表达起着关键的调控作用[6]。有学者使用免疫组织化学和免疫荧光技术对人类AS组织研究发现,在AS组织中有明显的 NF-κ B激活现象[7]。血管内皮细胞是AS发病过程中最先被激活的细胞,单核细胞与内皮细胞黏附、向内皮下迁移及泡沫化在AS发生、发展过程中至关重要,NF-κ B通过调控细胞黏附分子的表达而参与了单核细胞浸润与迁移的全过程。因此,认为 NF-κ B是 AS发生的始动机制之一[8]。具有抑制NF-κ B作用的药物可能有防治AS的发生和发展作用[9]。
吡格列酮作为噻唑烷二酮(TZDs)类药物之一,PPARγ的高选择性、高亲和性激动剂,通过抑制血管细胞促炎基因的表达起着抗炎作用[10]。2000年以来,几项在小鼠动脉粥样硬化模型的研究表明,噻唑烷二酮类药物可以通过改善引起动脉粥样硬化的代谢危险因素以及减少动脉管壁的炎性因子而减轻动脉硬化[11,12]。Giulia等[13]证实,TZDs罗格列酮可以通过抑制NF-κ B亚基p65/RelA的转录活性及抗凋亡的NF-κ B信号通路来减轻炎症反应的作用。2005年,Goldberg等[14]对 802例合并有脂质代谢障碍的2型糖尿病患者研究发现,与罗格列酮相比,吡格列酮具有明显的降低三酰甘油和低密度脂蛋白浓度、增加高密度脂蛋白胆固醇浓度,这与本实验结果一致。支持吡格列酮对心血管起保护作用观点。
本实验通过HE染色观察到吡格列酮能减轻动脉粥样硬化大鼠主动脉内膜和肌层增厚,证实了它的抗动脉粥样硬化作用。通过采用免疫组化染色表明,动脉粥样硬化大鼠主动脉大量表达核因子-κ B,而吡格列酮能显著抑制它的表达,从而抑制促炎基因的表达,使炎症因子、细胞因子、黏附分子等生成减少。PPARγ激活后还能与转录因子NF-κ B、信号转导蛋白和转录激活子(STAT)等以非DNA结合方式相互作用,通过抑制炎症基因发挥抗炎特性,即转录抑制[15]。对NF-κ B进行深入研究将会对动脉粥样硬化的预防、诊断、治疗产生积极影响,有望成为抗动脉粥样硬化的新靶点。
[1]Ross R.Atherosclerosis an inflammato ry disease[J].N Eng J M ed,1999,340(2):115-126.
[2]Baeuerle PA,Baltimore D.NF-κ B:Ten years after[J].Cell,1996,87:13-20.
[3]Libby P,Ridker PM,Maseri A.Inflammation and atherosclerosis[J].Circulation,2002,105(9):1135-1143.
[4]唐晓明,李洁琪.5-脂氧化酶与动脉粥样硬化性疾病[J].实用医学杂志,2007,23(5):762-764.
[5]陈欣,王琳,杨汉东,等,缬沙坦对炎性动脉粥样硬化的影响[J].实用医学杂志,2006,22(13):1491-1493.
[6]Monaco C,Andreakos E,Kiriakidis S,et al.Canonical pathway of nuclear factor kappa B activation selectively regulates proinflammatory and prothrombotic responses in human atheroselerosis[J].Proc Natl Acad Sci USA,2004,101(15):5634-5639.
[7]Ritchie ME.Nuclear factor-κ B is selectively and markedly activated in humans with unstable angina pectoris[J].Circulation,1998,98:1707-1713.
[8]李建军,李庚山.核因子-κ B与冠心病的关系[J].现代诊断与治疗,2000,11:212-214.
[9]Orr AW,Sanders JM,Bevard M,et al.The subendothelial extracellular matrix modulates NF-kappaB activation by flow:A potential role in atherosclerosis[J].J Cell Biol,2005,169(1):191-202.
[10]Pasceri V,Wu HD,Willerson JT,et al.Modulation of vascular inflammation in vitro and vivo by peroxisome proliferators-activated receptor-gamma activators[J].Circulation,2000,101(3):235-238.
[11]Hsueh WA,Law RE.PPAR and atherosclerosis:Effects on cell growth and movement[J].Arterioscler T hromb Vasc Biol,2001,21(12):1891-1895.
[12]Plutzky J.PPARs in vascular biology and atherosclerosis:Emerging insights for evolving paradigms[J].Curr Atheroscler Rep,2000,24:327-335.
[13]Giulia C,Sabine G,Micheline A,et al.Activation of proliferatoractivated receptors αand γinduces apoptosis of human monocytederived macrophages[J].J Biol Chem,1998,273(40):25573-25580.
[14]Goldberg RB,Kendall DM,Deeg MA,et al.A comparison of lipid and glycemic effects of pioglitazone and rosiglitazone in patients with type 2 diabetes and dy slipidemia[J].Diabetes Care,2005,28(7):1547-1554.
[15]Marx N,Duez H,Fruchart JC,et al.Peroxisome proliferator-activated receptors and atherogenesis:Regulators of gene expression in vascular cells[J].Circ Res,2004,94:1168-1178.
