β-NGF融合蛋白的表达及其三步层析纯化工艺
2010-05-10张文俊张宇锋
张文俊,张宇锋
(天津大学药物科学与技术学院,天津 300072)
β-NGF融合蛋白的表达及其三步层析纯化工艺
张文俊,张宇锋
(天津大学药物科学与技术学院,天津 300072)
采用无血清培养基培养表达 HIR-β-NGF融合蛋白的工程细胞株 CHO,收集上清后,通过浓缩、过滤预处理,并采用亲和层析、阴离子交换层析和阳离子交换层析三步法工艺对融合蛋白进行纯化,最后用 Fc ELISA、CHOP ELISA、Western-blot等方法对目的蛋白进行质量检测.实验结果表明:HIR-β-NGF融合蛋白相对分子质量约为 190 kDa;蛋白收率达47.0%;经纯化后杂质DNA含量可降低到2.3 ng/mg以下,CHOP蛋白降到2.3 ng/mg以下,Protein A蛋白降低到49.8 ng/mg;产物仅有3.51%发生聚集;免疫印迹证明具有生物活性.该纯化工艺产品收率高,纯度高,质量检验方法稳定可靠,为大规模生产该蛋白提供参考.
神经生长因子;人胰岛素受体;融合蛋白;发酵纯化工艺;质量控制
β-神经生长因子(β-nerve growth factor,β-NGF)是神经营养因子中最早被发现的,具有神经元营养和促神经突起生长等生物学功能的一种神经细胞生长调节因子.包含α、β、γ 3个亚基,其中β亚基是活性区,由2个118个氨基酸组成的单链通过非共价键结合而成[1-2].它对中枢及周围神经元的发育、分化、生长、再生具有重要的调控作用[3-4].然而作为一种药理作用明确的生物大分子,在开发成药时一方面面临β-NGF自身无法穿透血脑屏障问题[5],另一方面也受到β-NGF在体内含量较低、来源有限的限制[6].因此如何对其进行改造并大量制备,已成为当前β-NGF研究领域中的一个极具实用价值的热点问题.
近年来,研究人员利用脑毛细血管内皮细胞膜中大量分布的转运蛋白受体,如转铁蛋白受体、胰岛素受体等,将外源药物与这些受体的特异性抗体相连,通过受体介导的内吞作用将药物转到脑组织中[7-8].因此,笔者首先将编码人的抗胰岛素受体的抗体(human insulin receptor monoclonal antibody,HIR MAb)基因与编码人β-NGF的基因片段进行连接、转染并筛选获得稳定表达融合蛋白的中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞株.然后经过发酵培养,对 HIR- β-NGF进行表达,探索三步层析大规模纯化 HIR- β-NGF的生产工艺,并对其质量检测进行研究,为HIR- β-NGF大规模生产奠定基础.
1 材料与方法
1.1 仪器及原料
β-NGF基因片段由中国药品生物制品检定所惠赠.SUNRISE酶标仪购自 TECAN;微型蛋白电泳装置和微型转膜装置购自Bio-Rad公司;Centriprep-30、70 mL离心超滤装置购自 Millipore公司;Centrifuge 5810R型离心机购自Eppendorf公司;96孔酶标板购自 Corning公司;SP-Sepharose FF、Q-Sepharose FF购自 GE Healthcare;Protein A 填料购自 Amersham Biosciences;8000-14000 Da透析袋购自北京索莱宝科技有限公司;Sartocon 50,kD购自Sartorius.
鼠抗人IgG1Fc 购自Zymed公司;人IgG κ链标准品、碱性磷酸酶标记的羊抗人 κ链购自 Sigma公司;羊抗人 IgG(H+L)、生物素化马抗羊 IgG(H+L)、兔抗β-NGF多抗和生物素化羊抗兔 IgG(H+L)购自 Vector公司;生物素标记的抗 Protein A、羊抗CHOP IgG、HRP标记的抗 CHOP购自 Cygnus技术公司;ABC 试剂盒和 DAB试剂盒购自 Vector Lab;PVDF Immobion-P膜购自Millipore公司;BCA蛋白检测试剂盒购自Pierce公司;预染的标准分子量蛋白购自 Bio-Rad公司;Tris、MES、SDS和 Glysine购自BBI公司.
1.2 细胞株的构建及培养
将β-NGF片段亚克隆至含有 HIR MAb基因的载体上,得到含有融合基因的 pHIR MAb-β-NGF质粒.用 Pvu I限制性内切酶酶切得到线性化的质粒,160,V的电压条件下电转化进入 CHO细胞.用含0.54,mg/mLG418的无血清培养基进行初筛.2周后选取阳性克隆,以不含次黄嘌呤和胸腺嘧啶的CD培养基(含有 100,nm,MTX)筛选抗 MTX的细胞克隆.MTX 的量从 20,nmol/L 增加至 80,nmol/L,通过渐增 MTX的浓度使细胞中的 DHFR基因以及与DHFR基因相连的目的基因得到大量扩增,进而提高目的基因的表达量.以表达量最高的细胞株为种子细胞株,并将该细胞株扩增建立原始细胞库、主细胞库和工作细胞库并进行发酵培养.
HIR- β-NGF融合蛋白的结构示意如图 1所示,人抗HIR的免疫球蛋白IgG恒定区Fc段由二硫键相连,2个β-NGF各通过一个氨基酸的肽接头与恒定区连接.

图1 HIR MAb-β-NGF融合蛋白结构Fig.1 Structure of HIR MAb-β-NGF
1.3 三步法纯化融合蛋白
1.3.1 Protein A亲和层析
用 5个柱体积的 buffer A(25,mmol/L Tris,25,mmol/L NaCl,5,mmol/L EDTA,pH=7.1)以 3.5,mL/min的流速平衡 Protein A柱子.取 3.4,L的发酵上清,用 Sartocon 50,kD 切向流过滤系统浓缩至400,mL,并用 0.45,µm 的滤膜过滤.以 3.5,mL/min的速度将样品加到柱子上,上样完成以相同流速换用Buffer A冲洗层析柱40,min,之后用1,mol/L NaCl洗脱层析柱,换用 30,mL Buffer A 冲洗柱子,并用70,mL Buffer B (25,mmol/L Tris,1,mol/L NaCl,5,mmol/L EDTA)洗脱重组蛋白,收集流出组分,待曲线到达基线后停止收集,共得到25,mL蛋白流出液.
1.3.2 SP-Sepharose FF阳离子交换层析
用 50 mL 的 Buffer C(0.02,mol/L MES,0.25 mol/L NaCl,pH=5.5)以3.5,mL/min的流速冲洗SPSepharose FF阳离子交换柱,并用 50,mL Buffer D(0.02 mol/L MES,0.05 mol/L NaCl,pH=5.5)平衡层析柱.将 1.3.1节得到的 25,mL 流出液,用Centriprep-30在 1,500g的转速下离心 120,min,得到5,mL液体.加入45,mL Buffer D和10,mL去离子水后,以2.5,mL/min的速度将样品加到层析柱上.之后以3.5 mL/min的流速,先后用50,mL Buffer D、30,mL Buffer C、25,mL Buffer E(0.02,mol/L MES,0.35,mol/L NaCl,pH=5.5)、50 mL Buffer F(0.02,mol/L MES,0.5 mol/L NaCl,pH= 5.5)和 50,mL Buffer G(0.02,mol/L MES,1,mol/L NaCl,pH=5.5)洗脱层析柱,每5,mL收集流出液,用Fc ELISA方法测定流出液中融合蛋白的浓度.
1.3.3 Q-Sepharose FF阴离子交换层析
将1.3.2节中用Buffer C洗脱得到的27,mL洗脱液,用 Centriprep-30浓缩至 3.8,mL后加入去离子水稀释到16.8,mL,并以2.5,mL/min的速度加到已经平衡好的Q-Sepharose FF层析柱上进行进一步纯化.先后用 25,mL的 Buffer H(0.025,mol/L Na2HPO4,0.05 mol/L NaCl,pH=7.0)、Buffer I(0.025,mol/L Na2HPO4,0.25,mol/L NaCl,pH=7.0)、Buffer J(0.025,mol/L Na2HPO4,0.5,mol/L NaCl,pH=7.0)和 Buffer K(0.025 mol/L Na2HPO4,1,mol/L NaCl,pH=7.0)洗脱层析柱,每5,mL收集流出液.将用Buffer J洗脱得到的35 mL流出液,用Centriprep-30进行浓缩后,对其中的蛋白进行鉴定和质量评价.
1.4 Fc ELISA法测定抗体浓度
采用双抗体夹心法测定融合蛋白的浓度.用100,µL 10,µg/mL 鼠抗人IgG1Fc将酶标板包被过夜.次日用 PBST溶液洗板后,封闭液封闭30,min.加入100,µL 400,ng/mL、100,ng/mL、30,ng/mL、10,ng/mL、3,ng/mL、1,ng/mL和 0,ng/mL的人 IgG κ链标准品,37,℃孵育 60,min.用 PBST洗板并加入 100,µL 0.125,µg/mL 碱性磷酸酶标记的羊抗人κ链二抗,室温孵育60,min.PBST洗板后,每孔加入100,µL PNPP试剂,暗处放置3,min,用1.2,mol/L NaOH终止反应,测定A405,绘制标准曲线并计算样品的蛋白浓度.
1.5 聚丙烯酰胺凝胶电泳
将 1.3.3节得到的蛋白进行还原态(reducing-PAGE)和非还原态(nonreducing-PAGE)聚丙烯酰胺凝胶电泳,方法见文献[9] .
1.6 蛋白质印迹
采用 SDS-聚丙烯酰胺凝胶电泳后针对 hIgG和β-NGF进行蛋白质印迹实验(Western blotting).在hIgG的Western blotting中,一抗选用羊抗hIgG(H+L),二抗选用生物素化马抗羊IgG(H+L).在β-NGF的Western blotting中,一抗选用兔抗β-NGF多抗,二抗选用生物素化羊抗兔 IgG(H+L).二者均采用DAB显色,待转印膜显色合适停止显色.转移膜置空气中干燥后,扫描留存转印图.
1.7 Protein A蛋白残留的测定
将融合蛋白的样品或标准品与蛋白变性缓冲溶液按照体积比为 1∶4混合并置于沸水中煮沸5,min,待冷却到室温后,6,000g离心 5,min,取上清待检.另取50,µL制备好的标准品或样品加入到已经用Protein A多克隆抗体包被的板条中,室温孵育60,min.用洗液洗板后加入 100,µL生物素标记的抗Protein A的二抗于孔板内,室温放置60,min.洗涤5次后加入 100 µL碱性磷酸酶标记的 Streptavidin并洗涤板框.加入 100,µL PNPP溶液室温孵育 45,min后测定A405,绘制标准曲线并计算样品中的Protein A含量.
1.8 宿主细胞CHO蛋白残留量测定
CHO 宿主细胞蛋白(CHO protein,CHOP)残留量采用双抗体夹心 ELISA法进行测定.一抗选用羊抗CHOP IgG,二抗选用 HRP标记的抗CHOP,标准品 CHOP 稀释成 40,ng/mL、10,ng/mL、3,ng/mL、1,ng/mL、0.3,ng/mL、0.1,ng/mL 和 0,ng/mL,显色底物选用OPD,操作步骤同1.4节.
1.9 DNA含量测定
采用Molecular Probes公司的Quant-iT DNA检测试剂盒,操作按照试剂盒说明书进行.
1.10 Native-PAGE
将纯化得到的样品进行非变性聚丙烯酰胺凝胶电泳(native-PAGE)以考察其产物的凝聚程度,电泳时以HIR MAb和hIgG为对照,方法见文献[9].
2 结果与讨论
2.1 融合蛋白的纯化
利用 CHO细胞表达外源融合蛋白,产物中残留的CHOP不仅具有毒性,而且有可能引起过敏反应,同时残留的DNA也是潜在的致癌性杂质,因此需要对表达出的融合蛋白进行纯化[10-11].实验首先采用Protein A亲和层析的方法对融合蛋白进行捕获,其次采用阴离子交换层析和阳离子交换层析的方法对发酵的上清液进行纯化,以期降低融合蛋白中的CHOP、宿主DNA以及纯化工艺中引入的Protein A等杂质,得到纯度较高的HIR MAb-β-NGF融合蛋白[12].具体步骤按照 1.3节进行,其中每一步的色谱图见图 2.
在图2(a)中,当样品加入到层析柱后,换用洗脱缓冲液B,在76,min时产生较强的吸收峰,融合蛋白被洗脱出来,收集该组分得到融合蛋白的粗品.将上述得到的融合蛋白采用SP-Sepharose FF进一步纯化,随着NaCl浓度从0.05,mol/L逐渐升高到0.5,mol/L,洗脱液中的离子强度逐渐增加,最终在NaCl为 0.5,mol/L时融合蛋白被洗脱液从层析柱上洗脱出来,对应于图 2(b)中保留时间为40,min的峰.将该峰对应的洗脱液进一步进行 Q-Sepharose FF的纯化(见图2(c)),洗脱液中 NaCl浓度为 0.05,mol/L时,大部分融合蛋白被洗脱出来,对应的保留时间为 35,min.收集该组份进行质量检测.采用1.4节的方法,对每一步中融合蛋白的含量进行测定,列于表1中.从表1中可以看出,经过三步纯化,最终蛋白的得率为47.0%.
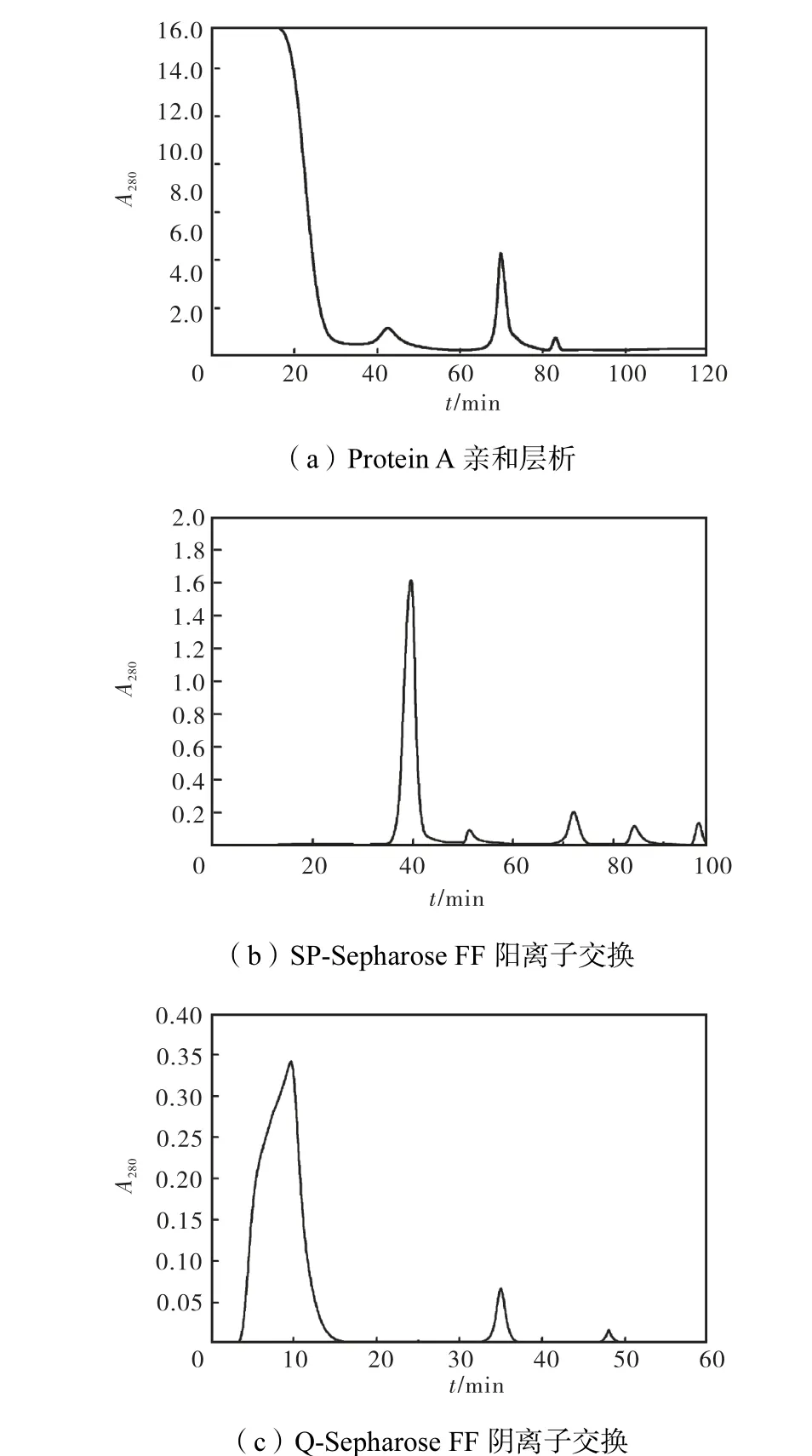
图2 三步法分离纯化融合蛋白色谱图Fig.2 Three-step purification chromatogram of fusion protein
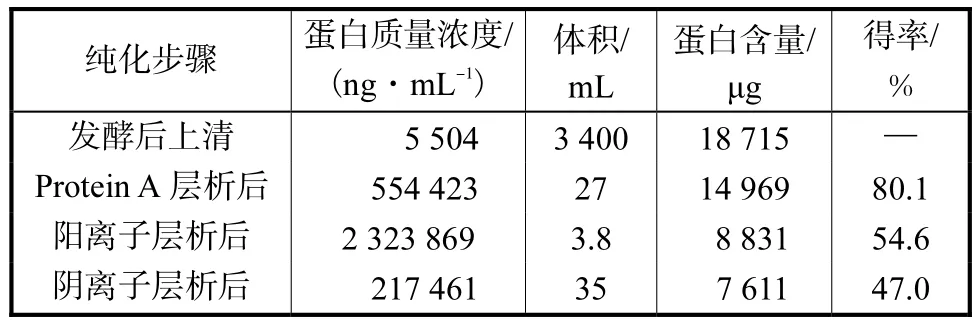
表1 三步法纯化工艺中融合蛋白的收率Tab.1 Fusion protein recovery during three-step purification process
2.2 融合蛋白的鉴定
将纯化得到的重组蛋白样品进行非还原态和还原态聚丙烯酰胺凝胶电泳,结果见图 3.从图 3(a)中可以看出,融合蛋白比 HIR MAb抗体的相对分子质量要略大,约为 190 kDa;从图 3(b)中可以看出,HIR MAb-β-NGF融合蛋白的重链条带b的相对分子质量大于 HIR MAb的重链条带 a.这些结果均表明 β-NGF被融合到了HIR MAb的重链上.

图3 重组蛋白的聚丙烯酰胺凝胶电泳Fig.3 SDS-PAGE of fusion protein
按照 1.6节的方法,对纯化后的融合蛋白样品进行 hIgG和β-NGF的免疫印迹,结果如图 4所示.在图4(a)中,在2和3下方有条带,而在1下方则没有条带产生;在图4(b)中,含有β-NGF的1下方和2下方有条带产生,结果表明不仅β-NGF被连接到融合蛋白上,而且融合蛋白 HIR-β-NGF可分别与抗 HIR MAb的抗体和β-NGF的抗体特异性结合,保持了各自蛋白的生物活性.
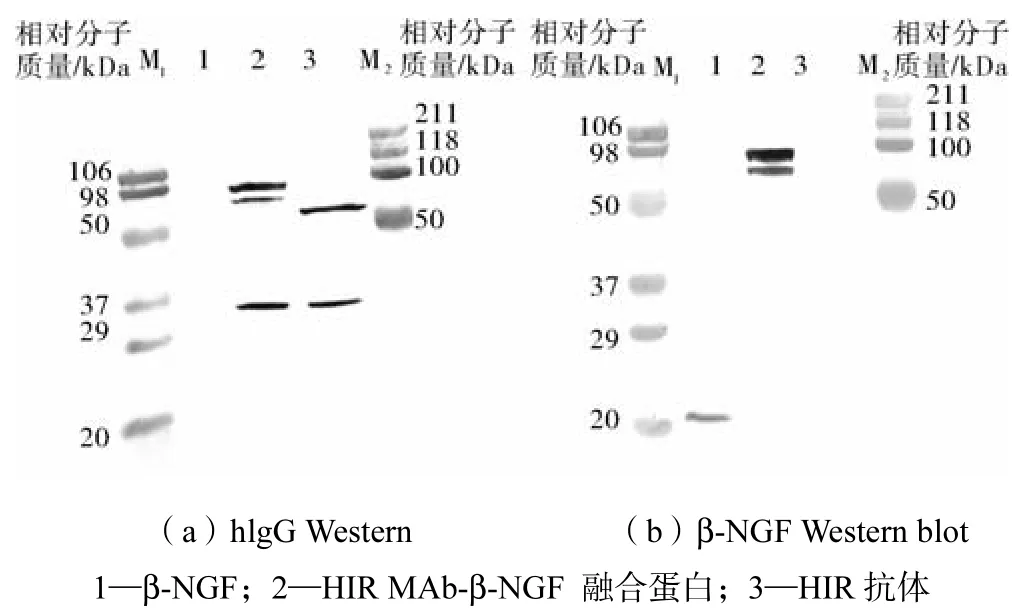
图4 重组蛋白的免疫印迹Fig.4 Western blot of fusion protein
2.3 融合蛋白的质量研究
生物制品生产过程中存在许多影响产品质量的残留物,诸如重组表达系统中宿主细胞蛋白以及生物制品加工过程中残留的污染物[13].在本研究中,由于采用 CHO细胞重组表达外源蛋白,其残留的宿主细胞蛋白 CHOP、宿主 DNA以及在融合蛋白纯化过程中引入的Protein A杂质是影响融合蛋白质量的主要因素.本实验中采用1.7节、1.8节和1.9节的方法对HIR MAb-β-NGF融合蛋白纯化过程中的 DNA、CHOP以及protein A进行检测,结果见表2.
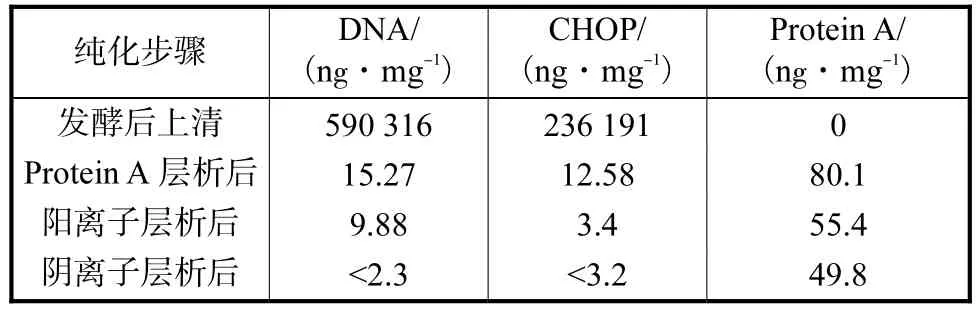
表2 纯化过程中杂质含量的测定Tab.2 Determination of impurity contents during purification process
在对融合蛋白进行亲和层析的过程中,融合蛋白利用其Fc段和Protein A的特异性结合,可以被填料所吸附,而CHOP和宿主DNA等在内的杂质大部分随着洗脱液流出.从表 2中可以看出,几乎全部的宿主DNA和CHOP在这一步得到了去除.但与此同时,由于使用了protein A作为亲和层析介质,有微量的protein A从填料上脱落混杂在融合蛋白中.已有文献[7]报道,Protein A常与抗体结合形成A-IgG复合物,具有很强的结合在阴离子交换柱上的倾向,因此可以采用离子交换层析的方法加以去除.通过本实验,最终将融合蛋白中的protein A降到了49.8 ng/mg.
融合蛋白中的另一个杂质为宿主细胞 DNA.由于 DNA带有负电荷,可强烈的结合阴离子交换柱,因此本实验采用在阳离子交换层析中让其随洗脱液穿透,在阴离子交换中让其吸附的方法,将杂质 DNA从融合蛋白中去除.从结果来看降到了2.3 ng/mg以下,得到了有效去除.此外通过离子交换,CHOP也得到了进一步的去除,降到了3.2 ng/mg以下,达到了国家药典的标准(质量分数<0.05%).
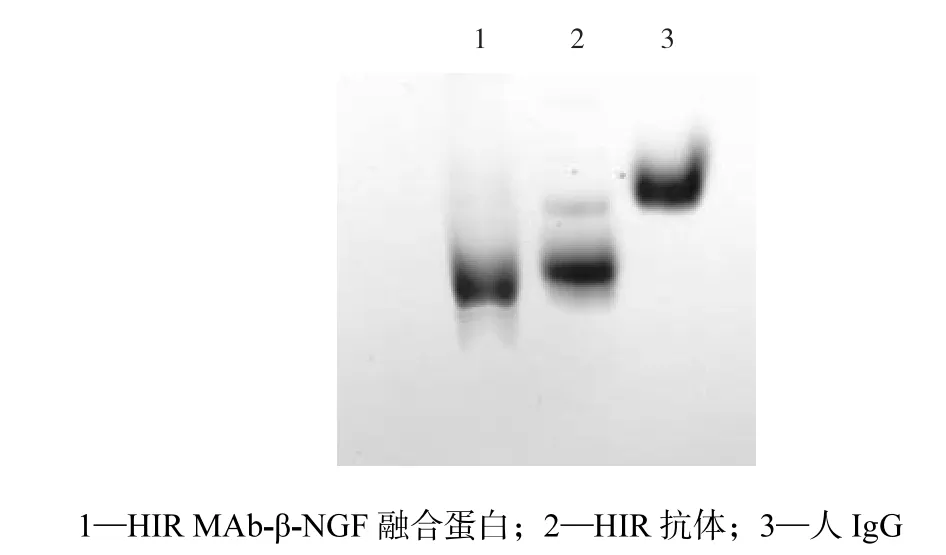
图5 重组蛋白的native-PAGE电泳Fig.5 Native-PAGE of fusion protein
按照 1.10节的方法对融合蛋白进行 Native-PAGE,考察其聚集程度,结果见图 5.从图中可以发现,融合蛋白的条带要比单纯的 HIR MAb条带迁移速度快,这主要是由于β-NGF作为一种阳离子性多肽,增加了融合蛋白的正点性,导致条带的电泳速度要大于单纯的HIR MAb.采用NIH-Image软件对融合蛋白的条带进行扫描分析,结果显示融合蛋白中只有3.51%发生聚集,其余的96.48%以单分子的形式存在,说明三步法纯化工艺不会导致融合蛋白的聚集,是一个优良的纯化工艺.
3 结 论
(1) 通过亚克隆的手段将β-NGF片段插入到HIR MAb载体上,并转染 CHO细胞,成功筛选出稳定表达融合蛋白的细胞株.
(2) 经过发酵培养,采用三步法纯化工艺对融合蛋白进行了纯化,蛋白收率为47.0%.
(3) 蛋白经纯化后,杂质 DNA含量可降低到2.3 ng/mg以下,CHOP蛋白降到了3.2 ng/mg以下,protein A蛋白可降低到49.8 ng/mg;96.48%的融合蛋白以单分子的形式存在;
(4) 该纯化工艺简单,重复性好,生产成本低,质量检验方法稳定可靠,为大规模生产 HIR MAb-β-NGF融合蛋白提供参考.
[1]Axel Ullrich,Alane Gray,Cara Berman,et al. Human βnerve growth factor gene sequence highly homologous to that of mouse[J].Nature,1983(303):821-825.
[2]Leibrock Joachim,Lottspeich Friedrich,Hohn Andreas.Molecular cloning and expression of brain-derived meurotrophic factor[J].Nature,1989(341):149-152.
[3]Sofroniew M V,Howe C L,Mobley W C. Nerve growth factor signaling,neuroprotection,and neural repair [J].Annual Review of Neuroscience,2001,24(1):1217-1281.
[4]Williams B J,Eriksdotter-Jonhagen M,Granholm A C.Nerve growth factor in treatment and pathogenesis of Alzheimer's disease[J].Progress in Neurobiology,2006,80(3):114-128.
[5]Friden P M,Walus L R,Watson P. Blood-brain barrier penetration and in vivo activity of an NGF conjugate[J].Science,1993,259(5093):373-377.
[6]Pizzuti A,Borsani G,Falini A. Detection of β-nerve growth factor mRNA in the human fetal brain[J].Brain Research,1990,518(1/2):337-341.
[7]Schwarze Steven R ,Ho Alan. In vivo protein transduction:Delivery of a biologically active protein into the mouse. [J].Science,1999,285(5433):1569-1572.
[8]Brasnjevic Ivona,Steinbusch Harry W M,Schmitz Christoph,et al. Delivery of peptide and protein drugs over the blood-brain barrier[J].Progress in Neurobiology,2009,87(4):212-251.
[9]萨姆布鲁克 J,拉塞尔D W. 分子克隆实验指南[M]. 3版. 黄培堂译.北京:科学出版社,2002.
Sambrook J,Russell D W.Molecular Cloning:A Laboratory Manual[M]. 3rd ed. Translated by Huang Peitang.Beijing:Science Press,2002(in Chinese).
[10]孙文改, 赟苗景 . 抗体生产纯化技术[J]. 中国生物工程杂志,2008,28(10):141-152.
Sun Wengai,Miao Jingyun. Antibody production technology [J].China Biotechnology,2008,28(10):141-152(in Chinese).
[11]傅 璐,黄 辉,陈舒阳. 抗 erbB2嵌合抗体 chA21大规模纯化工艺的建立及质量研究[J]. 中国生物工程杂志,2009,29(7):68-73.
Fu Lu,Huang Hui,Chen Shuyang,et al. Mass-scale purification and quality control of a single-chain chimeric anti-erbB2 antibody chA21[J].China Biotechnology,2009,29(7):68-73(in Chinese).
[12]杨建军, 泂张昕 ,周 洁. rhEPO-Fc融合蛋白的表达、纯化及质量研究[J]. 中国生物工程杂志,2007,27(6):6-9.
Yang Jianjun,Zhang Xinjiong,Zhou Jie. High expression,purification,quality control of rhEPO-Fc fusion protein[J].China Biotechnology,2007,27(6):6-9(in Chinese).
[13]Sauter A,Lambert K L,Rupf A K,et al. A three-step purification method of large quantities of human recombinant alpha endothelial cellular growth factor for clinical use[J].International Journal of Molecular Medicine,2007,19(1):97-103.
Expression of β-NGF Fusion Protein and Purification by Three Steps Column Chromatography Technology
ZHANG Wen-jun,ZHANG Yu-feng
(School of Pharmaceutical Science and Technology,Tianjin University,Tianjin 300072,China)
CHO cells expressing HIR-β-NGF fusion protein were cultured in serum free medium,then the supernate was collected and purified with a three-step purification process:affinity chromatography,cation exchange chromatography and anion exchange chromatography following concentration and filtering pretreatment;its quality was controlled by Fc ELISA,CHOP ELISA,Western-blot,etc. Experimental results show that the fusion protein relative molecular mass is about 190 kDa;protein recovery is 47.0%;DNA impurities decrease below 2.3 ng/mg;CHOP decreases below 3.2 ng/mg and Protein A decreases to 49.8 ng/mg;only 3.51% fusion protein aggregates;western blot analysis shows HIR- β-NGF kept biological activity. In conclusion,high recovery and purity are acquired and the purification process is stable and reliable,which could provide reference for large-scale production.
nerve growth factor;human insulin receptor;fusion protein;ferment and purification techniques;quality control
TQ464.7
A
0493-2137(2010)11-1031-06
2010-04-29;
2010-06-08.
张文俊(1980— ),男,博士研究生.
张文俊,tjzhangwenjun@163.com.
