延迟整流钾通道阻断药物与维拉帕米联合应用对豚鼠心室乳头肌动作电位的影响*
2010-05-07李妙龄杜俊蓉周文魏燕刘智飞杨艳裴杰曾晓荣
李妙龄 杜俊蓉 周文 魏燕 刘智飞 杨艳 裴杰 曾晓荣△
(1.泸州医学院心肌电生理学研究室,四川 泸州 646000;2.四川大学药学院药理学与生物制药系,四川 成都 610041)
延迟整流钾电流是心脏上一种重要的复极电流,也是抗心律失常药物作用的靶点之一,受PKA的调控,在心室肌上主要由快速延迟整流钾电流(IKr)和慢速延迟整流钾电流(IKs)组成。有研究显示[1-2]IKs特异性阻断剂比IKr阻断剂更具有速率依赖的优越特性,因此是一类更具优越性的抗心律失常药物,但因缺乏特异性的通道阻断药物使其对其他离子通道具有不同程度的药理作用而大大限制了临床的应用。近来研究发现,IKs阻断剂包括苯二氮卓类和 Chromanol类衍生物,其中Chromanol类衍生物 HM R1556[3]对 IKs的选择性比对IKr、Ito、ICa-L的选择性高1000倍,并能增加清醒狗的QT间期,在离体狗心肌上对APD无作用。当IKr受抑制时,IKs在复极过程中尤为重要。Jurkiewicz和Sanguinetti[1]首先认为在快心率时IKs阻断剂表现为优先选择性的延长APD作用。随后的研究发现明显阻断IKs的药物氨巴利特(Ambasilide)和阿齐利特(Azimilide)[2,4]能非频率依赖性的延长心房的APD,与多非利特(Dofetilide)相比能更有利于拮抗对迷走神经敏感的动作电位,但这些药物还可阻断其他的离子电流。这使得很难明确其与纯IKr阻断剂的作用的不同机制。随着更多的选择性的IKs阻断剂的不断发展,可以更直接的评价IKs特异性阻断剂的药理特性。
Chromanol 293B是Chromanol类衍生物,抑制IKs选择性作用强于Ito20倍以上,而对IKr并无作用,是目前公认的IKs特异性阻断剂。Bosch[5]等观察到在不同的刺激频率下Chromanol 293B能延长豚鼠和人的心室肌的APD,而Dofetilide则具有负性频率依赖性。
动作电位复极过程中,L-型钙通道的功能状态可能是诱发EAD和DAD的重要因素,研究发现EAD可被在慢心率时应用IKr阻断剂所诱发[6]。也有报道维拉帕米(Verapamil)[7]能够抑制QT间期延长综合征(Long QT syndrome,LQTS)模型心肌细胞的QT间期的延长,减少心肌离散度,防止EAD的产生,最终阻止Tdp的发生。IKr阻断剂在慢心率产生的明显作用可能依赖于L-型钙通道电流,因此 L-型钙通道电流阻断剂可能减少纯IKr阻断剂对慢心率的过度延长APD时程的作用。事实证明严重心律失常的过程中,心肌细胞内钙调控发生机制异常。因此,发展新的具有钙拮抗作用的复合型Ⅲ类抗心律失常药物,将有可能有效地治疗室性致死性心律失常并且具有较低的致心律失常作用。
因此本实验应用纯Ⅲ类抗心律失常药物Chromanol 293B、多非利特与维拉帕米联合应用来观察不同刺激频率下药物相互作用是否可以改善Ⅲ类抗心律失常药物产生的负性频率依赖性,探索致心律失常的作用机制并指导临床合理用药。
1 材料和方法
1.1 动物及药品 豚鼠,350-450g,由泸州医学院实验动物中心提供,♀♂不拘。多非利特由山东省化学药物重点实验室提供,纯度≥99%;维拉帕米(德国Knoll AG公司);Chromanol 293B和HEPES(Sigma公司);其他试剂购于国产分析纯。多非利特用盐酸溶解,Chromanol 293B用DM SO溶解,均配成1mmol◦L-1母液储存,实验前用新鲜台式液稀释至所需浓度,药物稀释后其PH值在7.2-7.4,药物稀释后最后的溶剂浓度一般不超过0.3%,此浓度对动作电位的形态无影响,每次实验新鲜配制。
1.2 方法
1.2.1 豚鼠心室乳头肌标本的制备 将豚鼠击头致昏后脱颈放血,迅速分离心脏至 100%02饱和的台式液中(mmol◦L-1:NaCl 147,KCl 5.4,CaCl21.8,MgCl21.05,HEPES 10,Glucose 11,使用前用NaOH调节pH至7.4),快速分离右心室乳头肌(选取直径0.4-0.8mm),从水平方向给予标本约0.5g的前负荷固定于10ml的恒温浴槽底部的硅胶片上,以持续100%O2、温度为36±0.5℃的台氏液灌流,流速3ml◦min-1,平衡 2h后用于实验。
1.2.2 豚鼠心室乳头肌动作电位的记录[8]肌条平衡2h后,应用一对铂金电极置于肌条的两侧(离肌条约0.2-0.3mm)作为刺激电极。用有芯玻璃毛细管(Havard,USA)在拉制仪(P-97,Sutter,USA)上拉制成玻璃微电极,将充灌3mol◦L-1KCl的玻璃微电极(阻抗 20-30MΩ)插入Ag-AgCl引导电极,固定于三维微操纵器(Narishige,Japan)上,用参比电极接地。电极入水后调零,缓慢插入电极至出现静息电位(RP)时,由电子刺激器(SEN-7203;Nihon Kohden,,Japan)发放刺激脉冲(2ms,1.5倍阈电压),通过隔离器(SS-202J,Nihon Kohden,Japan)将形成的场刺激作用于豚鼠乳头肌,诱发乳头肌的动作电位。这种引导的生物信号通过微电极放大器(M EZ-7200;Nihon Kohden,Japan)放大后应用生物机能实验系统(BL-420 E+,泰盟,成都)在计算机上进行实时采集和分析数据。
1.2.3 实验分组 动作电位记录稳定30min后给予浴槽终浓度为:①293B:Control;1μ mol◦ L-1;5μ mol◦ L-1;10μ mol◦L-1);②293B 10μ mol◦ L-1+多非利特 0.1μ mol◦ L-1。 ③293B 10μ mol◦ L-1+多非利特 0.1μ mol◦ L-1+维拉帕米(0.1,1,2.5μ mol◦L-1)。采用 10KHz采样频率和 1HZ的基本刺激频率引导并记录动作电位,待稳定30min后所记录的动作电位作为每组加药前的对照组(Control),然后依次给予0.2Hz,0.5Hz,1Hz,1.25Hz,2Hz刺激频率,每种刺激频率持续约3~5min。不同频率刺激结束后又回到1Hz刺激,加药后观察到APD较为稳定后(一般约15min),再给予以上的不同频率,观察不同刺激频率对豚鼠心室乳头肌动作电位的影响。不同浓度给药按上述方式重复。
1.2.4 观察指标
静息电位(RP),动作电位幅值(APA),复极 30%的 APD(APD30),复极 50%的 APD(APD50),复极 90%的 APD(APD90)。
1.3 统计处理
2 结果
2.1 Chromanol 293B对豚鼠乳头肌AP的影响
Chromanol 293B浓度依赖性的延长动作电位时程(图1,1Hz,n=6),293B在1μ mol◦L-1时开始对 APD有延长作用,与对照组相比延长 APD90达(3.84±0.24)%,当增加 293B至5μ mol◦ L-1延长 APD90达(7.53±1.06)%,当浓度增加到10μ mol◦ L-1明显延长APD90达(23.48±3.56)%。不同浓度的293B对APA和RP无明显影响。给予不同的刺激频率,可以观察到随着刺激频率的增高,APD90变化的百分比与刺激频率1Hz相比,没有明显差异,表现为一种非频率依赖性作用(图1)。
2.2 Chromanol 293B与多非利特(DO)合用对豚鼠心室乳头肌AP的影响
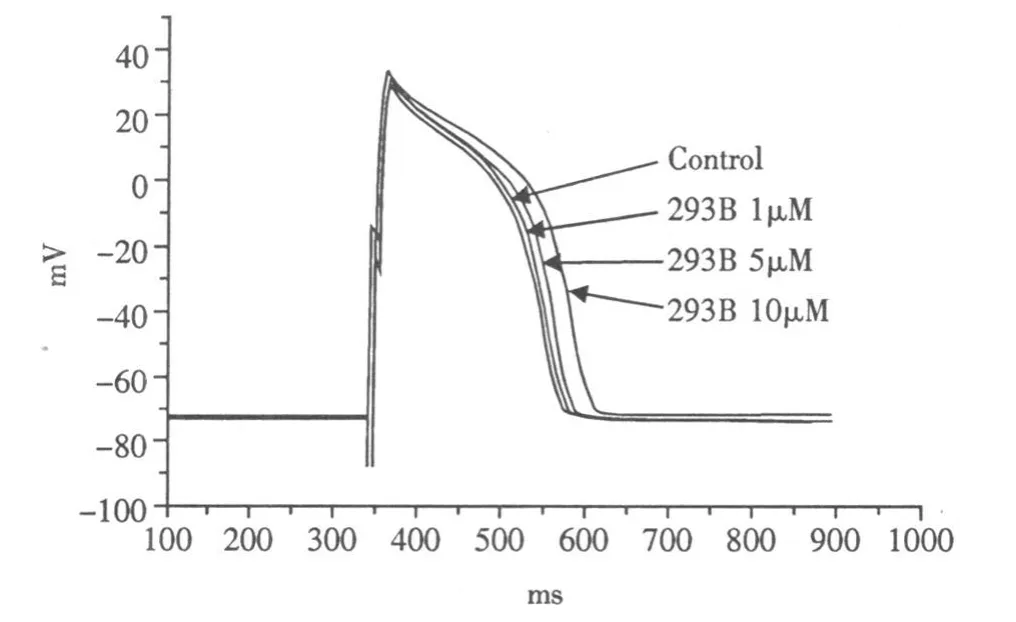
图1 Chromanol 293B(1-10μ mol◦L-1)对豚鼠心室乳头肌肌动作电位作用的原始记录图(1Hz)

图2 C hromanol 293B(10μ mol◦L-1)与多非利特(100nmol◦L-1)联合应用导致的异常电活动(1Hz)
293B(n=6)在10μ mol◦L-1对APD和 RP无明显影响,能非频率依赖性的延长豚鼠乳头肌APD;当加入 DO 0.1μ mol◦L-1后3min开始继续延长APD,持续作用约15min达到平衡状态,实验中发现在IKs特异性阻断剂293B作用后再加入IKr特异性阻断剂DO使APD延长明显,极易诱发早后除极(EAD)和晚后除极(DAD)(图2)。在不同的刺激频率作用下,与1Hz频率相比,1.25Hz下的APD90变化%有统计学差异(P<0.05,n=6),1Hz与2Hz相比差异明显(P<0.01,n=6),1Hz与0.2、0.5Hz相比差异异常明显(P<0.001,n=6),Chromanol 293B与多非利特合用后表现为明显的负性频率依赖性(图3)。
2.3 Chromanol 293B与多非利特合用后再联合应用维拉帕米(VE)对豚鼠乳头肌AP的影响
Chromanol 293B(10μ mol◦ L-1)与多非利特(0.1μ mol◦L-1)作用后加入不同浓度的维拉帕米(0.1,1,2.5μ mol◦L-1,n=6)(图4),可以看出0.1μ mol◦L-1维拉帕米使 APD缩短,能使异常电活动消失(EAD或 DAD),1μ mol◦L-1维拉帕米可使APD进一步缩短,当再增加浓度至2.5μ mol◦L-1缩短APD的作用减弱。

图3 在不同刺激频率下 293B(10μ mol◦ L-1)、多非利特(100n mol◦L-1)和维拉帕米(1μ mol◦L-1)分别或联合应用的 APD 90变化的百分比(,n=6,*P<0.05;**P<0.01;***P<0.001vs 1Hz)
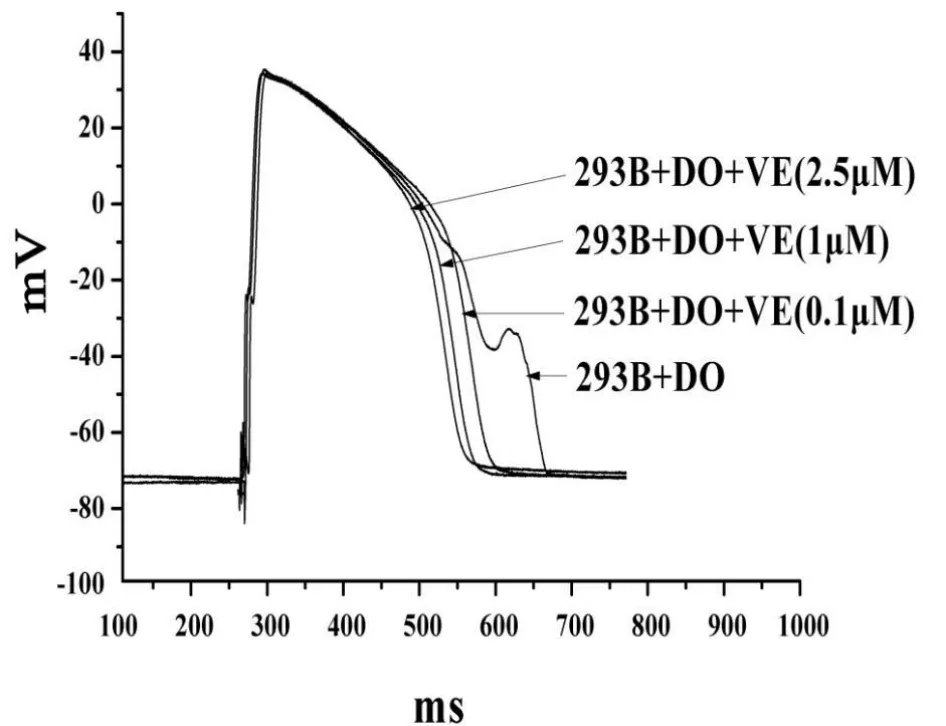
图4 不同浓度维拉帕米(0.1-2.5μ mol◦L-1)对 C hromanol 293B(10μ mol◦L-1)与对多非利特(100n mol◦L-1)联合应用对动作电位作用的原始记录图(1Hz)
给予不同的刺激频率,1μ mol◦L-1维拉帕米使 APD90均有不同程度的减小,减弱了293B与多非利特共同作用下的过度延长APD的作用,但作用程度不一。加入维拉帕米后,其他刺激频率的 APD90变化%与 1HZ相比:1Hz与 0.5Hz、1.25Hz、2Hz相比,APD90变化%差异有统计学意义(P<0.05,n=6),与0.2Hz相比差异明显(P<0.01,n=6)。维拉帕米与293B和多非利特联合应用减弱了其延长APD的作用,亦减弱了其对频率的依赖性(图3,表 1)。
3 讨论
本文研究表明:在活性正常的豚鼠心室乳头肌标本上,Chromanol 293B能非频率依赖性的延长 APD。Chromanol 293B与多非利特联合应用表现为负性频率依赖性的延长APD,能通过改变L-型钙通道的动力学特性来改善其负性频率依赖性。Iks特异性阻断剂与Ikr特异性阻断剂的联合应用并不能改变 Ш类抗心律失常药物的负性频率依赖性。这些发现提示同时阻断几种钾通道的药物很可能比特异性通道阻断剂危险性更大。
实验中我们观察了 0.1,1,2.5μ mol◦L-1维拉帕米对APD的影响,结果显示低于1μ mol◦L-1虽能改善过度延长APD导致的异常电活动(EAD,DAD)但对改善其频率依赖性影响不明显,而达到 2.5μ mol◦L-1因完全阻断 ICa-L可能诱导新的心律失常,因此在实验中选择了1μ mol◦L-1的维拉帕米,并观察到了其有益的抗心律失常的作用。
维拉帕米可以适度缓减在慢心率时APD的过度延长,减弱在慢心率时的副作用,表现为一种负性频率依赖性减弱的有益作用,而维拉帕米本身并无频率依赖型,表明了不同频率依赖性的两种药物的相互作用产生了较好的药效。有报道表明[9]钙通道阻断剂可以直接抑制 EAD的形成,降低已形成EAD的幅度,还可减弱对周围组织发生触发活动的能力。因此这种作用可能通过限制APD的过度延长和限制复极离散度的增加来减弱这种负性频率依赖性的程度。最近的研究[10]发现钙通道活性的恢复可能是EAD产生的载体,有产生Tdp危险倾向者可能是内在的平衡被打破,过度延长APD或加速了钙通道的恢复都可能导致EAD,最终出现 Tdp。因此,钙通道的功能状态和心室的复极化被认为是一种“生理学上的稳态”。我们的实验也支持:延长整流钾通道阻断剂与L-型钙通道阻断剂的联合应用(按适当的比例)可以发挥这样的保护作用。也有报道在动物模型中[11],90%的IKr阻断剂过度延长APD最后都导致了EAD的出现,然而约20%阻断ICa却能使EAD消失,并保持APD的延长作用,这也暗示了这种结果的产生可能受诸多因素的影响,也可以说明在形成动作电位的各离子机制中,钙通道起到了调节其他离子通道活性的重要作用。我们的研究结果证实了L-型钙通道阻断剂改善了Ⅲ类抗心律失常的负性频率依赖型,钙通道功能状态可能是产生负性频率依赖性的多因素之一。
对钙通道阻断作用的可能解释是:慢心率时(平台期变长)L-型钙通道很容易被再次激活。在阻断复极化电流的过程中,虽然内向电流只引起小的变化,但却在平台期的终末引起明显的APD的变化。这种现象很可能说明在慢心率时内向L-型钙通道活性能够调节Ⅲ类抗心律失常药物的作用。由于APD过度延长使失活的L-型钙通道被再激活使胞外Ca2+内流增强,胞浆内Ca2+浓度升高,心肌细胞中的RyR2被胞外钙内流所激活,由此通过“钙触钙释放”方式触发肌浆网上的RyR2释放更多的钙,使胞内游离钙明显增多。而L-型钙通道阻断剂可以缩短 APD,减少钙超载现象,1μ mol◦L-1Verapamil可以适度缩短APD,减少胞外钙内流,调节胞内钙信号调控系统。
这样的研究结果可能对临床应用具有一定的指导意义,在临床上将Ⅲ类抗心律失常药物与钙通道阻断药联合应用可以减少Ⅲ类抗心律失常药物的致心律失常作用。通过对钙通道活性的调节来改变抗心律失常的作用,有利于稳定抗心律失常的作用。也有报道表明,钙通道阻断剂可以抑制与EAD相关的快速性心律失常、QT间期的延长。这种作用类似于Amiodarone和Azimilide,这些复合性的Ⅲ类抗心律失常药物包含有钙通道阻断作用和纯Ⅲ类抗心律失常药物的作用。
表1 Chromanol 293B(10μ mol◦L-1)、多非利特(100nmol◦L-1)与维拉帕米(1μ mol◦L-1)分别或联合应用对动作电位各参数的作用(1Hz,,n=6)
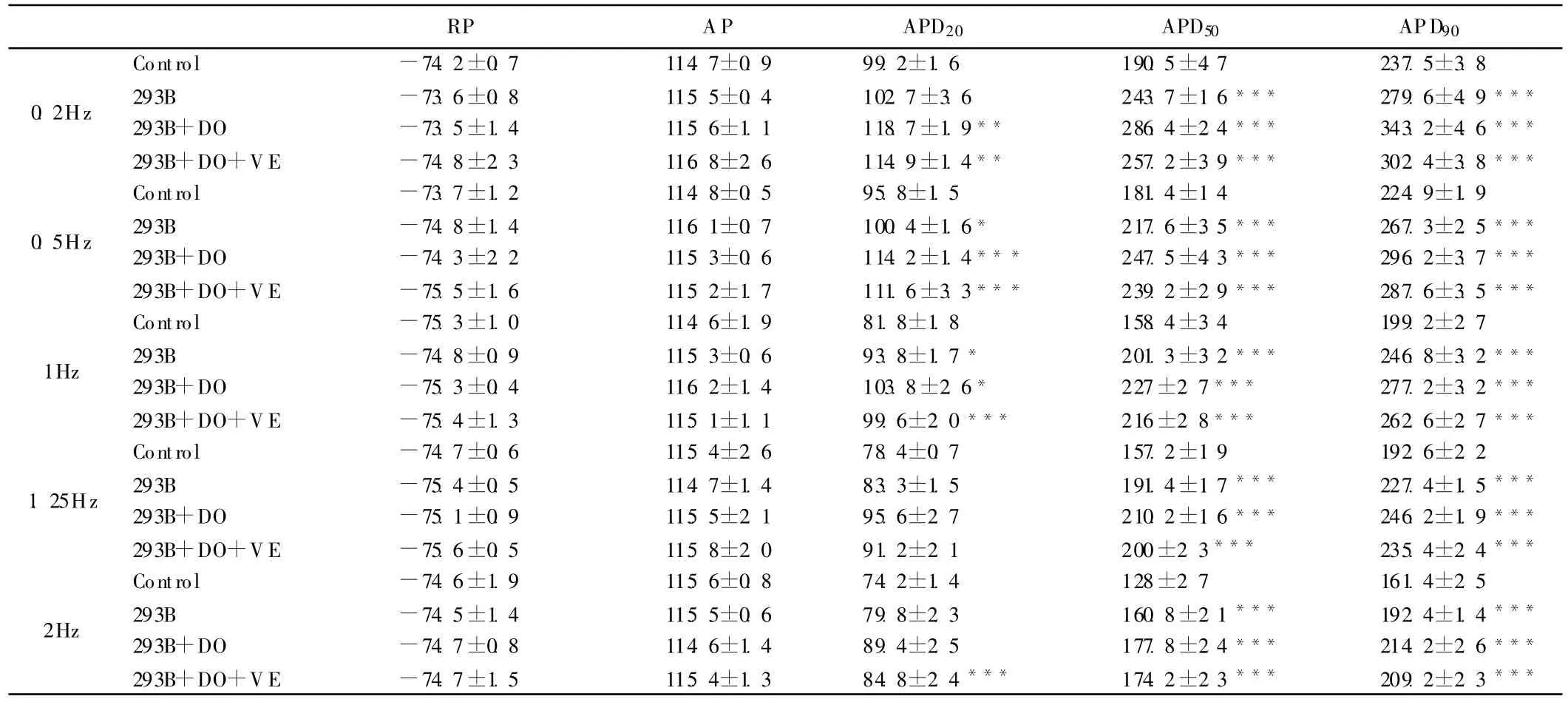
表1 Chromanol 293B(10μ mol◦L-1)、多非利特(100nmol◦L-1)与维拉帕米(1μ mol◦L-1)分别或联合应用对动作电位各参数的作用(1Hz,,n=6)
注:与对照组相比:*P<0.05;**P<0.01;***P<0.001
RP AP APD20 APD50 APD90 0.2Hz Control -74.2±0.7 114.7±0.9 99.2±1.6 190.5±4.7 237.5±3.8293B -73.6±0.8 115.5±0.4 102.7±3.6 243.7±1.6*** 279.6±4.9***293B+DO -73.5±1.4 115.6±1.1 118.7±1.9** 286.4±2.4*** 343.2±4.6***293B+DO+VE -74.8±2.3 116.8±2.6 114.9±1.4** 257.2±3.9*** 302.4±3.8***0.5Hz Control -73.7±1.2 114.8±0.5 95.8±1.5 181.4±1.4 224.9±1.9293B -74.8±1.4 116.1±0.7 100.4±1.6* 217.6±3.5*** 267.3±2.5***293B+DO -74.3±2.2 115.3±0.6 114.2±1.4*** 247.5±4.3*** 296.2±3.7***293B+DO+VE -75.5±1.6 115.2±1.7 111.6±3.3*** 239.2±2.9*** 287.6±3.5***1Hz Control -75.3±1.0 114.6±1.9 81.8±1.8 158.4±3.4 199.2±2.7293B -74.8±0.9 115.3±0.6 93.8±1.7* 201.3±3.2*** 246.8±3.2***293B+DO -75.3±0.4 116.2±1.4 103.8±2.6* 227±2.7*** 277.2±3.2***293B+DO+VE -75.4±1.3 115.1±1.1 99.6±2.0*** 216±2.8*** 262.6±2.7***1.25Hz Control -74.7±0.6 115.4±2.6 78.4±0.7 157.2±1.9 192.6±2.2293B -75.4±0.5 114.7±1.4 83.3±1.5 191.4±1.7*** 227.4±1.5***293B+DO -75.1±0.9 115.5±2.1 95.6±2.7 210.2±1.6*** 246.2±1.9***293B+DO+VE -75.6±0.5 115.8±2.0 91.2±2.1 200±2.3*** 235.4±2.4***2Hz Control -74.6±1.9 115.6±0.8 74.2±1.4 128±2.7 161.4±2.5293B -74.5±1.4 115.5±0.6 79.8±2.3 160.8±2.1*** 192.4±1.4***293B+DO -74.7±0.8 114.6±1.4 89.4±2.5 177.8±2.4*** 214.2±2.6***293B+DO+VE -74.7±1.5 115.4±1.3 84.8±2.4*** 174.2±2.3*** 209.2±2.3***
抗心律失常药物的致心律失常的离子机制极为复杂,找寻抗心律失常的作用靶点是目前研究的热点,多靶点的协同作用有利于抗心律失常的有利作用,尽量减少由此产生的致心律失常作用。我们的研究显示Ⅲ类抗心律失常药物与Ⅳ类抗心律失常药物在一定剂量的联合应用可以改善Ⅲ类抗心律失常药物的致心律失常作用,但抗心律失常的机制是复杂的,很多药物均与多通道作用有关,因此开发的抗心律失常药物希望其仅延长快速性心律失常的APD,对窦性心律失常无作用,应用计算机辅助方法研发的药物应有利于改变速率依赖性的延长APD,钾通道阻断剂与钾通道的相互作用具有时间和状态的依赖性。从分子药理学考虑发展一种状态依赖性的钾通道阻断剂其作用靶点仅为病理性快速心律失常,而作用靶点在钾通道的药物对快速性心律失常作用特别重要,因此钾通道阻断剂仍然是抗心律失常药物研究的重点。
1 Jurkiewicz NK,Sanguinetti MC.Rate-dependent prolongation of cardiac action potentials by a methanesulfonanilide classⅢantiarrhy thmic agent.Specific block of rapidly activating delayed rectifier K+current by dofetilide[J].Circ Res,1993,72(1):75-83.
2 Nattel S,Liu L,St-Georges D.Effects of the novel antiarrhythmic agent azimilide on experimental atrial fibrillation and atrial electrophy siologic properties[J].Cardiovasc Res,1998,37(3):627-635.
3 Tamargo J,Caballero R,G mez R,et al.Pharmacology of cardiac potassium channels.Cardiovascular Res,2004,62(1):9-33.
4 Wang J,Feng J,Nattel S.ClassⅢantiarrhythmic drug action in experimental atrial fibrillation.Differences in reverse use dependence and effectiveness between D-sotalol and the new antiarrhythmic drug ambasilide[J].Circulation,1994,90(4):2032-2040.
5 Bosch RF,Gaspo R,Busch AE,et al.Effects of the chromanol 293B,a selective blocker of the slow,component of the delayed rectifier K+current,on repolarization in human and guinea pig ventricular my ocytes[J].Cardiovasc Res,1998,38(2):441-450.
6 Lankipalli RS,Zhu T,Guo D,et al.Mechanisms underlying arrhythmogenesis in long QT syndrome[J].J Electrocardiol,2005,38(4):69-73.
7 Aiba T,Shimizu W,Inagaki M,et al.Cellular and ionic mechanism for drug-induced long QT syndrome and effectiveness of verapamil[J].J Am Coll Cardiol,2005,45(2):300-307.
8 苗维纳,沈映君,曾晓荣.葛根素对豚鼠心肌细胞动作电位及有效不应期的影响[J].中国药理学通报,2001,17(5):565-568
9 Yamada M,Ohta K,Niwa A,et al.Contribution of L-type Ca2+channels to early after depolarizations induced by I Kr and I Ks channel suppression in guinea pig ventricular my ocytes[J].J Membr Biol,2008,222(3):151-166.
10 guo D,Zhou J,Zhao X,et al.L-type calcium current recovery versus ventricular repolarization:preserved membrane-stabilizing mechanism for different QT intervals across species[J].Heart Rhythm,2008,5(2):271-279.
11 T homas G,Gurung IS,Killeen MJ,et al.Effects of L-type Ca2+channel antagonism on ventricular arrhy thmogenesis in murine hearts containing a modification in the Scn5a gene modelling human long QT syndrome 3[J].J Phy siol,2007,578(Pt1):85-97.
