低温植酸酶产生菌鉴定及其酶学性质初步研究
2010-04-12迟乃玉张庆芳
陈 璨,迟乃玉,王 鑫,董 硕,张庆芳*
(1.大连工业大学生物工程学院,辽宁大连,116034;2.大连大学生物工程学院,辽宁 大连 116622;3.辽宁省海洋微生物工程技术中心,辽宁 大连 116622)
植酸酶(phytase)是催化植酸及植酸盐水解成磷酸 (或磷酸盐)和肌醇的一类酶[1]。其来源广泛,在微生物、动物、植物中都有发现[2]。由于植酸酶可解决植酸带来的环境及营养问题,已经成为食品、酶制剂及饲料添加剂研究的热点[3]。现在应用的植酸酶大多是中温和高温酶,最适酶温度一般为44℃~60℃[4],在较低温环境中效果达不到最佳。而低温植酸酶表现出在较低温条件下(0℃~30℃)催化活力高、酶的最适作用温度低等特征。特别是在当今世界资源及能源危机的情况下,低温植酸酶可以有效的利用有机磷(植酸及植酸盐),降低能耗,节约能源。目前,国内外对产低温植酸酶菌株的研究较少。本研究分离出一株产低温植酸酶的菌株,进行了初步鉴定;并初步研究了其酶学性质。
1 材料与方法
1.1 菌株
酵母菌CZC0208:分离于渤海湾,保藏于大连大学生物工程学院发酵工程实验室。
1.2 培养基
分离培养基:植酸钙0.10%、葡萄糖5.00%、NH4NO30.40%、KCl 0.05%、MgSO4·7H2O 0.05%、琼脂1.50%、蒸馏水100mL、pH5.5。
保藏培养基:PDA培养基[5]。
液体发酵培养基:葡萄糖5.00%、蛋白胨1.00%、硫酸铵0.30%、KCl 0.05%、MgSO4·7H2O 0.05%、蒸馏水100mL、pH5.5。
1.3 菌株分离
将样品按一定比例稀释后涂布于分离培养基上,在15℃培养3d~5d,保藏产生透明圈的菌株。
1.4 菌种鉴定
1.4.1 形态学分析
观察菌落形态、颜色、直径以及用光学显微镜观察细胞形态等,进行分析[6]。
1.4.2 ITS序列分析
利用UNIQ-10柱式细菌基因组DNA抽提试剂盒提取样品的基因组DNA,ITS 区段的扩增采用引物1(ITS1:5'-TCC GTA GGT GAA CCT GCG G-3')和引物2(ITS4:5'-TCC TCC GCT TAT TGA TAT GC-3')。PCR反应体系(50μL):模板1μL,引物1 1.0μL,引物2 1.0μL,dNTP S 1μL,Pfu Buffer 5.0μL,Pfu 酶0.25μL,补加双蒸水到50μL。扩增程序为98℃双链预变性5min;95℃变性30s,54℃复性25s,72℃延伸45s,进行35个循环;72℃延伸4min。以CZC0208DNA为模板,利用ITS rDNA通用引物进行PCR,产物经琼脂糖凝胶电泳后回收。PCR回收产物由生工生物工程(上海)有限公司进行测序。将测得的ITS区rDNA基因核苷酸序列输入GenBank数据库,进行blast比对,获取与CZC0208 ITSrDNA基因序列相似度高的菌种。采用Clustal X进行多序列匹配比对,通过Mega4.1软件计算出序列的系统进化距离,Neighbor-Joining法构建系统进化树,系统发育树评估采用自举法(Bootstraping),自举次数设置为1000次。
1.5 酶活力测定
酶活测定方法[7]:植酸酶活力定义为每分钟水解1nmol无机磷所需的酶量为1个酶活性单位(U/mL)。
1.6 温度对酶活的影响测定
按照植酸酶的测定方法,在不同温度,分别测定其降解植酸钠的能力,并根据所得数据绘图。
2 结果与分析
2.1 菌种筛选
利用分离培养基从采自渤海湾的样品中筛选出3株能够产生低温植酸酶的酵母菌,其中一株命名为CZC0208,挑取CZC0208少许点种于分离培养基上,在15℃培养3d~5d后得到单菌落,有较明显透明圈。
2.2 菌种鉴定
2.2.1 菌株形态学鉴定
植酸酶产生菌菌落特征和菌体形态见附表。

附表 菌落特征和菌体形态Attached table.Colony characteristics and cellular morphology
挑取少许分离纯化后的菌体,进行美兰染色,结果见图1。
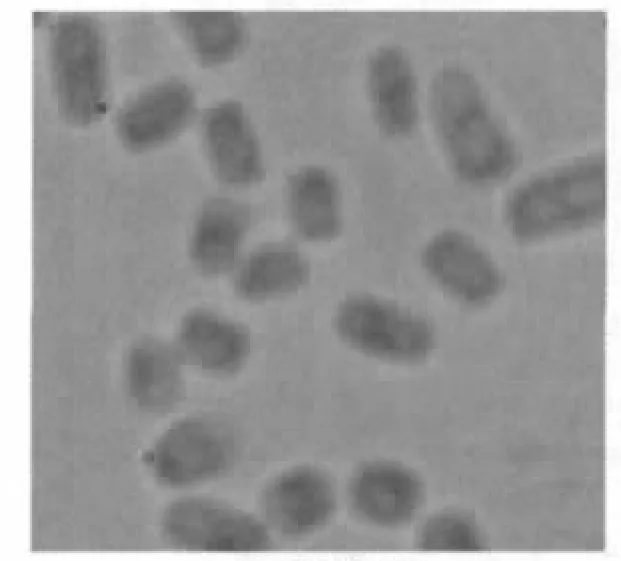
图1 菌株形态Figure 1.Morphology of strain CZC0208
根据菌落及细胞形态,初步鉴定该菌株为酵母菌。
2.2.2 菌株ITS rDNA的序列分析与系统发育树的构建
该菌株ITS rDNA经测序其长度为372bp。
从GenBank中下载与CZC0208的ITS相似性高的菌株的ITS序列,进行系统发育树分析,结果见图2。
由图2系统发育树表明,CZC0208与Dipodascussp.Ccre7(AF481862.1)在同一分支上,同源性为99%。与CNY0820系统发育比较密切的菌株还有:Galactomyces geotrichum(DQ189222.1)、Geotrichumsp.Po67(AY513953.1)、Geotrichumsp.Po4-mu(AY211069.1)、Dipodascaceaesp.LM380(EF060694.1)、Galactomycesgeotrichum(AJ279445.1)、Dipodascus australiensis(AF157596.1)。因为菌株CZC0208与Dipodascussp.Ccre7同源性最高,达到99%,所以初步鉴定为Dipodascus(双足囊菌属)。CZC0208的ITSrDNA序列:

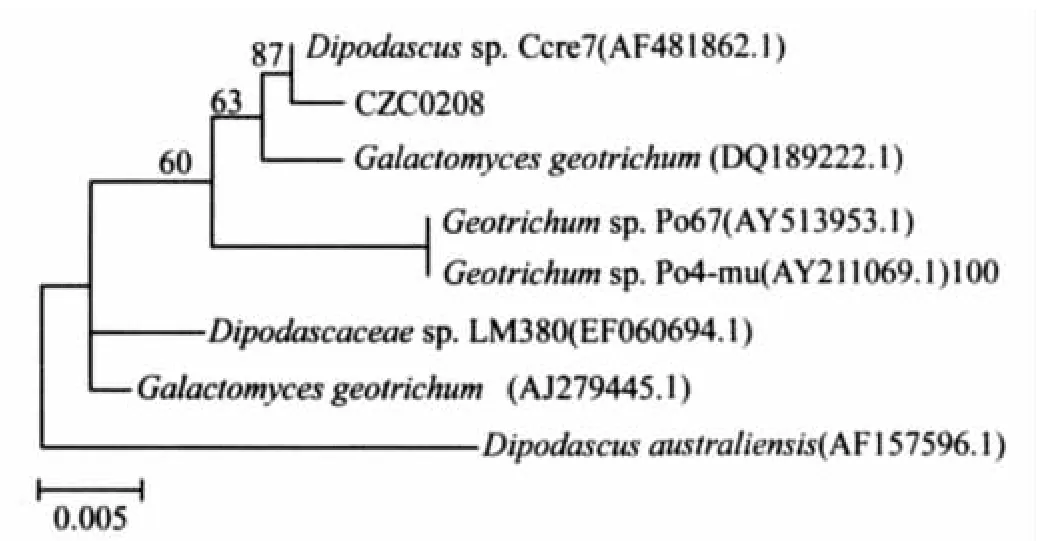
图2 邻接法构建的菌株CZC0208的ITS的系统发育树Figure 2.Phylogenetic tree based on ITS rDNA gene sequences of CZC0208
2.3 低温植酸酶的最适温度
在不同温度条件下,分别测定粗酶液降解植酸钠的能力,结果见图3。
由图3可以看出,15℃~35℃时植酸酶活力逐步上升,当温度为35℃时,酶的活力达到最高点,酶活为90.17U/mL。随着温度升高,酶活力又逐步下降。表明在20℃~30℃时,有一定的催化活力,其最适温度为35℃。
3 小结与讨论
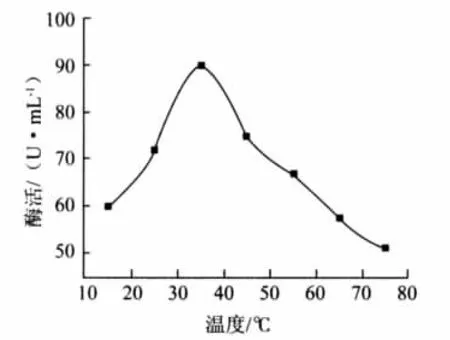
图3 温度对低温植酸酶的影响Figure 3.Effect of temperature on activity of phytase
从渤海湾分离出一株产低温植酸酶的菌株,命名为CZC0208,由菌落特征和菌体形态以及ITS rDNA的序列分析与系统发育树的构建结果可初步鉴定菌株CZC0208为酵母菌,属于双足囊菌属(Dipodascus)。该菌所产植酸酶活力在35℃时达到最大,较中温及高温植酸酶最适作用温度低。
植酸酶可以催化水解反应将磷酸盐从植酸中释放出来,提高磷利用率,降低环境中的磷污染[8],并可以消除植酸的螯合作用,促进动物对矿质元素的吸收。此外植酸酶还是一种新型食品添加剂和制备药用肌醇磷酸酯的催化剂。有关低温植酸酶的研究尚处于起步阶段,主要集中在菌种选育、发酵条件优化、相关基因克隆以及酶学性质的研究等方面[9]。
[1]WODZINSKY R J,ULLAH A H J.Phytase[J].Adv Appl Microbiol,1996,42:263-302.
[2]CAO L,WANG W,YANG C,et al.Application of microbial phytase in fish feed[J].Enzyme Microbiol Tech,2007,40:497-507.
[3]周建琴,刘菊香.聚乙烯醇复合固定化植酸酶方法研究[J].中国酿造,2009(11):112-115.
[4]OH BC,CHOI WC,PARK S,et al.Biochemical properties and substrate speci cities of alkaline and histidine acid phytases[J].Appl Microbiol Biotechnol,2004,63:362-372.
[5]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995.
[6]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[7]叶 冰,王运吉,张苓花.植酸酶毕赤酵母基因工程菌高密度发酵[J].大连轻工业学院学报,2002,21(3):193-196.
[8]LUO H Y,HUANG H Q,YANG P L,et al.A Novel Phytase appA from Citrobacter amalonaticus CGMCC1696:Gene Cloning and Overexpression in Pichia pastoris[J].Curr Microbiol,2007,55:185-192.
[9]HUANG H,LUO H,WANG Y,et al.Novel Low-Temperature-Active Phytase from Erwinia carotovora var.carotovota ACCC 10276 [J].J Microbiol Biotechnol,2009,19(10):1085-1091.
