高效液相色谱法检测猪肉中安眠酮残留量
2010-03-23朱事康曹维强吴云普
吕 飞,朱事康,黄 刚,曹维强,吴云普
(惠州出入境检验检疫局综合技术中心,广东 惠州 516006)
高效液相色谱法检测猪肉中安眠酮残留量
吕 飞,朱事康,黄 刚,曹维强,吴云普
(惠州出入境检验检疫局综合技术中心,广东 惠州 516006)
建立高效液相色谱法 (HPLC)检测猪肉中安眠酮残留量。经过实验确定用二氯甲烷提取,固相萃取(SPE)柱净化,流动相定容后用高效液相色谱仪测定;采用乙腈:乙酸胺溶液(25mmol/L)=40:60(V/V)为流动相,226nm为测定波长,1.0mL/min的流速。在0.020~0.20mg/kg范围内具有良好的线性关系,最低检测限为0.020mg/kg,回收率在70%~110%之间,标准曲线回归方程为Y=6.90×104X+3.71×103,相关系数为0.999。此法操作简便、快速、灵敏、准确,样品处理简便易行,适用于测定猪肉中的安眠酮。
高效液相色谱法;猪肉;安眠酮;固相萃取
安眠酮(methaqualone),又称甲苯喹啉酮。分子式C16H14N2O,相对分子质量250.29。白色结晶粉末。无臭、微苦。熔点120℃。微溶于水,易溶于乙醇、乙醚、丙酮、氯仿等。有吸湿性、有镇静和催眠作用,适用于精神性失眠。
农业部公布的《食用动物禁用的兽药及其它化合物清单》中有21类近40个品种的原料药及其单方、复方制剂产品停止使用,其中安眠酮也位列其中。安眠酮系喹唑酮类衍生物,临床上常用作催眠药、镇定药[1],主要用于动物过度兴奋或惊厥,可使机体平静。但该药副作用较大,消费者误食了含有安眠酮的猪肉,会表现出恶心、呕吐、头晕、无力、四肢及口舌麻木,个别较重患者有短时间的精神失常。过量中毒可出现昏迷、视神经乳头水肿、心跳过速、呼吸抑制等症状。久吃含有此药的肉类,人体可产生耐药性。近年来,随着畜牧养殖业的迅速发展,一些不法分子在经济利益的驱动下,置法律法规于不顾,擅自在畜禽饲养中添加使用,从而严重影响人们的身体健康。目前,在国内动物源性食品中安眠酮残留量的检测还没有相关的检验标准[2-3]。本实验采用二氯甲烷提取,用高效液相色谱仪检测,建立动物源性食品中安眠酮残留量的测定方法,以期为动物源性食品的质量控制提供一定的参考。
1 材料与方法
1.1 材料与试剂
猪瘦肉 惠州东进肉联厂。
安眠酮标准品(纯度>99.0%,质量浓度10.000mg/L);乙腈、甲醇、丙酮、正己烷、二氯甲烷(均为色谱纯)德国Meker公司;乙腈饱和正己烷(色谱纯);乙酸胺、氢氧化钠、无水硫酸钠(均为分析纯);净化用洗脱液:
乙腈+丙酮(体积比1:1)。除另有规定外,所用试剂均为分析纯,水为GB/T 6682—2008《分析实验室用水规格和试验方法》规定的一级水。
1.2 仪器与设备
高效液相色谱仪(带2487紫外-可见波长检测器或2998二极管阵列检测器)、Empower 2 工作站、固相萃取装置、HLB C18SPE(3cc,60mg) 美国Waters公司;717Plus 自动进样器 德祥科技有限公司;3-18K型离心机 Sigma公司;R-210型旋转蒸发仪 Buchi公司;滤膜、快速定性滤纸。
1.3 方法
1.3.1 标准曲线的绘制
精确移取安眠酮标准品1.000mL,用乙腈稀释并定容至10mL,摇匀,制备成质量浓度为1.000mg/L的标准储备液。精确吸取标准储备液2.0、5.0、10、20mL分别置于100mL容量瓶中,用流动相稀释至刻度,摇匀,使质量浓度为0.02、0.05、0.10、0.20mg/L的标准使用液,使用前配制。以组分的峰面积为纵坐标、质量浓度为横坐标,绘制标准曲线,以外标法定量。
1.3.2 色谱分离条件
色谱柱为Sunfire C18(250mm×4.6mm,5μm);测定波长为226nm;流动相为乙腈:乙酸胺 (25mmol/L)=40: 60(V/V);流速1.0mL/min;进样量20μL;柱温40℃。
1.3.3 样品处理
1.3.3.1 提取
称取5.0g(精确到0.01g)组织样品和10g无水硫酸钠于50mL离心管中,加入1mL 1mol/L NaOH溶液和20mL二氯甲烷,均质提取1min,4000r/min离心5min,上清液经快速定性滤纸过滤到100mL浓缩瓶中,残渣用20mL二氯甲烷超声提取10min,4000r/min离心5min,合并二氯甲烷,40℃旋转蒸发至干。
1.3.3.2 净化
残留物中加入1mL流动相,充分旋涡振荡,转移至5mL离心管中,加入3mL乙腈饱和正己烷,旋涡混匀,4000r/min离心5min,弃去上层正己烷层,原离心管中再加入3mL乙腈饱和正己烷,旋涡混匀,4000r/min离心5min,下层加0.1mol/L的NaOH溶液稀释至5mL,作为待净化液以备用。用3mL甲醇,3mL 0.1mol/L的NaOH以1mL/min的流速淋洗活化萃取柱,然后将5mL待净化液通过柱子(控制流速小于0.5mL/min),依次用3mL 0.1mol/L的NaOH溶液,3mL甲醇以1mL/min的流速过柱洗杂,最后用5mL乙腈-丙酮(体积比1:1)洗脱(控制流速小于0.5mL/min),收集洗脱液于25mL浓缩瓶中,40℃旋转蒸发至干,加1mL流动相溶解残渣,溶液过0.45μm有机相滤膜后上高效液相色谱仪测定。
1.3.4 样品测定
取供上机检测的样品溶液20μL,注入高效液相色谱仪。根据样液中安眠酮含量的情况,选取相应值相近的标准工作溶液,标准工作溶液和待测样液中安眠酮含量的相应值均应在仪器的线性范围内,对标准工作溶液和样液等体积参插进样测定。与标准的保留时间比较定性,外标法定量。
2 结果与分析
2.1 样品的预处理
2.1.1 提取溶剂的选择
由于安眠酮易溶于乙醇、乙醚、丙酮、二氯甲烷、氯仿5种试剂做回收率比对实验,回收率分别为70.1%、82.5%、83.7%、91.4%、89.8%。二氯甲烷的回收率最高,所以用二氯甲烷作提取液。
2.1.2 样品溶液pH值的调节[4]
安眠酮在弱碱性条件下更易溶于有机溶剂,考虑在提取液中加入了1mL 1mol/L NaOH溶液,调节pH值在8~9之间。分别做回收率比对实验,回收率为87.5% (pH8~9)和80.3%(未调pH值),所以选择在样品提取液中加入了1mL 1mol/L NaOH溶液,控制pH值在8~9之间。
2.1.3 净化时残渣溶解液的选择
选用二氯甲烷、乙腈及流动相溶解残留物。用二氯甲烷溶解时与正己烷互溶,严重的影响样品的回收,不予考虑;用乙腈溶解时,杂质干扰峰较多,综合考虑采用流动相溶解效果最好。
2.1.4 萃取柱净化[5-7]
由于动物肌肉中通常含有脂肪,首先需要脱脂步骤,在提取溶剂中加入正己烷,去除脂类杂质。若基质比较干净,则可直接装瓶上机;若干扰峰较多,则要进行固相萃取柱萃取。对OasisHLB、MCX、MAX不同极性的萃取柱进行方法实验,结果表明:OasisHLB得到的回收率较高且稳定,通过上柱条件,淋洗,洗脱各条件实验,最终确定的固相萃取条件如下:样液转移至已预先用3mL甲醇活化、3mL 0.1mol/L NaOH溶液平衡的OasisHLB固相萃取柱中,依次用3mL 0.1mol/L的NaOH溶液和3mL甲醇洗涤,抽至近干后,用洗脱液洗脱。实验表明,采用OasisHLB固相萃取柱处理样品除杂质效果好,分析物有高回收率、重现性好。
2.2 色谱条件的选择
2.2.1 流动相的选择[8-9]
在所有条件相同的情况下,进相同质量浓度的标准溶液。比较甲醇-水和乙腈-乙酸胺(25mmol/L)这两种流动相,分别取甲醇-水体积比为40:60、50:50、30:70,此流动相在这3个比例的条件下均未出峰;乙腈-乙酸胺(25mmol/L)的体积比为30:70、45:55、40:60、75:25、
90:10、15:85,比较峰面积(图1),表明适合以乙腈:乙酸胺溶液(25mmol/L)=40:60(V/V)为流动相。2.2.2检测波长的选择
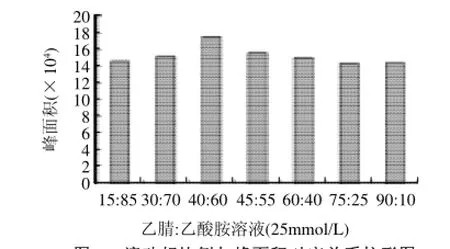
图1 流动相比例与峰面积对应关系柱形图Fig.1 Relationship between mobile phase composition and peak area of methaqualone
在 200~400nm 范围内对安眠酮标准溶液进行扫描,安眠酮在 206、226、266、306、318nm 处有 5 个依次变低的吸收峰。参照文献[8]最终确定检测波长为226nm。2.2.3色谱条件的确定[10]
考虑到Sunfire C18色谱柱针对碱性化合物能有效地改善分离度,在低和中等pH值流动相条件下,对酸性、中性和碱性化合物都有杰出的柱效。且实验表明分离效果理想。在目标峰附近无干扰峰。经实验采用的色谱条件为:色谱柱为Sunfire C18(250mm×4.6mm,5μm)、柱温为40℃、流动相为乙腈-乙酸胺(25mmol/L)溶液(40:60,V/V),流速为1.0mL/min,检测器为紫外检测器或二极管阵列检测器,检测波长为226nm,进样量为20μL,安眠酮的保留时间约为8min左右,所得色谱峰峰形较好,并且实现了安眠酮与杂质的良好分离。2.3标准色谱图和样品加标色谱图
3 结 论
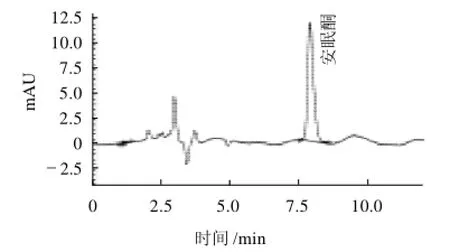
图2 安眠酮标准品液相色谱图Fig.2 Liquid chromatogram of methaqualone standard
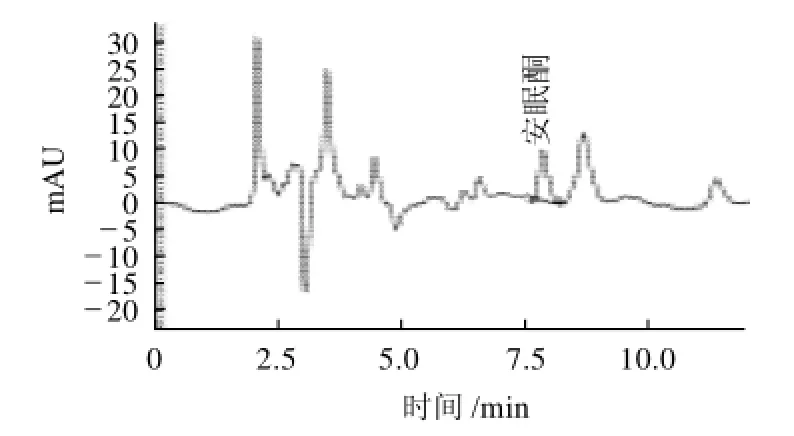
图3 加标样品液相色谱图Fig.3 Liquid chromatograms of a spiked sample
按照2.2.3节条件进行色谱分析得到安眠酮的色谱图,图2为安眠酮的标准色谱图,出峰时间在7.5min左右;图3为猪肉样0.020mg/kg标品添加量回收色谱图。
2.4 方法的线性关系
安眠酮在0.02~0.20mg/L内线性关系显著。以峰面积-质量浓度作图,得到标准曲线回归方程为Y=6.90× 104X+3.71×103,相关系数为0.999。
2.5 最低检测限
在RSN=3条件下确定安眠酮最低检测限为0.020mg/kg。
2.6 方法的加标回收率
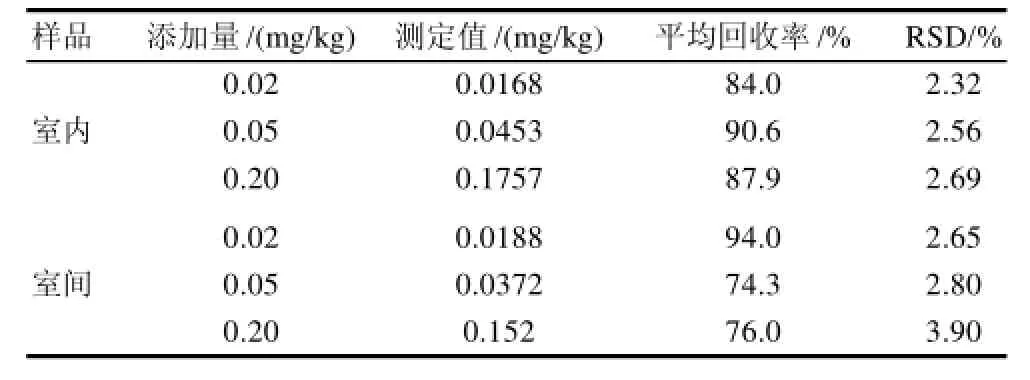
表1 样品加标平均回收率(n=6)Table 1 Inter-and intra-laboratory average recovery rates of methaqualone (n=6)
由表1可见,在添加量在0.020~0.20mg/kg范围内,回收率在70%~110%之间,RSD在2.32%~3.90%之间,回收效果较好。
本实验旨在建立安眠酮的高效液相色谱检测方法。用二氯甲烷提取,固相萃取(SPE)柱净化,流动相定容后用高效液相色谱仪测定。采用乙腈:乙酸胺溶液(25mmol/L)=40:60(V/V)为流动相,226nm为测定波长,1.0mL/min的流速色谱分析条件,可以实现动物组织中安眠酮的检测。此法操作简便、快速、灵敏、准确,样品处理简便易行,适用于测定猪肉中的安眠酮。
[1]郭幼梅, 诸秋珉, 姜宴. 用HPLC法同时检测生物检材中安眠酮及其2-羟甲基代谢物[J]. 上海医科大学学报, 1996, 23(1): 43-45.
[2]员克明, 李贵明, 王英元, 等. 安眠酮薄层色谱扫描检测研究[J]. 中国法医学杂志, 1997, 12(1): 25-26.
[3]宋凤瑞, 刘淑莹. 安眠镇静药物的串联质谱分析方法[J]. 分析化学, 1998, 26(11): 1394-1396.
[4]冯翠玲, 刘阴棠, 罗毅. 两种检测器两种色谱柱对21种安眠镇静药物的系统分析[J]. 药物分析杂志, 1994, 14(5): 3-6.
[5]汪丽萍, 邱月明, 赵海香, 等. 镇静剂残留分析的样品前处理技术研究进展[J]. 药物检测, 2004, 21(4): 28-29.
[6]邢若葵, 温锦锋, 王松才, 等. 自动固相萃取法(SPE)提取常见安眠镇静药[J]. 刑事技术, 2003(3): 12-15.
[7]周淑光, 徐婉. 固相萃取技术在生物样品中微量毒物分析的研究与应用[J]. 中国法医学杂志, 1995, 10(2): 126-128.
[8]汤文利, 梁萌, 任爱丽, 等. 高效液相色谱法测定饲料中安眠酮的含量[J]. 饲料检测, 2005, 26(24): 49-51.
[9]冯翠玲, 刘荫棠, 罗毅. 血样中13种安眠镇静药的HPLC系统分析方法[J]. 药学学报, 1995, 30(12): 914-919.
[10]汤文利, 梁萌, 任爱丽, 等. 高效液相色谱法同时测定饲料中地西泮、安眠酮的含量[J]. 家禽科学, 2006(7): 11-13.
Determination of Methaqualone Residues in Pork by High Performance Liquid Chromatography
(Center of Comprehensive Technology, Huizhou Entry-Exit Inspection and Quarantine Bureau, Huizhou 516006, China)
A high performance liquid chromatographic method was established to determine the content of methaqualone residues in pork. Sample extraction was carried out using dichloromethane as the extraction solvent, followed by clean-up on a solid-phase extraction column and dillution to a certain volum with the mobile phase composed of acetonitrile and 25 mmol/L ammonium acetate before injection onto HPLC system. The detection wavelength was 226 nm and the mobile phase flow rate was 1.0 mL/min. The calibration curve of the developed method was as follows: Y = 6.90 × 104X +3.71 × 103, with a correlation coefficient of 0.999, which exhibited good linearity over the concentration range from 0.020 to 0.20 mg/kg. The detection limit was 0.020 mg/kg, and the inter- and intra-laboratory average spike recovery rates of methaqualone at three levels were between 70% and 110%. This method has the benefits of simplicity, rapidity, high sensitivity, convenience and good feasibility and most suitable for the determination of methaqualone residues in pork.
high performance liquid chromatography;pork;methaqualone;SPE
TS207.3;R155.5
A
1002-6630(2010)18-0295-03
2009-12-16
吕飞(1978—),女,工程师,在职硕士研究生,主要从事食品检验研究。E-mail:lvfei1026@163.com
