蓝靛果红色素微波提取及抗氧化作用
2010-03-23张雁南刘硕芳张艳荣
张雁南,刘硕芳,李 皓,张艳荣*
(1.吉林工程技术师范学院食品工程学院,吉林 长春 130052;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
蓝靛果红色素微波提取及抗氧化作用
张雁南1,刘硕芳1,李 皓1,张艳荣2,*
(1.吉林工程技术师范学院食品工程学院,吉林 长春 130052;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
采用微波辅助法提取蓝靛果中红色素,以吸光度为评价指标,采用单因素试验探讨乙醇溶液体积分数、料液比、微波功率、提取时间对蓝靛果红色素提取率的影响,采用正交试验优化提取工艺。用DPPH法测定蓝靛果红色素的抗氧化活性。结果表明:微波辅助提取蓝靛果红色素的最佳提取工艺条件为乙醇溶液体积分数65%、料液比1:10(g/mL)、微波功率540W、提取时间90s,此条件下红色素提取量为105.5mg/100g果实,抗氧化实验证明蓝靛果红色素具有清除DPPH自由基的作用。
蓝靛果;色素;微波辅助提取;抗氧化
蓝靛果是一种纯天然、无污染的优质野生果,我国东北地区有分布[1]。蓝靛果果实紫黑色,含多种维生素、矿物质,尤其是锌、硒、铁、钙含量较高[2],蓝靛果果皮中含有大量的红色素,研究表明此类红色素属多酚类衍生物中的花青素类[3],有抗氧化功能[4-5]。可代替合成色素用于食品着色,增加食品的安全性。
微波是一种超高速电磁波,具有很强的穿透作用。微波萃取技术又称微波辅助提取,是近年来发展起来的一种新型萃取方法,具有操作时间短、溶剂耗量少、有效成分提取率高等优点,符合绿色、清洁及环境友好性生产模式的要求[6],广泛用于多种天然产物的提取。现有报道蓝靛果红色素的提取方法主要有溶剂浸提法[7]、超声波法[8]等。
DPPH自由基(1,1-二苯基-2-苦肼基)是一种非常稳定的以氮为中心的自由基,若受试物能将其清除,则说明受试物具有降低羟自由基、烷基自由基或过氧化自由基的浓度及终止脂质过氧化链反应的作用[9]。本实验利用微波辅助萃取技术,以乙醇溶液为提取剂,提取蓝靛果红色素,确定最佳提取工艺条件,并对蓝靛果红色素DPPH自由基清除能力进行测试,考察其抗氧化活性,为蓝靛果红色素产品的开发和应用提供参考。
1 材料与方法
1.1 材料与试剂
蓝靛果采自吉林省敦化长白山地区的野生鲜果,挑选除杂后速冻贮藏;柠檬酸、磷酸氢二钠、无水乙醇(均为分析纯) 天津化学试剂有限公司;DPPH自由基(1,1-二苯基-2-苦肼基) Sigma公司。
1.2 仪器与设备
UV-1600型紫外-可见分光光度计 北京瑞利分析仪器公司;NN-J993型微波炉 日本松下电器产业株式会社; pHS-25型酸度计 上海理达仪器厂。
1.3 蓝靛果红色素的提取
1.3.1 微波法
准确称取2.00g冷冻蓝靛果,置于研钵中研磨,用一定量的提取剂转移至250mL烧杯中,在一定功率下微波提取一定时间,提取1次,将提取液移入50mL的容量瓶中,用pH4.5的柠檬酸/磷酸氢二钠缓冲溶液定容,过滤收集滤液。吸取0.55mL滤液于10mL具塞刻度试管中,用pH4.5的柠檬酸/磷酸氢二钠缓冲溶液稀释至刻度,以缓冲溶液作空白,在520nm处测定色素溶液的吸光度[10]。根据朗伯-比尔定律公式A=KCL(K消光系数,C为色素浓度,L比色皿光程),随着色素浓度增加吸光度增大[11],因此以吸光度为评价指标,考察各因素对蓝靛果红色素提取率的影响。
1.3.2 传统乙醇浸提法
根据本实验室前期试验结果同时参考赵桂红[7]的研究结果,采用体积分数60%乙醇溶液,料液比1:10 (g/mL),提取温度50℃,提取时间2h,提取液稀释浓度与微波法相同,波长520nm处测吸光度,与微波法最优化的提取工艺条件下的提取量比较。
1.3.3 提取剂的选择
蓝靛果红色素溶于水、乙醇、甲醇等极性溶剂,稍溶于丙酮,不溶于苯、石油醚、乙醚、氯仿等非极性溶剂[12]。由于甲醇、丙酮有毒性,而且乙醇可有效沉淀果胶、糖、淀粉、蛋白质,起到初步精制的作用,所以选用有机溶剂乙醇作为提取剂。
1.3.4 影响蓝靛果红色素提取率的单因素试验
通过单因素试验研究乙醇溶液体积分数、料液比、微波功率、提取时间对蓝靛果红色素提取率的影响。
1.3.4.1 乙醇体积分数对蓝靛果红色素提取率的影响
分别用35%、45%、55%、65%、75%、85%不同体积分数乙醇溶液提取蓝靛果红色素,料液比1:10(g/ mL),在180W条件下微波加热60s,过滤,稀释,在520nm处测定色素溶液的吸光度。
1.3.4.2 微波功率对蓝靛果红色素提取率的影响
采用体积分数55%的乙醇溶液提取蓝靛果红色素,料液比1:10(g/mL),分别在180、360、540、720、900W等不同功率条件下微波加热60s,过滤,稀释,在波长520nm处测定色素溶液的吸光度。
1.3.4.3 提取时间对蓝靛果红色素提取率的影响
采用体积分数55%乙醇溶液提取蓝靛果红色素,料液比为1:10(g/mL),在180W条件下微波处理30、60、90、120、150s,过滤,稀释,在520nm处测定色素溶液的吸光度。
1.3.4.4 料液比对蓝靛果红色素提取率的影响
采用体积分数55%乙醇溶液提取蓝靛果红色素,以1:6、1:8、1:10、1:12和1:14(g/mL)不同料液比,在180W的条件下微波处理60s,过滤,稀释,在波长520nm处测定色素溶液的吸光度。
1.3.5 提取工艺条件的优化
在单因素试验的基础上,采用L9(34)正交试验,以乙醇溶液体积分数、微波功率、提取时间和料液比4因素3水平进行正交试验,优化蓝靛果红色素的提取工艺,因素水平设计见表1。
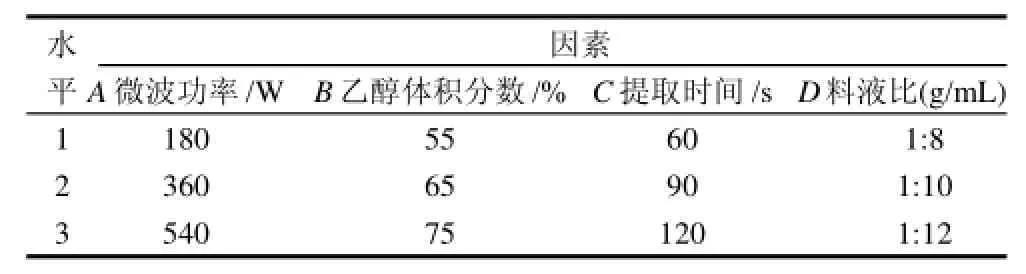
表1 正交试验因素水平表Table 1 Factors and levels in the orthogonal array design
1.3.6 蓝靛果红色素提取量的计算
蓝靛果红色素主要成分矢车菊素-3-葡萄糖苷[3],按照1.3节方法在最优化的提取工艺条件下提取蓝靛果红色素,测其吸光度,计算蓝靛果红色素的含量[13]。
Similarly to the first round, significantly more female participants completed both first and second FIT rounds in comparison to male participants (16 of 95 or 16.8%vs 8 of 116 or 6.8%, P = 0.05).

式中:A为吸光度;M为矢车菊素-3-葡萄糖苷分子量(取449.2);V为稀释液体积(909.1mL);K为矢车菊素-3-葡萄糖苷的摩尔消光系数(取26900);1为比色皿光程(1cm);m为蓝靛果取样量(2g)。
1.4 蓝靛果红色素提取物清除DPPH自由基活性的测定[14]DPPH自由基乙醇溶液呈紫色,最大吸收波长为517nm。当DPPH自由基溶液中加入自由基清除剂时,溶液颜色变浅,在517nm处的吸光度变小,吸光度变小的程度与自由基被清除的程度呈线性关系。精确称取44mg DPPH自由基样品,用无水乙醇溶解并定容于100mL容量瓶中,DPPH自由基浓度为120μmol/L,避
光保存(0~4℃)。
按1.3节方法在最优化的提取工艺条件下提取蓝靛果红色素,用体积分数65%的乙醇将提取液稀释至600、800、1000、1200mL,取2mL稀释液与2mL 120μmol/L DPPH自由基溶液加入同一试管中,摇匀,在黑暗中放置30min,以无水乙醇为空白在517nm测定其吸光度,计算清除率。
清除率/%=[(Ac-Ai)/Ac]×100
式中:Ac为2mL无水乙醇加2mL 120μmol/L DPPH溶液的吸光度;Ai为2mL蓝靛果红色素稀释液加2mL 120μmol/L DPPH溶液的吸光度。
2 结果与分析

图1 乙醇溶液体积分数对红色素提取率的影响Fig.1 Effect of ethanol concentration on red pigment extraction
由图1可知,随着乙醇溶液体积分数的提高,吸光度增大,体积分数在65%时,提取效果最好,说明蓝靛果红色素提取物的极性与体积分数65%的乙醇溶液相似。水是吸收微波最好的介质[15],微波加热时,乙醇体积分数继续增大时,减少了提取剂中水的比例,物料升温减慢从而影响色素的溶出。另外,随乙醇体积分数增加,醇溶性杂质提取量增加,对色素溶液吸光度的测定存在干扰。因此乙醇体积分数选择在65%较为适宜。
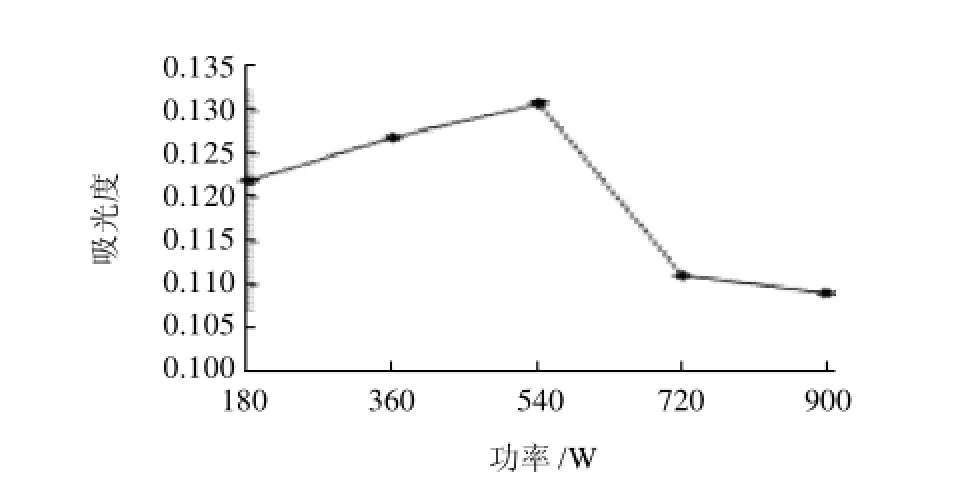
图2 微波功率对红色素提取率的影响Fig.2 Effect of microwave power on red pigment extraction
2.2 微波功率对蓝靛果红色素提取率的影响由图2看出,提取时间一定时,随着微波辐射功率的提高,提取体系吸收的微波能增加,提取体系温度上升,色素成分扩散速率提高,溶出量增加,吸光度增大。微波功率在540W时,色素提取率最大。微波功率大于540W时,吸光度下降,原因可能是微波功率过大体系温度过高,使部分色素分解破坏,造成色素损失。因而选择540W为浸提最佳微波功率。
2.3 提取时间对蓝靛果红色素提取率的影响

图3 提取时间对红色素提取率的影响Fig.3 Effect of microwave time on red pigment extraction
由图3看出,在一定的微波功率下,随着提取时间的延长,色素成分溶出,吸光度增大,提取90s色素提取率最高。当提取时间大于90s时,随时间延长吸光度降低,其原因可能是随提取时间延长,色素长时间处于较高温度状态下,色素的部分结构被破坏。因此提取时间应控制在90s左右。
2.4 料液比对蓝靛果红色素提取率的影响

图4 料液比对红色素提取率的影响Fig.4 Effect of solid/liquid ratio on red pigment extraction
由图4可知,色素提取率随着料液比的减小而增大,料液比降到1:10以下后提取率下降。原因可能是,提取剂用量增加,干扰杂质的浸出量也增加,导致色素溶液吸光度测定值下降;大部分微波能被提取剂吸收,导致蓝靛果细胞对微波能吸收减少,细胞破裂不完全,色素不能充分溶出。因此确定料液比在1:8~1:12范围内比较合理。
2.5 最佳提取工艺条件的确定
由表2极差R值可知,各因素对蓝靛果红色素提取率的影响程度为提取时间>乙醇溶液体积分数>微波功率>料液比,即提取时间影响最大,其次是乙醇溶液体积分数,然后是微波功率,料液比影响最小。通过k值和R值分析可得出最佳提取条件为A3B2C2D2,这与正交表中吸光度最大的试样8条件(A3B2C2D3)不相符,重复A3B2C2D2试验,吸光度为0.139,大于A3B2C2D3条件下的0.136,即提取率优于A3B2C2D3。因此蓝靛果红色素的最佳提取条件为A3B2C2D2,即微波功率540W、乙醇溶液体积分数65%、料液比1:10(g/mL)、提取时间90s,按1.3.6节公式计算得此条件下蓝靛果红色素提取量为105.5mg/100g,而传统乙醇浸提法蓝靛果红色素提取量为87.3mg/100g,因此微波法的提取量高于传统乙醇浸提法。
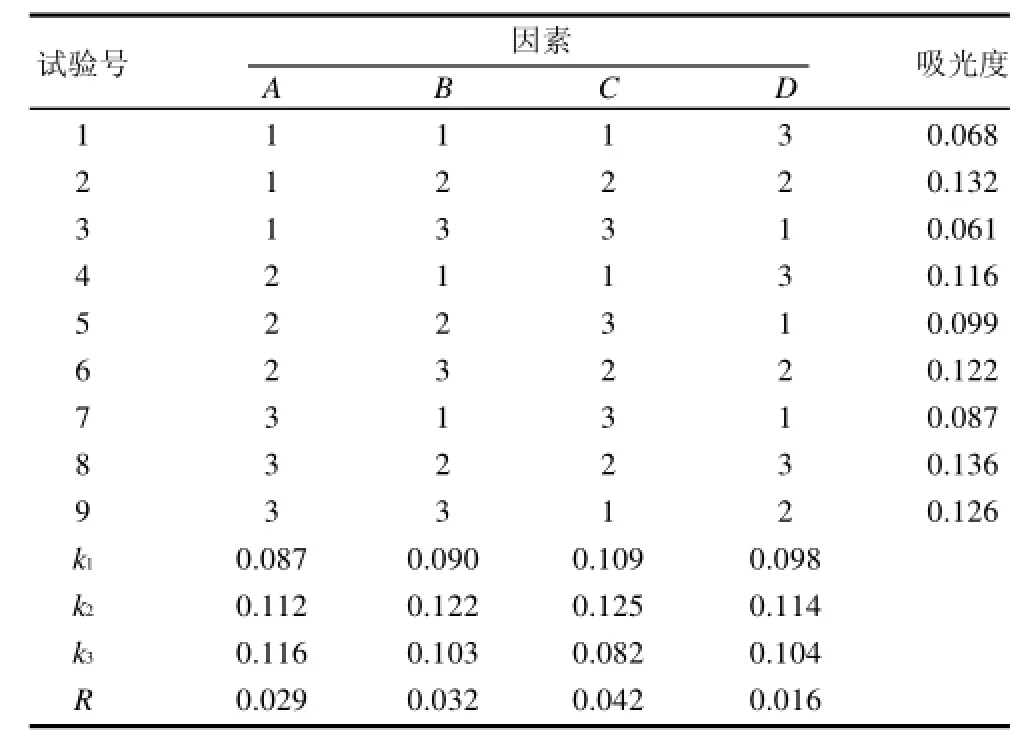
表2 L9(34)正交试验设计及结果Table 2 Orthogonal array design layout and experimental results
2.6 蓝靛果红色素提取物清除DPPH自由基活性的测定
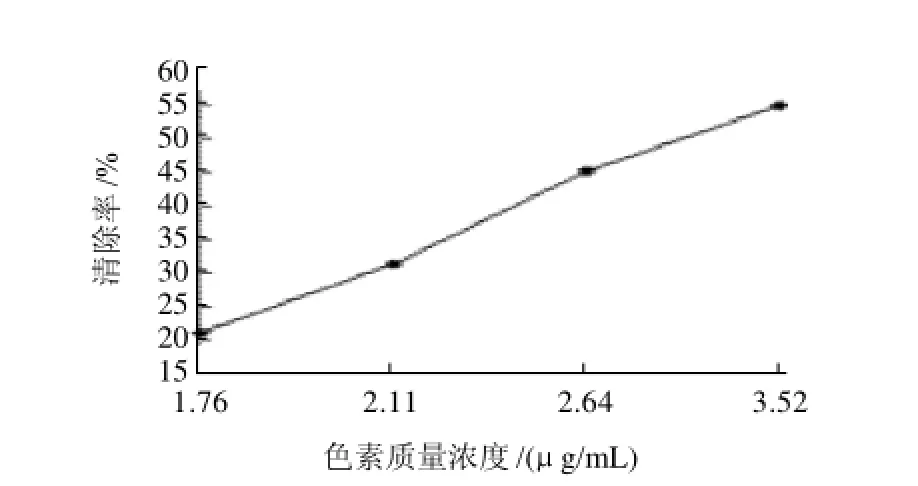
图5 红色素对DPPH自由基的清除作用Fig.5 Concentration-dependent DPPH free radical scavenging effect of the red pigments
按1.3节方法在最优化的提取工艺条件下提取蓝靛果红色素,提取率为105.5mg/100g,用体积分数65%的乙醇将提取液稀释至600、800、1000、1200mL,即色素质量浓度分别为3.52、2.64、2.11、1.76μg/mL,按照1.4节方法测定蓝靛果红色素对DPPH自由基的清除率,结果表明蓝靛果红色素具有抗氧化活性,并且其清除DPPH自由基的能力与质量浓度有量效关系。
3 结 论
采用微波辅助法提取蓝靛果红色素,通过正交试验得出各因素影响蓝靛果红色素提取效果的主次顺序为提取时间>乙醇溶液体积分数>微波功率>料液比,蓝靛果红色素的最佳提取条件为微波功率540W、乙醇溶液体积分数65%、料液比1:10(g/mL)、提取时间90s,此条件下蓝靛果红色素提取量为105.5mg/100g果实。抗氧化实验证明蓝靛果红色素提取物对DPPH自由基具有清除作用。
[1]ZHUO lihuan, WANG Ling, CHEN Quanshe, et al. Wild fruit resources and ex-ploitation in Xiaoxing'an mountains[J]. Journal of Forestry Research, 1999, 10(1): 31-33.
[2]李淑芹, 李延冰, 姜福臣, 等. 野生植物-蓝靛果营养成分研究[J]. 东北农业大学学报, 1994, 25(4): 401-404.
[3]吴信子, 朴京一, 张小勇, 等. 蓝靛果花青素的分离与鉴定[J]. 延边大学学报: 自然科学版, 2001, 27(3): 191-194.
[4]ATUE-GARCIA M T, HEINONEN M, FRANKEL E N. Anthocyanins as antioxidants on human low-density lipoprotein and lecithin-liposome system[J]. J Agric Food Chem, 1997, 45: 3362-3367.
[5]CHAOVANALIKIT A. Athocyanins, phenolics antioxidant capacity and color characteristics of bluehoneysuckles[J]. J Agric Food Chem, 2001, 45: 362-367.
[6]刘川生, 王平, 王立飞,等. 微波萃取技术在天然药物提取中的研究进展[J]. 中国天然药物, 2003, 1(3): 187-192.
[7]赵桂红, 王世平. 蓝靛果天然红色素的提取及稳定性研究[J]. 食品研究与开发, 2009, 30(6): 166-168.
[8]岳晓霞, 张根生, 李志. 超声波辅助乙醇法提取蓝靛果色素工艺条件的研究[J]. 食品科学, 2008, 29(11): 287-289.
[9]王威. 4种蔬菜和8种常用天然色素抗氧化活性的研究[J]. 天津师范大学学报: 自然科学版, 2004, 24(1): 24-26.
[10]李颖畅, 孟宪军, 修英涛, 等. 蓝莓果中花色苷的提取工艺研究[J].食品科技, 2007(11): 73-76.
[11]王福荣. 生物工程分析与检验[M]. 北京: 中国轻工业出版社, 2006: 4.
[12]赵彦杰. 蓝靛果紫红色素的提取及其理化性质研究[J]. 食品科学, 2006, 27(10): 276-278.
[13]唐琳, 李子江, 赵磊, 等. 两种pH值法测定玫瑰花花色苷含量的比较[J]. 食品科学, 2009, 30(18): 310-313.
[14]白红进, 汪河滨, 罗锋. 黑果枸杞色素的提取及其清除DPPH自由基作用的研究[J]. 西北农业学报, 2007, 16(2): 190-192.
[15]张拥军. 食品卫生与检验[M]. 北京: 中国计量出版社, 2007: 25.
Microwave-aided Extraction and Antioxidant Activity Assessment of Red Pigments from Lonicera edulis Fruits
ZHANG Yan-nan1,LI,UShuo-fang1,LI Hao1,ZHANG Yan-rong2,*
(1. College of Food Engineering, Jilin TeacheInstitute of Engineering and Technology, Changchun 130052, China;2. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The microwave-aided extraction of red pigments from the fruits of Lonicera edulis was optimized using orthogonal array design method based on single factor investigations for maximizing the 520 nm absorbance of the extract. Meanwhile, DPPH radical scavenging assay was employed to assess whether the extracted pigments have antioxidant effect. The optimum microwave-aided extraction conditions were as follows: ethanol concentration 65%, solid/liquid ratio 1:10 (g/mL), microwave power 540 W, and extraction time 90 s. The maximum red pigment yield was 105.5 mg/100 g of fruits under such conditions. The red pigments had the ability to scavenge DPPPH free radicals.
Lonicera edulis;pigment;microwave-aided extraction;antioxidation
TS202.3
A
1002-6630(2010)18-0104-04
2010-06-30
“十一五”国家科技支撑计划项目(2006BAD27B07)
张雁南(1976—),女,讲师,硕士,研究方向为天然植物功能成分提取及食品保鲜。E-mail:zhyn1221@163.com
*通信作者:张艳荣(1965—),女,教授,博士,研究方向为粮食、油脂与植物蛋白工程。E-mail:xcpyfzx@163.com
