丹参药材-中间体-丹参片的HPLC指纹图谱及其相关性研究
2010-02-07韩晓锦
张 聪, 韩晓锦
(1.上海市中药研究所,上海200002;2.上海中医药大学,上海201203)
丹参片是由丹参药材提取制成的单方制剂,临床上主要用于治疗冠心病、心绞痛、心肌梗塞等症,有显著疗效,为了提高丹参片质量控制水平,因此对其生产工艺进行分析研究,控制和提高丹参片质量。
就目前中药指纹图谱的发展现状来看,主要运用在原料药材和制剂中较多,而在对生产过程中中间体的分析较少,而中间体是原料药到成药的转化过程中的桥梁,对药材有效成分的转移率有很大的影响,因此从原料药材选择抓起,同时控制中间体和成品的质量,对生产工艺过程进行规范和改进,是从整体上系统地控制并提高药品质量的有效途径[1]。中药指纹图谱的具有系统性、特征性和稳定性[2],是一种综合的,可量化的鉴别手段。
1 仪器、试剂与材料
1.1 样品来源
本实验收集了山东河南陕西浙江等产地的26批丹参药材,经上海华宇药业公司鉴定为唇形科鼠尾草属多年生草本植物丹参(Salvia miltiorrhiza Bunge)的干燥根及根茎。丹参片中间体和丹参片均由上海雷允上制药总厂提供。见表1~2。
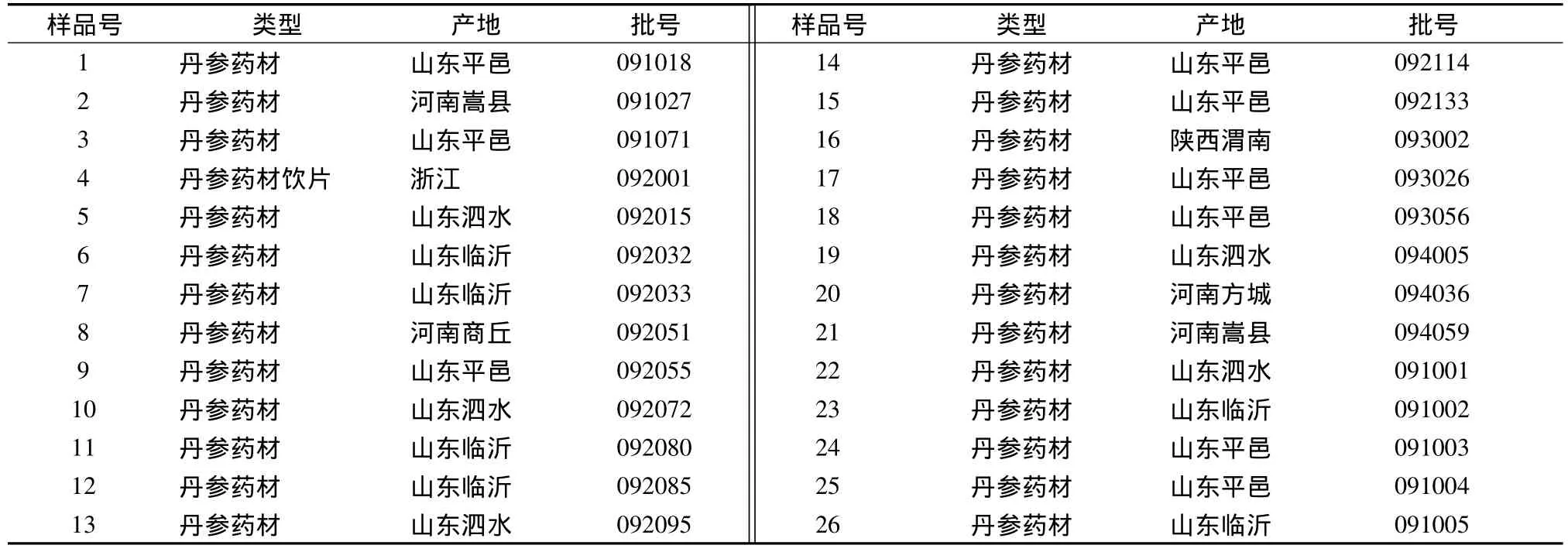
表1 丹参药材的批号及产地

表2 丹参中间体、丹参片的批号
1.2 仪器与试剂
Agilent1200色谱仪:DegasserG1322A;QuatPump G1311A;ALS G1329A;Column GCC G1316A;Detector G1314B岛津高效液相色谱仪:Degasser DGU-12A;Liquid Chromatograph LC-10AT VP;System Controller SCL-10A VP;Column OVEN CTO-10A VP;UV-VIS Detector SPD-10A VP,紫外分析仪:Shimadzu UV-2401PC乙腈(色谱纯);甲酸(分析纯);甲醇(色谱纯分析纯);水(双蒸水)。
1.3 对照品
丹参素钠(110855-200508),咖啡酸(885-200001),异阿魏酸(111698-200602),丹酚酸B(111562-200605),隐丹参酮(110852-200305),丹参酮Ⅰ(0867-200205),丹参酮ⅡA(110766-200518)均购自中国药品生物制品检定所,迷迭香酸(070602),丹酚酸A(07802)均购自上海融禾医药科技有限公司,紫草酸(ZZF070915)购自上海友思生物技术有限公司。
2 实验方法
2.1 供试品溶液的制备
2.1.1 丹参药材溶液的制备
丹参药材在放有五氧化二磷的真空干燥箱中干燥,然后打粉,过三号筛。精密称取丹参药材粉末(过三号筛)1 g,置50 mL的量瓶中,用70%甲醇超声提取1 h[3-5],放置至室温定容,放置过夜,取上清液,0.45 μm微孔滤膜滤过,得供试品溶液。
2.1.2 丹参中间体溶液的制备
精密称取丹参中间体粉末(过三号筛)1 g,置于50 mL的量瓶中,用70%甲醇超声提取1 h,静置,定容,放置过夜,取上清液0.45 μm滤膜滤过,取续滤液,得供试品溶液。
2.1.3 丹参片溶液的制备
取同一批号的丹参片20片,打粉,精密称取丹参片粉末(过三号筛)1 g,置于50 mL量瓶中,用70%甲醇超声提取1 h,静置,定容,放置过夜,取上清液0.45 μm滤膜滤过,取续滤液,得供试品溶液。
2.1.4 对照品溶液的制备
精密称取在五氧化二磷真空干燥至恒重对照品,置于20 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,作为混合对照品贮备液。
2.2 色谱条件
Agilent Zorbax Extand Reversed-Phase C18column[6-10,14](5 μm,250 mm × 4.6 mm)色谱柱;流动相[11-15]:乙腈(A)-0.5%甲酸水溶液(B),流速:1.0 mL/min,进样量:10 μL,检测波长280 nm,柱温:30℃。线性梯度洗脱程序为[6,16-23]:开始时0 min 10%A,10~20 min 20%A,40 min 30%A,45 min 35%A,55 min 42%A,75 min 55%A,85 min 65%A,92 min 70%A,102 min 80%A,112 min 100%A,色谱峰记录时间为120 min。对照品HPLC图谱见图1。

图1 对照品HPLC色谱图
3 数据处理
Spss(13.0)统计分析软件;国家药典委员会出版的《中药色谱指纹图谱相似度评价系统》(2004年A版)
4 结果和讨论
4.1 丹参药材的指纹图谱研究
4.1.1 丹参药材的指纹图谱建立
将供试品溶液按选定的色谱条件测定,得到26批样品的图谱,建立的指纹图谱共有31个共有峰。26批供试品色谱图中十二强峰峰面积占总峰面积的百分比见表3。
4.1.2 丹参药材指纹图谱的相似度计算
采用国家药典委员会出版的《中药色谱指纹图谱相似度评价系统》(2004年A版),对所得的HPLC指纹图谱全谱进行相似度计算,结果见表4。
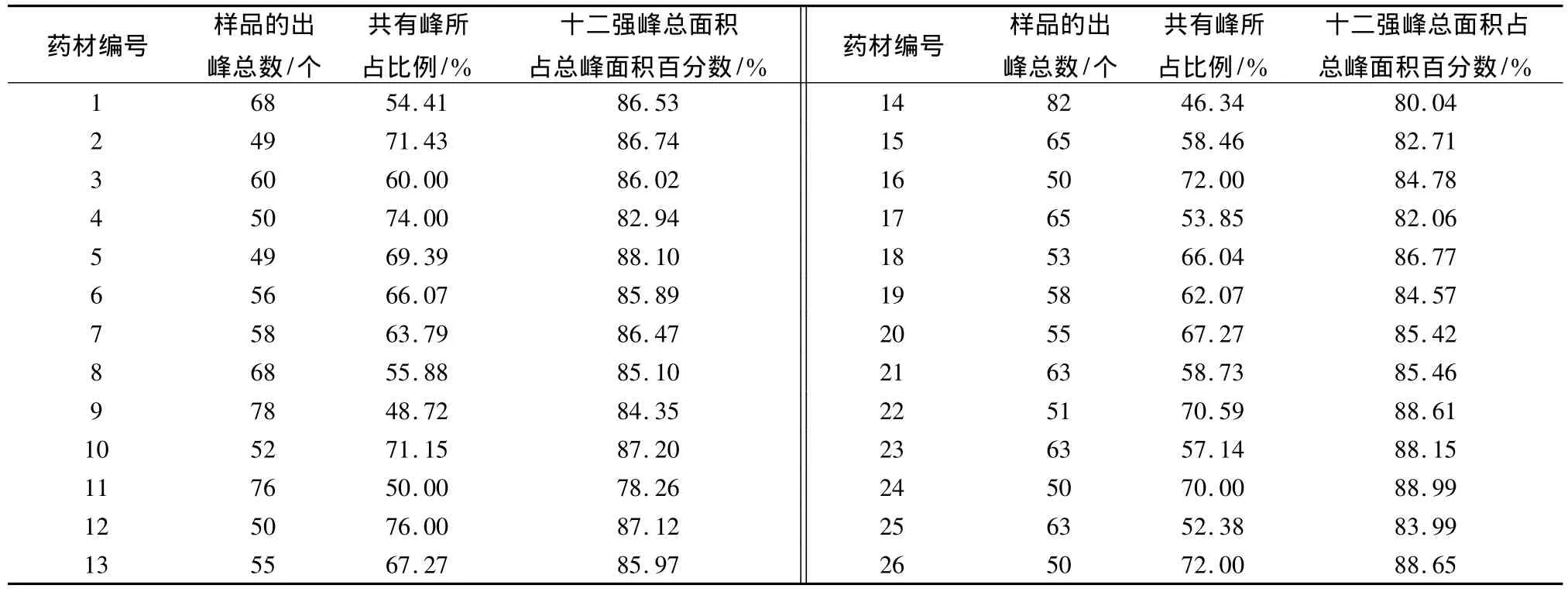
表3 26批药材的总峰数、共有峰占总峰数的比例、十二强峰峰面积占总峰面积的百分比
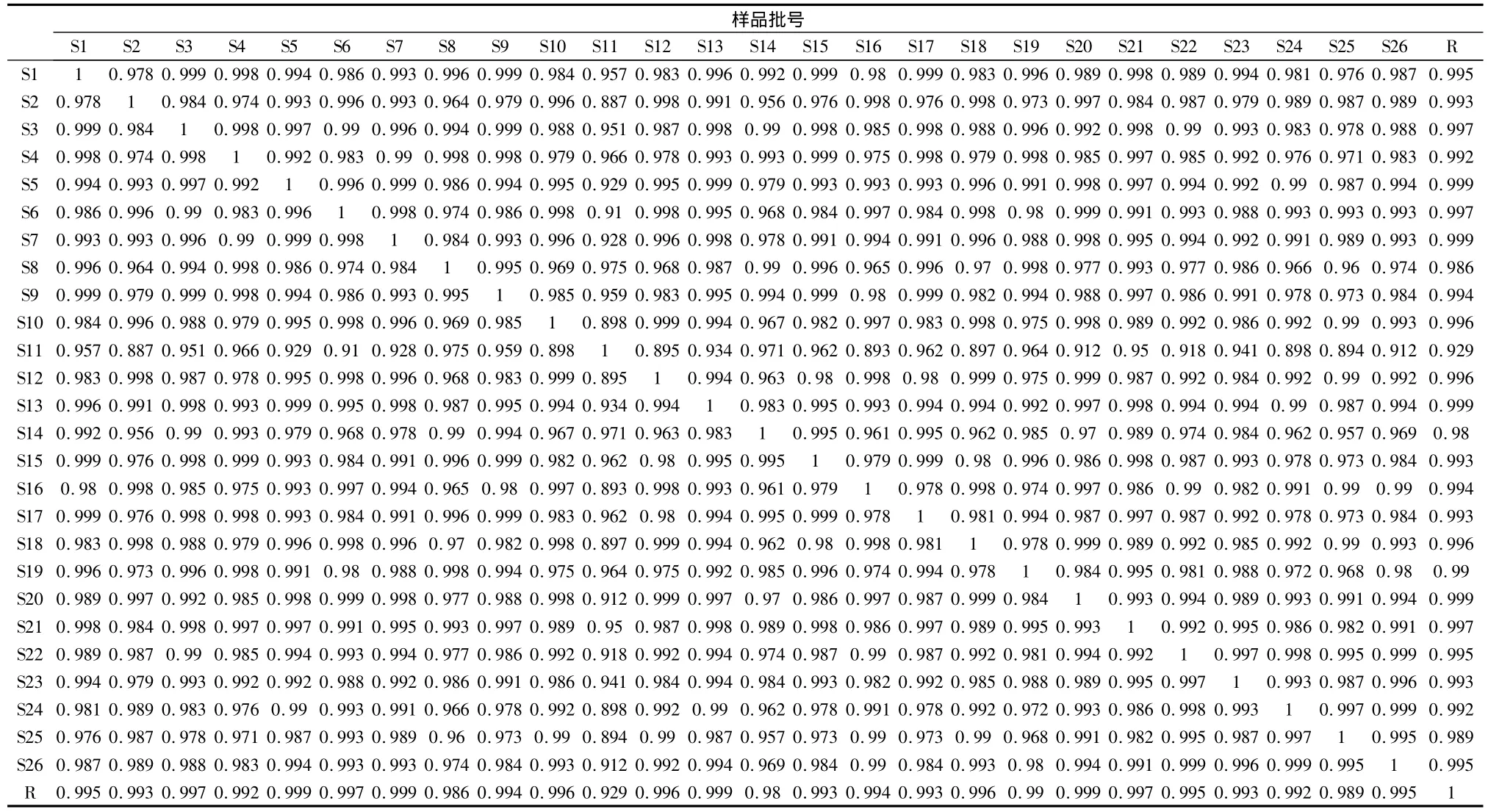
表4 不同产地的26批的丹参药材的指纹图谱相似度计算结果
4.1.3 结果
本实验用HPLC法梯度洗脱研究了不同产地不同批次的丹参药材的HPLC指纹图谱,其供试品的精密度、稳定性、重复性均良好。26批不同产地的丹参药材样品指纹图谱的特征性较强,共有31个共有峰,每个药材的十二强峰的峰面积和占总的峰面积值均在80%以上的有25个,其中只有11号稍低于80%;26批丹参药材中只有5号和25号样品的特征指纹峰检出率稍低于90%,其他药材的特征指纹峰检出率都较高,在90%以上,符合要求。利用《中药色谱指纹图谱相似度评价系统》(2004年A版)对26批次药材色谱图之间的相似度进行了研究,各个药材之间的相似度达到了0.893以上,但其中11 号药材与2、5、6、10、12、13、16、18、21、22、23、24、25、26号药材的相似度在0.950~0.893之间,相似度稍低,其他的药材间的相似度均高于0.950,符合国家对药材指纹图谱研究技术要求的规定,也确定了该实验方法使用的可行性,可用其对丹参药材进行鉴别和质量控制。
4.2 丹参中间体的指纹图谱研究的建立
4.2.1 丹参中间体的指纹图谱建立
将供试品溶液按选定的色谱条件测定,得到12批样品的图谱,建立的指纹图谱共有80个共有峰。12批供试品色谱图中十二强峰峰面积占总峰面积的百分比见表5。
4.2.2 丹参中间体指纹图谱的相似度计算
采用国家药典委员会出版的《中药色谱指纹图谱相似度评价系统》(2004年A版),对所得的HPLC指纹图谱全谱进行相似度计算,结果见表6。

表6 12个不同批号的丹参中间体的指纹图谱相似度计算结果
4.2.3 结果
本实验建立了不同批次丹参中间体的HPLC指纹图谱,12批丹参中间体共有80个共有峰;每个丹参中间体的十二强峰的峰面积和占总的峰面积值均在70%以上;其特征指纹峰的检出率均高于90%,符合要求。其相似度研究表明各个中间体之间的相似度达到0.987以上,及相对保留时间和峰面积的RSD差异不明显也说明不同批次丹参中间体间的化学成分有较好的一致性和稳定性,因此我们通过建立丹参中间体指纹图谱库,从而实现通过控制中间体质量和稳定性来控制成品的质量,为方便、快速、准确地控制药品质量提供良好的方法。
4.3 丹参片的指纹图谱的建立
4.3.1 丹参片的指纹图谱建立
将供试品溶液按选定的色谱条件测定,得到20批样品的图谱。20批供试品色谱图中十二强峰峰面积占总峰面积的百分比见表7。

表7 20批丹参片的总峰数、共有峰占总峰数的比例、十二强峰峰面积占总峰面积的百分比
4.3.2 丹参片指纹图谱的相似度计算
采用国家药典委员会出版的《中药色谱指纹图谱相似度评价系统》(2004年A版),对所得的HPLC指纹图谱全谱进行相似度计算,结果见表8。
4.3.3 结果
本实验建立了20批丹参片的HPLC指纹图谱,共获得52个共有峰(包括10个对照品的峰),每个丹参片的十二强峰的峰面积和占总的峰面积值均在60%以上;20批丹参片中,其中1号、9号和17号的特征指纹峰检出率分别84.38%、82.81%、79.37%低于90%外,其他样品的特征指纹峰检出率均在90%以上。对20批丹参片色谱图之间的相似度进行研究,各个丹参片之间的相似度均达到了0.953以上。由上可知,部分丹参片检出率稍低可能是提取时间和提取温度及其pH的不同造成的,与它醇沉水提的工艺有密不可分的联系,有待进一步验证和研究。但并没有对药品质量造成明显影响,所生产药品还是符合要求的。
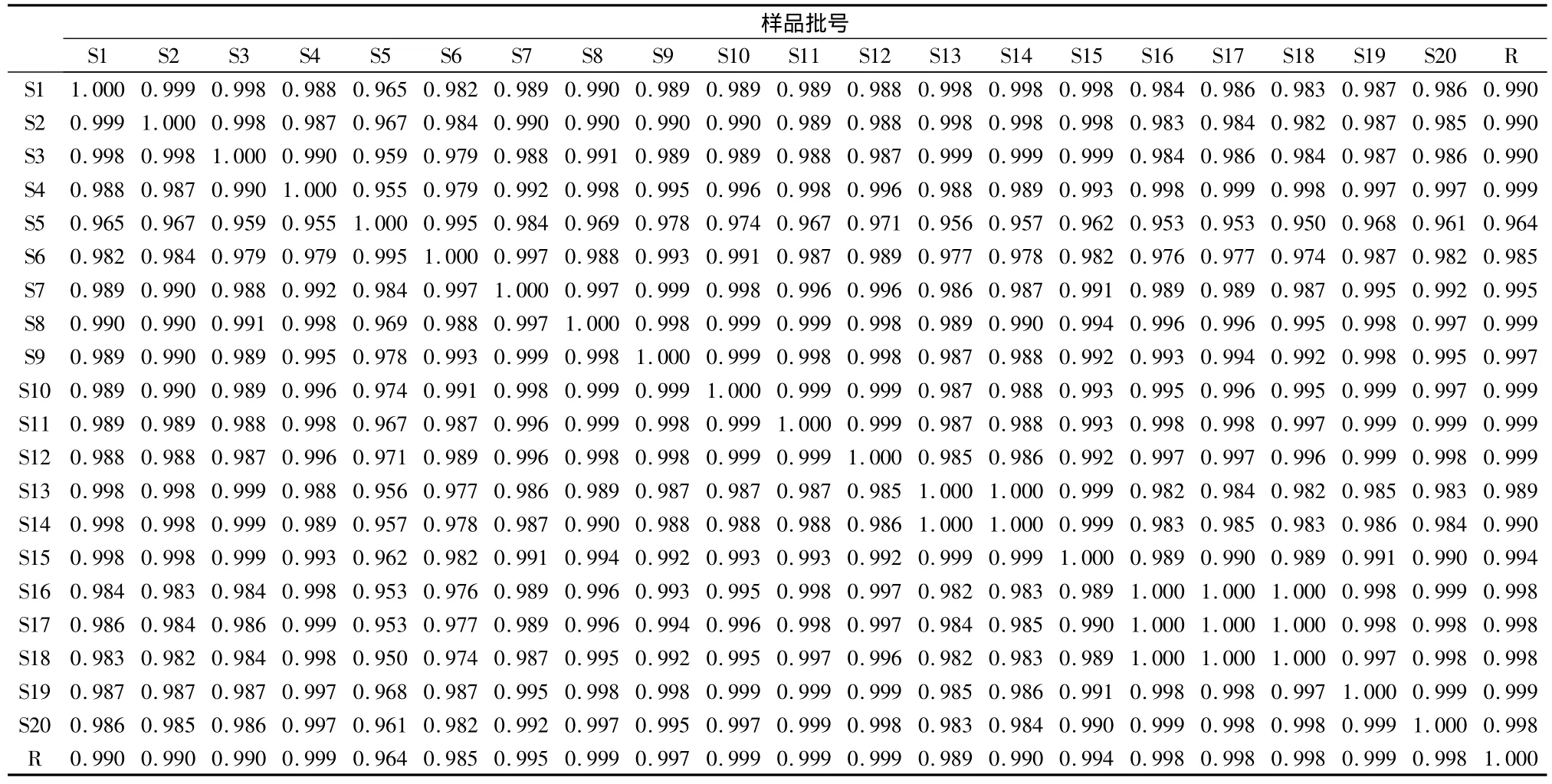
表8 同一厂家20个不同批号的丹参片指纹图谱相似度计算结果
5 丹参药材-丹参中间体-丹参片HPLC图谱的相关性分析
5.1 丹参药材-中间体-丹参片指纹图谱相似度分析[24]
分别取5批丹参药材,及相应的5批丹参中间体及相应的14批丹参片,按照拟定的方法测定其HPLC图谱,采用相似度评价软件分别对原药材、中间体、片剂进行全谱的相似度评价及共有图谱拟合[25-27],分别得到其共有指纹图谱见图2,结果见表9~13。
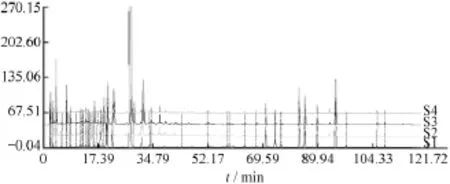
图2 药材批号为091001的丹参药材-中间体-丹参片的指纹图谱相似度示意图
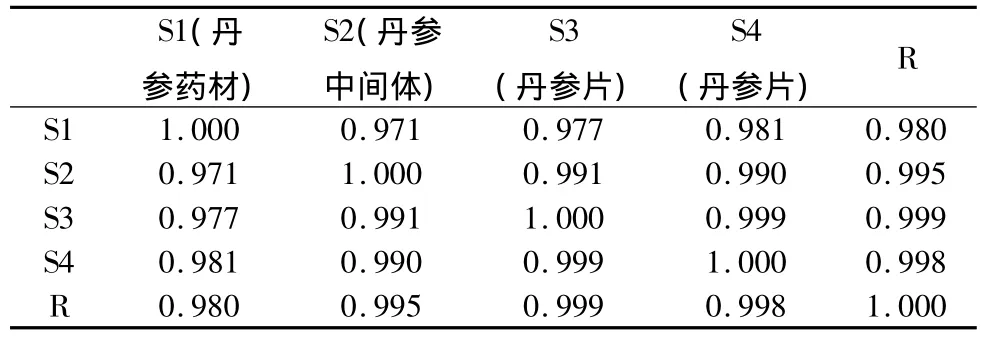
表9 药材批号为091001的丹参药材-中间体-丹参片的指纹图谱相似度计算结果
药材批号为091001的丹参片,从原药材、中间体、到片剂共有47个共有峰(包括10个对照品的峰),他们之间的相似度在0.971~0.999之间,其化学成分相关性较好。

表10 药材批号为091002的丹参药材-中间体-丹参片的指纹图谱相似度计算结果
批号为091002的丹参片,从原药材、中间体、到片剂共有44个共有峰(包括10个对照品的峰),原药材-中间体的相似度均在0.965~0.999之间,相关性较好,但是原药材和中间体与丹参片的相似度较小,不符合要求,可能是提取的时间和提取温度及其pH值不同的原因,但尚未确定,需要进一步研究。
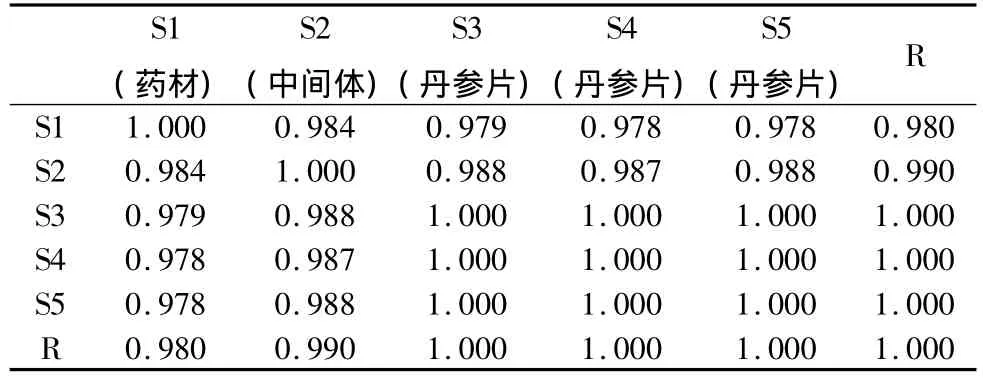
表11 药材批号为091003的丹参药材-中间体-丹参片的指纹图谱相似度计算结果
批号为091003的丹参片,从原药材、中间体、到片剂共有35个共有峰(包括10个对照品的峰),其相似度均在0.978~1.000之间,其化学成分相关性较好。

表12 药材批号为091004的丹参药材-中间体-丹参片的指纹图谱相似度计算结果
批号为091004的丹参片从原药材、中间体、片剂共有33个共有峰(包括10个对照品的峰),其之间的相似度在0.974~0.999以上,从药材到中间体浸膏到制剂,其化学成分相关性较好。
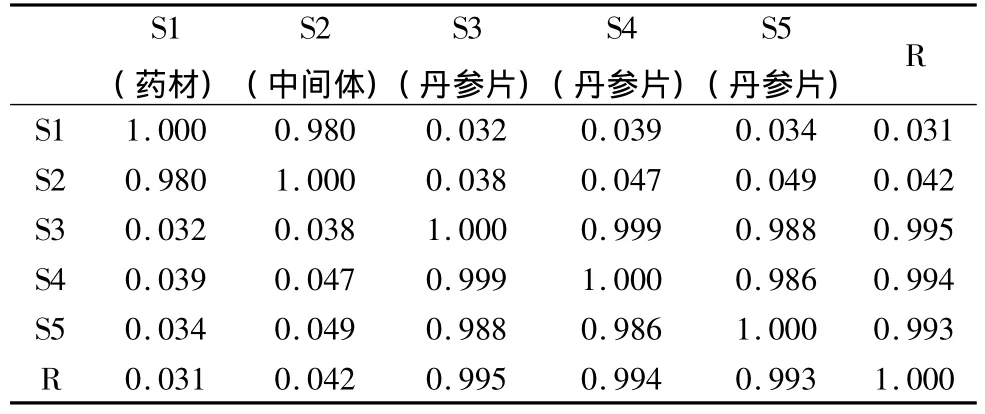
表13 药材批号为091005的丹参药材-中间体-丹参片的指纹图谱相似度计算结果
药材批号为091005的丹参片的从原药材、中间体、丹参片共有29个共有峰(包括10个对照品的峰),原药材、中间体的相似度均在0.980以上,3个对应批号的丹参片的相似度在0.986以上,但是处方药材和中间体与丹参片的相似度很小,说明之间差异很大。与上面批号为091002的样品出现了同样的问题,这可能与提取溶剂有关,也可能和提取过程的操作有关,都有待进一步验证并找出问题所在。
5.2 10个对照品在丹参药材-中间体-丹参片中的含量变化
在丹参片生产过程中,生药浸膏比为1 g生药得到0.6 g的中间体浸膏,生药成品比为1 g生药得到0.3 g的成品。见图5与表14。
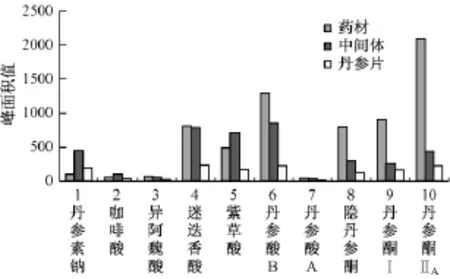
图5 10个对照品在批号091001丹参药材-中间体-丹参片中含量变化
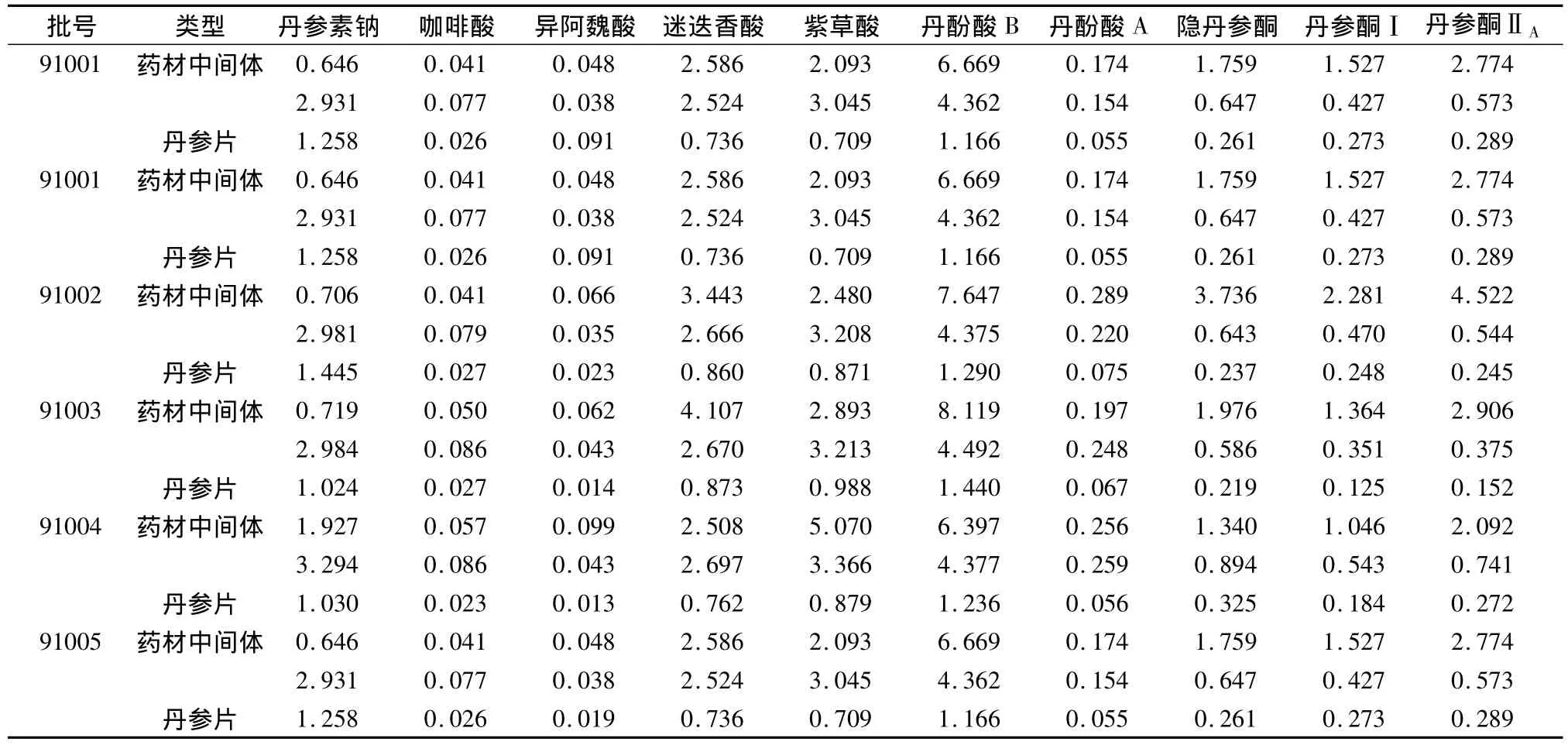
表14 10个对照品在5批丹参药材-中间体-丹参片中含量变化(mg/g)
5.3 讨论
对丹参药材、中间体、丹参片的指纹图谱进行相似度分析,结果显示 091001、091003、091004 3 批的药材-中间体-片剂的相似度均高于0.970,相关性良好,但091002和091005中,药材-中间体的相似度在0.965~1.000之间和0.985~1.000之间,相关性良好,但是两者与片剂的相似度却相当低,总结原因可能是以下两个因素:一是受片剂生产过程中加入辅料的影响,二是可能是不同时间做实验时的流动相pH值的影响,导致出峰时间的稍微改变。也可能是生产过程的其他因素引起的,有待进一步研究,这也同时反映了生产过程存在的某些问题,需要我们去寻找发现解决。
将丹参药材,中间体,片剂的共有指纹图谱进行重叠比较,发现丹参药材中的主要的有效组分的色谱峰在中间体及成品的色谱图中都有所体现,而中间体和成品中的主要色谱峰也能在药材的图谱中找到追溯,但是原料药材中水溶性成分在生产过程中损失较少,其中丹参素钠,咖啡酸,异阿魏酸,紫草酸在生产过程中损失较少,迷迭香酸,丹酚酸B,丹酚酸A在药材到中间体的过程中损失较少,而在到片剂过程中损失较多;脂溶性成分隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA在药材-中间体的过程中损失较多,到片剂过程损失较少。有些脂溶性成分由于本身含量较少及自身的不稳定性,在生产过程中发生了丢失,因此改进和提高生产工艺是非常必要和有效的。
通过对化学成分及其稳定性的研究,揭示了中药制剂与原药材和中间体的基源相关性,其中中间体及成品与原药材的指纹图谱间的差异主要是由中间体前的工艺过程中产生的,提取条件和提取方法的统一是使中间体和片剂与药材在成分上统一和稳定的关键因素,统一和完善提取工艺是用来较好的控制丹参片的质量有效方法,能实现最终产品质量的一致性和稳定性,并为提高药品质量提供依据和参考。
[1]谢培山.中药色谱指纹图谱[M].北京:人民卫生出版社,2005:8-14.
[2]谢培山.中药质量控制模式的发展趋势[J].中药新药与临床药理,2001,12(3):188.
[3]任志会,苏会霞,柏艳柳.丹参脂溶性及水溶性成分集成提取工艺研究[J].中国中医药信息杂志,2009,16(3):54-56.
[4]陈 宇,赵芝兰,朱河水.不同提取方法对复方丹参片中丹参酮ⅡA和丹酚酸B含量测定的影响[J].农业基础科学,2007,23(5):134-138.
[5]王立萍,周凤琴.近十年来丹参指纹图谱的研究进展[J].齐鲁药事,2009,28(2):101-103.
[6]安 睿,王新宏,周思丽,等.HPLC测定不同产地丹参药材中脂溶性成分[J].中成药,2004,26(4):294-297.
[7]娄子洋,张 海,李 翔,等.HPLC法同时测定中药丹参中水溶性和脂溶性成分的含量[J].第二军医大学学报,2009,30(2):190-193.
[8]Liu Mei,Li Yongguo,Chou Guixin,et al.Extraction and ultraperformance liquid chromatography of hydrophilic and lipophilic bioactive components in a Chinese herb Radix Salviae Miltiorrhizae[J].J Chromatogr A,2007.1157:51-55.
[9]Liu Ai-Hua,Li Lie,Xu Man,et al.Simultaneous quantification of six major phenolic acids in the roots of Salvia miltiorrhiza and four related traditional Chinese medicinal preparetions by HPLCDAD method[J].J Pharm Biomed Anal,2006,41:48-56.
[10]Cao Jun,Wei Yingjie,Qi Lianwen,et al.Determination of fifteen bioactive components in Radix et Rhizoma Salviae Miltiorrhizae by high-performance liquid chromatography with ultraviolet and mass spectrometric detection[J].Biomed Chromatogr,2008,22:164.
[11]Ping Hu,Liang Qionglin,Luo Guoan,et al.Multi-component HPLC Fingerprinting of Radix Salviae Miltiorrhizae and Its LCMS-MS Identification[J].Chem Pharm Bull,2005,53(6):677-683.
[12]Ping Hu,Luo Guoan,Zhao Zhongzhen,et al.Quality Assessment of Radix Salviae Miltiorrhizae[J].Chem Pharm Bull,2005,53(5):481-486.
[13]Lü Tao,Yao Xixian.Comparison of protocatechuic aldchyde in Radix Salvia miltiorrhiza and corresponding pharmacological sera from normal and fibrotic rats by high performance liquid chromatography[J].World Gastroenterol,2006,12(14):2195-2200.
[14]Li Yongguo,Song Long,Liu Mei,et al.Advancement in analysis of Salviae miltiorrhizae Radix et Rhizoma(Danshen)[J].J Chromatogr A,2009,1216:1941-1953.
[15]Chen Anjia,Li Cunhong,Gao Wenhua.Application of non-aqueous micellar electrokinetic chromatography to the analysis of active components in radix salviae miltiorrhizae and its medicinal preparations[J].J Pharm Biomed Anal,2005,37:811.
[16]王立萍,周凤琴.近十年来丹参指纹图谱的研究进展[J].齐鲁药事,2009,28(2):101-103.
[17]Sun Di,Liu Wenying ,Liang Cai.Simultaneous quantitative determination of four active components in Salvia miltiorrhiza tablets by HPLC[J].J Chin Pharm Univ,2007,38(1):51-54.
[18]马晓蕾,康 琛,李曼玲.丹参药材质量标准研究进展[J].中国中医药信息杂志,2008,15:118-122.
[19]宋平顺,杨树声,马真金,等.指纹图谱评价甘肃丹参中脂溶性成分的质量[J].中国现代中药,2009,11(9):21-24.
[20]郑晓珂,董三丽,冯卫生.HPLC法测定丹参中丹参素、丹参酮ⅡA、二氢丹参酮Ⅰ、隐丹参酮的含量[J].中国实验方剂学杂志,2003,9(6):12-15.
[21]谭生建,王文明,刘 刚,等.HPLC法测定丹参酮滴耳液中二氢丹参酮Ⅰ隐丹参酮丹参酮Ⅰ和丹参酮ⅡA含量[J].解放军药学学报,2003,19(4):269-270.
[22]潘英妮,袁 丹,付文卫,等.HPLC法测定丹参类注射液中4种水溶性成分含量[J].沈阳药科大学学报,2004,21(3):196-200.
[23]杨树声,宋平顺,赵建邦,等.HPLCF法同时测定丹参类药材中水溶性活性成分的含量[J].甘肃中医学院学报,2008,25(6):42-45.
[24]唐旭利,刘 静,李国强,等.注射用丹红(粉针)-中间体-药材HPLC指纹图谱相关性研究.中国海洋大学学报,2009,39(1):61-65.
[25]尹 雪.广藿香、阳春砂仁、藿香正气制剂特征指纹图谱“数字化标准”的构建与应用[D].广州:广州中医药大学,2009.
[26]李喜凤,孟 璐.蒲公英片药材-浸膏-制剂HPLC指纹图谱的相关性研究[J].中成药,2009,31(2):174-176.
[27]杨荣平,王宾豪,寿清耀,等.复方补骨脂缓释片药材-中间体-制剂HPLC指纹图谱的相关性研究[J].中国中药杂志,2007,32(9):855-857.
