复制缺陷型腺病毒为载体的Math1基因内耳应用安全性研究△
2010-01-25徐金操胡吟燕徐延军孙建和黄德亮杨仕明
徐金操 胡吟燕 徐延军 孙建和 黄德亮 杨仕明
虽然前庭功能障碍有一系列不同的原因,但前庭毛细胞的缺失是前庭功能障碍的基本原因[1]。目前,相当部分的前庭功能障碍是不可治愈的,而且,迄今为止,还没有一种象助听器、人工耳蜗一样的人工装置可以用来替代前庭功能的丧失[2],临床上也缺乏专门针对内耳疾病的药物。近来国外研究报道[3],内耳导入以腺病毒为载体的Math1(Ad-Math1)基因后,药物性前庭功能障碍的小鼠出现了前庭毛细胞再生和功能的恢复,使通过基因导入治疗前庭功能障碍成为可能。
腺病毒由于其转染效率高的特点,是目前使用较多的基因转导载体,但腺病毒本身对宿主细胞有损害作用,尽管现在已经对其进行了改良,然而目前关于其对动物内耳毛细胞安全性方面的研究和报道不多。此外,Math1基因除可以诱导毛细胞增殖分化外,是否也会引起内耳的不良反应,也需要观察。因此,本研究旨在探讨Ad-Math1对内耳毛细胞的安全性,为临床前庭功能障碍基因治疗的相关研究提供理论基础。
1 材料与方法
1.1实验动物与分组 10只成年Wistar大鼠,雌雄不限,体重250~300 g,健康活泼,无偏头、步态不稳、强迫环绕运动等前庭功能障碍表现。将10只大鼠分为正常对照组(n=5)、Ad- Math1-EGFP前庭阶导入组(实验组,n=5)。Ad- Math1-EGFP(由美国旧金山Genetech公司高维强教授惠赠,北京本元正阳基因技术有限公司扩增纯化)导入组大鼠在右耳通过耳蜗底回鼓阶或前庭阶打孔的方法导入物理滴度为2.1×1011v.p./ml的Ad- Math1-EGFP 5 μl(Ad- Math1的溶剂接近细胞外液),对照组大鼠不做任何处理。
1.2前庭阶导入方法 以新型兽用麻醉药速眠新Ⅱ(军事医学科学院军事兽医研究所提供),按1 ml/kg的剂量麻醉大鼠后,颈部腹侧径路,暴露听泡,以耳科电钻磨去听泡部分骨质(位置应靠后),暴露前庭窗(可见镫骨),在前庭窗稍外上方(腹侧观)以自制纤细的钨丝针(针尖外径约0.1 mm)在耳蜗底回钻开耳蜗骨壁进入前庭阶,钻开后即可见清亮外淋巴液流出,通过最小刻度为0.1 μl的10 μl微量进样器(上海安亭微量进样器厂)连接自制微导管,通过TJ-1A型注射器泵控制器按0.5 μl/min的速度,将5 μl 物理滴度为2.1×1011v.p./ml的Ad-Math1-EGFP从前庭阶打孔处缓慢注入耳蜗内,注射完毕后,医用耳脑胶将大小合适的肌肉块封闭打孔处。用软组织封闭听泡骨壁缺损后,缝合手术切口。
1.3冰冻切片HE染色观察 导入Ad-Math1-EGFP 7天后,以速眠新Ⅱ麻醉大鼠,断头处死,迅速取出听泡,浸泡在4%多聚甲醛中。剥离听泡后,取出镫骨,开放圆窗和前庭窗,蜗尖打孔,从蜗尖以4%多聚甲醛进行灌注并在4℃冰箱中固定2小时,以10%EDTA脱钙48小时后OCT包埋,进行冰冻切片和HE染色,具体过程参照姜泗长等[4]主编的耳鼻咽喉科实验技术。然后在Leica DMI 400 B倒置荧光显微镜(配置有Leica DMI400 B FX图像采集系统)下进行观察拍照。
1.4耳蜗及前庭组织Phalloidin染色激光共聚焦显微镜观察 导入Ad-Math1-EGFP 7天后,按上述方法,将耳蜗基底膜、球囊斑、椭圆囊斑、三个半规管壶腹嵴分别取出,用0.01 mol/L PBS清洗5分钟3次后,放入0.3%Triton X-100(购自北京中杉金桥生物工程技术有限公司)浸泡10分钟,PBS再次清洗5分钟3次后,放入以PBS配制的1:40 Phalloidin-Tetramethylrhodamine(一抗已用红色荧光标记)中室温下孵化30分钟,以PBS充分洗涤后,固定于载玻片上,10%防荧光淬灭甘油封片,并在Zeiss AXIOVERT 200 M BP激光共聚焦显微镜下进行观察拍照。
1.5扫描电镜观察 将导入Ad-Math1-EGFP 7天的大鼠麻醉处死后,按上述方法以2.5%戊二醛进行灌注并在4℃冰箱中固定过夜,脱钙一周后进行大鼠前庭器官电镜标本的制作。具体过程参照姜泗长等[4]主编的耳鼻咽喉科实验技术,并在Hitachi S4800扫描电镜下进行观察拍照。
1.6游泳试验 参照Staecker等[3]的方法,将大鼠从离水面约20 cm高处丢入直径约1米、高度为50 cm的不透光并盛有与大鼠体温接近的温水的容器中,通过摄像机记录大鼠从接触水到出现有目的的游泳之间的时间。每只大鼠测量完后用暖风机吹干并休息20分钟后重复测量一次,取两次的平均值。
1.7CDM-CEP的检测 CDM-CEP是反应球囊功能的前庭源性短声诱发电位[5,6],导入Ad-Math1-EGFP 7天后,参照Matsuzaki[5]等的方法,动物麻醉后,行颈背部正中入路,暴露颈椎及颈嵴硬膜,将银球电极置于第三颈椎水平颈嵴硬膜上,参考电极置于第一胸椎水平的背部脂肪垫。刺激条件:短声(click)刺激,刺激频率5 次/秒,叠加次数200次,带通滤波30 ~3000 Hz,经插入式耳机给声,测试仪采用美国智听(IHS)公司的Smart EP 诱发电位仪。每只动物测量两次,取其平均值。
1.8ABR检测 麻醉方法同前,将记录电极固定于大鼠颅骨正中,参考电极固定于双侧耳垂。刺激条件:短声(click)刺激,刺激频率19.30 次/秒,叠加次数1 024次,带通滤波30~3 000 Hz,经插入式耳机给声,测试仪采用美国智听(IHS)公司的Smart EP 诱发电位仪。每只动物测量三次,以波V为准确定阈值,取其平均值做为结果。
1.9统计学方法 游泳时间、CDM-CEP阈值、ABR阈值以均数±标准差表示。以Excel表格储存,以SPSS 10.0软件采用方差分析进行比较。部分图像用Photoshop 8.0进行处理。
2 结果
2.1冰冻切片HE染色观察 对照组大鼠耳蜗Corti器内毛细胞及外毛细胞均正常,球囊、椭圆囊及半规管壶腹嵴毛细胞及纤毛未见破坏,支持细胞、耳石膜存在;实验组大鼠耳蜗Corti器、球囊斑、椭圆囊斑、半规管壶腹嵴在形态上表现与对照组大鼠基本一致,毛细胞及纤毛、支持细胞均正常(图1)。
2.2Phalloidin染色观察 正常大鼠耳蜗内外毛细胞及前庭囊斑毛细胞纤毛形态正常,表皮板、网状表面及毛细胞相互之间的连接结构清晰可见。实验组耳蜗及前庭组织可见GFP的阳性表达明显,与正常组相比,耳蜗及前庭结构形态无明显区别(图2)。
2.3扫描电镜观察 正常对照组大鼠耳蜗基底膜内毛细胞和三排外毛细胞排列整齐,纤毛正常,球囊、椭圆囊耳石膜及半规管壶腹嵴终帽覆盖良好,未见破坏,局部放大后可见耳石颗粒形态及壶腹嵴毛细胞纤毛正常;实验组大鼠耳蜗基底膜内外毛细胞纤毛正常,椭圆囊耳石膜及半规管壶腹嵴终帽覆盖良好,未见破坏,局部放大后可见耳石颗粒及毛细胞纤毛正常,球囊虽耳石膜缺失(标本制作时所致),但毛细胞纤毛排列均匀紧密,局部放大后,可见纤毛形态正常(图3)。

图1 对照组和实验组大鼠耳蜗及前庭器官冰冻切片HE染色图片
a~d为对照组大鼠,可见耳蜗Corti器(a)内毛细胞(IHC)及外毛细胞(OHC)均正常存在,球囊斑(b)、椭圆囊斑(c)及半规管壶腹嵴(d)毛细胞(HC)、纤毛(S)未见破坏,支持细胞(SC)、耳石膜存在(OM);e~h为实验组大鼠,耳蜗Corti器(e)、球囊斑(f)、椭圆囊斑(g)、半规管壶腹嵴(h)在形态上表现同对照组大鼠基本一致,毛细胞及纤毛、支持细胞均正常存在。以上图片标尺为25 μm
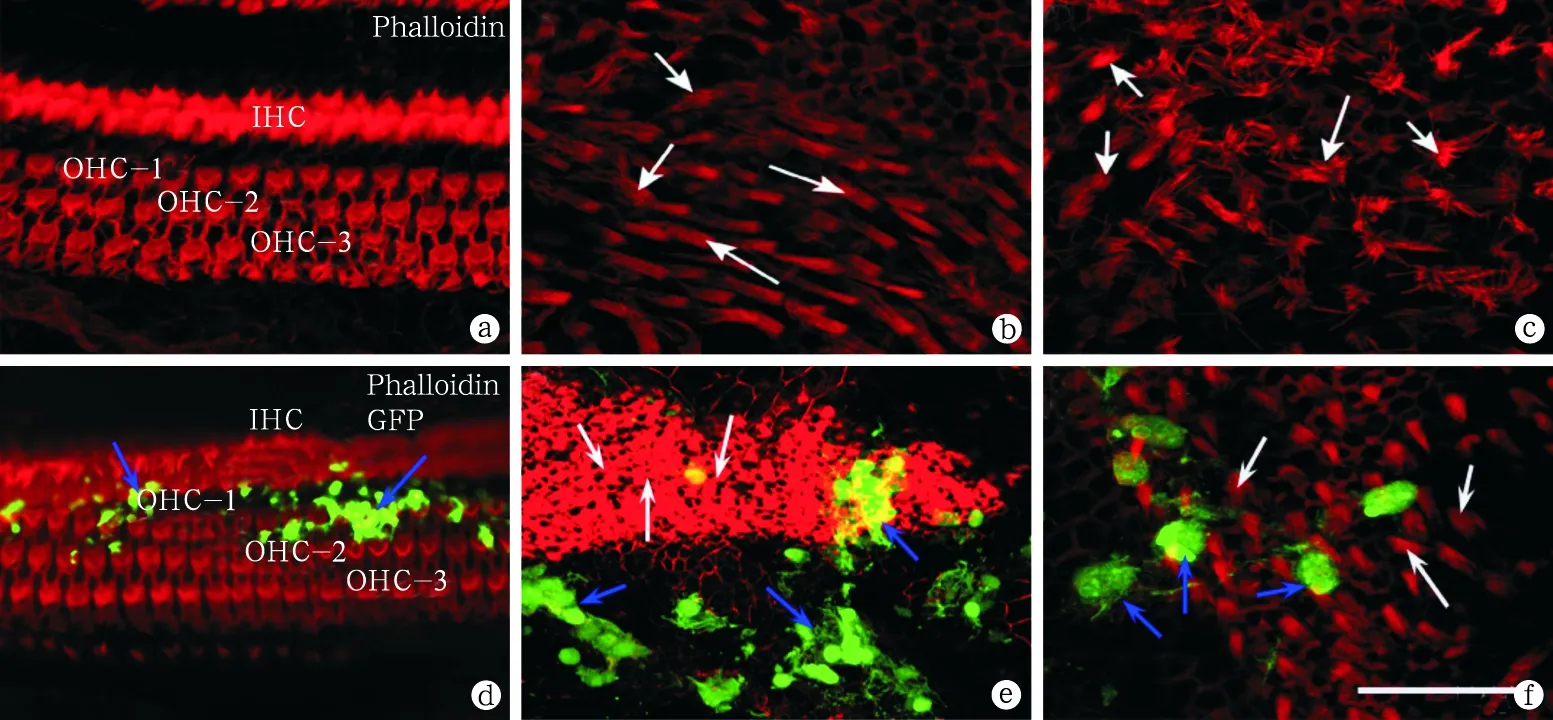
图2 两组大鼠耳蜗前庭组织铺片phalloidin染色激光共聚焦显微镜观察
a~c为正常对照组大鼠,可见耳蜗内毛细胞(IHC)外毛细胞(OHC)(a)及前庭囊斑毛细胞(b、c)纤毛形态正常(白色箭头所示),表皮板、网状表面及毛细胞相互之间的连接结构清晰可见。d~f为实验组大鼠,可见耳蜗基底膜(a)及前庭囊斑毛细胞(e、f)GFP表达明显(蓝色箭头所示),与正常组相比,耳蜗及前庭结构形态无明显区别。以上图片标尺均为10 μm(图中e与b的染色差异为标本处理过度所致)

图3 两组大鼠耳蜗前庭器官组织扫描电镜图片
a~d为正常对照组大鼠,可见耳蜗基底膜(a)内毛细胞(IHC)和三排外毛细胞(OHC)排列整齐,纤毛正常,球囊斑(b)、椭圆囊斑(c)耳石膜(箭头所示)及半规管壶腹嵴终帽(d)(箭头所示)覆盖良好,未见破坏;e~h为实验组大鼠,可见耳蜗基底膜(e)、内外毛细胞纤毛正常,椭圆囊斑(g)耳石膜(箭头所示)及半规管壶腹嵴终帽(h)(箭头所示)覆盖良好,未见破坏。球囊斑(f)虽耳石膜缺失,但毛细胞纤毛排列均匀紧密(箭头所示),纤毛形态正常。以上标尺1(a、e)为2.5 μm,标尺2(b~d,f~h)为25 μm,标尺3(a~h右上角小图)为4 μm
2.4功能方面 两组大鼠游泳时间、CDM-CEP和ABR阈值差异均无统计学意义(P>0.05)(表1)。
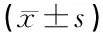
表1 两组动物的游泳时间、CDM-CEP阈值及ABR阈值
3 讨论
目前,临床上还没有专门针对内耳疾病的药物,因此基因治疗被应用于耳毒性或内耳缺血-再灌注损伤的动物模型中[7],为内耳疾病基因治疗的临床应用进行探索。将治疗基因导入内耳并在靶器官上获得良好的表达是基因治疗的关键所在。多种载体可以将基因转导入内耳,主要分为病毒和非病毒类载体,前者转染效果好,但有一定的不良反应;后者安全,但转染效果低下[8]。
由于腺病毒(adenovirus,Adv)宿主范围广、转染效率高、表达强度高的显著优点,该病毒成为目前运用最普遍的病毒载体之一[8]。研究证实腺病毒载体可以在体外转导毛细胞和神经节细胞[9,10],但在内耳引起的免疫反应较明显。新一代改良后的腺病毒载体,去掉了载体基因组中的E1/E3或E4片段,在新生大鼠的培养组织中证实可以转导毛细胞和螺旋神经节细胞[10],而Luebke等[11]也证实新一代腺病毒载体(E1、E3缺失)在内耳的耐受性要比老一代的腺病毒载体(未缺失E1、E3)更好,不良反应小。Math1是哺乳动物内耳毛细胞发育过程中所必需的一个基因[12],已有研究证实,敲除了Math1基因的小鼠,听觉和前庭毛细胞都没有发育,而在体外培养的Corti器中加入以质粒为载体的Math1基因后,产生了额外的毛细胞[12,13]。用Math1在人类中的同源基因Hath1,同样重复出了上述结果[14],因此,Math1是目前前庭功能障碍潜在的治疗基因,但Math1基因的应用是否对内耳有不良的影响,目前尚不清楚。
本研究结果显示,通过前庭阶导入Ad-Math1-EGFP(E1、E3缺失)一周后,实验组大鼠的CDM-CEP、ABR阈值和游泳时间与正常大鼠相比,差异均无统计学意义,而且大鼠前庭组织铺片Phalloidin染色、冰冻切片HE染色及扫描电镜观察可见导入Ad-Math1-EGFP 7天后,耳蜗前庭毛细胞均未受到损害,与正常对照大鼠相比,组织形态正常。可见本研究中所使用的以新一代复制缺陷型腺病毒为载体的Math1基因对前庭和耳蜗毛细胞是安全的。此外,观察到内耳注入腺病毒一个月后,通过冰冻切片,在荧光显微镜下仍可见EGFP的表达,虽然其表达效率较低(资料未显示),但仍说明表达时间较长,而载体在动物体内长时间表达,亦是基因治疗有效性的一个保证[15,16]。
本研究证实,新一代复制缺陷型腺病毒载体可以作为内耳基因转导较理想的载体,经前庭阶耳蜗底回打孔导入以复制缺陷型腺病毒为载体的Ad-Math1-EGFP,可以在前庭器官获得良好的表达。
4 参考文献
1 Tsuji K, Velasquez-Villasenor L, Rauch SD, et al. Temporal bone studies of the human peripheral vestibular system. Ménière's disease[J]. Ann Otol Rhinol Laryngology, 2000,181:S20.
2 Wall C, Merfeld DM, Rauch SD, et al. Vestibular prostheses: the engineering and biomedical issues[J]. J Vestib Research, 2002,12:95.
3 Staecker H, Praetorius M, Baker K, et al. Vestibular hair cell regeneration and restoration of balance function induced by Math1 gene transfer[J]. Otology & Neurotology, 2007, 28: 223.
4 姜泗长,翟所强,主编. 耳鼻咽喉科实验技术[M].北京:人民军医出版社,1999.61~65.
5 Matsuzaki M, Murofushi T. Click- evoked potentials on the neck of the guinea pig[J]. Hear Res, 2002, 165:152.
6 吴子明, 郭维维, 张素珍,等. 大鼠颈髓膜表面短声诱发电位及起源[J].听力学及言语疾病杂志, 2003, 12:244.
7 Maiorana CR,Staecker H. Advances in inner ear gene therapy: Exploring cochlear protection and regeneration[J].Current Opinion in Otolaryngology & Head & Neck Surgery, 2005,13:308.
8 黄文林,主编. 分子病毒学[M].北京:人民卫生出版社,2002.241~253.
9 Dazert S, Battaglia A, Ryan AF. Transfection of neonatal rat cochlear cells in vitro with an adenovirus vector[J]. Int J Dev Neurosci, 1997,15:595.
10 Kanzaki S, Ogawa K, Camper SA,et al. Transgene expression in neonatal mouse inner ear explants mediated by first and advanced generation adenovirus vectors[J]. Hear Res, 2002, 169:112.
11 Luebke AE, Steiger JD, Hodges BL, et al. A modified adenovirus can transfect cochlear hair cells in vivo without compromising cochlear function[J]. Gene Ther, 2001, 8:789.
12 Bermingham NA,Hassan BA,Price SD, et al. Math1: an essential gene for the generation of inner ear hair cells[J]. Science, 1999,284:1 837.
13 Zheng JL,Gao WQ. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears[J]. Nat Neurosci, 2000,3:580.
14 Shou J,Zheng JL,Gao WQ. Robust generation of new hair cells in the mature mammalian inner ear by adenoviral expression of Hath1[J]. Mol Cell Neurosci, 2003,23:169.
15 Praetorius M, Baker K, Weich CM, et al. Hearing preservation after inner ear gene therapy: The effect of vector and surgical approach[J]. ORL J Otorhinolaryngol Relat Spec, 2003,65:211.
16 Staecker H, Li D, O'Malley BW, et al. Gene expression in the mammalian cochlea: A study of multiple vector systems[J]. Acta Otolaryngol ,2001,121:157.
