大鼠双侧耳蜗毁损后下丘核生长相关蛋白表达研究*
2010-01-25郜元坤华清泉廖华李孟
郜元坤 华清泉 廖华 李孟
生长相关蛋白-43(growth-associated protein,GAP-43)是与神经发育、轴突再生、突触重建密切相关的一种快速转运胞膜磷酸蛋白,是神经细胞生长锥膜面富含的特异性酸性磷蛋白,是生长锥膜的主要组成部分,在神经系统的发育中起重要作用。生长锥膜上GAP-43表达量与轴突生长相一致,可反映轴突生长及突触形成所处的大致状态。GAP-43与神经损伤后突触的再生及重组密切相关[1]。关于大鼠单侧耳蜗毁损后下丘中央核突触素的表达,国外已有文献报道[2],但双侧耳蜗毁损后下丘核GAP-43的表达变化目前国内外尚未见报道。本研究通过机械毁损大鼠的双侧耳蜗建立大鼠双侧耳蜗去传入损伤模型,观察耳蜗毁损后不同时间下丘GAP-43的表达及意义,探讨双侧耳蜗去传入损伤大鼠下丘发生的可塑性变化及可能机制。
1 材料与方法
1.1实验动物及分组 由华中科技大学同济医学院实验动物中心提供成年健康SD大鼠35只,雌雄不拘,体重200~220 g,耳廓反应灵敏,适应性饲养一周后随机分为7组,每组各5只动物,分别为对照组和耳蜗毁损后3、7、14、21、28 、90天组。
1.2双侧耳蜗毁损术 10%水合氯醛(0.35 ml/kg)经腹腔注射麻醉动物,按Alvarado法[3]行双侧耳蜗毁损,即无菌条件下,取耳后下切口,暴露并打开听泡,暴露耳蜗,用显微剥离子毁损耳蜗,吸除残留的耳蜗内容物,填塞明胶海绵后缝合。对照组在去除听泡腹后侧壁后即行缝合。术毕各组立即肌注青霉素160万u/kg,分笼喂养。
1.3组织切片的制备 于术后3、7、14、21、28 、90天分别处死各组动物,完成双侧下丘组织切片。方法:10%水合氯醛(0.35 ml/kg)腹腔内注射麻醉下,打开腹腔,自心尖部插入灌注针头至主动脉升部,并用血管钳夹住动脉内的针头以免滑出,剪开右心耳,先快速注入4℃含肝素(20 U/ml)的生理盐水200 ml冲洗,继而灌注固定液4%多聚甲醛液400 ml,先快后慢,共30分钟,至大鼠全身变硬,随即断头,取脑前在解剖显微镜下验证耳蜗毁损的程度,然后开颅取出双侧下丘,再在40 g/L多聚甲醛液中后固定4小时,经脱水、透明、浸蜡、石蜡包埋,连续冠状位切片(片厚4 μm),置于多聚赖氨酸包被的载玻片上,干燥后置于4℃冰箱用于GAP-43的免疫组化染色。
1.4免疫组织化学检测方法 鼠抗GAP-43单克隆抗体及SABC试剂盒均购自武汉博士德生物技术有限公司。切片常规脱蜡至水化,依次加入3%过氧化氢灭活内源性过氧化物酶10分钟,微波抗原修复,5%正常山羊血清室温下封闭20分钟,加兔抗山羊GAP-43(武汉博士德),湿盒4℃过夜;以PBS洗3次,每次2分钟,加生物素标记二抗(山羊抗小鼠IgG),室温20分钟;以PBS洗3次,每次2分钟,加入第三抗体液(SABC,来自SABC试剂盒)室温20分钟;以PBS洗4次,每次5分钟,滴加DAB室温显色10~15 min,显微镜下控制。自来水冲洗,脱水、透明,中性树胶封片。
光镜下观察下丘核GAP-43在细胞内的分布,其阳性产物呈棕黄色点状或颗粒样;免疫组化染色图像分析用Olympus显微摄像系统采集图片,采用灰度测量法,采集的图像均在同一光强度、同一放大倍数进行。采集下丘核细胞阳性反应产物,每张切片取五个不同的视野,采用千屏医学图文显微图像分析系统进行灰度值分析,最后取五个数值的平均值为每张切片的平均灰度值,平均灰度值越低,其表达程度越高。
1.5统计学方法 采用SPSS13.0分析软件,运用单因素方差分析比较各组间差异进行分析处理。
2 结果
2.1大鼠双侧耳蜗毁损后不同时间下丘核细胞内GAP-43的表达如图1~7所示,从图中可见:对照组大鼠的下丘核细胞的GAP-43阳性产物主要位于胞浆,呈棕黄色点状或颗粒样,分布较均匀,耳蜗毁损后各组下丘核细胞的GAP-43阳性产物的分部部位与对照组相同,只是细胞内阳性产物的密度和有阳性表达的细胞数目有不同程度的增加。
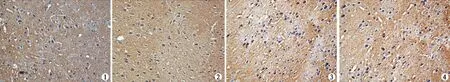
图1 假手术对照组下丘GAP-43表达 (免疫组化染色×400)图2 耳蜗毁损后3天组下丘GAP-43表达 (免疫组化染色×400)图3 耳蜗毁损后7天组下丘GAP-43表达 (免疫组化染色×400) 图4 耳蜗毁损后14天组下丘GAP-43表达 (免疫组化染色×400)
2.2各组双侧耳蜗毁损后不同时间下丘核GAP-43免疫组化染色图像分析的平均灰度值见表1。
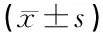
表1 各组下丘核GAP-43平均灰度值(n=5只)
注:* 与对照组比较,P>0.05
从表1可见,双侧耳蜗毁损后3天GAP-43表达升高, 7、14天其表达持续上升,14天时上升达高峰,21、28天逐渐下降,到毁损后90天GAP-43水平略高于正常组。单因素方差分析显示:除术后90天组外,其余各组与对照组比较差异均有显著统计学意义(P<0.01)。各组动物左右两侧比较差异均无统计学意义(P>0.05)。
3 讨论
下丘核(IC)是最重要的听中枢皮质下会聚站, 在声信号处理过程中起着至关重要的作用,听觉传导通路中所有上行和下行投射纤维均在 IC形成专一性突触(obligatory synapse),这种联系既有兴奋性突触(excitatory synapse)也有抑制性突触(inhibitory synapse)[4]。研究表明,在强纯音声损伤前后检测灰鼠耳蜗单个神经元功能活动的变化时发现,约半数下丘神经元在受到纯音损伤后表现更为活跃,自发放电率增加[5~8],说明在中耳及内耳的结构和功能发生变化的同时,听觉中枢也相应发生了改变,即发生了可塑性(plasticity)的改变或重组(reorganization)。在参与听觉信号的传递过程中下丘核-耳蜗声信号通路有多种蛋白、酶等参与,切除一侧或者双侧耳蜗将引起它们的改变或重新分布。耳蜗切除后除了下丘核-耳蜗声信号通路递质、受体以及参与调节的相关蛋白等发生相应的改变外,也可导致该通路的结构、电生理功能出现相应的重塑,以适应耳蜗切除后的改变,维持结构、生理和功能的平衡[9,10]。
生长相关蛋白是一种分子量为23.6KD的突触前膜蛋白、神经调素,被认为是神经发育和再生的一个内在决定因子和标志性蛋白[11]。GAP-43在脑中分布广泛但不均一,在大多数成熟神经元,其表达水平低或为阴性,在神经系统发育与再生过程中,GAP-43的合成显著增高。生长锥膜上GAP-43含量的表达与轴突生长相一致,可反映轴突生长及突触形成所处的大致状态。有作者在大鼠迷路损伤后不同时期观察到前庭核中GAP-43mRNA水平的不同变化,提示GAP-43mRNA水平的提高可能与前庭代偿中突触重组和神经可塑性相关[12]。在轴突外生和突触形成时,GAP-43蛋白高水平表达,这种高水平维持整个大脑发育期的突触可塑性过程[13]。本实验发现大鼠的双侧耳蜗毁损后,GAP-43的表达有先增高达到峰值后逐渐降低的趋势,推测GAP-43免疫活性的增高可能与轴突再生、突触重建相关。可能是在正常神经元,由靶器官产生的抑制性信号通过逆行轴浆转运至胞体,抑制GAP-43表达;而外周神经损伤后,损伤局部正反馈信号逆行转运至胞体或由胞体本身产生的正反馈信号刺激了GAP-43的表达[14,15]。此外,神经系统损伤后,机体可能启动了潜伏状态的神经元轴突,GAP-43mRNA转录增加,GAP-43表达增强,使潜伏期状态的突触转化成活细胞状态,1~2周后,潜伏期状态的细胞全部活化,GAP-43表达也达到最高水平,轴突再生、突触重建也达到最迅速时期;之后负反馈信号占主导作用,部分细胞开始逐渐失活,GAP-43表达逐渐下降,其免疫活性也下降。Michler等[16]发现,在单侧声损伤或耳蜗切除的大鼠,毁坏其Corti器后,术侧外侧橄榄体(LSO)生长相关蛋白在术后3天微量表达,术后9天表达较强,第三周达到高峰,持续约1.5年;在对侧LSO,其生长相关蛋白阳性反应术后3~16天升高,持续1年。研究还发现,在过度听觉刺激后,GAP-43的阳性细胞在IC、耳蜗前腹核也有变化。Chen等[17]研究表明,在单侧耳蜗毁损后2天,耳蜗前复核GAP-43表达与对照组无差别,术后4天明显增加,8天达高峰,14天时比4天时弱,28天仍比对照组高,60天有继续下降的趋势。Mossop[18]等发现成年沙鼠一侧耳蜗切除后24 h和7 d,术耳对侧IC的GAP较同侧明显减少,但是在术后4 h和一年进行检测则没有发现上述改变。Illing[19]等发现,单侧耳蜗切除后,GAP-43在同侧上橄榄核急剧上升,而在其它听觉脑干核团则下降,同时发现在耳蜗切除后上橄榄核中GAP-43 mRNA表达增高的神经元其蛋白质免疫活性也高。相反,在术耳对侧IC中GAP-43表达mRNA的表达则明显减低,认为上橄榄复合体参与了耳蜗切除后听觉脑干的重塑过程。
GAP-43的独特性质在于它是突触前末端的生长相关蛋白,生长锥膜上GAP-43的表达与轴突生长相一致,从而可反映出轴突生长及突触形成所处的大致状态。本实验只研究了大鼠双侧耳蜗毁损后三个月内不同时间点的GAP-43表达变化,对耳蜗毁损后中枢可塑性机制进行初步探讨,至于一年后或更长时间的变化有待进一步深入研究。
4 参考文献
1 Wiese UH,Ruth JL,Emson PC.Differential expression of growth-associated protein(GAP-43)mRNA in rat primary sensory neurons after peripheral nerve lesion:A non-radioactive in situ hybrization study[J].Brain Res,1992,592:141.
2 Alvarado JC, Fuentes-Santamaria V,Franklin SR, et al. Synaptophysin and insulin-like growth factor-1 immunostaing in the central nucleus of the inferior colliculus in adult ferrets following unilateral cochlear removal: A densitometric analysis[J].Synapse,2007,61:288.
3 Alvarado JC, Fuentes-Santamaria V,Henkel CK,et al. Alterations in calretinin immunostaing in the ferret superior olivary complex after cochlear ablation[J].The Journal of Comparative Neurology,2004, 470: 63.
4 Pollak GD , Park TJ .The effects of GABA ergic inhibition on monaural response properties of neurons in the mustache bat's inferior colliculus[J]. Hear Res,1993,65 : 99.
5 Salvi RJ, Wang J, Ding D. Auditory plasticity and hyperactivity following cochlear damage[J]. Hear Res, 2000,261.
6 Gutfreund Y, Zheng W, Knudsen EI. Gated visual input to the central auditory system[J].Science,2002, 297:1 556.
7 Knudsen EI. Instructed learning in the auditory localization pathway of the barn owl[J]. Nature,2002,417:322.
8 Kullmann PH, Ene FA, Kandler K. Glycinergic and GABA ergic calcium responses in the developing lateral superior olive[J]. Eur J Neurosci, 2002, 15: 1 093.
9 Alvarado JC, Fuentes-Santamaria V, Franklin SR, et al.Unilateral deafening in adult ferret results in upregulation in the calretinin immunoreactivity in the inferior colliculus[J]. Neuroscience, 2005, 136: 957.
10 Syka J. Plastic changes in the central auditory system after hearing loss, restoration of function, and during learning[J]. Physiol Rev,2002,82:601.
11 Huang X, Chen S, Tietz E. Immunocytochemical detection of regional protein changes in rat brain sections using computer-assisted image analysis[J]. J Histochem Cytochem,1996,44:981.
12 孙久荣,余瑞元,刘文胜,等.迷路损伤增强大鼠前庭内侧核生长相关蛋白mRNA水平[J].生理学报,1998,50:587.
13 McGuir CB,Snipes GJ,Norden JJ.Light-microscopic immunolo-calization of the growth-and plasticity-associated protein GAP-43 in the developing rat brain[J].Brain Res, 1988,469:277.
14 Chen B,Wang JF,Sun X.Regulation of GAP-43 expression by chronic desipramine treatment in rat cultured hippocampal cells[J].Biol paychiatry,2003,3:530.
15 Faison MO,Preozzi EF,Caran N,et al. Axonal localization of delta Ca/calm-Odulin dependent protein kinase II in developing P19 neurons[J].Int J Dev-Neurosic,2002,20:585.
16 Michler SA,Illing RB. Acoustic trauma Induces reemergence of the growth- and plasticity-associated protein GAP-43 in the rat auditory brainstem[J].J Comp Neurol,2002,451:250.
17 Chen TJ,Huang CW,Wang DC.Co-induction of growth-associated protein GAP-43 and neuronal nitric oxide synthase in the cochlear nucleus following cochleotomy[J]. Brain Res,2004,158: 151.
18 Mossop JE,Wilson MJ,Caspary DM,et al.Down-regulation of in hibition following unilateral deafening[J].Hear Res,2000,147:183.
19 Illing RB,Cao QL,Fomter CR,et al.Auditory brainstem:Development and plasticity of GAP-43 mRNA expression in the rat[J].J Comp Neurol,1999,412:353.
