内衬上皮的管状组织工程软骨构建的实验研究
2010-01-25程友黄金中王秋萍李泽卿王天友江满杰周玫
程友 黄金中 王秋萍 李泽卿 王天友 江满杰 周玫
喉、气管狭窄与缺损修复的关键是恢复喉、气管软骨支架及腔内黏膜上皮的完整性,但软骨自我修复能力有限[1],故其仍是目前临床亟待解决的难题。组织工程化软骨技术的发展为喉、气管软骨缺损的修复带来了希望[2];喉、气管内的黏膜大面积缺损可通过移植肌皮瓣、裂层皮片等方式使其在体内逐渐上皮化实现功能修复[3,4],但如何同时进行喉、气管软骨支架和腔内黏膜上皮的修复,尚未见报告。为此,本研究尝试以聚丙交酯-乙交酯共聚物[poly(DL-lactide-co-glycolide), PLGA]包埋甲壳胺无纺布为细胞支架,用同种异体软骨细胞在有免疫力的动物体内构建内衬上皮的管状组织工程软骨,为喉、气管缺损的修复探索新方法。
1 材料与方法
1.1主要实验试剂和材料 1640培养基(Hyclone公司),胎牛血清(Hyclone公司),胰蛋白酶和Ⅱ型胶原酶(Sigma公司), 甲壳胺无纺布(海南欣龙公司,脱乙酰度:≥90%,分子量:20~50万),单体丙交酯(dl-LA)和乙交酯(GA)(中山大学高分子研究所),PLGA包埋甲壳胺无纺布支架(孔隙率为82%~86%、孔径为100~300 μm、剪切强度为48 MPa、厚度约为1.5 mm,与中山大学高分子研究所合作自行制备)。
1.2实验方法
1.2.1兔耳廓软骨细胞改良培养法(软骨细胞悬液和软骨块共同培养法[5]) ①软骨细胞的分离:无菌条件下取1月龄新西兰大白兔耳廓软骨,PBS液(含青霉素200 U/ml,链霉素200 μg/ml)漂洗3次,剪成1 mm×1 mm×1 mm大小,软骨碎片置于10 ml离心管中,加入2倍体积的Ⅱ型胶原酶(0.3 mg/ml,Sigma公司),37℃恒温震荡器内消化4~6 h,PBS液终止消化并漂洗2次,离心2 000 r/min×10 min,弃上清。②软骨细胞的培养:200目铜筛网过滤,将离心所得的软骨细胞与在筛网上未滤下的小片软骨(约0.4 mm3大小)共同培养。培养瓶预先用0.1%多聚赖氨酸预处理后干燥,先放入在筛网上取下的小软骨块,加入少量1640培养基(含150 g/L胎牛血清,50 mg/L 维生素C,100 U/ml青霉素,100 μg/ml链霉素,292 mg/L谷氨酰胺,Sigma公司),翻转培养瓶培养1~2 h后,加入软骨细胞,将细胞悬液和软骨块均匀分瓶,于37℃、50 ml/L的CO2及饱和湿度下共同培养。每天在相差显微镜下观察软骨细胞生长情况,3 d后第1次换液,以后每隔2 d换液1次。原代细胞贴壁并融合成单层时,2.5 g/L胰蛋白酶消化3~5 min,传代培养。
1.2.2软骨细胞/PLGA包埋甲壳胺无纺布支架复合物的构建 将PLGA包埋甲壳胺无纺布支架剪切成2.0 cm×2.5 cm大小的片状,多聚赖氨酸中浸泡6 h;自然干燥,75%的乙醇中浸泡2 h,大量Hank's液冲洗3次,放入细胞瓶中用1640培养基于37℃、5%CO2及饱和湿度下孵育24 h。植入细胞前2 h充分吸去其中的1640培养基,培养箱中待用。收集第3~4代细胞,制成细胞悬液,调整软骨细胞悬液密度达7.5×107个/ml,分别接种于支架材料上,在37℃、5%CO2、饱和湿度培养箱内培养,2 d换液1次,体外培养7~10 d。
1.2.3人工软骨培养物体内培养构建内衬上皮的管状组织工程软骨 实验动物为12只4月龄新西兰白兔(体重2.0~2.5 kg),3%戊巴比妥钠按30 mg/kg耳缘静脉注射麻醉动物后,无菌条件下在兔腹部行纵行平行皮肤切口,分离切口间皮下组织;将一有数十个侧孔的长2.0 cm、外径0.6~1.2 cm 硅胶管置皮肤表面,缝合两切口内侧皮肤边缘制作内裹硅胶管的皮管;再将软骨细胞支架复合物卷曲包裹于皮管上,4-0可吸收缝线缝合固定;最后,分离两切口外侧皮下组织及切口范围内腹部肌肉至腹膜,将含软骨细胞支架复合物的皮管包埋至腹肌深部(图1),拉拢、分层缝合。术后用青霉素80万U肌注×3 d。
1.2.4染色及观察方法 分别于术后6、12、18周各处死4只兔,取出包埋的移植物,观察管状组织工程软骨是否形成及与皮管贴合情况,然后置于4%中性福尔马林固定,常规石蜡切片,行HE染色(显示软骨细胞形态、软骨细胞陷窝形成状态及软骨细胞与周围组织关系)、甲苯胺蓝染色(显示胞体周围软骨基质)和Masson's染色(显示胶原),显微镜下观察软骨细胞成熟度及上皮层与软骨贴合情况。
2 结果
2.1软骨细胞体外培养相差显微镜下观察 相差显微镜下见软骨细胞以单个或群落状吸附于支架纤维上;培养1周时支架纤维间有蜘蛛网状基质产生。
2.2移植物观察
2.2.1大体观察 术后6周,软骨细胞支架复合物基本保持植入前的形状,管状植入物外包裹一层粉红色结缔组织,去除结缔组织后见标本呈乳白色,无血管分布,大小与植入前相当。12周时管状组织工程软骨基本形成,管状植入物周围有结缔组织膜包绕,内面与皮管贴合紧密。18周时软骨细胞支架复合物体积无明显变化,去除包绕的结缔组织膜,为管状乳白色、有弹性的软骨样组织,内衬皮管(图2),管状工程软骨最长1.8 cm,最大内径0.8 cm。
2.2.2组织学观察 术后6周时复合物中有基质分泌,软骨细胞不成熟,形状多为椭圆形(图3)。12周时,新生软骨呈管状,软骨细胞接近成熟,可见软骨陷窝,基质含量明显增多(图4)。18周时新生软骨细胞呈圆形,软骨陷窝明显,细胞形态及基质含量与正常软骨细胞无明显区别,甲苯胺蓝染色显示胞体周围有丰富的软骨基质(图5);软骨陷窝之间胶原绿色深染,显示胶原含量丰富,上皮层与软骨贴合紧密(图6)。
3 讨论
喉、气管呈中空管状,正常的纤毛黏膜上皮是防止分泌物潴留和瘢痕形成的关键,理想的移植物除了要有足够的支撑作用和能够长期体内留置外,还应有黏膜上皮覆盖,目前临床上常通过移植肌皮瓣、裂层皮片等方式使其在体内逐渐黏膜化从而完成功能修复。三维细胞支架在组织工程化软骨的形成过程中起临时的细胞外基质作用,为软骨细胞提供附着、 增殖、 分化和代谢的场所[6,7], 是组织工程化软骨形成的关键[8]。理想的生物载体材料应具备良好的生物相容性和细胞界面、良好的降解吸收性和通透性、良好的可塑性和机械强度及三维立体结构[2]。呈中空管状、足够的机械强度和灵活的塑形性是喉、气管软骨对细胞培养支架的特殊要求。PLGA是由丙交酯和乙交酯按一定配比共聚所得到的一种新型高聚物材料,具有良好的抗张强度、生物相容性和降解性,目前在软骨组织工程中应用较多[9,10],但其脆性大、可塑性差;甲壳胺无纺布是以甲壳胺为原料,用先进的无纺技术制造出的新型高分子生物材料,本研究前期动物实验已经证明甲壳胺无纺布对生物体无毒性和炎症反应,易于在体内降解吸收,降解吸收周期适宜且可以人为调控[11],其可塑性好,但强度和抗张性能差。从文中结果看,利用这两种材料的优势和特色,用PLGA包埋甲壳胺无纺布的新型聚合物支架制作方法[12]制作新型支架,其力学性能、可塑性、三维结构良好,孔隙率为82%~86%,孔径为100~300 μm,种植于该支架的兔耳廓软骨细胞贴壁、生长良好。因此该支架符合中空状喉、气管软骨组织工程对细胞培养支架的特殊要求,在组织工程修复喉、气管软骨缺损的研究中将具有广泛应用前景。
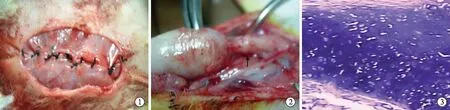
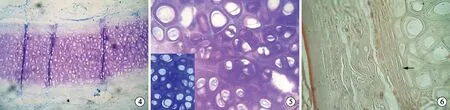
图1将含软骨细胞支架复合物的皮管包埋至腹肌深部
图2 18周时,管状组织工程软骨形成,内衬皮管(箭头所示),硅胶管尚未取出
图3 6周时,新生软骨细胞欠成熟,形状多为椭圆形,软骨间有基质分泌(HE×40)
图4 12周时,新生软骨细胞接近成熟,可见软骨陷窝,基质含量明显增多(HE×40)
图5 18周时,新生软骨细胞完全成熟(左下角为兔耳廓软骨细胞),软骨陷窝明显,基质分泌旺盛,胞体周围有丰富的软骨基质(甲苯胺蓝染色×100)
图6 18周时,新生软骨细胞完全成熟,软骨陷窝明显,软骨陷窝之间胶原绿色深染,说明胶原含量丰富;上皮层(箭头所示)与软骨贴合紧密(Masson's染色×400)
Vacallti等[13]首先在裸鼠体内以聚乙交酯(PGA)无纺网为支架制备出管状工程化软骨。聚乙交酯(也称聚羟基乙酸,PGA)、聚丙交酯(也称聚乳酸,PLA)以及两者的共聚物——聚丙交酯-乙交酯共聚物[Poly(DL-lactide-co-glycolide),PLGA]具有良好的生物相容性、可降解吸收性,是目前组织工程研究中应用最为广泛的一类材料,但这类材料在亲水性、细胞粘附性、生物相容性、降解周期等生物学特性及机械性能等方面存在差别。本研究在有免疫力的动物体内选用PLGA包埋甲壳胺无纺布为支架材料构建出内衬上皮的管状组织工程软骨,接种子细胞后体外培养7~10 d植入体内,6周时复合物中有基质分泌,软骨细胞不成熟;12周时新生软骨细胞接近成熟,可见软骨陷窝;18周时新生软骨细胞形态以及基质含量与正常软骨细胞无明显区别,说明种子细胞接种至该新型支架后分布状态良好,附着均匀,分泌基质旺盛,证实该新型支架是目前软骨组织工程中比较合适的细胞三维生长支架材料,可以在体内形成软骨组织。文献报道体外软骨细胞成熟的时间点不太一致,大多为16~18周,亦有报道为6~12周[14~18],可能与软骨取材部位、种植的软骨细胞所处生长期、接种密度、所采用的三维支架、实验动物、移植至动物体内的位置、各类软骨细胞调节因子的影响等有关。
同种异体软骨细胞作为种子细胞应用于组织工程中构建软骨组织或器官,是目前最为关注的种子细胞之一。研究表明,同种异体软骨细胞与PLGA包埋甲壳胺无纺布的细胞支架形成复合物植入体内后可形成组织工程化软骨且不发生免疫排斥,这可能是由于软骨组织本身免疫性较弱,且种子细胞经过消化分离、体外培养和载体接种等过程后,其表面抗原受到削弱或破坏,从而减弱了其免疫原性[19]。随着组织工程及相关技术和方法的不断进展和日趋成熟,利用本实验设计思路可构建人同种异体软骨细胞内衬上皮的管状组织工程软骨,从而应用于喉、气管缺损的临床一期整体修复。
利用组织工程学的方法治疗喉、气管狭窄与缺损,理想的目标是复合工程化软骨与工程化黏膜、黏膜下组织和工程化喉内肌肉等工程化组织实现在原位或异位同步形成具有软骨、黏膜及其附隶肌肉的复合化喉、气管组织工程器官。本研究仅是对此进行的一些初步探索,实验中收获的内衬上皮的管状工程软骨最大内径为0.8 cm,更大管径的实验研究显示新生软骨形成不满意,可能与种植于实验动物的细胞支架复合物受动物体型较小、局部肌肉软组织欠丰富及活动频繁、局部未建立足够有效滋养有关,具体机理尚待进一步探讨。另外,获取的组织工程化软骨支撑强度、韧性、能量吸收效率和应力度能否达到或接近实际应用的要求,有待进一步研究。
4 参考文献
1 Ochi M.Clinical result of transplantation of tissue-engineered cartilage and future direction of cartilage repair-novel approach with minimally invasive procedure [J]. Yonsei Med J, 2004,45:74.
2 黄金中, 李雪盛, 全大萍, 等. 新型高孔隙率海绵状聚乳酸支架在软骨组织工程研究和应用中的意义[J].现代康复, 2001,5:58.
3 Spriano G, Piantanida R, Pellini R. Hypopharyngeal reconstruction using pectoralis major myocutaneous flap and prevertebral fascia [J]. Laryngoscope, 2001,111:544.
4 关中, 彭解人, 黄晓明, 等. 胸大肌皮瓣修复喉咽癌术后组织缺损[J]. 中华显微外科杂志, 2004, 27:300.
5 程友,王秋萍,李景红,等.人鼻中隔软骨细胞培养法的改良及其生物学特性观察[J].中国耳鼻咽喉头颈外科,2006,13:47.
6 Britt JC, Park SS. Autogenous tissue-engineered cartilage[J]. Arch Otolaryngol Head Surg, 1998,124:671.
7 Sittinger M, Bujia J, Minuth WW, et al. Engineering of cartilage tissue using bioresorbable polymer carriers in perfusion culture[J]. Bromaterials,1994,15:451.
8 Langer R, Vacanti JP. Tissue engineering[J]. Science,1993,260: 920.
9 Holy CE, Cheng C, Davis JE, et al. Optimizing the sterilization of PLGA scaffolds for use in tissue engineering [J]. Biomaterials, 2001,22:25.
10 袁欣, 张其清. 软骨组织工程支架材料研究进展[J]. 中华整形外科杂志, 2002,18:49.
11 程友,黄金中,李景红,等.甲壳胺无纺布的降解性及生物相容性观察[J].中国耳鼻咽喉颅底外科杂志, 2005,11:150.
12 程友,黄金中,全大萍,等. 构建聚丙交酯-乙交酯共聚物包埋甲壳胺无纺布的新型高聚物材料支架[J]. 中国临床康复, 2005,9:60.
13 Vacanti CA, Paige KT, Kim W, et al. Experimental tracheal replacement using tissue engineered cartilage[J]. J Pediatr Surg,1994,29:201.
14 夏万尧,刘伟,曹谊林,等. 壳聚糖-明胶多孔复合支架构建自体组织工程化软骨组织的实验研究[J].中华医学杂志,2003,83:577.
15 王常勇,薄斌,赵强,等. 以β-磷酸三钙多孔陶瓷为载体建造组织工程化人工软骨[J].中华整形外科杂志,2002,18:9.
16 夏万尧,曹谊林,商庆新,等. 自体组织工程化软骨组织在体内最佳形成时间的研究[J].上海第二医科大学学报,2001,21:97.
17 崔鹏程,陈文弦,罗家胜. 鼻中隔软骨细胞组织工程法构建预定形态软骨[J].中华耳鼻咽喉科杂志,2001,36:22.
18 李景红,黄金中,程友,等. 转化生长因子β1和同种异体软骨细胞及高孔隙率聚乳酸复合物修复兔耳廓软骨缺损[J].中华耳鼻咽喉科杂志,2004,39:340.
19 Vunjak-Novakovic G, Obradovic B, Martin I, et al. Dynamic cell seeding of polymer scaffolds for cartilage tissue engineering[J]. Biotechnol Prog,1998,14:193.
