共培养大肠杆菌和谷氨酸棒杆菌合成圣草酚研究
2025-01-25查健赵停兰刘婧怡时夫龙吕宝龙田斌吴瑕







摘 要:微生物共培养技术在生物制造中应用广泛,尤其在天然产物的微生物合成中发挥重要作用.植物天然产物圣草酚具有抗菌、抗氧化等多种药理作用,在医药、食品等领域具有良好应用前景.为利用葡萄糖这一廉价碳源从头合成圣草酚,运用微生物共培养技术,构建了大肠杆菌BAK101菌株与谷氨酸棒杆菌NE1菌株的共培养发酵体系, 其中BAK101可将葡萄糖转化为L-酪氨酸,NE1可将L-酪氨酸转化为圣草酚.通过系统优化,采用补料分批发酵结合分段式共培养方式,利用2%的葡萄糖经过100 h发酵,在摇瓶中实现了4.72 mg/L圣草酚的从头合成.本研究为黄酮类化合物的微生物共培养合成奠定了基础,也为复杂天然产物在微生物中的从头合成提供了参考.
关键词:共培养; 圣草酚; L-酪氨酸; 大肠杆菌; 谷氨酸棒杆菌
中图分类号:Q939.97
文献标志码: A
Study on co-culture of Escherichia coli and Corynebacterium glutamicum for the biosynthesis of eriodictyol
ZHA Jian1, ZHAO Ting-lan1, LIU Jing-yi1, SHI Fu-long2,LYU Bao-long2, TIAN Bin1, WU Xia1*
(1.School of Food Science and Engineering, Shaanxi University of Science amp; Technology, Xi′an" 710021, China; 2.Baoji Fufeng Biotechnologies Co., Ltd., Baoji 722405, China)
Abstract:Microbial co-cultures are widely used in biomanufacturing and play important roles in the microbial biosynthesis of natural products.The plant natural product eriodictyol can be potentially applied in pharmaceutical and food industries due to its antimicrobial,anti-oxidative activities and other medical properties.To achieve de novo biosynthesis of eriodictyol from the cheap carbon source glucose,the co-culture strategy was adopted utilizing Escherichia coli strain BAK101 and Corynebacterium glutamicum strain NE1,in which BAK101 could convert glucose into L-tyrosine,whereas NE1 was able to metabolize L-tyrosine into eriodictyol.Via system optimization combined with fed-batch fermentation and segmented co-cultivation,de novo biosynthesis of eriodictyol was accomplished with a titer of 4.72 mg/L in shake flasks from 2% glucose in 100 h of fermentation.This study sets an example for the biosynthesis of flavonoid compounds using microbial co-cultures,and provides guidance to the de novo microbial biosynthesis of complicated natural products.
Key words:co-culture; eriodictyol; L-tyrosine; escherichia coli; corynebacterium glutamicum
0 引言
植物天然产物圣草酚(Eriodictyol)是黄酮类化合物的一种二氢衍生物,属于黄烷酮类,常见于柑橘类水果中,具有抗菌、抗炎、保护神经及心血管、促进胰岛素分泌等多种生理活性[1,2],在医疗保健、食品及化妆品生产等领域广受青睐.目前圣草酚的工业生产方式主要为植物提取,但该生产方式大量使用有机溶剂,且严重依赖植物的种植,对土地、气候等有较高需求.本文尝试使用生物合成的方法对圣草酚进行生产.
为实现圣草酚的生物合成,现有研究主要对大肠杆菌、酵母菌等单一菌株进行工程化改造,人为引入圣草酚合成途径,并根据途径起点外源添加前体物对香豆酸、酪氨酸或柚皮素[3-5].为转化这些底物合成圣草酚,需引入植物来源P450氧化酶和与之匹配的P450还原酶[4,6].然而,P450酶的异源表达是一个重要难题,表现在酶表达量低、活性低、反应过程需消耗NADPH[6].一种新策略是表达一种非P450型的单加氧酶HpaBC,可实现圣草酚的高效合成[5].但是较高的底物成本是圣草酚合成中的重要限制因素.因此,实现以廉价碳源(如葡萄糖、甘油)为底物是生物合成圣草酚的重要挑战.
自然界中的各种微生物间通常存在互利共生、偏利共生、寄生等多种相互作用[7].利用这些作用模式,研究人员开发了微生物共培养技术,即在无菌条件下,将两种或多种特定微生物置于同一体系中混合培养,从而合成某种目标产品[8,9].该技术将较长的合成代谢途径分成若干个模块,分别转入不同的微生物细胞,通过共培养模式,一方面可减轻每种菌株的代谢负担[10,11],另一方面可为特定酶促反应的发生提供最适合的细胞环境[11],并可通过物理阻隔解除某些反馈抑制[12,13],因而有利于目标产品、尤其是结构复杂的天然产物在微生物细胞内有效合成[14].
本文采用微生物共培养技术,对可生产L-酪氨酸的重组大肠杆菌BAK10菌株和可将L-酪氨酸转化为圣草酚的重组谷氨酸棒杆菌NE1菌株构建共培养体系,从而实现目标产物圣草酚的分段式生物合成.
1 材料与方法
1.1 实验材料
1.1.1 主要试剂
脑心浸液肉汤培养基(BHI)、LB 肉汤培养基,北京奥博星生物技术有限公司; L-酪氨酸、丙二酸钠、二甲基亚砜、柚皮素标准品,麦克林生化科技有限责任公司;浓盐酸(分析纯)、冰乙酸(分析纯)、甲醇(分析纯)、琼脂粉,国药集团试剂有限公司;壮观霉素、卡那霉素,上海源叶生物科技有限公司;葡萄糖(分析纯),天津科密欧化学试剂有限公司;氢氧化钠(分析纯),天津天力化学试剂有限公司;L-酪氨酸标准品、圣草酚标准品,北京索莱宝科技有限公司.
1.1.2 主要仪器
SX-500灭菌锅,TOMY;Infinite M NANO酶标仪,TECAN;CT15E常温离心机,Himac;Agilent 1200高效液相色谱仪,安捷伦科技有限公司;GL124-1SCN精密电子天平,赛多利斯科学仪器(北京)有限公司;PHS-25精密 pH 计,上海仪电科学仪器股份有限公司;SW-CJ生物洁净工作台,苏州安泰空气技术有限公司; HNY-2102C恒温培养箱,天津欧诺仪器股份有限公司;MDF-382超低温冰箱,松下冷链(大连)有限公司;XMTE-8112电热干燥箱,上海精宏实验设备有限公司.
1.2 实验方法
1.2.1 菌株的构建
大肠杆菌 BAK10是本实验室已有的产L-酪氨酸的工程菌株[15],在其中转入pEKEx3 (壮观霉素抗性)和 pZM1 (卡那霉素抗性)两个空质粒,即得到具有相应抗生素抗性的菌株BAK101.谷氨酸棒杆菌 NE1为本实验室前期构建,能以L-酪氨酸为前体物生产圣草酚[5].
1.2.2 大肠杆菌 BAK101产L-酪氨酸能力测试
将大肠杆菌BAK101甘油菌在LB平板(含壮观霉素和卡那霉素各50 mg/L)上划线后于37 ℃过夜培养.挑取单菌落接种至含LB培养基中(含壮观霉素和卡那霉素各50 mg/L),于37 ℃、200 rpm过夜培养后,转接至含相同浓度抗生素的15 mL新鲜AMM培养基中,使转接初始OD600为0.5~0.6,在30 ℃、200 rpm条件下培养至OD600达到1.2左右时,添加异丙基-β-D-硫代半乳糖苷(IPTG)至0.1 mmol/L终浓度以诱导酶表达.诱导后0 h、24 h、48 h、60 h收集发酵液上清,进行L-酪氨酸含量分析.菌株BAK10的培养及测试方法与此类似,但其培养基中不添加壮观霉素和卡那霉素.
为测定抗生素浓度对L-酪氨酸产量的影响,菌株BAK101培养时将壮观霉素及卡那霉素的浓度由50 mg/L调整至25 mg/L,菌体培养及L-酪氨酸测定与上述步骤相同.
1.2.3 大肠杆菌-谷氨酸棒杆菌共培养体系构建
按1.2.2的方法培养大肠杆菌 BAK101菌株,使用25 mg/L的壮观霉素及卡那霉素.对于谷氨酸棒杆菌NE1菌株,提前取其甘油菌,在含有壮观霉素和卡那霉素(各25 mg/L)的LB平板上划线,于30 ℃过夜培养活化.挑取单菌落接种于BHI液体培养基(壮观霉素和卡那霉素各25 mg/L),于30 ℃、200 rpm条件下过夜培养.待BAK101诱导达48 h时,将NE1菌液以OD600=0.5的初始菌浓转接至发酵液中,在30 ℃、200 rpm下发酵培养4 h后,加入终浓度为0.5 mmol/L IPTG及2 g/L丙二酸钠诱导产物合成,并于NE1接入后12 h、24 h、36 h、48 h、72 h收集发酵液上清,用于圣草酚及柚皮素的浓度分析.
1.2.4 共培养体系的分批补料发酵
在发酵过程中的特定时间点,添加不同组成的营养物质,共设置3种补料方式,分别为:补料方式1在接入NE1时补充40% 葡萄糖0.25 mL以及2.5倍浓缩的AMM新鲜培养基1.75 mL,在NE1接入后24 h、36 h、48 h时间点各补充1.75 mL无菌水;补料方式2在接入NE1时补充40% 葡萄糖 0.25 mL及无菌水1.75 mL,在NE1接入后24 h、36 h、48 h时间点各补充40% 葡萄糖1.75 mL;补料方式3在接入NE1时补充40% 葡萄糖0.25 mL与2.5倍浓缩AMM新鲜培养基1.75 mL,并在NE1接入后24 h、36 h、48 h时间点各补充1.75 mL的40% 葡萄糖.于相应时间点通过平板涂布法统计发酵液中大肠杆菌及谷氨酸棒杆菌的菌落数,以监测发酵液中两种菌体的生长状况.同时于各时间点收集发酵液上清,以便于后续对菌体代谢产物进行浓度分析.
1.2.5 共培养体系的分段式发酵
大肠杆菌BAK101及谷氨酸棒杆菌NE1菌液的准备及发酵方法同1.2.3.在接入NE1之前,将BAK101发酵液离心(5 000 rpm,10 min)去除体系中BAK101,将NE1接入离心后的发酵液上清,同时补充1.75 mL新鲜AMM培养基(2.5倍浓缩)及40% 葡萄糖0.25 mL.在NE1接入后24 h、36 h、48 h各补充40%葡萄糖1.75 mL,并于12 h、24 h、36 h 和 48 h时收集发酵液上清以分析代谢物浓度.
1.2.6 代谢产物的HPLC检测
在发酵过程的不同时间点,分别取200 μL发酵液,与4 mol/L盐酸等体积混合并于37 ℃孵育1 h,离心(12 000 rpm,10 min)收集上清液,使用C18柱(5 μm,4.6x250 mm)反相色谱分析L-酪氨酸、圣草酚及柚皮素的含量,样品进样量为10 μL,紫外检测器检测波长为280 nm.使用标准品对各物质含量进行定量分析.
L-酪氨酸的检测使用0.1 mol/L乙酸钠水溶液(使用冰醋酸调pH至4.0)作为流动相A相,以甲醇为B相,洗脱程序为0~8 min,10% B;8~13 min,10%~40% B;13~16 min,40% B;16~21 min,40%~5% B;21~31 min,5% B.流动相流速为0.5 mL/min.
圣草酚及柚皮素的检测以水(含0.1%甲酸)为A相,乙腈(含0.1%甲酸)为B相,洗脱程序为0~10 min,10%~40% A;10~15 min,40%~60% A;15~20 min,60%~10% A.流动相流速为1 mL/min.
1.2.7 生长曲线及菌体数量测定
测定生长曲线时,在不同发酵时间点,分别取发酵液200 μL于96孔板,使用酶标仪测定其600 nm波长处的吸光度值(OD600),必要时对发酵液进行稀释.
对于共培养体系,在发酵不同时间点,分别取100 μL发酵液,使用PBS缓冲液进行梯度稀释后,取90 μL菌液涂布于LB固体平板,于30 ℃培养20 h.根据平板上大肠杆菌和谷氨酸棒杆菌的形态差异,分别对两种细菌进行计数.
2 结果与讨论
2.1 共培养体系的设计
从葡萄糖到圣草酚的合成途径较长,在单一微生物中表达易导致较重的代谢负担.实验室前期获得了可从葡萄糖生产L-酪氨酸的重组大肠杆菌菌株BAK10[15],以及可利用L-酪氨酸生产圣草酚的重组谷氨酸棒杆菌菌株NE1[5].为此,本研究将整体合成途径分解为两部分,分别置于重组大肠杆菌BAK10及重组谷氨酸棒杆菌NE1中,以BAK10为上游菌株,以NE1下游菌株,以上游菌株的代谢产物作为下游菌株的代谢前体物(如图1所示).由于菌株NE1在培养时需添加卡那霉素和壮观霉素,而菌株BAK10不具有相应抗性,因此,在菌株BAK10中引入分别携带这两种抗性基因的质粒pZM1和pEKEx3,获得菌株BAK101,以其作为上游菌株进行发酵测试.
2.2 大肠杆菌BAK101产L-酪氨酸能力测试及优化
以大肠杆菌BAK10为阳性对照,对BAK101进行培养.发酵过程中,菌株BAK10与BAK101所合成的L-酪氨酸最高浓度分别为364.3 mg/L(48 h)与108.4 mg/L(36 h),此后均有所降低,表明菌体对L-酪氨酸进行了利用转化.此外,BAK101的L-酪氨酸产量始终明显低于BAK10(如图2所示),可能原因是BAK101培养时使用了卡那霉素和壮观霉素,迫使菌体表达抗生素抗性基因,增加了代谢负担.为减轻此种代谢负担,从而为下游菌株提供更多的L-酪氨酸,本研究尝试将两种抗生素浓度从50 mg/L分别降低至25 mg/L.如图3所示, L-酪氨酸产量随抗生素浓度下降而明显提升,在48 h时达到188 mg/L,相比使用高浓度抗生素时的最高产量提高了74%.后续研究均使用25 mg/L的抗生素浓度.
2.3 共培养体系的构建及补料发酵优化
将大肠杆菌BAK101在诱导后培养至48 h,加入一定量谷氨酸棒杆菌NE1继续培养,获得共培养体系.共培养4 h后对下游菌株进行诱导,并通过高效液相色谱测定不同时间点发酵液中柚皮素与圣草酚的含量.然而,随发酵时间延长,几乎没有产物合成,因此推测上游菌株合成L-酪氨酸时消耗了体系中大量营养物质,使下游菌株无法正常生长代谢,从而导致圣草酚合成效率低下.
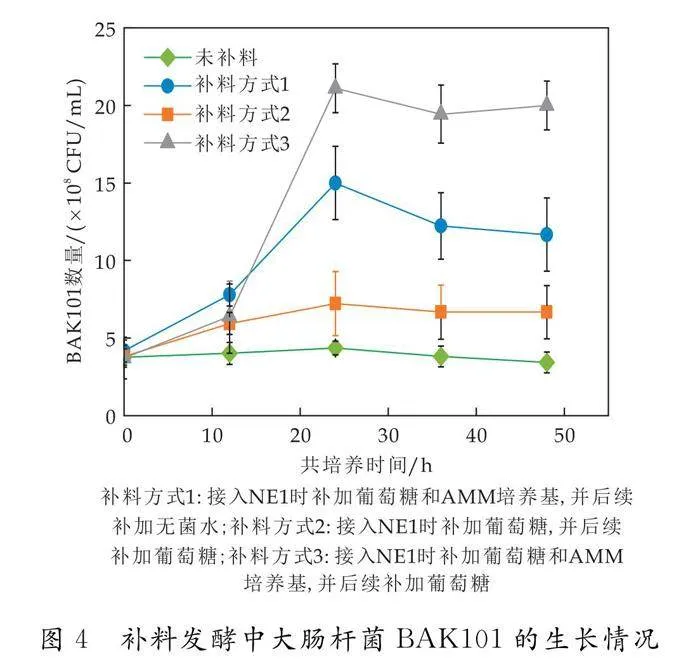
为解决这一问题,本研究尝试向共培养体系中分批补加不同组成的新鲜培养基,并比较菌体生长与L-酪氨酸积累的变化趋势.如图4、图5所示,相比于未补加营养物质的发酵,补料发酵有效提高了上游菌株和下游菌株的菌体数量.其中,补料方式3效果最为显著,在共培养24 h时上游菌株BAK101和下游菌株NE1的数量分别达到最大值2.1×109 CFU/mL和7.8×108 CFU/mL.其后,BAK101数量在经历小幅下降后保持稳定, NE1数量持续下降,表明NE1无法从共培养体系中获取足够营养物质,从而发生菌体死亡.对比三种补料方式可知,在共培养起始时间点补加AMM新鲜培养基以及在发酵过程中补加葡萄糖对于提升菌体数量至关重要.
补料发酵中L-酪氨酸的含量变化如图6所示.为展示该物质浓度在整个发酵过程中的变化,时间零点选为大肠杆菌BAK101诱导时刻,因此,发酵48 h对应谷氨酸棒杆菌NE1的接入,发酵96 h对应共培养第48 h.在前48 h,发酵体系内只有大肠杆菌BAK101,且各补料方式的发酵条件相同,故L-酪氨酸浓度相同,表现为随菌体生长而逐渐增加.在接入谷氨酸棒杆菌NE1后,L-酪氨酸浓度变化受两方面因素影响.一方面,营养物质的及时补充可促进上游菌株生长,使其持续积累L-酪氨酸;另一方面,下游菌株将其转化为柚皮素,使其浓度下降.这两个过程的相对速率决定了发酵体系内L-酪氨酸的浓度变化.对于补料方式1和3,由于下游菌株数量极大提升且在共培养24 h时达到峰值,导致L-酪氨酸含量在发酵48~72 h时间段内(共培养0~24 h)急剧下降,并在发酵72 h达到或接近最低值.此后,由于下游菌株数量逐渐下降,其代谢L-酪氨酸的能力逐渐减弱,导致该物质浓度不断升高.对于补料方式2,由于下游菌株数量明显少于其它两种补料方式,菌体生长缓慢,故菌体对L-酪氨酸的利用速率较低,而此时上游菌株仍在不断合成该物质,导致其在短时间内发生积累,浓度高峰的出现延迟至共培养12 h(发酵60 h)时.
对补料发酵体系中的柚皮素和圣草酚含量进行分析发现,尽管补充营养物质可改善下游菌株生长及L-酪氨酸利用,然而圣草酚合成量仍低于1 mg/L(如图7所示).可能原因是上游菌株对圣草酚合成过程产生了抑制作用,或L-酪氨酸经其它途径转化生成了代谢副产物.
2.4 分段式共培养体系的建立及表征
为验证上游菌株大肠杆菌BAK101的存在是关键的限速步骤,本研究采用分段式共培养方法,即在接入NE1前通过离心移除发酵液中的上游菌体,收集发酵上清液(含有上游菌株分泌的L-酪氨酸),将NE1接入其中.采用该方式后,NE1菌体数量持续增加,在分段式共培养第48 h时达到了1.3×109 CFU/mL,相比于非分段式共培养体系中的最高菌体数量提高了67%(如图8所示).该结果表明,上游菌株确实可抑制下游菌株的生长.该抑制作用可能由两种菌株对营养物质的代谢速率差别导致.上游菌株在发酵体系内的数量多于下游菌株,且其生长速率较快,从而导致上游菌株作为优势菌株对下游菌株的生长代谢产生抑制.这种抑制或竞争现象是多种共培养体系的共性特征[16].
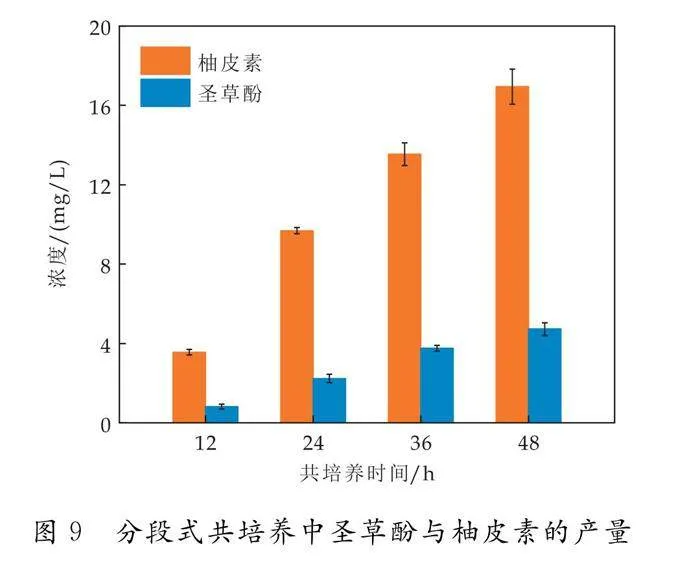
在分段式共培养体系中接入NE1后,柚皮素及圣草酚浓度随发酵进程逐渐升高,在分段式共培养第48 h分别达到16.9 mg/L和4.7 mg/L,与连续式共培养补料发酵方式相比提高了10倍以上(如图9所示).然而,柚皮素到圣草酚的转化率较低,可能原因是催化该反应的羟化酶HpaBC底物谱较宽泛,存在多种竞争性底物如L-酪氨酸等,导致柚皮素利用率降低[17].
3 结论
本文运用微生物共培养策略,利用下游谷氨酸棒杆菌重组菌株NE1和上游大肠杆菌菌株BAK101实现模块化代谢及分工协作,共同完成从葡萄糖合成圣草酚的目标.后续可通过代谢调控、酶表达水平调控、发酵参数优化等方式,进一步提高圣草酚的产量.本文构建的大肠杆菌-谷氨酸棒杆菌共培养体系为黄酮类化合物及其它复杂天然产物的从头合成提供了参考.
参考文献
[1] Islam A,Islam M S,Rahman M K,et al.The pharmacological and biological roles of eriodictyol[J].Archives of Pharmacal Research,2020,43(6):582-592.
[2] Guo S,Xing N,Xiang G,et al.Eriodictyol:A review of its pharmacological activities and molecular mechanisms related to ischemic stroke[J].Food amp; Function,2023,14(4):1 851-1 868.
[3] Gao S,Xu X,Zeng W,et al.Efficient biosynthesis of (2S)-eriodictyol from (2S)-naringenin in Saccharomyces cerevisiae through a combination of promoter adjustment and directed evolution[J].ACS Synthetic Biology,2020,9(12):3 288-3 297.
[4] Zhu S,Wu J,Du G,et al.Efficient synthesis of eriodictyol from L-tyrosine in Escherichia coli[J].Applied and Environmental Microbiology,2014,80(10):3 072-3 080.
[5] Wu X,Liu J,Liu D,et al.Biosynthesis of eriodictyol from tyrosine by Corynebacterium glutamicum[J].Microbial Cell Factories,2022,21(1):86.
[6] Lv Y,Marsafari M,Koffas M,et al.Optimizing oleaginous yeast cell factories for flavonoids and hydroxylated flavonoids biosynthesis[J].ACS Synthetic Biology,2019,8(11):2 514-2 523.
[7] Faust K,Raes J.Microbial interactions:From networks to models[J].Nature Reviews Microbiology,2012,10(8):538-550.
[8] Tsoi R,Dai Z,You L.Emerging strategies for engineering microbial communities[J].Biotechnology Advances,2019,37(6):107 372.
[9] Peng H,Chen R,Shaw W M,et al.Modular metabolic engineering and synthetic coculture strategies for the production of aromatic compounds in yeast[J].ACS Synthetic Biology,2023,12(6):1 739-1 749.
[10] Pan R,Yang X,Qiu M,et al.Construction of coculture system containing Escherichia coli with different microbial species for biochemical production[J].ACS Synthetic Biology,2023,12(8):2 208-2 216.
[11] Qi Z,Tong X,Ke K,et al.De novo synthesis of dihydro-β-ionone through metabolic engineering and bacterium-yeast coculture[J].Journal of Agricultural and Food Chemistry,2024,72(6):3 066-3 076.
[12] Zhang R,Yao M,Ma H,et al.Modular coculture to reduce substrate competition and off-target intermediates in androstenedione biosynthesis[J].ACS Synthetic Biology,2023,12(3):788-799.
[13] Seo H,Castro G,Trinh C T.Engineering a synthetic Escherichia coli coculture for compartmentalized de novo biosynthesis of isobutyl butyrate from mixed sugars[J].ACS Synthetic Biology,2024,13(1):259-268.
[14] Roell G W,Zha J,Carr R R,et al.Engineering microbial consortia by division of labor[J].Microbial Cell Factories,2019,18(1):35.
[15] Zhou L,Ding Q,Jiang G Z,et al.Chromosome engineering of Escherichia coli for constitutive production of salvianic acid A[J].Microbial Cell Factories,2017,16(1):84.
[16] Guex I,Mazza C,Dubey M,et al.Regulated bacterial interaction networks:A mathematical framework to describe competitive growth under inclusion of metabolite cross-feeding[J].PLoS Computational Biology,2023,19(8):e1 011 402.
[17] Gong P,Tang J,Wang J,et al.A novel microbial consortia catalysis strategy for the production of hydroxytyrosol from tyrosine[J].International Journal of Molecular Sciences,2023,24(8):6 944.
【责任编辑:陈 佳】
