Kv1.3抑制剂玛格斑蝎毒素对肾损伤模型小鼠M1型巨噬细胞极化及肾脏炎症和损伤的影响
2025-01-25孔佳伟李莎莎刘其锋

[摘要] 目的: 观察电压门控钾离子通道亚型(voltage-gated potassium channel isoform,Kv)1.3抑制剂玛格斑蝎毒素(margatoxin,MgTx)对单侧输尿管梗阻(unilateral ureteral obstruction,UUO)小鼠巨噬细胞(macrophage,M )极化及肾脏炎症和损伤的影响。方法: 将48只雄性C57BL/6J小鼠随机均分为4组:假手术(Sham)组、Sham+MgTx组、UUO组、UUO+MgTx组,每组12只;Sham组行单纯开腹及关腹手术,术后每日腹腔注射生理盐水,Sham+MgTx组行开腹及关腹手术,术后每日腹腔注射MgTx,UUO组行UUO手术,术后每日腹腔注射生理盐水,UUO+MgTx组行UUO手术,术后每日腹腔注射MgTx。分别于术后第3天、第7天每组麻醉6只小鼠,眼球采血留取外周血,然后立即处死小鼠并收集肾组织;采用HE染色评估肾脏损伤程度;蛋白免疫印迹法检测肾组织中Kv1.3及转化生子因子-β1(TGF-β1)、α-平滑肌肌动蛋白(α-SMA)表达;流式细胞术分析外周血单核细胞的改变及肾组织中M 极化情况;qRT-PCR检测肾组织M1型及M2型M 标志物相关mRNA相对表达量。结果: 与Sham组相比,UUO组可见明显的肾损伤及炎症反应,Kv1.3、TGF-β1、α-SMA相对表达水平明显升高( P <0.001);与UUO组相比,UUO+MgTx组肾损伤明显减轻,Kv1.3、TGF-β1、α-SMA相对表达水平明显降低( P <0.001)。此外,与Sham组相比,UUO组外周血单核细胞及肾组织中M1型M 比例明显升高( P <0.01),M1型M 标志物相关mRNA相对表达量明显升高( P <0.01),M2型M 标志物相关mRNA相对表达量明显降低( P <0.01);与UUO组相比,UUO+MgTx组外周血单核细胞比例及肾组织中M1型M 比例明显降低( P <0.01),M1型M 标志物mRNA相对表达量显著降低( P <0.01),M2型M 标志物mRNA水平显著升高( P <0.01)。结论: Kv1.3抑制剂MgTx可抑制UUO小鼠M 向M1极化,减轻肾脏炎症和损伤。
[关键词] 电压门控钾离子通道亚型1.3;玛格斑蝎毒素;巨噬细胞;极化;肾脏损伤;单侧输尿管梗阻
[中图分类号] R692.2" [文献标志码] A" [文章编号] 1671-7783(2025)01-0013-08
DOI: 10.13312/j.issn.1671-7783.y230250
[引用格式]孔佳伟, 李莎莎, 刘其锋. Kv1.3抑制剂玛格斑蝎毒素对肾损伤模型小鼠M1型巨噬细胞极化及肾脏炎症和损伤的影响[J]. 江苏大学学报(医学版), 2025, 35(1): 13-20.
[基金项目]江苏省卫生健康委2023年度医学科研立项项目(Z2023039)
[作者简介]孔佳伟(1997—),男,硕士研究生;刘其锋(通讯作者),副主任医师,硕士生导师,E-mail: lqfeng02@163.com
Effects of Kv1.3 inhibitor margatoxin on polarization of M1 macrophages and renal inflammation and injury in mice with renal injury
KONG Jiawei1, LI Shasha2, LIU Qifeng1
(1. Department of Nephrology, 2. Clinical Research amp; Lab Center, Affiliated Kunshan Hospital of Jiangsu University, Suzhou Jiangsu 215300, China)
[Abstract] Objective: To observe the effect of voltage-gated potassium channel isoform (Kv) 1.3 inhibitor, margatoxin (MgTx), on macrophage (M ) polarization and renal inflammation and injury in mice with unilateral ureteral obstruction (UUO). Methods: Forty-eight male C57BL/6J mice were randomly and equally divided into four groups: Sham group, Sham+MgTx group, UUO group, UUO+MgTx group, with 12 mice in each group. The Sham group underwent simple open and closed abdominal surgery, with daily intraperitoneal injection of noraml saline after operation; Sham+MgTx group underwent open and closed abdominal surgery, with daily intraperitoneal injection of MgTx after surgery; UUO group underwent UUO operation, with daily intraperitoneal injection of normal saline after operation; UUO+MgTx group underwent UUO operation, with daily intraperitoneal injection of MgTx after operation. On the 3rd and 7th day after operation, six mice in each group were anesthetized, and whole blood was collected from the eyeballs, then the mice were immediately euthanized and kidney tissue was harvested. Renal injury was assessed by HE staining; protein levels of Kv1.3, TGF-β1 and α-SMA were detected by Western blotting; changes of peripheral blood monocytes and renal M "polarization were analyzed by flow cytometry; mRNA levels of M1 and M2 biomarkers were detected by qRT-PCR. Results: Compared with Sham group, UUO group showed obvious renal injury and inflammation, and the relative expression levels of Kv1.3, TGF-β1, α-SMA were significantly increased ( P lt;0.001). Compared with UUO group, renal injury was reduced, and relative expression levels of Kv1.3, TGF-β1 and α-SMA were greatly decreased in UUO + MgTx group ( P lt;0.001). In addition, compared with Sham group, the proportion of M1 type M "in peripheral blood monocytes and kidney tissues, and the relative expression level of M1 type M "marker related mRNA weresignificantly increased ( P lt;0.01), while the relative expression level of M2 type M "marker related mRNA were obviously decreased in UUO group ( P lt;0.01). Compared with UUO group, the proportion of peripheral blood mononuclear cells and M1 type M "in renal tissues were significantly decreased in UUO+MgTx group, the relative mRNA expression levels of M1 type M "marker were significantly decreased ( P lt;0.01), while the mRNA levels of M2 type M "markers were greatly increased ( P lt;0.01). Conclusion: Kv1.3 inhibitor MgTx could inhibit M "polarization towards M1 and attenuate renal inflammation and injury in UUO mice.
[Key words] voltage-gated potassium channel isoform 1.3 (Kv1.3); margatoxin; macrophage; polarization; kidney injury; unilateral ureteral obstruction (UUO)
慢性肾脏病(chronic kidney disease,CKD)是由多种原因导致的肾功能进行性下降的慢性炎症性疾病,持续性的炎症反应诱导组织损伤和修复异常,最终导致肾纤维化[1] 。巨噬细胞(macrophage,M )作为机体最重要的炎症细胞,在肾脏炎症和损伤过程中起重要作用[2] 。在不同的环境刺激下,M 可分化为形态、功能、表型截然不同的亚型,主要包括促炎型M1型M 及抗炎型M2型M ,该过程称为M 极化;M 极化异常是CKD等多数炎症性疾病进行性发展的重要因素[3-5] 。研究报道,电压门控钾离子通道亚型(voltage-gated potassium channel isoform,Kv)1.3作为M 高表达的离子通道,参与调控M 极化过程[6-7] 。目前已有多项研究证实Kv1.3参与对M 极化的调控,抑制Kv1.3产生的抗炎效应已在急性肝损伤[8] 、动脉粥样硬化[9] 、哮喘[10] 和2型糖尿病[11] 等多种疾病模型中得到证实。然而,Kv1.3在肾脏疾病中的作用尚不清楚。玛格斑蝎毒素(margatoxin,MgTx)是一种从玛格丽特蝎蝎毒中分离得到的高亲和力Kv1.3通道抑制剂[12] ,目前已广泛应用于离子通道的研究。本研究通过单侧输尿管梗阻(unilateral ureteral obstruction,UUO)[13] 手术建立小鼠肾损伤模型,探究肾损伤中Kv1.3表达水平及M 极化情况,并通过MgTx干预,探究Kv1.3抑制剂对M 极化及肾脏炎症和损伤的影响。
1 材料和方法
1.1 实验动物、主要试剂与仪器
48只C57BL/6J小鼠,雄性,4~6周,体重18~20 g,购自杭州子源实验动物科技有限公司,许可证号:SCXK(浙)2019-0004。
MgTx(美国Med Chem Express公司);小鼠抗小鼠Kv1.3抗体(美国Santa Cruz公司);兔抗小鼠转化生长因子-β1(TGF-β1)、β-微管蛋白(β-Tubulin)、α-平滑肌肌动蛋白(α-SMA)抗体(杭州华安生物科技公司);引物GAPDH、肿瘤坏死因子-α(TNF-α)、诱导型一氧化氮合酶(iNOS)、白介素-1β(IL-1β)、精氨酸酶-1(arginase-1,Arg-1)、CD206、白介素-10(IL-10)由南京诺唯赞生物科技公司合成;FcRblock、PE抗小鼠CD86抗体、PerCP/Cyanine5.5抗小鼠CD11b抗体、APC抗小鼠CD206抗体、固定缓冲液、细胞内染色渗透洗涤缓冲液、细胞内染色缓冲液(美国Biolegend公司);RNA提取试剂盒、逆转录试剂盒和荧光定量PCR试剂盒(南京诺唯赞生物科技公司);多组织解离试剂盒及组织处理器(德国Miltenyi Biotec公司);小鼠脏器组织单个核细胞分离试剂盒(北 京索莱宝科技有限公司);E-BLOT接触式化学发光成像仪(上海易孛特生命科学有限公司);480型荧光定量PCR仪(瑞士Roche公司);CantoⅡ型流式细胞仪(美国BD公司)。
1.2 小鼠分组及肾损伤模型构建
将48只C57BL/6J小鼠随机均分为4组,每组12只,分别为假手术(Sham)组、Sham+MgTx组、UUO组和UUO+MgTx组。Sham组及Sham+MgTx组小鼠仅行开腹和关腹手术;UUO组及UUO+MgTx组小鼠行UUO手术处理。
采用UUO法建立小鼠肾损伤模型。具体步骤:小鼠常规备皮、消毒;予以0.3%戊巴比妥钠溶液腹腔注射麻醉(200 μL/g),于左侧耻骨上逐层分离皮肤及皮下组织显露左侧肾脏及左侧输尿管,4-0号丝线在输尿管上下两端分别结扎,于两处结扎点间切断输尿管,逐层关闭腹腔。以术后次日为第1天,Sham+MgTx组、UUO+MgTx组予以MgTx每天5 μL/g腹 腔注射(300 nmol/L),Sham组、UUO组每天腹腔注射等量生理盐水;分别于术后第3、7天从各组随机抓取6只小鼠,予以0.3%戊巴比妥钠溶液(200 μL/g)腹腔注射麻醉,眼球采血(EDTA-K2 抗凝),然后立即采用颈椎脱位法处死,取肾组织,一部分用于流式细胞术检测及肾脏病理标本的制作,一部分置于液氮中冻存,用于后续实验。
术后通过检测各组小鼠肾脏病理及肾损伤蛋白,以Sham组为对照,评估肾损伤模型构建是否成功。
本实验按照《动物实验护理和使用指南》进行,并经江苏大学动物研究伦理委员会批准。
1.3 小鼠肾脏病理标本制作
取各组小鼠肾脏组织,于4%甲醛溶液中固定2~ 3 d;PBS清洗3次,每次20 min;蒸馏水清洗3次,每次20 min;依次经过50%、75%、80%、90%、95%、100%乙醇脱水,各级乙醇中脱水1~2 h;二甲苯透明2次,每次1 h;纯石蜡溶液中浸蜡2 h;石蜡包埋、切片备用,切片厚5 μm。
1.4 小鼠肾组织HE染色
石蜡切片依次经二甲苯Ⅰ10 min、二甲苯Ⅱ10 min 、二甲苯Ⅲ5 min;100%乙醇10 min,95%、90%、80%、75%梯度乙醇各5 min;蒸馏水洗涤10 min ;苏木精染色20 min;自来水洗去浮色;0.5%盐酸乙醇分色数秒;自来水冲洗10 min;伊红染色2 min ;95%乙醇分色2 min;依次经95%乙醇5 min、100%乙醇Ⅰ10 min、100%乙醇Ⅱ10 min脱水;纯二甲苯透明2次,每次10 min;晾干,中性树胶封片,显微镜下观察。
1.5 小鼠外周血及肾组织单个核细胞悬液制备
1.5.1 外周血单细胞悬液制备 小鼠眼球采血后置于EDTA-K2抗凝管,旋涡混匀1~3 s;取80 μL外周血,加入1 mL红细胞裂解液,旋涡混匀1~3 s,室温避光孵育10 min;2 000 r/min室温离心5 min;弃上清液,加入1 mL PBS,旋涡混匀1~3 s;重复上述离心;弃上清液,加入3 mL外周血及组织稀释液重悬,即得到外周血单细胞悬液。
1.5.2 肾组织单细胞悬液制备 参照多组织解离试剂盒操作说明书,取1/4小鼠肾脏组织,剪成1 mm 3 左右,置于特制离心管中;加入相应量DMEM及消化酶,将离心管连接至组织处理器,运行预设程序解离肾组织得到组织悬液;用细胞滤网过滤至50 mL离 心管中,并用15 mL PBS冲洗滤网上残留的细胞至离心管中;室温300× g 离心10 min;弃上清液,加入3 mL组织稀释液重悬,即获得单细胞悬液。
1.5.3 小鼠外周血及肾组织单个核细胞悬液制备 "参照说明书制备。取15 mL离心管,加入3 mL分离液,取“1.5.1”制备的外周血单细胞悬液,平铺于分离液上,注意保持两液面界面清晰,使两者形成明显的分层界面,室温500× g 离心30 min;小心吸取第二层环状乳白色单个核细胞层至另一离心管中,加入10 mL细胞洗涤液,250× g 离心10 min;弃上清液,加入5 mL PBS重悬,250× g 离心10 min;重复洗涤2~3次;弃上清液,加入50 μL PBS重悬,即为小鼠外周血单个核细胞悬液,用于流式细胞术检测。以同样的方法制备小鼠肾组织单个核细胞悬液。
1.6 流式细胞术分析M 表型
取“1.5.3”单个核细胞悬液50 mL,加入1 μL FcRblock,4 ℃封闭10 min,分别加入0.5 μg抗CD11b、CD86抗体行细胞表面染色,4 ℃孵育30 min ;加入50 μL PBS洗涤细胞,1 500 r/min离心3 min;弃上清液,重复洗涤2~3次;加入500 μL细胞固定液,室温避光固定30 min;室温1 000 r/min离心5 min;弃上清液;加入2 mL 1×细胞内染色渗透洗涤缓冲液重悬细胞,150× g 离心5 min;弃上清液,重复上述步骤2~3次;加入100 μL 1×细胞内染色渗透洗涤缓冲液重悬细胞,加入0.5 μg CD206抗体,室温避光孵育30 min;加入2 mL 1×细胞内染色渗透洗涤缓冲液,1 500 r/min离心3 min;弃上清液,重复洗涤细胞2~3次;加入500 μL细胞内染色缓冲液重悬细胞,上机检测,并用FlowJo软件对数据进行分析。
1.7 蛋白免疫印迹法检测Kv1.3、TGF-β1和α-SMA相对表达水平
取小鼠肾脏组织,剪成1 mm3 左右置于匀浆管,加入消化酶及匀浆磁珠,匀浆至无明显肉眼可见固体;取组织匀浆至EP管中,冰上静置10 min;4 ℃ 12 000 r/min离心10 min;取上清液,BCA法测定蛋白浓度。每孔上样25 μg总蛋白,行10%SDS-PAGE,80 V电泳2 h;300 mA 1.5 h转至PVDF膜;10%脱脂牛奶4 ℃封闭过夜;加入TBST稀释的一抗(兔 抗小鼠β-Tubulin抗体、兔抗小鼠α-SMA抗体、小鼠抗小鼠Kv1.3抗体,稀释比1∶2 000,兔抗小鼠TGF-β1抗体,稀释比1∶500),于4 ℃孵育过夜;TBST洗涤;加入二抗(羊抗小鼠IgG、小鼠抗兔IgG,稀释比1∶2 000),室温孵育1~2 h;TBST洗涤;ECL显色。以β-Tubulin为内参,用Image J软件分析各蛋白相对表达水平。
1.8 qRT-PCR检测M 生物标志物mRNA相对表达
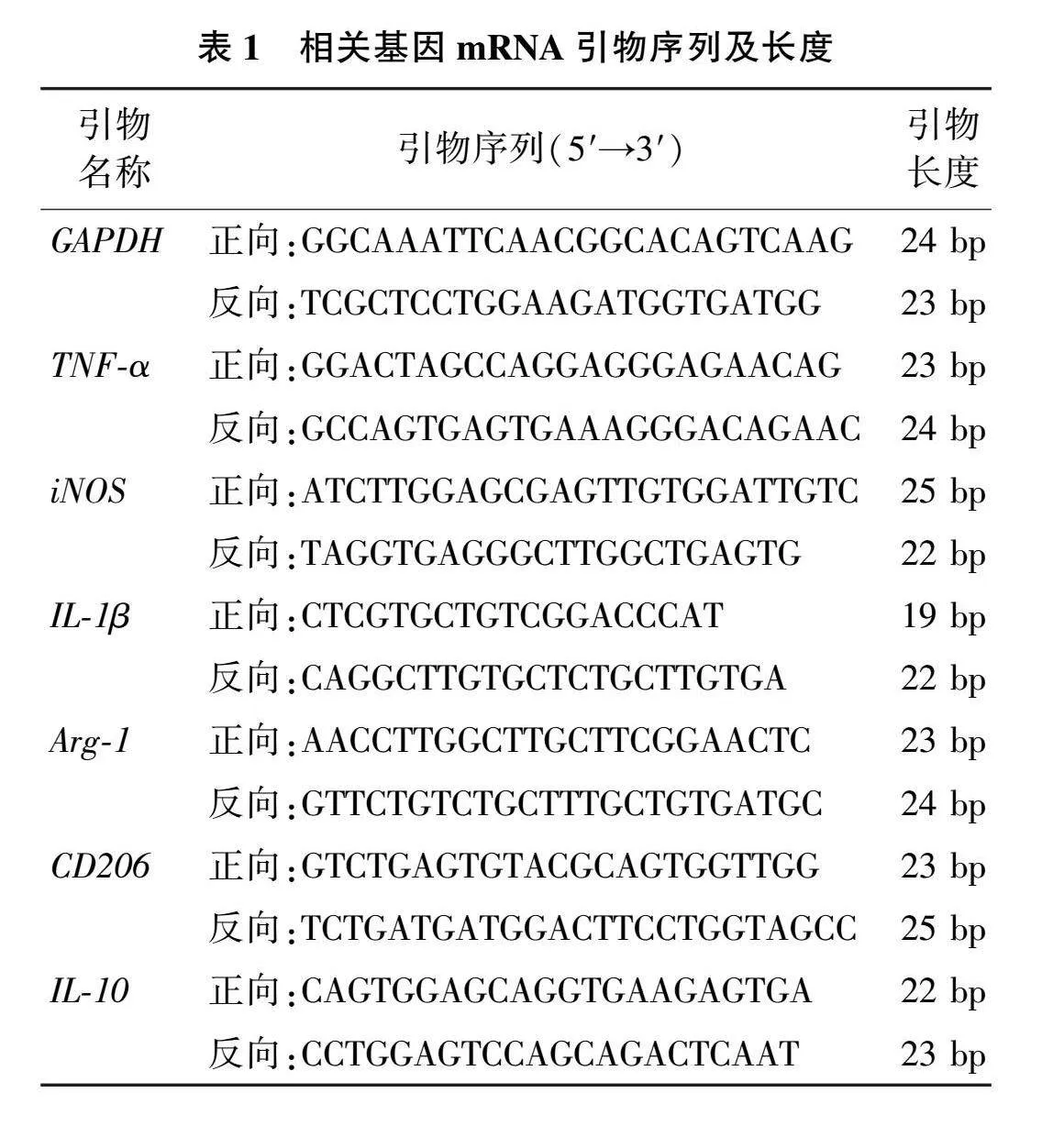
提取小鼠肾组织总RNA,逆转录为相应的cDNA,行qRT-PCR,引物序列见表1。qRT-PCR反应体系:10 μL 2× Taq "Pro Universal SYBR qPCR Master Mix、0.4 μL上游引物、0.4 μL下游引物、2 μL "cDNA、7.2 μL双蒸水;扩增条件:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,40个循环。以GAPDH为内参,采用2-ΔΔCt 半定量方法计算各基因mRNA相对表达水平。
1.9 统计学分析
采用GraphPad Prism 8.3软件对数据进行统计分析,所有实验均独立重复至少3次。计量资料以均数±标准差( x±s )表示,多组间比较采用单因素方差分析,组间比较采用Tukey法, P lt;0.05为差异有统计学意义。
2 结果
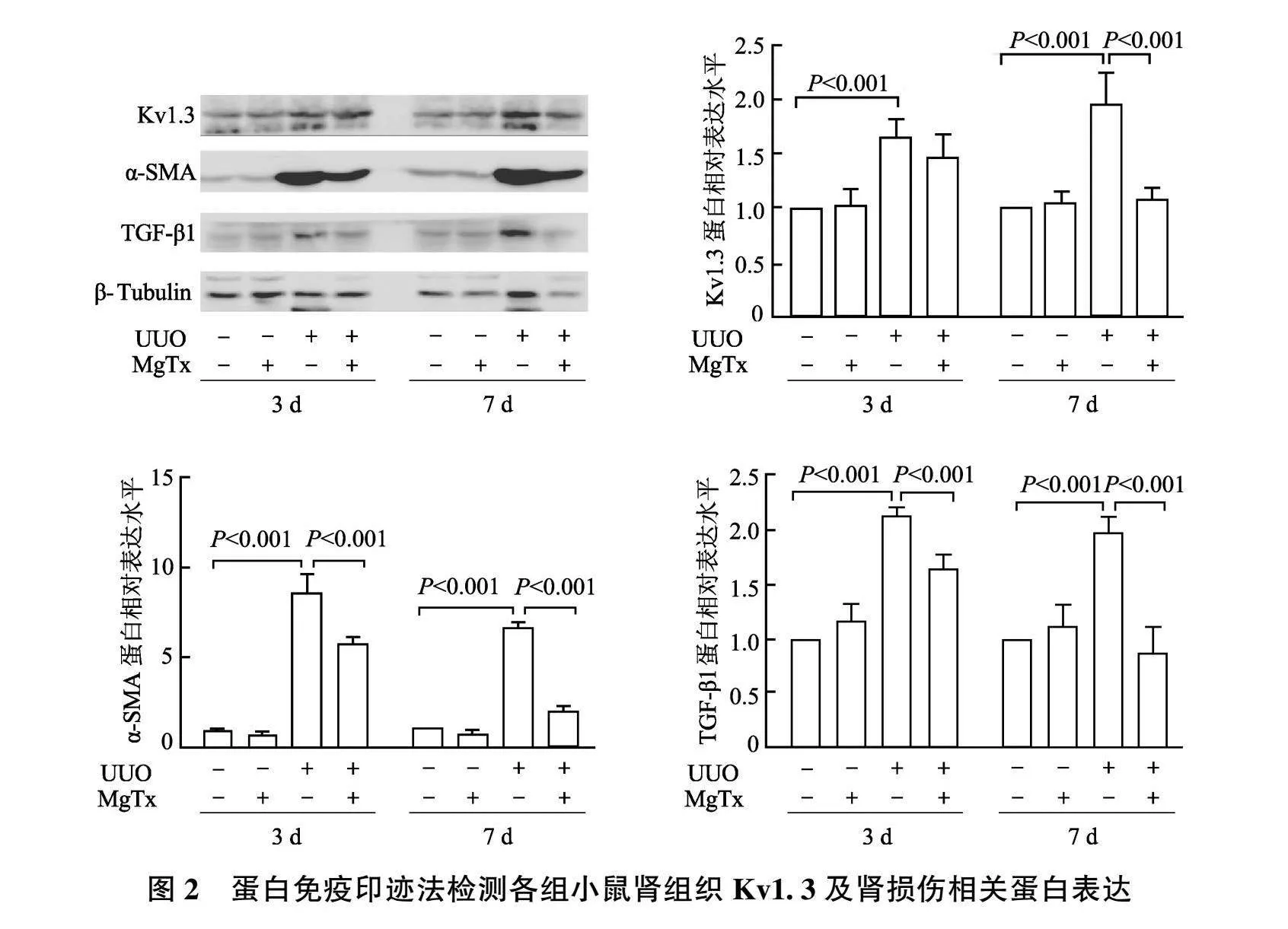
2.1 MgTx对各组小鼠肾脏组织和Kv1.3表达的影响
HE染色结果显示(图1),Sham组肾组织未见明显肾组织损伤,与Sham组相比,UUO组术后第3天和第7天肾组织结构出现明显的破坏,包括肾小管扩张、上皮细胞坏死、肾间质水肿和炎症细胞浸润,且第7天较第3天加重;与UUO组相比,UUO+MgTx组肾脏病理损伤得到改善;与Sham组相比,Sham+MgTx组肾脏病理上无明显改变。
蛋白免疫印迹结果显示(图2),与Sham组相比,UUO组术后第3天和第7天肾组织中Kv1.3及肾损伤相关蛋白TGF-β1、α-SMA相对表达水平显著升高( P 均<0.001);与UUO组相比,UUO+MgTx组术后第3天肾组织中Kv1.3蛋白相对表达水平无明显改变( P gt;0.05),第7天明显降低( P <0.001),TGF-β1、α-SMA相对表达水平在第3天和第7天均显著降低( P 均<0.001);与Sham组相比,Sham+MgTx组Kv1.3和TGF-β1、α-SMA相对表达水平无显著差异( P 均>0.05)。
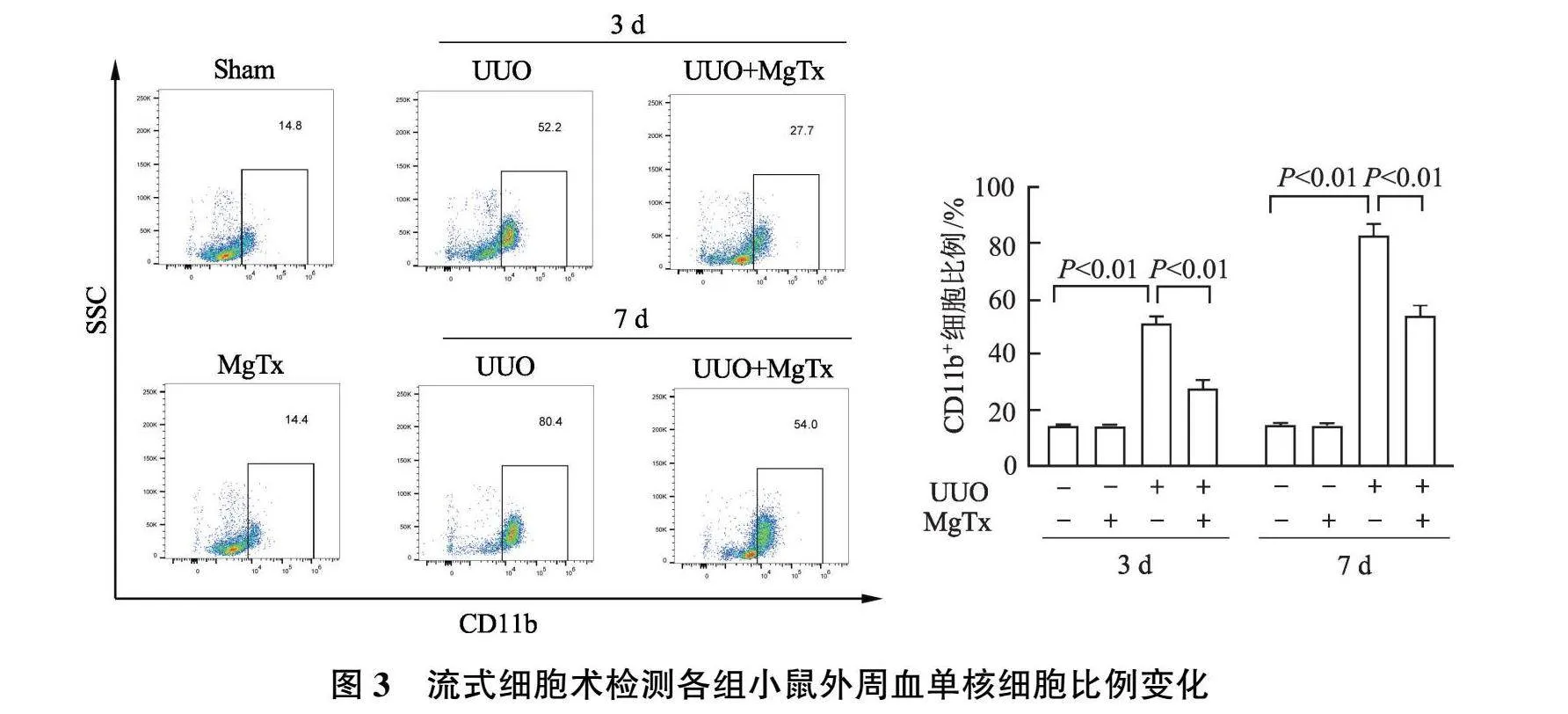
2.2 MgTx对各组小鼠外周血单核细胞比例的影响
流式细胞术结果显示(图3),与Sham组相比,UUO组术后第3天和第7天外周血单核细胞(CD11b + 细胞)比例显著增加( P 均<0.01);与UUO组相比,UUO+MgTx组术后第3天和第7天外周血单核细胞比例显著降低( P 均<0.01),提示MgTx干预对UUO小鼠外周血单核细胞活化表现出抑制作用;与Sham组相比,Sham+MgTx组术后第3天和第7天外周血单核细胞比例无显著改变( P 均>0.05),说明MgTx干预对正常小鼠外周血单核细胞比例不产生影响。
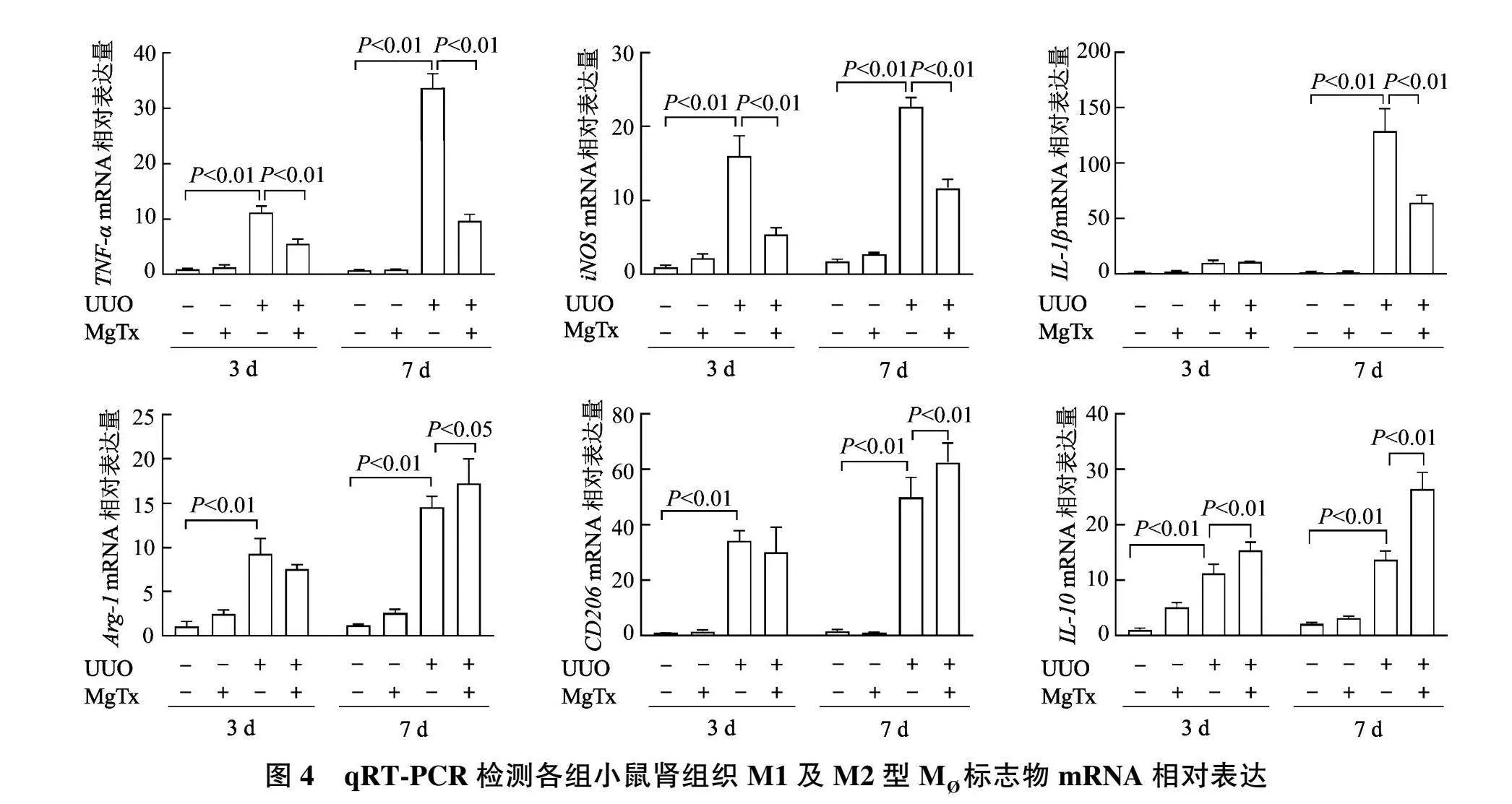
2.3 MgTx对各组小鼠肾组织M 标志物mRNA水平的影响
qRT-PCR结果显示(图4),与Sham组相比,UUO组术后第3、7天肾组织中 TNF-α "mRNA和 iNOS "mRNA相对表达量明显升高( P 均<0.01),第7天 IL-1β "mRNA相对表达量明显升高( P 均<0.01);此外,与Sham组相比,UUO组术后第3、7天肾组织中 Arg-1 "mRNA、 CD206 "mRNA、 IL-10 "mRNA相对表达量明显升高( P 均<0.01)。
qRT-PCR结果显示(图4),与UUO组相比,UUO+MgTx组术后第3天肾组织中 TNF-α "mRNA、 iNOS "mRNA相对表达量明显降低( P 均<0.01), IL-10 "mRNA相对表达量显著升高( P <0.01);术后第7天 TNF-α "mRNA、 iNOS "mRNA、 IL-1β "mRNA相对表达量明显降低( P 均<0.01), Arg-1 "mRNA、 CD206 "mRNA和 IL-10 "mRNA相对表达量明显升高( P <0.05或 P <0.01);与Sham组相比,Sham+MgTx组肾组织M 标志物mRNA水平均无显著差异( P 均>0.05)。
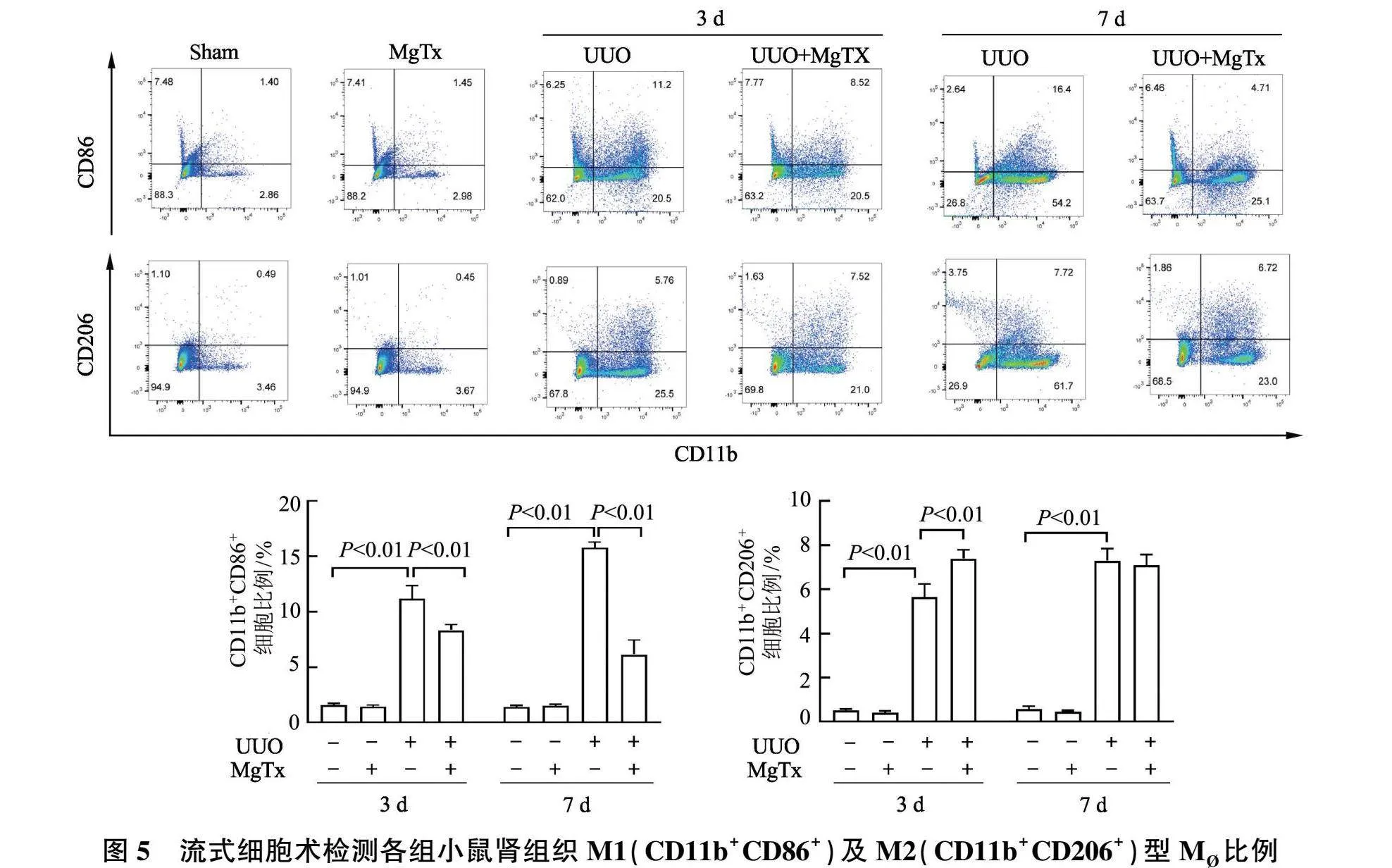
2.4 MgTx对各组小鼠肾组织M 比例的影响
流式细胞术结果显示(图5),与Sham组相比,UUO组术后第3天和第7天肾组织中M1(CD11b+ CD86+ )及M2(CD11b+ CD206+ )型M 比例显著增加( P 均< 0.01);与UUO组相比,UUO+MgTx组术后第3天和第7天肾组织中M1型M 比例显著降低( P 均<0.01);与Sham组相比,Sham+MgTx组肾组织M 比例均无显著差异( P 均>0.05)。
3 讨论
UUO手术通过结扎单侧输尿管形成梗阻性肾病,加速模拟人类慢性阻塞性肾病,目前已广泛应用于肾脏疾病的相关研究。本研究结果显示,UUO组和UUO+MgTx组肾小管扩张、肾间质水肿、白细胞浸润以及肾小管上皮细胞凋亡和成纤维细胞活化,TGF-β1和α-SMA相对表达水平升高,这与Martínez-Klimova等[13] 研究结果相一致,说明UUO造模成功且致小鼠肾脏损伤。UUO造成的损伤可诱导循环单核细胞迁移至肾组织并分化为不同亚型的M ,导致各亚型M 比例增加;炎性环境下M 以向促炎M1型M 极化为主,且TNF-α、iNOS、IL-1β表达增加,这些细胞因子既是M1型M 增加的标志,也是重要的促炎症因子,可诱导并加重肾脏炎症反应[14] 。本研究结果显示,相较于Sham组,UUO组肾组织中M1及M2型M 标志物mRNA相对表达量在术后3、7 d均明显增加;此外,UUO术后3 d肾组织中M1型及M2型M 比例显著升高,随着梗阻时间延长至7 d,两者比例进一步升高。通常组织损伤早期以M1型M 为主,通过促炎反应消除损伤因素,而晚期则以M2型M 为主,发挥抗炎和纤维化修复作用[15] 。由此可见,UUO术后3 d和7 d均处于肾脏炎症早期,该阶段M1型M 极化明显增强,本研究结果与其相符。另有研究表明,UUO术后3 d即可观察到炎症反应,术后7 d炎症反应进一步增强,14 d时可观察到明显的肾纤维化[13] 。Cao等[16] 研究表明,CKD患者中M1型M 可能是诱导早期肾功能进行性下降的主要M 类型。由此可见,在肾脏损伤早期,抑制M1型M 极化具有重要意义。本研究发现,UUO组肾组织Kv1.3蛋白相对表达水平明显高于Sham组,提示Kv1.3通道参与UUO病理过程,与肾脏炎症和损伤相关。Kv1.3在炎症组织中呈高表达,已在急性肝损伤、动脉粥样硬化、支气管哮喘和2型糖尿病等模型中证实,抑制其表达则表现出明显的抗炎作用[8-11] 。MgTx作为Kv1.3高亲和力抑制剂,1 nmol/L即可抑制Kv1.3表达[17] 。M 为肾组织中表达Kv1.3的主要细胞,是MgTx靶细胞。本研究结果显示,MgTx干预7 d时,UUO小鼠肾组织中Kv1.3蛋白相对表达、M1型M 比例及相关标志物mRNA相对表达量显著降低,说明MgTx通过抑制肾组织M 向M1型极化,并抑制炎相关症因子表达,从而改善UUO小鼠肾脏损伤和炎症反应。
然而,本研究结果显示,MgTx干预3 d时Kv1.3蛋白相对表达水平以及 IL-1β "mRNA、 Arg-1 "mRNA、 CD206 "mRNA相对表达量变化无显著差异,分析原因:一方面,干预时间可能影响MgTx治疗效果,且不同的细胞因子对MgTx敏感度可能也不同;另一方面,MgTx可能通过其他途径改善肾脏炎症反应;但是,M1型M 在肾组织的浸润明显减少,且 TNF-α "mRNA、 iNOS "mRNA和 IL-10 "mRNA相对表达量明显降低,表明MgTx对小鼠肾损伤具有一定治疗效果。肾脏M 无法自我更新,主要依赖于外周血单核细胞补充[18] 。病理状态下,肾脏损伤可诱导更多的外周血单核细胞浸润肾组织并进一步分化为M ,该过程从损伤后即开始,持续整个UUO发展的全程[19] 。研究显示,单侧肾脏缺血再灌注肾损伤模型小鼠损伤后1 d,74.69%肾脏M 来源于外周血,且血源性M 较肾脏固有M 具有更强的促炎活性,可激活更多的炎症相关信号通路。因此,血源性M 是始动和放大肾损伤的关键,而肾脏固有M 主要负责维持肾脏稳态和修复作用[20] 。本研究结果显示,相较于Sham组,UUO组外周血单核细胞比例在术后3 d即 显著升高,表明单核细胞在肾组织浸润;MgTx干预3 d和7 d均可显著抑制UUO诱导的外周血单核细胞增加,说明MgTx可抑制外周血单核细胞的活化,由此减少M 在肾组织的浸润,改善肾脏炎症反应。研究表明,Kv1.3开放可促进单核细胞的趋化性,而抑制Kv1.3则抑制炎性单核细胞的增殖和募集,致单核细胞对CC趋化因子配体2的反应性降低[21] 。另有研究表明,抑制Kv1.3可抑制B淋巴细胞释放趋化因子,从而减少单核细胞的迁移[21] 。由此表明,MgTx可能通过抑制外周血单核细胞的增殖和向肾组织的迁移,改善单核M 在UUO肾组织的浸润,从而减轻肾脏炎症和损伤。
综上所述,本研究结果表明,Kv1.3在UUO肾脏炎症和损伤中表达明显增加,同时M 向M1型极化增强,而通过MgTx抑制Kv1.3可以抑制M 向M1极化并减轻肾脏炎症和损伤,靶向抑制Kv1.3可能通过调控M 极化发挥抗炎和肾脏保护作用。但是,M 极化的调控涉及多条信号通路,Kv1.3具体如何调控M 极化有待后续进一步探究。
[参考文献]
[1] Kadatane "SP, Satariano M, Massey M, et al. The role of inflammation in CKD[J]. Cells, 2023, 12(12): 1581.
[2] Huen "SC, Cantley LG. Macrophages in renal injury and repair[J]. Annu Rev Physiol, 2017, 79: 449-469.
[3] Shapouri-Moghaddam "A, Mohammadian S, Vazini H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. J Cell Physiol, 2018, 233(9): 6425-6440.
[4] Guiteras "R, Flaquer M, Cruzado JM. Macrophage in chronic kidney disease[J]. Clin Kidney J, 2016, 9(6): 765-771.
[5] 陈 天琰, 张磊, 高建一, 等. 人胚胎干细胞源神经干细胞微囊泡对巨噬细胞极化的影响[J]. 江苏大学学报(医学版), 2020, 30(6): 515-519, 525.
[6] Liu "J, Lv XW, Zhang L, et al. Review on biological characteristics of Kv1.3 and its role in liver diseases[J]. Front Pharmacol, 2021, 12: 652508.
[7] Zhang "Q, Liu L, Hu Y, et al. Kv1.3 channel is involved in ox-LDL-induced macrophage inflammation via ERK/NF-κB signaling pathway[J]. Arch Biochem Biophys, 2022, 730: 109394.
[8] Wu "BM, Liu JD, Li YH, et al. Margatoxin mitigates CCl4-induced hepatic fibrosis in mice via macrophage polarization, cytokine secretion and STAT signaling[J]. Int J Mol Med, 2020, 45(1): 103-114.
[9] 刘 雪琴, 王彦富, 张慧玲, 等. 动脉粥样硬化中钾通道KV1.3阻断剂对巨噬细胞极化的影响[J]. 临床心血管病杂志, 2016, 32(9): 901-904.
[10] Zhou "QL, Wang TY, Li M, et al. Alleviating airway inflammation by inhibiting ERK-NF-κB signaling pathway by blocking Kv1.3 channels[J]. Int Immunopharmacol, 2018, 63: 110-118.
[11] Zayas-Arrabal "J, Alquiza A, Rodríguez-de-Yurre A, et al. Kv1.3 channel blockade improves inflammatory profile, reduces cardiac electrical remodeling, and prevents arrhythmia in type 2 diabetic rats[J]. Cardiovasc Drugs Ther, 2023, 37(1): 63-73.
[12] 李 艳灵, 赵婷婷, 魏艳平, 等. 蝎毒肽作为Kv1.3离子通道阻滞剂研究进展[J]. 世界科学技术中医药现代化, 2021, 23(12): 4632-4640.
[13] Martínez-Klimova "E, Aparicio-Trejo OE, Tapia E, et al. Unilateral ureteral obstruction as a model to investigate fibrosis-attenuating treatments[J]. Biomolecules, 2019, 9(4): 141.
[14] Engel "JE, Chade AR. Macrophage polarization in chronic kidney disease: a balancing act between renal recovery and decline?[J]. Am J Physiol Renal Physiol, 2019, 317(6): F1409-F1413.
[15] Yunna "C, Mengru H, Lei W, et al. Macrophage M1/M2 polarization[J]. Eur J Pharmacol, 2020, 877: 173090.
[16] Cao "Q, Harris DC, Wang Y. Macrophages in kidney injury, inflammation, and fibrosis[J]. Physiology (Bethesda), 2015, 30(3): 183-194.
[17] Schwartz "AB, Kapur A, Wang W, et al. Margatoxin-bound quantum dots as a novel inhibitor of the voltage-gated ion channel Kv1.3[J]. J Neurochem, 2017, 140(3): "404-420.
[18] Liu "F, Dai S, Feng D, et al. Distinct fate, dynamics and niches of renal macrophages of bone marrow or embryonic origins[J]. Nat Commun, 2020, 11(1): 2280.
[19] Ucero "AC, Benito-Martin A, Izquierdo MC, et al. Unilateral ureteral obstruction: beyond obstruction[J]. Int Urol Nephrol, 2014, 46(4): 765-776.
[20] Yao "W, Chen Y, Li Z, et al. Single cell RNA sequencing identifies a unique inflammatory macrophage subset as a druggable target for alleviating acute kidney injury[J]. Adv Sci (Weinh), 2022, 9(12): e2103675.
[21] 张 双霞, 王宪沛, 高传玉, 等. 阻断Kv1.3和KCa3.1钾通道对单核/巨噬细胞增殖和趋化功能的影响[J]. 生理学报, 2015, 67(5): 505-512.
[22] Zhang "S, Wang X, Ju C, et al. Blockage of KCa3.1 and Kv1.3 channels of the B lymphocyte decreases the inflammatory monocyte chemotaxis[J]. Int Immuno- pharmacol, 2016, 31: 266-271.
[收稿日期] 2023-11-29" [编辑] 刘星星
