微卫星不稳定与胃癌患者病理特征的关系及意义
2025-01-02赵石砚韩春荣
【摘要】目的 探讨微卫星不稳定(MSI)与胃癌患者病理特征的关系及意义,为临床提供参考。方法 选取2019年2月至2024年7月南京市溧水区人民医院收治的144例胃癌患者进行回顾性分析,所有患者均行手术治疗,根据病理检查结果评估微卫星是否稳定,分为MSI组(22例)与微卫星稳定(MSS)组(122例)。比较两组患者临床资料(肿瘤最大直径、浸润深度、有无淋巴结转移、Lauren分型、远处转移情况、TNM分期、组织分化程度、吸烟史、饮酒史)及血清糖类抗原(CA)125、CA199水平;分析影响胃癌患者MSI的独立危险因素。结果 两组患者肿瘤最大直径、远处转移、吸烟史、饮酒史占比及血清CA125、CA199水平比较,差异均无统计学意义(均Pgt;0.05);MSI组患者T3期及以上浸润深度、有淋巴结转移、Lauren分型为肠型、TNM分期为Ⅲ~Ⅳ期、组织低分化占比均高于MSS组(均Plt;0.05)。多因素Logistic回归分析结果显示,T3期及以上浸润深度、有淋巴结转移、Lauren分型为肠型、TNM分期为Ⅲ~Ⅳ期、组织低分化均是影响胃癌患者MSI的独立危险因素(均Plt;0.05)。结论 胃癌患者MSI受浸润深度、淋巴结转移、Lauren分型、TNM分期、组织分化程度的影响,临床应密切监测。
【关键词】微卫星不稳定;胃癌;病理特征
【中图分类号】 R735.2 【文献标识码】A 【文章编号】2096-2665.2025.01.0107.03
DOI:10.3969/j.issn.2096-2665.2025.01.035
胃癌作为消化道常见恶性肿瘤,早期通常无特异性表现,诊断难度较大,一旦出现腹部症状加剧、消瘦和贫血等明显症状时,提示疾病已进展至晚期,远期预后较差[1]。目前,临床尚缺乏有效预测胃癌患者远期预后的特异性指标。因此,探索能够有效评估胃癌患者预后的指标,已成为临床研究的重要方向。近年研究显示,错配修复(MMR)受损导致的微卫星不稳定(MSI)可能参与胃癌的发生、发展。部分胃癌患者存在MSI,主要是因MMR蛋白缺失促使微卫星序列次数缺失或增加,促使微卫星片段长度缩短或延长,且不能被修复,进而导致MSI发生[2]。基于此,本研究探讨MSI与胃癌患者病理特征的关系及意义,现报道如下。
1 资料与方法
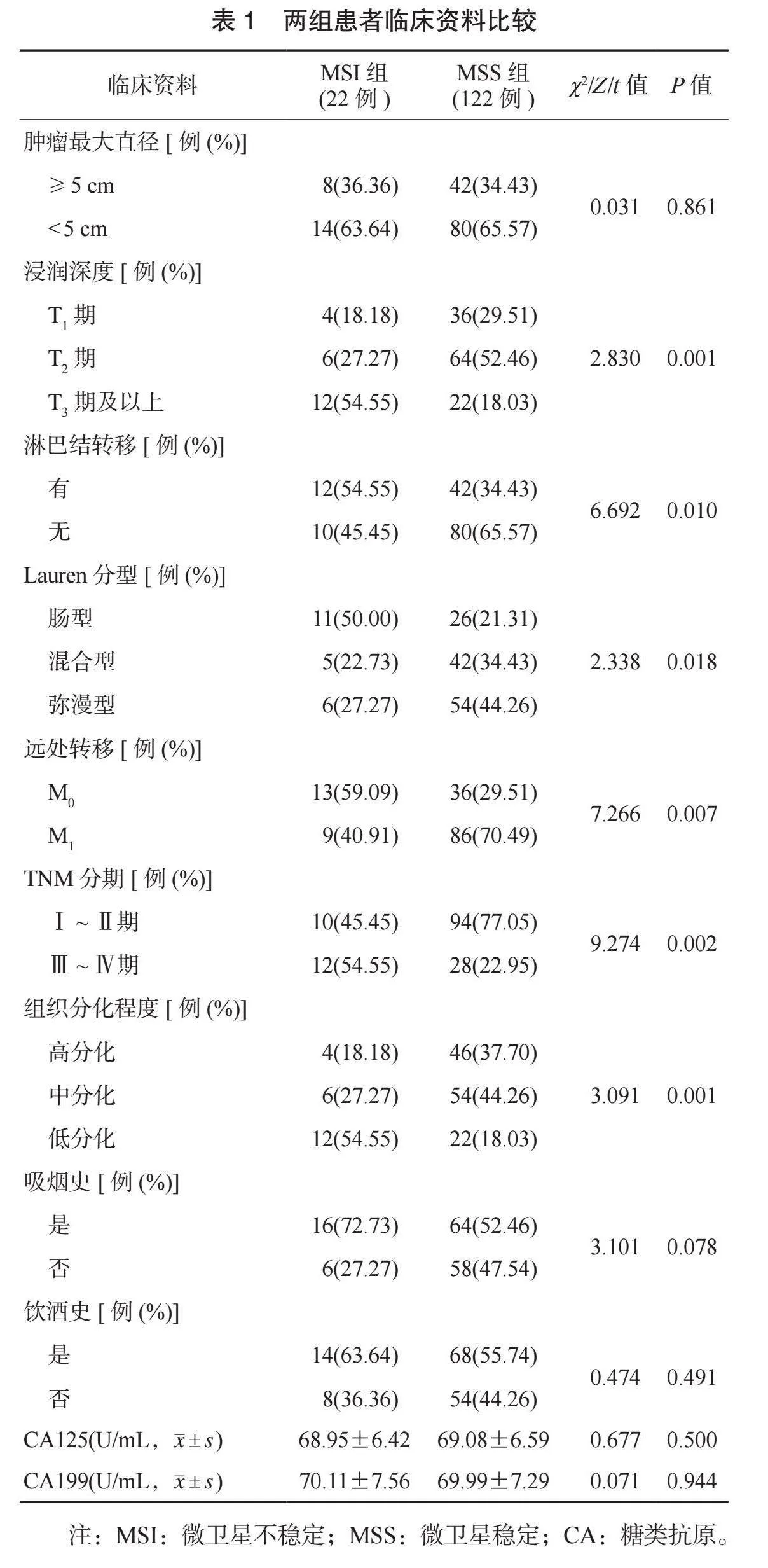
1.1 一般资料 选取2019年2月至2024年7月南京市溧水区人民医院收治的144例胃癌患者进行回顾性分析。所有患者均行手术治疗,肿瘤组织经病理检查后,根据检查结果评估微卫星是否稳定[肿瘤细胞核中产生棕黄色颗粒为阳性,mut-l同源物1、2、6及减数分裂后分离蛋白2染色均为阳性则判定为微卫星稳定(MSS),任一项染色为阴性则判定为MSI[3],分为MSI组(22例)与MSS组(122例)。MSI组患者中男性12例,女性10例;年龄60~75岁,平均年龄(68.56±5.56)岁;肿瘤部位;贲门4例,胃体6例,胃窦10例,超过胃的2/3 2例;吸烟史16例;饮酒史14例。MSS组患者中男性62例,女性60例;年龄60~76岁,平均年龄(68.72±5.29)岁;肿瘤部位;贲门28例,胃体35例,胃窦52例,超过胃的2/3 7例;吸烟史64例;饮酒史68例。两组患者一般资料比较,差异均无统计学意义(均Pgt;0.05),组间具有可比性。本研究经南京市溧水区人民医院医学伦理委员会批准。纳入标准:⑴符合胃癌的诊断标准[4];⑵所有患者均接受手术治疗,术式为胃大部分切除术;⑶临床资料完整。排除标准:⑴入组前接受手术、放化疗、免疫治疗者;⑵存在其他恶性肿瘤者;⑶存在精神病史者;⑷合并凝血、内分泌功能障碍者;⑸合并心、脑、肾等脏器严重障碍者;⑹合并急、慢性感染者;⑺预计生存期lt;6个月者;⑻有胃癌家族史者。
1.2 研究方法 采集两组患者入院后的临床资料。包括肿瘤最大直径(≥5 cm、lt;5 cm)、浸润深度(T1期、T2期、T3期及以上)、淋巴结转移(有、无)、Lauren分型(肠型、混合型、弥漫型)、远处转移情况(M0、M1)、TNM分期(Ⅰ~Ⅱ期、Ⅲ~Ⅳ期)、组织分化程度(高分化、中分化、低分化)、吸烟史(是、否)、饮酒史(是、否)。血清学指标:抽取两组患者入院后空腹静脉血3 mL,采用离心机以4 000 r/min的转速离心10 min(离心半径为10 cm),取上层清液,使用全自动化学发光免疫分析仪(美国雅培公司,型号:i2000)测定糖类抗原(CA)125、CA199水平。
1.3 观察指标 ⑴比较两组患者临床资料。⑵分析影响胃癌患者MSI的独立危险因素。
1.4 统计学分析 采用SPSS 22.0统计学软件对数据进行处理。计量资料以(x)表示,组间比较行独立样本t检验;计数资料以[例(%)]表示,组间比较行χ2检验或秩和检验。危险因素分析采取非条件Logistic逐步回归分析。以Plt;0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较 两组患者肿瘤最大直径、远处转移、吸烟史、饮酒史占比及血清CA125、CA199水平比较,差异均无统计学意义(均Pgt;0.05);MSI组患者T3期及以上浸润深度、有淋巴结转移、Lauren分型为肠型、TNM分期为Ⅲ~Ⅳ期、组织低分化占比均高于MSS组,差异均有统计学意义(均Plt;0.05),见表1。
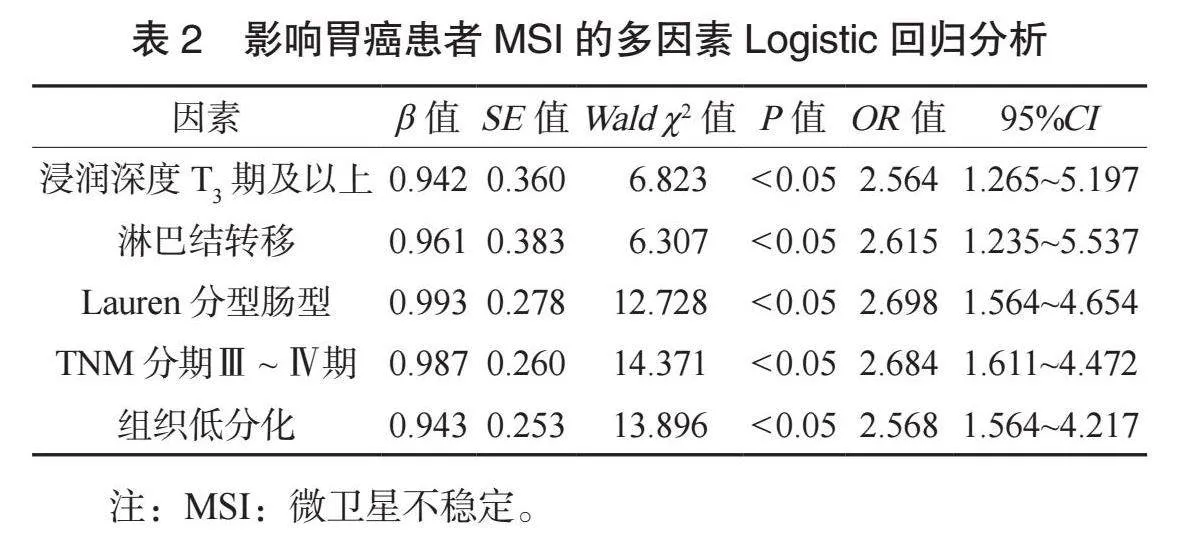
2.2 影响胃癌患者MSI的多因素Logistic回归分析 将胃癌患者MSI设置为因变量(否=0,是=1),将可能影响胃癌患者MSI的因素作为自变量,行量化赋值,浸润深度(T1期、T2期=0,T3期及以上=1)、淋巴结转移(无=0,有=1)、Lauren分型(弥漫型、混合型=0,肠型=1)、TNM分期(Ⅰ~Ⅱ期=0,Ⅲ~Ⅳ期=1)、组织分化程度(高分化、中分化=0,低分化=1)。多因素Logistic回归分析结果显示,T3期及以上浸润深度、有淋巴结转移、Lauren分型为肠型、TNM分期Ⅲ~Ⅳ期、组织低分化均是影响胃癌患者MSI的独立危险因素(均Plt;0.05),见表2。
3 讨论
胃癌的发生是由多种调控基因功能的复杂生物过程紊乱所致,其中,外基因的改变和基因的不稳定性是造成调控基因紊乱的主要因素[5]。有研究显示,由于MSI能够提升肿瘤细胞对程序性死亡配体1(PD-L1)抑制剂的敏感性,因此,可作为评估免疫治疗效果的可靠生物标志物[6]。
本研究结果显示,MSI组患者T3期及以上浸润深度、有淋巴结转移、Lauren分型为肠型、TNM分期Ⅲ~Ⅳ期、组织低分化占比均高于MSS组;本研究多因素Logistic回归分析结果显示,T3期及以上浸润深度、有淋巴结转移、Lauren分型为肠型、TNM分期Ⅲ~Ⅳ期、组织低分化均是影响胃癌患者MSI的独立危险因素,提示上述临床病理特征指标可能是胃癌患者MSI 的危险因素。分析原因为,MSI通常是因MMR系统缺陷引起,会进一步促使DNA复制过程中微卫星区域突变、不稳定。MMR基因突变可能与深层浸润等侵袭性特征相关,可促使肿瘤细胞在复制过程中更易积累突变,增加肿瘤细胞进入淋巴系统、血液循环风险,从而促进肿瘤转移和MSI发生;MSI肿瘤细胞通常具有较高的突变负荷,可能通过免疫逃逸机制(如PD-L1表达调控机制)抑制免疫细胞的攻击。有淋巴结转移的肿瘤细胞可能更易在转移过程中激活这些免疫逃逸机制,表现出更高的基因组不稳定性,从而增加MSI的发生风险[7-8]。肠型胃癌通常与慢性炎症和肠化生有关,肠型胃癌的特征是细胞排列成肠上皮样结构,这种形态学改变可能与某些基因突变有关,如TP53和APC基因突变,这些突变进一步促进肿瘤的进展和MSI的发生[9]。另有研究显示,肠型胃癌患者的肿瘤组织中,DNA MMR系统功能障碍较常见[10]。因此,肠型胃癌患者中MSI的发生率较高,可能与MMR系统的功能障碍有关。Ⅲ~Ⅳ期胃癌表示肿瘤已经进展至晚期,肿瘤细胞可能已经侵入邻近组织并可能转移至远处器官[11]。肿瘤细胞在不断增殖和分化的过程中,基因组稳定性逐渐降低,导致微卫星位点的突变累积,从而增加MSI发生风险。此外,Ⅲ~Ⅳ期胃癌患者往往伴有更广泛的肿瘤浸润和转移,这可能与肿瘤细胞的高侵袭性有关。MSI状态下的肿瘤细胞表现出更强的基因组不稳定性,这可能导致其具有更高的侵袭性和转移能力[12]。因此,MSI可能在一定程度上促进肿瘤的进展和转移;组织低分化提示肿瘤细胞的形态和结构与正常细胞差异较大,分化程度低的肿瘤细胞生长和分裂速度通常较快,容易突破基底膜,侵入周围组织,导致肿瘤的浸润和转移[12]。由于这些细胞的异质性较高,基因组稳定性较差,容易发生基因突变,从而增加MSI的发生率。此外,低分化肿瘤细胞的增殖活性较高,细胞周期调控机制可能发生紊乱,细胞周期失控会导致细胞在未完成DNA修复的情况下进入下一个周期,增加基因突变的风险。这种失控的细胞增殖和基因突变的累积,进一步增加MSI的发生率[13]。
综上所述,T3期及以上浸润深度、有淋巴结转移、Lauren分型为肠型、TNM分期Ⅲ~Ⅳ期、组织低分化均是影响胃癌患者MSI的独立危险因素,临床应密切监测。
参考文献
李兆申.慢性萎缩性胃炎的早筛、早诊、早治与胃癌的预防[J].中华消化杂志, 2021, 41(Z1): 5-8.
赵倩. 微卫星不稳定性与胃癌临床病理特征相关性的Meta分析[D]. 石家庄:河北医科大学, 2022.
刘芹,刘宝瑞. 2019ESMO转移性胃癌临床实践指南解读:泛亚洲人群适用[J/CD]. 肿瘤综合治疗电子杂志, 2019, 5(2): 97-101.
中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜专业委员会.中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)[J].中华消化杂志, 2014, 34(7): 433-448.
邓建忠,刘秀玲,陆文斌,等.应用生物信息学方法筛选与早期胃癌预后相关的核心基因[J].山东医药, 2021, 61(10): 1-5.
王鑫宇,胡雅洁,董坤,等.高度微卫星不稳定胃癌中PD-L1的表达水平及其预后价值[J].中华病理学杂志, 2020, 49(11): 1114-1119.
詹鹏超,邱庆雅,刘珂衍,等.微卫星高度不稳定型胃癌的CT及临床病理学特征分析[J].实用放射学杂志, 2023, 39(7): 1101-1105.
张朝浩.微卫星不稳定型胃癌患者程序性死亡-配体1表达与预后的相关性分析[J].医药前沿, 2024, 14(3): 127-129.
周志毅,郭庆,杨树东,等.胃癌组织PBRM1基因缺失/突变的临床病理意义和分子改变[J].中华肿瘤防治杂志, 2021, 28(9): 668-675.
郝美玲,张秀芬,李子鑫,等.胃癌组织中MLH1, MSH2, MSH6和PMS2表达及与临床病理特征和预后的相关性分析[J].现代检验医学杂志, 2023, 38(2): 48-51, 62.
孟宁,刘晟楠,周谦. MSI、HGF与胃癌临床病理学特征及预后关系研究[J].分子诊断与治疗杂志, 2021, 13(11): 1787-1791.
刘莹,臧凤琳,邱志强,等. 886例胃腺癌患者错配修复蛋白表达和EB病毒感染状态与其临床病理特征的关系[J].中华胃肠外科杂志, 2021, 24(5): 440-448.
詹鹏超,李莉明,吕东博,等.临床及CT影像组学特征预测胃癌微卫星高度不稳定状态[J].中国医学影像技术, 2024, 40(1): 77-82.
