基于 VOS viewer的多黏菌素B研究进展分析
2024-12-31陈姝璇董思瑶王彦改陈冰白向荣

摘要:目的 基于Web of Science,PubMed数据库,分析多黏菌素B的研究热点和发展趋势。方法 以“polymyxin B,Aerosporin”为检索词在Web of Science核心数据集和PubMed中检索近5年的英文文献。用VOS viewer作关键词和研究热点分析,总结多黏菌素B的抗菌机制、耐药性机制与检测方法、药代动力学及其临床应用情况。结果 共纳入分析英文文献2012篇(2019年1月1日—2023年12月8日),发文量整体呈上升趋势。澳大利亚莫纳什大学发文量最多,学者Li Jian被收录的文献最多。中国发文量最高,美国总被引频次最高。结论 多黏菌素B的耐药性机制、药代动力学和联合治疗方案优化是目前的研究热点。其中脓毒症是近年来多黏菌素B的关注焦点。
关键词:多黏菌素B;药代动力学;耐药性;可视化分析
中图分类号:R978.1 文献标志码:A
Research progress analysis of polymyxin B based on VOS viewer
Chen Shuxuan1,2, Dong Siyao1,2, Wang Yangai1, Chen Bing1, and Bai Xiangrong1
(1 Xuanwu Hospital Capital Medical University, Department of pharmacy,National Clinical Research Center for Geriatric Diseases, Beijing 100053; 2 Capital Medical University,College of Pharmacy, Beijing 100053)
Abstract Objective To analyze the research hotspots and trends of polymyxin B based on the Web of Science and PubMed databases. Methods The English literature of the last 5 years was searched in the Web of Science core dataset and PubMed using “polymyxin B, aerosporin” as search terms. VOS viewer was used for keyword and research hotspot analysis to summarize the antibacterial mechanism, resistance mechanism, detection method, pharmacokinetics of polymyxin B and its clinical application. Results A total of 2012 English literatures (2019.1.1—2023.12.8) were included for analysis, with an overall increasing trend in the number of publications. Monash University in Australia had the highest number of publications, and Li Jian was included in the most publications. China had the highest number of publications and the United States had the highest total citation frequency. Conclusion The resistance mechanism, pharmacokinetics and optimization of a combination therapy regimen for polymyxin B are the current research hotspots. Among them, sepsis has been the focus of attention for polymyxin B in recent years.
Key words Polymyxin B; Pharmacokinetics; Drug resistance; Visual analysis
在抗生素的发现帮助人类抵御细菌感染的同时,细菌耐药性的传播,也给人类带来了更大的危机[1]。自从多黏菌素在20世纪40年代末被发现以来,黏菌素和多黏菌素开始应用于临床,并起到了卓越的作用[2]。而本世纪初,随着多黏菌素B在临床使用的增加,人们对其认识也在逐步加深。其中,多黏菌素B在治疗鲍曼不动杆菌、铜绿假单胞菌和大肠埃希菌等革兰阴性菌导致的感染中[3],体现出较高的临床价值,但与此同时,其肾毒性也成为临床应用中的一大挑战[4]。
目前,多黏菌素B已经成为对抗革兰阴性耐药菌的最后一道重要防线[5]。因此,对多黏菌素B的进一步深入研究已经刻不容缓。本研究旨在通过使用VOS viewer对近5年来(2019年1月1日—2023年12月8日)有关多黏菌素B文献进行研究现状分析,了解国际上多黏菌素B的研究热点和发展趋势,并为多黏菌素B的临床应用提供参考。
1 资料与方法
1.1 文献检索
本文于2023年12月8日在Web of Science 核心数据集和PubMed中检索近5年(2019年1月1日—2023年12月8日)文献。检索式为“ Polymyxin B”OR“Aerosporin ”。限定为主题检索,检索标题,摘要,作者和关键词。纳入研究类型为论著和综述,排除以下文献类型:在线发表,会议录论文,书籍章节等。语言限定为英文。
1.2 一般文献计量指标分析
将检索到的文献导入VOS viewer软件(1.6.19.0版本),统计分析文献的发表年份,文献作者的国家/地区和机构分布。观察分析其研究现状与热点。
1.3 关键词共现网络
将文献导入VOS viewer软件(1.6.19.0版本),关键词的阈值设置为20次,对符合要求的高频关键词进行聚类分析,生成可视化关键词共现网络图谱,分析当前的研究热点、研究趋势及研究方向。
2 结果
2.1 文献统计结果
检索Web of Science核心数据集,PubMed有关多黏菌素B的近5年发表的文献(2019年1月1日—2023年12月8日),排除重复文献及不合格文献,最终两数据库合计纳入分析2012篇文献。
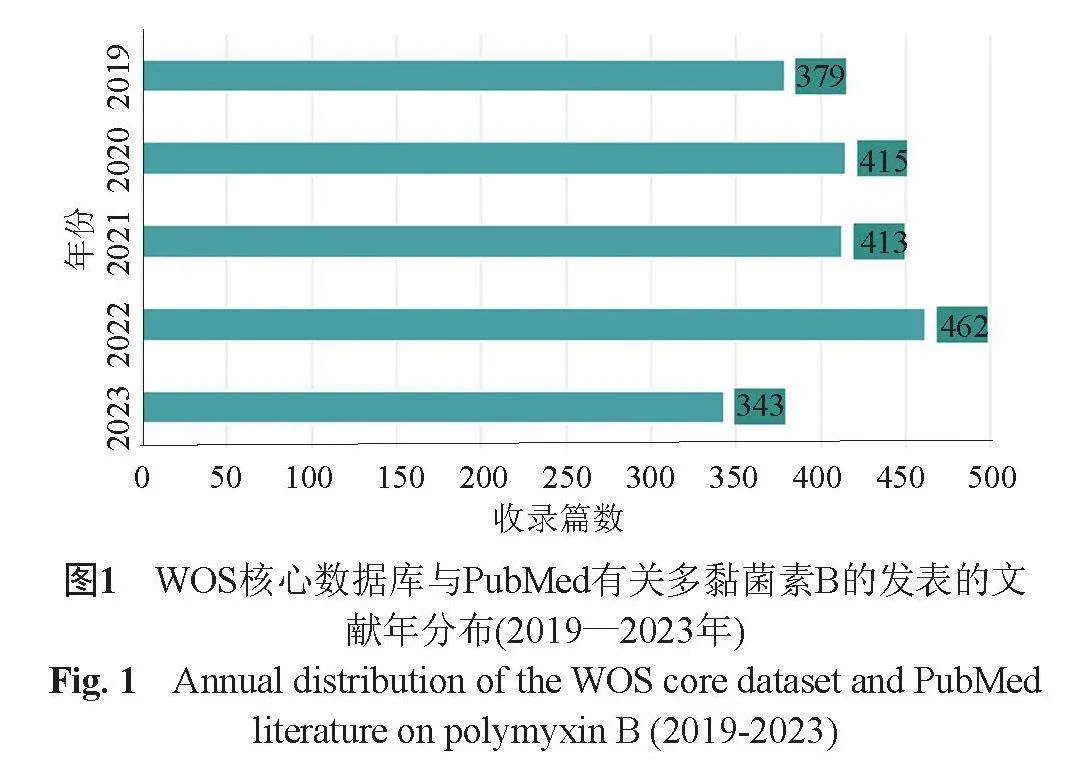
2.2 发文趋势及年分布
图1是其年发文量变化趋势图,每年的发表量呈现逐年上升趋势,年收录篇数均大于300篇。2019—2020年以多黏菌素B的耐药机制的研究为主,2021年及以后的研究焦点集中在多黏菌素B的临床疗效、肾毒性等临床方面的研究。
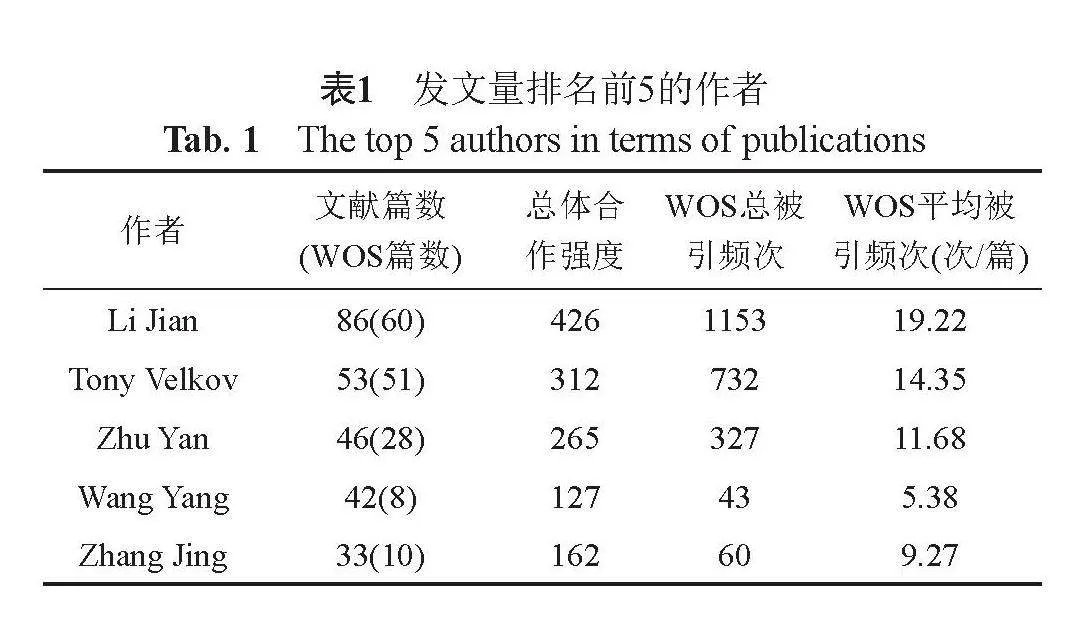
2.3 文献作者
2012篇文献共9435位学者发文,其中,澳大利亚莫纳什大学学者Li Jian发文数最多,其次为Tony Velkov。发文量排名前5的作者见表1。表1中Li Jian与Tony Velkov引用频次,合作强度位列前2,说明受到各国学者的广泛认可,具体见表1。
Li Jian共计被收录60篇文献,总被引频次及平均被引频次第一,研究方向主要集中于抗生素耐药性、抗菌药理、药物发现、药效学、药代动力学以及鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌等[6-7]。其中Li等[8]研究首次提出了黏菌素和多黏菌素B治疗的国际性治疗专家共识,从而为临床合理使用提供参考。
Velkov等[9-10]研究方向集中于多黏菌素B的药理学,包括其作用方式、化学、构效关系和毒性等。其中重点阐述多黏菌素B结构毒性关系,为未来设计出更具有优势的抗菌药物提供方向[11]。
我国发文量最多的学者是中国科学院天津工业生物技术研究所Zhu Yan。重点通过优化多黏菌素B结构,开发出一种新的合成脂肽,同时发现对多药耐药革兰阴性菌导致的肺部感染具有更好的疗效和安全性[12],
提示我国学者研究集中在药物研发方面。
2.4 发文国家
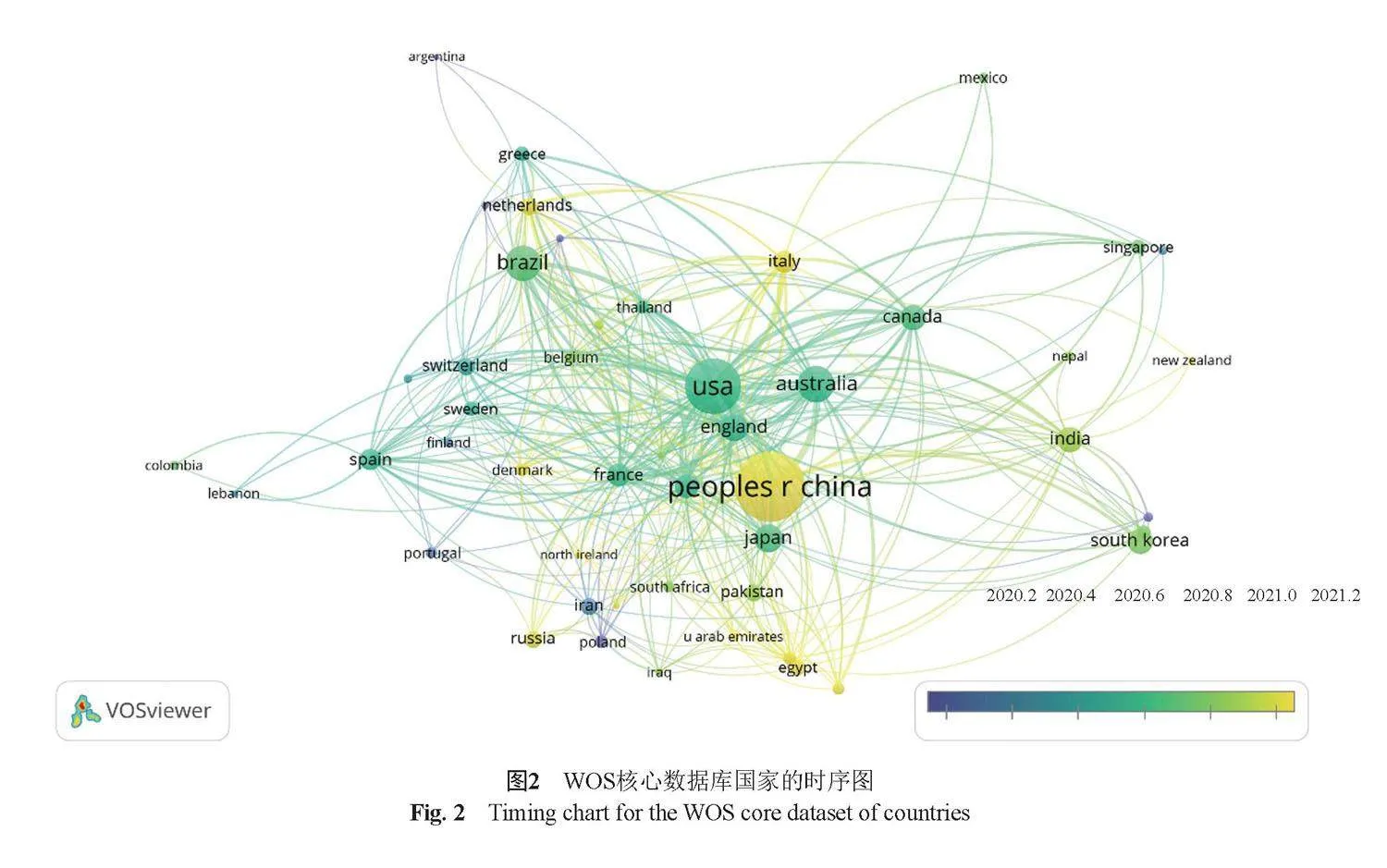
根据WOS核心数据库,1771篇文献共来自91个国家。根据图2,我国与美国、澳大利亚合作密切,从时间上看,我国整体发文时间略晚于美国、澳大利亚等国家。文献数量排名前 10位的国家及其文献的被引情况见表2。
发文量前7的国家分别为中国、美国、澳大利亚、巴西、日本、英国和加拿大。我国发文量居第一,占文献总数的30.66%。美国的总被引频次和总体合作强度均居第一,加拿大平均被引频次(25.39次/篇)最高。
加拿大主要研究方向集中于多黏菌素B的耐药性。加拿大学者Tyers等[13]研究提出了将联合治疗的观点,包括抗生素与抗生素的协同作用;抗生素与抗生素佐剂组合;抗生素与非抗生素的抑制剂的组合靶向作用于特定病原体。为临床上抗菌药物的选择提供参考。
2.5 发文机构
根据WOS核心数据库,1771篇文献共来自2432个机构。发文数排名前10的机构如表3所示。发文量前3的机构依次为莫纳什大学、墨尔本大学和浙江大学。根据图3所示,澳大利亚的莫纳什大学与墨尔本大学彼此之间合作关系密切。图3中左侧主要为欧美机构,右侧区域主要为亚洲机构,如我国的浙江大学、上海交通大学和温州医科大学等。在多黏菌素B的研究领域,莫纳什大学发表文章被引频次高(总被引频次1547次,平均被引频次1.55次/篇),综合水平较强,美欧学术机构之间的关系更为密切,合作较为频繁,具体见表3和图3。
浙江大学作为我国发文量最高的机构,研究成果是基于中国人群的多黏菌素B的耐药性与药代动力学研究[14-16],为我国的抗菌治疗策略和个性化用药方案提供依据。
莫纳什大学研究方向集中于微生物学,耐药性和抗菌药理等研究。其中Han等[17]揭示多黏菌素诱导的细胞反应动态以及多黏菌素B抗菌及耐药机制和潜在的细胞内靶点,有利于新一代多黏菌素的发现。也首次提出通过修改多黏菌素B支架内的多个非保守位置,同时优化其构效关系、结构-毒性关系和结构-药代动力学关系,从而开发出新的合成脂肽[12]。
墨尔本大学研究方向聚焦于首次证明并研究多黏菌素B与舍曲林联合使用的协同作用,强调了多黏菌素-舍曲林联合治疗多药耐药革兰阴性菌引起的感染的潜在可能性,为新的抗生素靶点的开发提供了有价值的参考[18]。
2.6 关键词
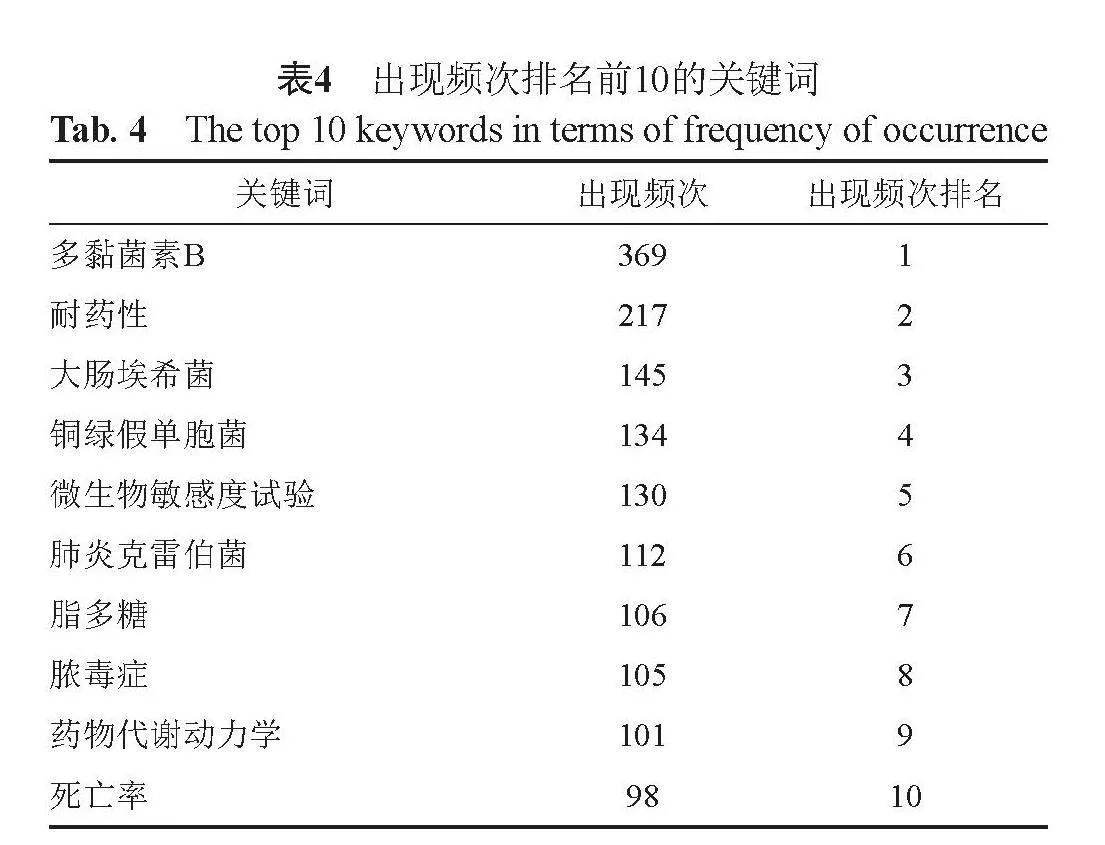
将Web of Science 核心数据集和PubMed中检索的2012篇文献有关多黏菌素B的文献导入 VOS viewer 软件后共检测出8269个关键词,出现频次≥20的关键词共148个。其中,耐药性(217次),微生物敏感度试验(130次),各微生物(大肠杆菌145次,铜绿假单胞菌134次),脓毒症(105次),药物代谢动力学(101次)出现频次较高,见表4。
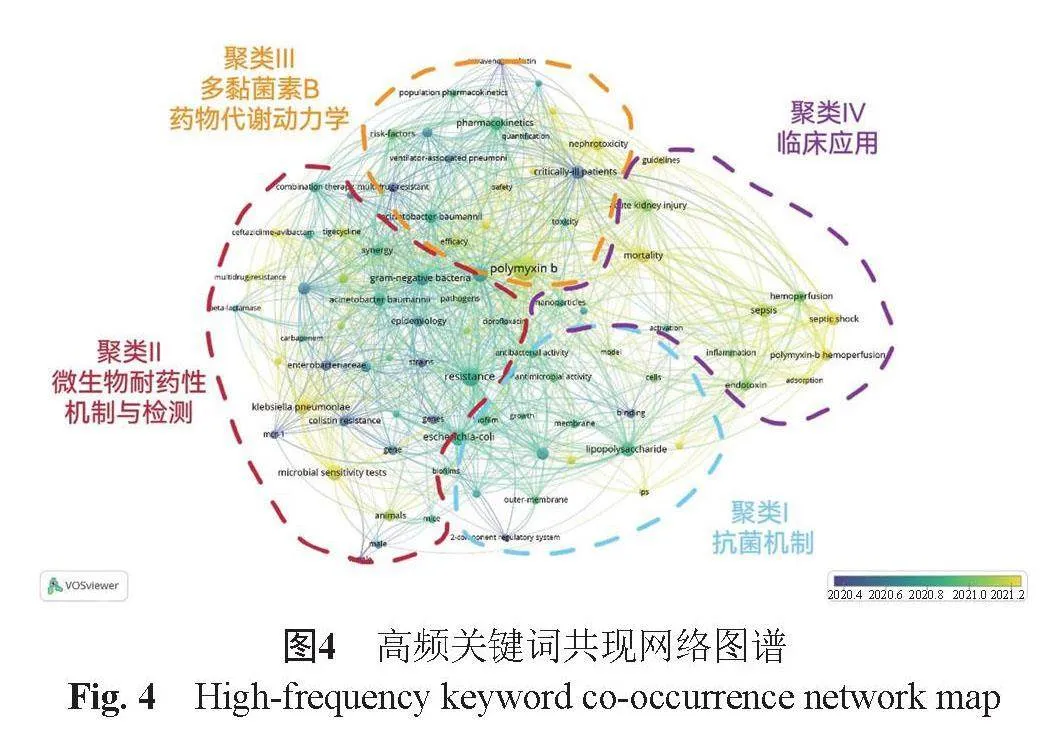
关键词共现分析见图4。
聚类Ⅰ最新进展是围绕多黏菌素B-脂多糖相关抗菌机制开发新药物及治疗策略。其中基于多黏菌素B与脂多糖间特异性相互作用,将多黏菌素与脂质体结合,用于治疗动脉粥样硬化[19]。该研究提出的策略为管理其他脂多糖相关疾病提供新的思路。
聚类Ⅱ聚焦于对耐药性基因发现与检测。通过对一种携带blaCMY-2、qnrB19和mcr-9等基因的多药耐药性菌进行检测和基因组特征描述,提示对公共健康构成威胁的耐多药人畜共患病原体的存在,以及对人类和非人类来源的抗菌素耐药性持续监测的必要性[20]。
聚类Ⅲ热点在于特殊人群的群体药代动力学模型,近年来关注点是建立肝功能障碍患者群体药代动力学[21]。
聚类Ⅳ临床应用最近的关注点是脓毒症与多黏菌素B的疗效与肾毒性。Xia等[22]分析多黏菌素B在中国老年脓毒症患者中的有效性和肾毒性,分析多黏菌素B相关急性肾损伤的发生率及相关危险因素,对于优化治疗方案与减少肾损伤,改善老年患者预后提供临床依据。
2.7 多黏菌素B的抗菌机制、耐药性机制与检测方法
目前,多黏菌素的抗菌机制主要有以下几种:Kim等[23]在2019年发表的文章指出多黏菌素B的抗菌机制可能与ROS以及电子传递异常有关。更早的研究还提及,多黏菌素B通过破坏革兰阴性菌的胞膜来杀死细菌[24],这一机制与脂多糖有关[19]。多黏菌素从磷酸基团中取代Mg2+和Ca2+,破坏外膜导致细菌死亡[25]。
有关耐药性机制,下面进行简单总结:2019年Li等[26]提及微生物耐药性与脂多糖的修饰相关。mcr-1基因编码的一种修饰脂质A的PEtN转移酶,可以改变其电荷,导致黏菌素耐药性。2022年Fortini等[27]通过基因组学方法检测发现,耐药性与编码脂多糖、参与外膜合成的蛋白(RfbN,LolB,ZraR)、外排泵(MdsC)有关的基因均相关。除此之外,2020年El-Sayed Ahmed等[28]还总结了其他耐药性相关原因,包括编码脂多糖丢失相关基因突变,编码孔蛋白的基因突变与以及黏菌素酶的失活等。
关于耐药性检测的方法主要是3大类。第一类是传统的微生物学分析,如经典的标准微量肉汤稀释法。另外,Lescat等[29]在2019年发表的文章中,基于显色原理使用了一种活性染色剂检测鲍曼不动杆菌和铜绿假单胞菌的耐药性,该方法的敏感性和特异性高达100%和95%。第二类是分子生物学方法。如Qiao等[30]通过PCR技术鉴定了常见的碳青霉烯类基因编码基因blaKPC, blaIMP, blaNDM和blaOXA。该技术所需时间短,操作简单。第三类是新方法,目前较新的方法是二代测序技术,有报道[31]使用NGS检测到相关的耐药基因(MEX、omp、oxA、abe和emr),基于NGS阳性结果,调整用药方案,给予多黏菌素B等对抗耐多药的病原体。
深入探究抗菌机制与耐药性机制,将为我们揭示出新的治疗方法和药物研发的线索,为未来疾病治疗开辟新的道路。
2.8 多黏菌素B的药代动力学与临床应用
由图4可知,各人群的药代动学研究时间开始早,持续时间长,可事实上相关研究仍然缺乏。Wang等[32]建立老年群体药代动力学模型,结果表明多黏菌素B的固定维持剂量为50和75 mg时可以在平衡老年患者肾毒性的同时达到最大疗效。关于儿童多黏菌素B的剂量指导数据同样较少,最近一研究[33]通过建立多黏菌素B在儿科患者中的群体药代动力学(population pharmacokinetics, PK)模型,评估不同剂量的可能适宜性。对于孕妇和哺乳期妇女,目前没有科学数据支持或建立其在使用中的安全性[34]。目前药代动力学的研究仍存在空白,需要更多的研究与探索进行补充,这对进一步了解多黏菌素B在体内过程,药物优化,临床提供更加科学和个性化的服务等具有重要意义。
有关多黏菌素B的临床应用,通过共现分析发现脓毒症是目前的研究热点。对于脓毒症,多黏菌素B与血液灌注结合的治疗方法是热点,该方法自1994年起在日本开始使用,并于1998年在欧洲获得CE标志的批准。Fujimori等[35]研究表示多黏菌素B血液灌注可降低脓毒症患者的血液内毒素水平,使用多黏菌素B血灌注治疗脓毒性休克和内毒素活性升高的患者可改善临床结果。Kellum等[36]也证实该方法可以在有效去除内毒素的同时避免全身毒性,接受多黏菌素B血液灌注治疗的患者的生存率明显高于未接受治疗的患者。另一研究热点是联合用药,相较于单药治疗,多药联合治疗对细菌的杀伤性更强。有研究表明[37],双重用药后细菌仍有再生可能,而多黏菌素B-利福平-阿米卡星三重用药,在5~25 h内未检测细菌繁殖,后续仅有较小幅度的再生,24和48 h检测结果表示几乎所有细菌都对多黏菌素B具有高度耐药性。另一模型结果表明[38],美罗培南与多黏菌素B联合治疗时,显著降低了美罗培南耐药菌达到最大活性一半所需的浓度。
目前,已经出现耐多黏菌素B的微生物,其药物剂量的不恰当使用可能造成其耐药性[37-38]。除此之外,多种药物的联合使用对患者具有更大的潜在肾毒性。为了保障患者的用药安全,未来的研究应聚焦于不同人群的药代动力学的研究,以科学地指导临床实践,这可能成为未来的研究重点。
3 讨论
本研究对近5年有关多黏菌素B的文献进行分析,通过VOS viewer软件进行关键词共现分析,进一步确定近年的研究热点与发展趋势。所研究文章出现频次较高的关键词中,聚类Ⅲ针对不同人群多黏菌素B药物代谢动力研究时间最早,聚类Ⅱ中“微生物敏感度试验”与“耐药性”关系紧密。耐药性与药代动力学是现阶段的研究热点,今后的研究方向可能以多黏菌素B临床合理应用为主。
通过分析文献基本情况发现:澳大利亚在多黏菌素B领域的研究处于领先地位,在国际上更具有影响力。其中,学者Li Jian与Tony Velkov发文质量与数量并重。
莫纳什大学、墨尔本大学发表论文最多且合作密切,我国关于多黏菌素B研究机构主要集中于浙江大学、上海交通大学、温州医科大学等高校。由图3看出,国内机构之间保持着相对密切的合作关系。欧美之间的合作联系更为紧密,然而与我国的合作相对较少。因此,我国应当积极与国际社会建立紧密的合作关系,广泛开展国际交流与合作,以更好地推动多黏菌素B领域研究的发展。
通过VOS viewer软件进行关键词共现分析得出,多黏菌素B的抗菌机制、微生物耐药性机制与检测、多黏菌素B的药代动力学、多黏菌素B的临床应用尤其是脓毒症的临床应用为近年研究热点。WOS核心数据库被引频次最高的研究是Luther等[39]2019年发表的“Chimeric peptidomimetic antibiotics against Gram-negative bacteria”。研究描述了一类受多黏菌素B和黏菌素启发的合成抗生素,面对多重药耐药菌时具有良好的活性,且在体外和体内也显示出良好的药物特性。
Sabnis等[40]在2021年发表的高引用文献“Colistin kills bacteria by targeting lipopolysaccharide in the cytoplasmic membrane”的研究,证明多黏菌素通过靶向作用于外膜和调节胞膜的脂多糖,发挥杀菌以及提高细菌对多黏菌素的敏感性作用。这项研究有助于理解其作用机制,为提高多黏菌素B的疗效提供了新思路。
除此之外,还有多篇高引用文献指出多黏菌素B对脓毒症患者在血流动力学、器官功能和28 d生存率方面有较好的临床结果[41-44]。其在脓毒症的临床应用具有极大的潜力和价值,然而在发挥其疗效的同时,多黏菌素B的肾毒性问题也需要特别关注。维持疗效和肾毒性之间的平衡,密切关注患者的病情变化及各功能指标,通过控制剂量等方法保障多黏菌素B的疗效的同时减轻其肾毒性影响,以确保治疗的顺利进行和患者的安全。
4 总结
综上所述,利用VOS viewer对领域内的大量文章进行研究进展分析,从多个角度展示该领域的概况与研究热点及趋势,分析研究进展,发现多黏菌素B领域澳大利亚、莫纳什大学墨尔本大学、学者Li Jian与Tony Velkov更具有影响力。多黏菌素B的耐药性机制、药代动力学和联合治疗方案优化是目前的研究热点。其中脓毒症是近年来多黏菌素B的关注焦点。本研究通过分析多黏菌素B的发展趋势和未来研究方向,为未来多黏菌素B的研究状况提供参考。
参 考 文 献
Bassetti M, Giacobbe D R. A look at the clinical, economic, and societal impact of antimicrobial resistance in 2020[J]. Expert Opin Pharmacother, 2020, 21(17): 2067-2071.
Nation R L. Conclusion[M]. Polymyxin Antibiotics: From Laboratory Bench to Bedside. 2019: 363-364.
李燕菊, 汪海涛, 马新萍, 等. 多黏菌素B联合头孢哌酮钠舒巴坦钠和替加环素治疗多重耐药鲍曼不动杆菌肺炎的疗效观察[J]. 药物评价研究, 2021, 44(2): 376-380.
Falagas M E, Kyriakidou M, Voulgaris G L, et al. Clinical use of intravenous polymyxin B for the treatment of patients with multidrug-resistant Gram-negative bacterial infections: An evaluation of the current evidence[J]. J Glob Antimicrob, 2021, 24: 342-359.
Velkov T, Roberts K D, Thompson P E, et al. Polymyxins: A new hope in combating Gram-negative superbugs[J]? Future Med Chem, 2016, 8(10): 1017-1025.
Garcia E, Diep J K, Sharma R, et al. Evaluation strategies for triple-drug combinations against carbapenemase-producing Klebsiella pneumoniae in an in vitro hollow-fiber infection model[J]. Clin Pharmacol Ther, 2021, 109(4): 1074-1080.
Hussein M, Han M L, Zhu Y, et al. Metabolomics study of the synergistic killing of polymyxin B in combination with amikacin against polymyxin-susceptible and -resistant Pseudomonas aeruginosa[J]. Antimicrob Agents Chemother, 2019, 64(1): e01587-01519.
Tsuji B T, Pogue J M, Zavascki A P, et al. International consensus guidelines for the sptimal use of the polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti‐infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP)[J]. Pharmacotherapy, 2019, 39(1): 10-39.
Dai C, Li M, Sun T, et al. Colistin-induced pulmonary toxicity involves the activation of NOX4/TGF-β/mtROS pathway and the inhibition of Akt/mTOR pathway [J]. Food Chem Toxicol, 2022, 163: 112966.
Nang S C, Azad M A K, Velkov T, et al. Rescuing the last-line polymyxins: Achievements and challenges[J]. Pharmacol Rev, 2021, 73(2): 679-728.
Velkov T, Roberts K D. Discovery of novel polymyxin-like antibiotics[J]. Adv Exp Med Biol, 2019, 1145: 343-362.
Roberts K D, Zhu Y, Azad M A K, et al. A synthetic lipopeptide targeting top-priority multidrug-resistant Gram-negative pathogens[J]. Nat Commun, 2022, 13(1): 1625.
Tyers M, Wright G D. Drug combinations: A strategy to extend the life of antibiotics in the 21st century[J]. Nat Rev Microbiol, 2019, 17(3): 141-155.
Shi Q, Yin D, Han R, et al. Emergence and recovery of ceftazidime-avibactam resistance in blaKPC-33-harboring Klebsiella pneumoniae sequence type 11 isolates in China[J]. Clin Infect Dis, 2020, 71(Suppl 4): S436-s439.
Han R, Shi Q, Wu S, et al. Dissemination of carbapenemases (KPC, NDM, OXA-48, IMP, and VIM) among carbapenem-resistant Enterobacteriaceae isolated from adult and children patients in China[J]. Front Cell Infect Mi, 2020, 10: 314.
Liu X, Chen Y, Yang H, et al. Acute toxicity is a dose-limiting factor for intravenous polymyxin B: A safety and pharmacokinetic study in healthy Chinese subjects[J]. J Infect, 2021, 82(2): 207-215.
Han M L, Zhu Y, Creek D J, et al. Comparative metabolomics and transcriptomics reveal multiple pathways associated with polymyxin killing in Pseudomonas aeruginosa[J]. mSystems, 2019, 4(1): e00149-00118.
Hussein M, Schneider-Futschik E K, Paulin O K A, et al. Effective strategy targeting polymyxin-resistant Gram-negative pathogens: Polymyxin B in combination with the selective serotonin reuptake inhibitor sertraline[J]. Acs Infect Dis, 2020, 6(6): 1436-1450.
Liu H W, Wang H L, Li Q Y, et al. LPS adsorption and inflammation alleviation by polymyxin B-modified liposomes for atherosclerosis treatment[J]. APSB, 2023, 13(9): 3817-3833.
Braga P R C, Dos Santos C A, Bertani A M J, et al. Detection and genomic characterization of a multidrug-resistant Salmonella newport co-harbouring bla(CMY-2), qnrB19 and mcr-9 from the diarrheic faeces of a foal[J]. J Glob Antimicrob Re, 2023, 35: 198-201.
Li X, Cheng Y, Chen B, et al. Population pharmacokinetics of polymyxin B in patients with liver dysfunction[J]. Br J Clin Pharmacol, 2023, 89(12): 3561-3572.
Xia G L, Xu X, You X B, et al. Efficacy and nephrotoxicity of polymyxin B in elderly patients with carbapenem resistant bacterial infection[J]. Ann Clin Microbiol Antimicrob, 2023, 22(1): 101.
Kim S Y, Park C, Jang H-J, et al. Antibacterial strategies inspired by the oxidative stress and response networks[J]. J Microbiol, 2019, 57(3): 203-212.
Tam V H, Schilling A N, Vo G, et al. Pharmacodynamics of polymyxin B against Pseudomonas aeruginosa[J]. AAC, 2005, 49(9): 3624-3630.
Bialvaei A Z, Samadi Kafil H. Colistin, mechanisms and prevalence of resistance[J]. Curr Med Res Opin, 2015, 31(4): 707-721.
Li Z, Cao Y, Yi L, et al. Emergent polymyxin resistance: End of an Era[J]? Open Forum Infect Dis, 2019, 6(10): ofz368.
Fortini D, Owczarek S, Dionisi A M, et al. Colistin resistance mechanisms in human Salmonella enterica strains isolated by the National Surveillance Enter-Net Italia(2016–2018)[J]. Antibiotics, 2022, 11(1): 102.
El-Sayed Ahmed M A E-G, Zhong L-L, Shen C, et al. Colistin and its role in the Era of antibiotic resistance: An extended review(2000–2019)[J]. Emerg Microbes Infect, 2020, 9(1): 868-885.
Lescat M, Poirel L, Tinguely C, et al. A resazurin reduction-based assay for rapid detection of polymyxin resistance in Acinetobacter baumannii and Pseudomonas aeruginosa[J]. J Clin Microbiol, 2019, 57(3): e01563-01518.
Qiao J, Chen Y, Ge H, et al. Coexistence of blaIMP-4, blaNDM-1 and blaOXA-1 in blaKPC-2-producing Citrobacter freundii of clinical origin in China[J]. Front Microbiol, 2023, 14: 1074612.
Wang R, Feng R, Xia C, et al. Early detection of Gram‑negative bacteria using metagenomic next‑generation sequencing in acute respiratory distress syndrome: A case report[J]. Exp Ther" Med, 2022, 24(3): 573.
Wang P, Liu D, Sun T, et al. Pharmacokinetics and pharmacodynamics of polymyxin B and proposed dosing regimens in elderly patients with multi-drug-resistant Gram-negative bacterial infections[J]. Int J Antimicrob Ag, 2022, 60(5-6): 106693.
Wang P L, Liu P, Zhang Q W, et al. Population pharmacokinetics and clinical outcomes of polymyxin B in paediatric patients with multidrug-resistant Gram-negative bacterial infections[J]. J Antimicrob Chemother, 2022, 77(11): 3000-3008.
Andrade F F, Silva D, Rodrigues A, et al. Colistin update on its mechanism of action and resistance, present and future challenges[J]. Microorganisms, 2020, 8(11): 1716.
Fujimori K, Tarasawa K, Fushimi K. Effectiveness of polymyxin B hemoperfusion for sepsis depends on the baseline SOFA score: a nationwide observational study[J]. Ann Intensive Care, 2021, 11(1): 141.
Kellum J A, Formeck C L, Kernan K F, et al. Subtypes and mimics of Sepsis [J]. Crit Care Clin, 2022, 38(2): 195-211.
Aye S M, Galani I, Yu H, et al. Polymyxin triple combinations against polymyxin-resistant, multidrug-resistant, KPC-producing Klebsiella pneumoniae[J]. ACC, 2020, 64(8): e00246-00220.
Lenhard J R, Bulitta J B, Connell T D, et al. High-intensity meropenem combinations with polymyxin B: New strategies to overcome carbapenem resistance in Acinetobacter baumannii[J]. J Antimicro Chemother, 2017, 72(1): 153-165.
Luther A, Urfer M, Zahn M, et al. Chimeric peptidomimetic antibiotics against Gram-negative bacteria[J]. Nature, 2019, 576(7787): 452-458.
Sabnis A, Hagart K L, Klöckner A, et al. Colistin kills bacteria by targeting lipopolysaccharide in the cytoplasmic membrane[J]. Elife, 2021, 10: e65836.
Peerapornratana S, Manrique-Caballero C L, Gómez H, et al. Acute kidney injury from sepsis: Current concepts, epidemiology, pathophysiology, prevention and treatment[J]. Kidney Int, 2019, 96(5): 1083-1099.
Nadim M K, Forni L G, Mehta R L, et al. COVID-19-associated acute kidney injury: Consensus report of the 25th Acute Disease Quality Initiative (ADQI) workgroup[J]. Nat Revi Nephrol, 2020, 16(12): 747-764.
Huang M, Cai S, Su J. The Pathogenesis of sepsis and potential therapeutic targets[J]. Int J Mol" Sci, 2019, 20(21): 5376.
Jarczak D, Kluge S, Nierhaus A. Sepsis—pathophysiology and therapeutic concepts[J]. Front Med, 2021, 8: 628302.
文章编号:1001-8689(2024)09-0986-09
收稿日期:2023-11-27
基金项目:北京市属医院科研培育项目(No. PX2020038)
作者简介:陈姝璇,女,生于2002年,主要研究方向为临床药学,E-mail: zzjzdg@126.com
*通信作者,E-mail: xiangrongbai@163.com
