四川地区鲍曼不动杆菌、医院不动杆菌及皮特不动杆菌实验室检出情况与耐药性分析
2024-12-31黄湘宁 刘鑫 龙姗姗 喻华


摘要:目的 分析四川省细菌耐药监测网2021—2023年间鲍曼不动杆菌、医院不动杆菌以及皮特不动杆菌各成员单位分离鉴定及报告情况,以及各菌株科室、标本分布和抗菌药物耐药性差异,为临床微生物菌种鉴定以及临床抗菌药物选择提供参考。方法 利用WHONET5.6软件对2021—2023年四川省细菌耐药监测网成员共111家单位上报数据中上述3种细菌的科室分布、标本及药敏结果数据进行比较分析。并通过问卷星对四川省细菌耐药监测核心网成员单位进行基质辅助激光基质电离飞行时间质谱仪使用情况的调查。结果 本次研究共纳入51918株细菌,其中鲍曼不动杆菌占98.6%,皮特不动杆菌占1.2%,医院不动杆菌占0.2%。111家医院中仅7家医院(6.3%)有医院不动杆菌和皮特不动杆菌的报告。3种细菌主要分离于呼吸道样本,鲍曼不动杆菌和医院不动杆菌主要分离自ICU、呼吸内科和神经内科,皮特不动杆菌主要分离自呼吸内科、神经外科和外科。鲍曼不动杆菌对所有抗菌药物耐药性均显著高于医院不动杆菌和皮特不动杆菌。结论 鲍曼不动杆菌复合群由于通过生化反应难以进行区分,造成微生物实验室通常并未区分至菌种,但由于上述3种细菌样本来源、分离科室以及耐药性均有明显差异,提示微生物实验室应尽量使用基质辅助激光基质电离飞行时间质谱仪对菌种进行准确鉴定并加强耐药监测,以指导临床合理经验用药。
关键词:鲍曼不动杆菌;皮特不动杆菌;医院不动杆菌;准确鉴定;MOLDI-TOF
中图分类号:R978.1 文献标志码:A
Laboratory detection and drug resistance analysis of Acinetobacter baumannii, Acinetobacter nosocomialis and Acinetobacter pitt in Sichuan area
Huang Xiangning, Liu Xin, Long Shanshan, and Yu Hua
(Sichuan Academy of Medical Sciences amp; Sichuan Provincial People's Hospital (Affiliated Hospital of University of Electronic Science and Technology of China), School of Medince UESTC, Chengdu 610072)
Abstract Objective To analyze the isolation, identification and reporting of Acinetobacter baumannii, Acinetobacter nosocomialis and Acinetobacter pittii in the member units of the Sichuan Antimicrobial Surveillance Network from 2021 to 2023, as well as the distribution of strains in departments, the distribution of specimen sources, and the differences in antimicrobial resistance, in order to provide a reference for the isolation of clinical strains and the selection of clinical antimicrobial agents. Methods The use by matrix-assisted laser desorption ionization-time of flight mass spectrometry was conducted by questionnaire survey among the member units of the core network of the Sichuan Antimicrobial Surveillance Network. Comparative analysis of departmental distribution, specimen, and antimicrobial susceptibility result data of the above three bacteria in the data reported by a total of 111 members of the Sichuan Antimicrobial Surveillance Network from 2021 to 2023 was performed using WHONET 5.6 software. Results A total of 51,918 clinical strains were included in this study, of which A. baumannii accounted for 98.6%, A. pittii for 1.2% and A. nosocomialis for 0.2%. Only 7 hospitals (6.3%) out of 111 hospitals had reports of A. nosocomialis and A. pittii. The three bacteria were mainly isolated from respiratory samples, A. baumannii and A. nosocomialis were mainly isolated from intensive care, respiratory medicine and neurology, and A. pittii was mainly isolated from respiratory medicine, neurosurgery and surgery. The resistance rate of A. baumannii was significantly higher than that of A. nosocomialis and A. pittii. Conclusion The A. baumannii complex is difficult to differentiate by biochemical reactions, resulting in microbiological laboratories usually not differentiating to strains. Due to the obvious differences between A. baumannii, A. nosocomialis and A. pittii in terms of isolation samples, isolation departments and antimicrobial resistance, therefore, clinical microbiology laboratories should use a variety of techniques to accurately identify relevant strains of the A. baumannii complex in order to guide rational empirical clinical use.
Key words Acinetobacter baumannii; Acinetobacter pittii; Acinetobacter nosocomialis; Accurate identification; MALDI-TOF
众所周知,鲍曼不动杆菌引起的院内获得性感染已经成为临床治疗非常棘手的问题,由于泛耐药鲍曼不动杆菌的不断增加且缺乏有效的治疗药物,世界卫生组织已将碳青霉烯耐药鲍曼不动杆菌列为最迫切需要预防和研发新的治疗药物的细菌[1],足见该菌在临床的重要地位。但由于鲍曼不动杆菌(Acinetobacter baumannii, ABA)、皮特不动菌(Acinetobacter pittii, APT)、医院不动杆菌(Acinetobacter nosocomialis, ANO)、乙酸钙不动杆菌(Acinetobacter calcoaceticus,ACA)难以通过目前临床微生物实验室常用的自动化细菌鉴定系统加以区分,无法准确鉴定至菌种,上述菌种通常均被鉴定为鲍曼不动杆菌复合群(Acinetobacter baumannii complex, ABC),并以鲍曼不动杆菌(ABA)上报至全国细菌耐药监测网(CARSS)。而基质辅助激光基质电离飞行时间质谱仪(Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry, MALDI-TOF MS,简称质谱仪)可将其鉴定至菌种。值得关注的是有文献报道鲍曼不动杆菌、医院不动杆菌及皮特不动杆菌感染患者的临床特点及耐药性存在较大差异[2-3],菌种的准确鉴定可能会影响临床的抗感染治疗。本研究回顾性分析了四川省细菌耐药监测网成员单位2021—2023年间对上述3种细菌的分离情况,并比较了各自的科室分布、样本来源分布以及耐药性差异,以期了解四川省临床微生物实验室针对鲍曼不动杆菌、医院不动杆菌及皮特不动杆菌菌种鉴定的情况,以及对临床诊疗的影响。
1 材料与方法
1.1 细菌来源
收集2021—2023年四川省细菌耐药监测网共111所核心网成员单位上报数据中皮特不动杆菌(Acinetobacter pittii, APT)、医院不动杆菌(Acinetobacter nosocomialis, ANO)以及鲍曼不动杆菌(Acinetobacter baumannii, ABA)菌株耐药监测数据(剔除同一患者同一部位相同菌种重复分离菌株),菌株收集按照相应年度的四川省细菌耐药监测网监测方案进行。经过系统自动审核和人工审核后纳入数据分析的分离菌株数总计为51918株。
1.2 细菌鉴定及药敏试验
各成员单位多采用自动化鉴定及药敏系统和纸片扩散法进行细菌鉴定和药敏试验,部分实验室使用质谱仪进行菌种鉴定。药敏试验参照美国临床实验室标准化协会(Clinical Laboratory Standard Institute, CLSI)M02及M07[4-5]推荐的方法进行。质控菌株包括大肠埃希菌ATCC 25922、大肠埃希菌ATCC 35218和铜绿假单胞菌ATCC 27853等。药敏结果参照CLSI M100[6]细菌药敏折点进行判读,其中头孢哌酮/舒巴坦参照头孢哌酮折点标准判读,替加环素参考美国食品药品监督管理局(Food and Drug Administration, FDA)解释标准判读。质控菌株药敏结果在控,研究菌株结果方可纳入数据分析。
通过问卷星对四川省细菌耐药监测网核心中的83家医院进行质谱仪使用情况调查。
1.3 数据统计方法
鉴定及药敏所得结果用WHONET 5.6软件进行分析,同一患者同一部位相同细菌仅纳入第一株。使用SPSS 26.0进行统计分析。采用R×C χ2检验(R×C χ2 Tests)将3种细菌对不同抗菌药物耐药率进行比较,Plt;0.05,表明差异有统计学意义。采用χ2分割法,按照α=0.017的检验水准进行两两比较。
2 结 果
2.1 细菌分布
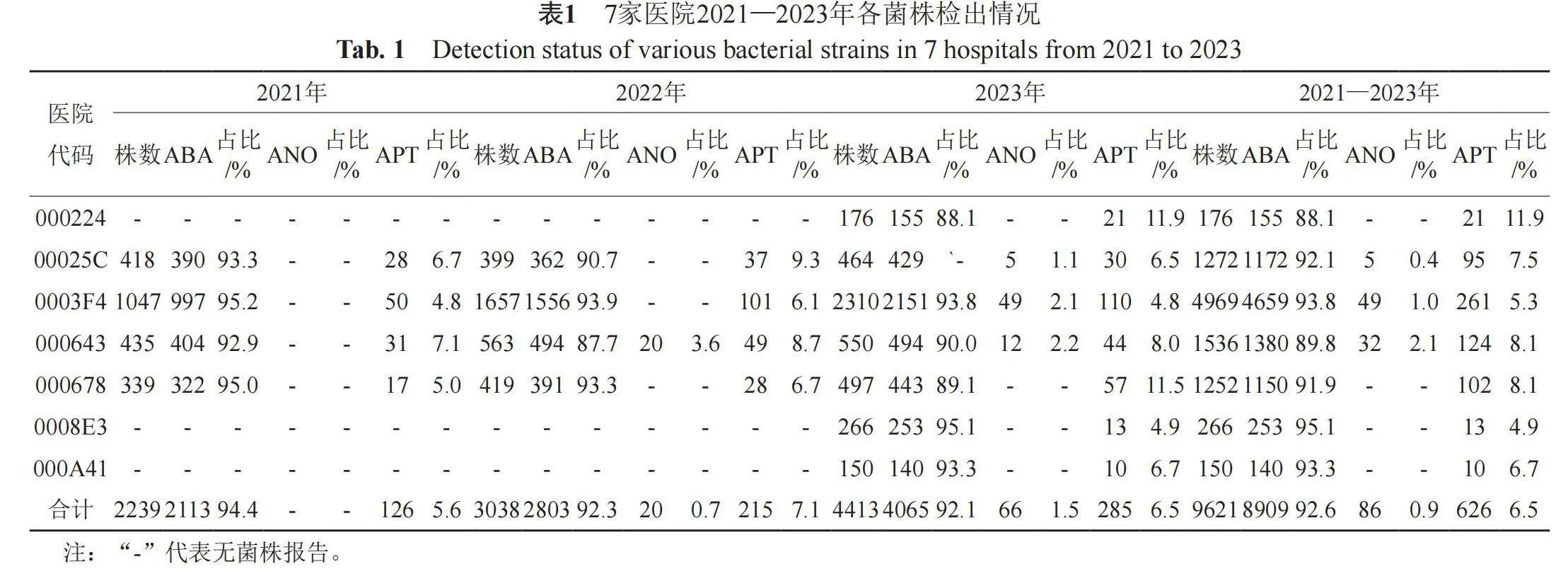
按患者首次分离菌株进行统计分析,2021—2023年间四川省细菌耐药监测网111家核心网成员单位共收集医院不动杆菌、皮特不动杆菌及鲍曼不动杆菌51918株 ,其中医院不动杆菌86株(86/51918,0.2%),皮特不动杆菌626株(626/51918, 1.2%),鲍曼不动杆菌51206株(51206/51918, 98.6%)。
111家医院中,2021年仅4家医院检出皮特不动杆菌,占所有监测单位的3.6%(4/111);2022年仍仅4家医院检出皮特不动杆菌,其中仅1家检出医院不动杆菌,占所有监测单位的0.9%(1/111);2023年检出皮特不动杆菌的医院数增至7家,占所有监测单位的6.3%(7/111),其中3家检出医院不动杆菌,占所有监测单位的2.7%(3/111)。
7家检出皮特不动杆菌及医院不动杆菌的医院中,皮特不动杆菌检出占比为5.3%~11.9%,医院不动杆菌检出占比为0~2.1%。7家医院3年间鲍曼不动杆菌的检出占比为92.6%,皮特不动杆菌检出占比为6.5%,医院不动杆菌检出占比为0.9%。各医院2021—2023年各菌株检出情况见表1。
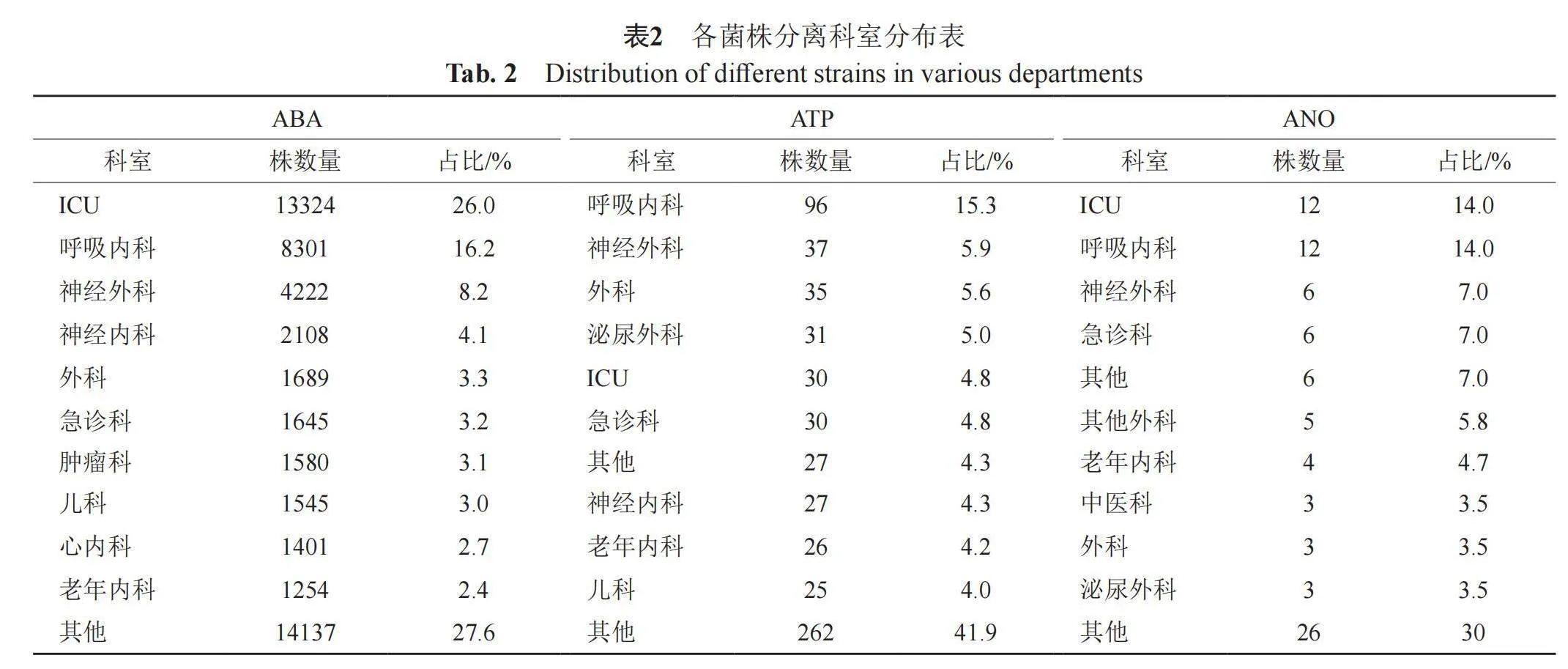
2.2 各菌株分离科室分布情况
各菌分离主要科室占比略有所差异,鲍曼不动杆菌主要分离至重症监护病房(ICU)(26%)、呼吸内科(16.2%)以及神经外科(8.25%),皮特不动杆菌主要分离自呼吸内科(15.3%)、神经外科(5.9%)以及普通外科(5.6%),医院不动杆菌主要分离至ICU(14.0%)、呼吸内科(14.0%)以及神经外科(7.0%),详见表2。
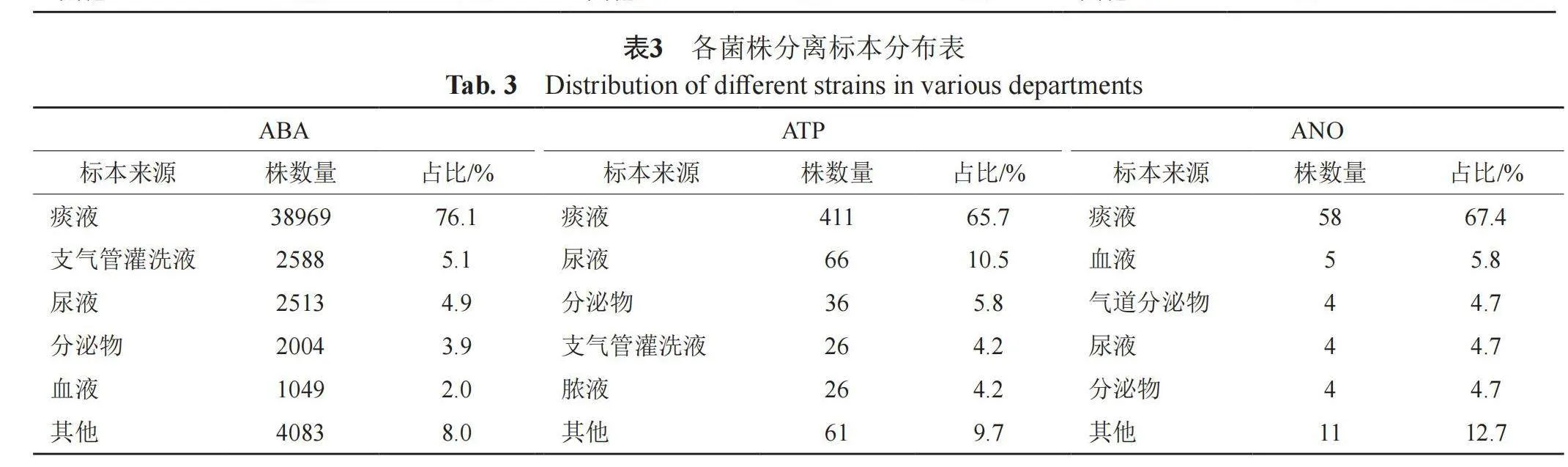
2.3 各菌株分离标本分布情况
各菌主要标本来源占比有一定差异,但仍以呼吸道样本为主。其中鲍曼不动杆菌主要分离至痰液(76.1%)、支气管灌洗液(5.1%)及尿液(4.9%);皮特不动杆菌主要分离自痰液(65.7%)、尿液(10.5%)以及分泌物(5.8%);医院不动杆菌主要分离痰液(67.4%)、血液(5.8%)以及气道分泌物(4.7%),详见表3。
2.4 各菌对抗菌药物耐药情况
鲍曼不动杆菌对各类抗菌药物的耐药性均明显高于皮特不动杆菌及医院不动杆菌,比较而言,皮特不动杆菌对抗菌药物的敏感性最高。以亚胺培南和美罗培南为例,鲍曼不动杆菌的耐药率分别为47.3%和49.5%,皮特不动杆菌为10.1%和10.2%,医院不动杆菌分别为25.6%和27.2%。采用R×C χ2检验(R×C χ2 Tests)对3者各抗菌药物耐药率进行比较,结果显示3种细菌除替加环素外的其他抗菌药物的耐药性均有统计学意义(Plt;0.001)。用χ2分割法,按照α=0.017的检验水准进行两两比较,发现仅APT组与ANO组的头孢曲松检出差异无统计学意义(P=0.074),其余药物的耐药性均有统计学差异。各菌株对不同抗菌药物药敏情况见表4。
2.5 各成员单位质谱仪使用情况
由于条件所限,部分医院并未配置质谱仪进行菌种鉴定,部分医院仅对部分少见罕见菌种进行质谱鉴定,故无法准确区分鲍曼不动杆菌复核群各菌种。本次共83家核心网成员单位参与质谱仪使用情况调查,其中47%(39/83)未配置质谱仪,自2019年(9.6%,8/83)起逐年有医院优先使用质谱仪进行细菌鉴定,至2023年共36.1%(30/83)的医院优先使用质谱仪进行细菌鉴定。详见表5。
3 讨论
不动杆菌属细菌广泛分布于自然界,例如:水、土壤、食物以及人类或动物的体表,其中的鲍曼不动杆菌由于可以很好地存活于医院的环境中,且通常具有极高的耐药性,其引起的院内获得性感染成为了临床非常棘手的问题,尤其是呼吸机相关性肺炎和血流感染具有很高的发病率和死亡率[7]。然而随着微生物检测手段的进步,皮特不动杆菌、医院不动杆菌逐渐被发现同样是引起院内获得性感染的重要病原体[8],其与鲍曼不动杆菌的亲缘关系接近,并且在临床引起的感染类似,但据文献报道鲍曼不动杆菌耐药性更为显著且和医院内流行性播散关系更为密切,并且可能与全身感染患者较高的病死率相关[2],这提示临床微生物室需要关注鲍曼不动杆菌复合群菌种的准确鉴定。
目前微生物实验室通常使用以生理生化特性为依据的传统细菌鉴定系统进行对不动杆菌属进行鉴定,并不能很好地区分其菌种,以法国BioMérieux公司VITEK-2-COMPACT系统为例,其仅能鉴定至ABC,需要补充生化试验(如44和41 ℃生长试验及丙二酸盐试验)[9]。目前随着MALDI-TOF MS技术的应用,对鲍曼不动杆菌、皮特不动杆菌和医院不动杆菌的代表性菌株的光谱峰分析,它们的蛋白质特征之间有足够的差异,可以使用质谱仪进行准确的识别,并具有极高的(98.75%)重复性[10]。
本研究通过对四川省细菌耐药监测网成员单2021—2023年上报数据对皮特不动杆菌、医院不动杆菌与鲍曼不动杆菌的报告医院、分离科室、分离部位以及耐药性进行分析,发现常规分离并报告皮特不动杆菌及医院不动杆菌的医院比例极低,医院不动杆菌的检出比例仅为0.2%,皮特不动杆菌的检出比例为1.2%,2020年前未有皮特不动杆菌和医院不动杆菌菌株的上报,2021年仅4家医院(3.6%)报告皮特不动杆菌,2023年也仅有7家医院(6.3%)有不动杆菌及皮特不动杆菌的报告,说明绝大部分医院未能很好地将3种细菌进行菌种区分。根据问卷调查显示,约半数的医院尚未配置质谱设备,约20%的医院仅针对少见、罕见细菌进行质谱鉴定,无法对鲍曼不动杆菌复合群进行菌种区分。优先使用质谱仪鉴定的医院也仅有不足1/3的医院对3种细菌进行了区分报告,究其原因,可能是由于实验室未对皮特不动杆菌和医院不动杆菌进行准确的WHONET对码有关。
鲍曼不动杆菌、皮特不动杆菌及医院不动杆菌的检出科室集中在ICU、呼吸内科及神经外科,各菌分离主要科室占比略有所差异。各菌主要标本来源以呼吸道样本占主要地位,尤其是鲍曼不动杆菌占到了81.2%。在本统计数据中,皮特不动杆菌及医院不动杆菌仅19株分离自血液样本,这与国内外多项研究结果相差甚远,据报道皮特不动杆菌和医院不动杆菌引起的鲍曼不动杆菌复合群血流感染占到了相当的比例,如中国台湾24%~25%、美国29%、韩国50%以及挪威66%[2,8,11-13]。再次说明可能是由于鉴定手段的限制以及菌名代码未准确匹配导致了上述两种细菌检出率偏低,警示临床实验室强化能力建设的紧迫性。
通过对3种不动杆菌药敏结果的比较,差异显著,鲍曼不动杆菌对各类抗菌药物的耐药性均明显高于皮特不动杆菌及医院不动杆菌。除替加环素外,鲍曼不动杆菌比皮特不动杆菌对各药物的耐药率均高30%~40%,比医院不动杆菌对各药物的耐药率均高10%~20%,尚不排除纳入统计的鲍曼不动杆菌中包含了部分未被准确鉴定的皮特不动杆菌和医院不动杆菌,低估了其耐药率。Chen等[14]针对重症监护患者的一项研究报告称,鲍曼不动杆菌和医院不动杆菌的多重耐药率差异较大,分别为86%和21%,与本次研究结果一致。鲍曼不动杆菌表现出较其他两种菌种更高的抗菌药物耐药率,可能是由于不同的生物学特征,如黏附真核细胞的能力或多药耐药基因表达的差异[14]。
耐药监测数据的主要功能之一是用于临床抗感染经验治疗,菌种的准确鉴定是临床评估病原体以及其耐药性的重要前提。尤其是随着宏基因组测序和靶向测序等先进技术在临床感染性诊断中的广泛应用,临床经验治疗更依赖于耐药监测数据的准确性。鲍曼不动杆菌复合群中的菌种由于其生化特性的接近造成了其用传统细菌鉴定系统无法准确区分菌种的局限性,但由于其不同菌种的致病性[14]和抗菌药物耐药性存在的巨大差异,提示各医疗单位应对该问题引起足够重视,尽可能采用质谱的方法对其进行准确的菌种鉴定及报告,这对临床抗感染治疗和细菌耐药监测工作都具有十分重要的意义。
参 考 文 献
Asokan G V, Ramadhan T, Ahmed E, et al. 2019. WHO global priority pathogens list: A bibliometric analysis of Medline-PubMed for knowledge mobilization to infection prevention and control practices in Bahrain[J]. Oman Med J, 2019, 34(3): 184-193.
Park K H, Shin J H, Lee S Y, et al. The clinical characteristics, carbapenem resistance, and outcome of Acinetobacter bacteremia according to genospecies[J]. PLoS One, 2013, 8(6): e65026.
邓德耀, 袁文丽, 张唤, 等. 皮特不动杆菌、医院不动杆菌感染的临床特点及同源性[J]. 中国感染控制杂志, 2019, 18(1): 6-11.
CLSI M02 Performance Standards for Antimicrobial Disk Susceptibility Tests, 13th Edition ISBN Number: 1-56238-834-837.
CLSI M07 Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically, 11th Edition ISBN Number: 1-56238-836-3.
CLSI. Performance Standards for Antimicrobial Susceptibility Testing. 33th ed. CLSI supplement M100. Wayne, PA: Clinical and Laboratory Standards Institute, 2023.
Alrahmany D, Omar A F, Alreesi A, et al. Acinetobacter baumannii infection-related mortality in hospitalized patients: Risk factors and potential targets for Clinical and Antimicrobial Stewardship Interventions[J]. Antibiot (Basel), 2022, 11(8): 1086.
Wisplinghoff H, Paulus T, Lugenheim M, et al. Nosocomial bloodstream infections due to Acinetobacter baumannii, Acinetobacter pittii and Acinetobacter nosocomialis in the United States[J]. J Infect, 2012, 64(3): 282-290.
(美)KAREN C.CARROLL, (美)MICHAEL A.PFALLER原著; 王辉, 马筱玲, 钱渊, 等主译. 临床微生物学手册 第12版 第1卷[M]. 北京: 中华医学电子音像出版社, 2021.03.
Espinal P, Seifert H, Dijkshoorn L, et al. Rapid and accurate identification of genomic species from the Acinetobacter baumannii (Ab) group by MALDI-TOF MS[J]. Clin Microbiol Infect, 2012, 18(11): 1097-1103.
Karah N, Haldorsen B, Hegstad K, et al. Species identification and molecular characterization of Acinetobacter spp. blood culture isolates from Norway[J]. J Antimicrob Chemother, 2011, 66(4): 738-744.
Ko W C, Lee N Y, Su S C, et al. Oligonucleotide array-based identification of species in the Acinetobacter calcoaceticus-A. baumannii complex in isolates from blood cultures and antimicrobial susceptibility testing of the isolates[J]. J Clin Microbiol, 2008, 46: 2052e9. 11.
Lee Y C, Huang Y T, Tan C K, et al. Acinetobacter baumannii and Acinetobacter genospecies 13TU and 3 bacteremia: Comparison of clinical features, prognostic factors and outcomes[J]. J Antimicrob Chemother 2011, 66: 1839e46.
Chen L, Yuan J, Xu Y, et al. Comparison of clinical mani festations and antibiotic resistances among three genospecies of the Acinetobacter calcoaceticus-Acinetobacter baumannii complex[J]. PLoS One, 2018, 13(2): e0191748.
