他扎罗汀凝胶处方及微观结构特性评价的比较研究
2024-12-31沈丹丹 吴群 姜学美 沈川 许娟 侯立新





摘要:目的 为他扎罗汀凝胶一致性评价处方工艺设计及关键质量属性评价提供指导。方法 逆向解析原研产品ZORAC®和国产仿制药产品乐为®处方,比较处方(Q1)和关键辅料的处方用量(Q2)差异;并采用光学显微镜和流变仪考察粒度、流变特性等微观结构特性(Q3)差异。结果 国产仿制药产品乐为®与原研产品ZORAC®均为“非牛顿流体”,均属于弱性凝胶,但在稳定剂种类及用量、活性成分晶体形态、流变特性、pH值等5个关键质量属性方面差异显著,说明两者产品Q1、Q2及Q3均不一致,推测Q1、Q2和工艺设计不同引起Q3差异。结论 本研究可用于指导国内生产企业优化处方工艺设计,为皮肤外用半固体制剂一致性评价提供研究思路。
关键词:他扎罗汀凝胶;处方(Q1);处方用量(Q2);微观结构特性(Q3);流变特性
中图分类号:R9 文献标志码:A
Comparative study on the ingredients and microstructure arrangement of tazarotene gel
Shen Dandan1, Wu Qun1 , Jiang Xuemei1, Shen Chuan2, Xu Juan 3, and Hou Lixin1
(1 Chongqing Institute for Food and Drug Control, NMPA Key Laboratory of Quality Monitoring of Anaesthetic and Psychotropic Substances, Chongqing 401121; 2 Chongqing Qijiang District Hospital, Chongqing 401420;
3 Chongqing Renze Pharmaceutical Technology Co., Ltd , Chongqing 400021)
Abstract Objective To provide guidance for the formulation process design and the evaluation of critical quality attributes of tazarotene gel consistency. Methods The ingredients of the original product ZORAC® and domestic generic drug 乐为® were analysized by reverse engineering, and the differences between qualitative (Q1) and quantitative (Q2) compositions of inactive ingredients were compared. The differences in microstructure arrangement (Q3) were investigated by an optical microscope and rheometer, such as particle size and rheological properties. Results Both ZORAC® and 乐为® were “non-Newtonian fluids” and belong to weak gels. However, there were significant differences in five critical quality attributes, such as the type and amount of stabilizer, crystal morphology of the active ingredient, rheological properties, and pH value, which indicated that the Q1, Q2, and Q3 of the two products were inconsistent. It was suggested that the wide variations in Q3 were caused by the differences in Q1, Q2, and process design. Conclusion It was significant for this study to optimize formulation development, and provide research ideas for consistency evaluation of semisolid preparations for topical skin use.
Key words Tazarotene gel; Qualitative (Q1); Quantitative (Q2); Microstructure arrangement (Q3); Rheological properties
他扎罗汀凝胶(tazarotene gel)是由Allergan Inc公司开发的半透明水性凝胶剂,商品名为TAZORAC®(美国)/ZORAC®(欧洲),于1997年6月13日在美国上市,主要用于治疗斑状牛皮癣和寻常性痤疮。本品具有2个浓度规格,分别为0.05%和0.1%,原研未进口销售。国内有1家生产企业,商品名为炔维®(0.1%规格)和乐为®(0.05%规格)。对于皮肤局部外用仿制药,目前各国监管机构均倾向于与FDA保持一致,即保持最大程度的处方组成(Q1)、处方用量(Q2)及微观结构特性(Q3)等同,可提出临床豁免申请[1-3]。根据ZORAC®说明书[4-5],本品含有炔基,稳定性较差,同时本品的水溶性极差,在处方中使用了多种助溶剂和稳定剂,处方设计较为复杂,因此该产品不同处方及工艺可能导致具有不同的表观和功能特性,进而影响药物的安全性和有效性。
本研究以ZORAC®(0.05%规格)为参比制剂,逆向解析Q1及关键功能性辅料稳定剂苯甲醇、丁羟基茴醚、丁羟基甲苯的Q2,考察Q3的质量属性包括活性成分粒度、流变特性等,并与国产仿制药产品乐为®比较差异。根据国内外最新的外用半固体制剂技术指导原则,项目组完成了曲安奈德益康唑乳膏剂处方生产工艺解析、关键质量属性评价,取得了一定研究成果[6]。开展他扎罗汀凝胶剂Q1、Q2及Q3评价研究,有助于指导生产企业优化本品种处方工艺设计,实现豁免复杂的生物等效性研究;同时,本项目组建立了皮肤局部外用半固体制剂乳膏、凝胶剂等不同剂型评价的研究基础,也为国内皮肤局部外用仿制药开展一致性评价研究提供思路和方法。
1 仪器与试剂
1.1 仪器
U3000型高效液相色谱仪(Thermo);K51502653型电子天平(Sartorius AG);光学显微镜(Olympus Corporation);HAAKE MARS流变仪(Thermo);S220-K酸度计(Mettler Toledo)。
1.2 药物与试剂
苯甲醇对照品(中国食品药品检定研究院,批号:190019-201903,含量99.9%);丁羟基甲苯对照品(中国食品药品检验检测研究院,批号:510142-201701,含量100.0%);丁羟基茴醚对照品(默克公司,批号:K52622823,含量100.0%);他扎罗汀凝胶(厂家A,商品名乐为®,规格0.05%,批号:016210020);他扎罗汀凝胶(Allergan Inc公司,商品名ZORAC®,规格0.05%,批号:T1323);乙酸铵为分析纯,乙腈为色谱纯。
2 方法与结果
2.1 Q1分析
根据ZORAC®说明书[1-2]以及企业提供的乐为®处方工艺信息,由表1可见,国内仿制药乐为® Q1与ZORAC®均不一致,在抗氧剂、抑菌剂及助溶剂种类等方面差异显著。
2.2 Q2分析(苯甲醇、丁羟基茴醚及丁羟基甲苯的含量测定)
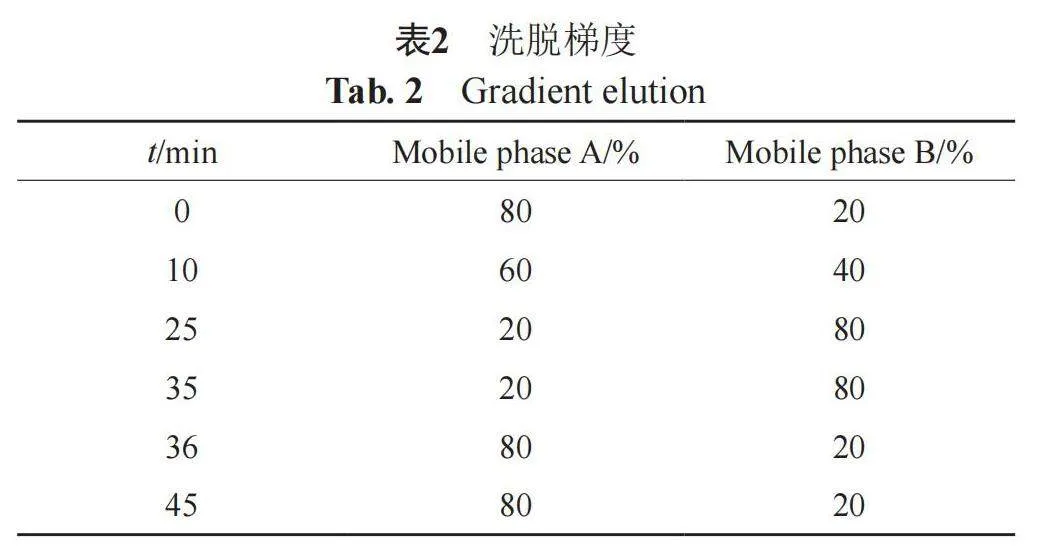
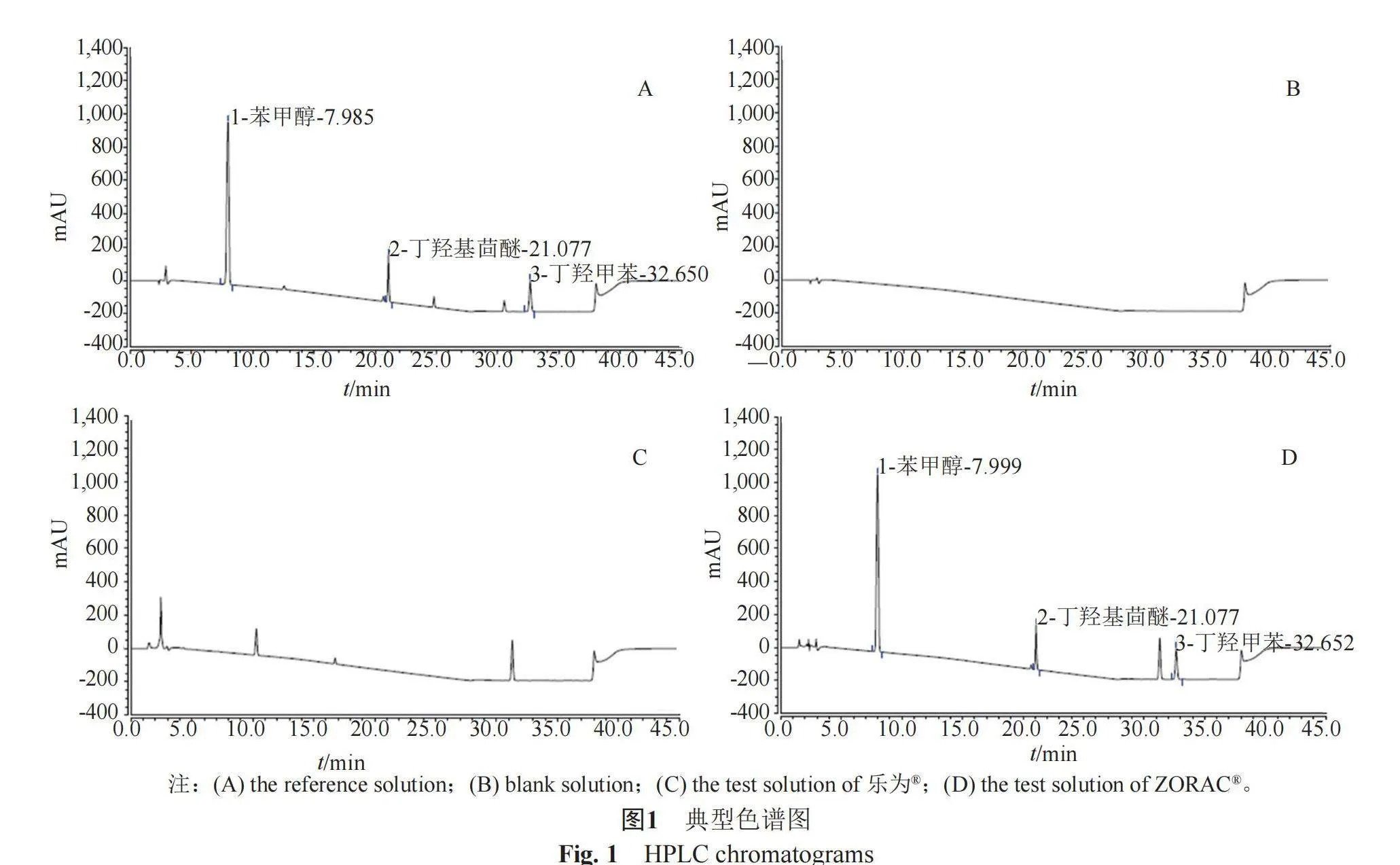
色谱条件:十八烷基硅烷键合硅胶为填充剂(ACE C18,250 mm×4.6 mm,5 μm),以0.02 mol/L 乙酸铵为流动相A,以乙腈为流动相B,按表2梯度洗脱;检测波长218 nm;柱温35 ℃;流速1.0 mL/min;进样量20 µL。
供试品溶液的配制:取本品0.5 g,精密称定,置10 mL量瓶中,加80%乙腈适量,充分振摇使溶解,用80%乙腈稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。
对照品混合溶液的配制:取苯甲醇对照品约250 mg,置25 mL量瓶中,用80%乙腈溶解并稀释至刻度,摇匀,作为对照品贮备溶液(1);取丁羟基茴醚及丁羟基甲苯对照品各约10 mg,置同一10 mL量瓶中,用80%乙腈溶解并稀释至刻度,作为对照品贮备溶液(2);精密量取对照品贮备溶液(1)1 mL与对照品贮备溶液(2)0.5 mL,置同一20 mL量瓶中,用80%乙腈稀释至刻度,摇匀,作为对照品混合溶液。
结果表明(典型色谱图见图1):ZORAC®中苯甲醇、丁羟基茴醚与丁羟基甲苯的含量分别为1.03%(g/g)、0.049%(g/g)、0.049%(g/g)。乐为®未检出苯甲醇、丁羟基茴醚和丁羟基甲苯。
2.3 Q3分析
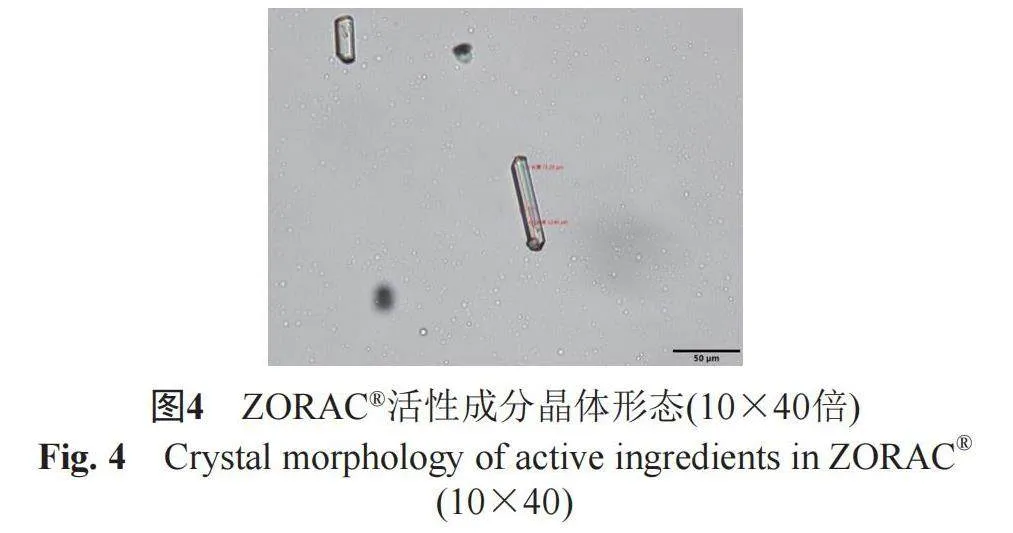
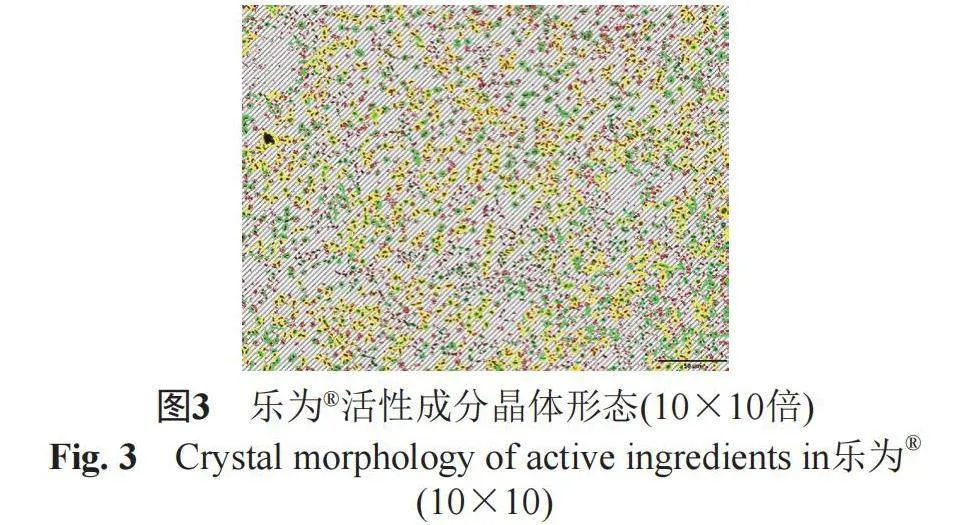
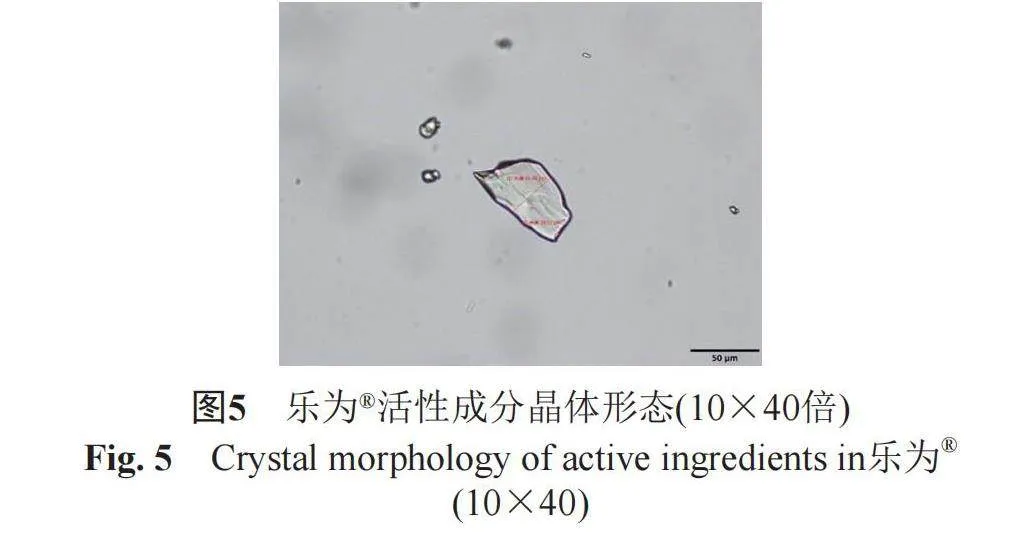
2.3.1 药用活性成分的晶体形态测定
取本品适量,置于载玻片上涂成薄层,覆以盖玻片,注意防止气泡进入,立即采用光学显微镜在10×10(图2~3)、10×40(图4~5)倍下观察活性成分的晶体形态,上下左右移动载物台,检视多个视野,使颗粒总数至少1000个。结果表明,ZORAC®中活性成分主要为柱状晶体,颗粒平均直径为5.06 µm,5 µm以下的颗粒比率为98.65%,5~10 µm之间的颗粒比率为1.35%;而邦力®中活性成分主要为不规则晶体,颗粒平均直径为6.2 µm,5 µm以下的颗粒比率为88.75%,5~10 µm之间的颗粒比率为11.25%。研究表明,虽然两种产品处方中均含有助溶剂,但均存在未完全溶解的活性成分混悬于凝胶基质中,ZORAC®产品中5 µm以下的颗粒比率明显高于邦力®,且颗粒平均直径更小。
2.3.2 流变特性研究
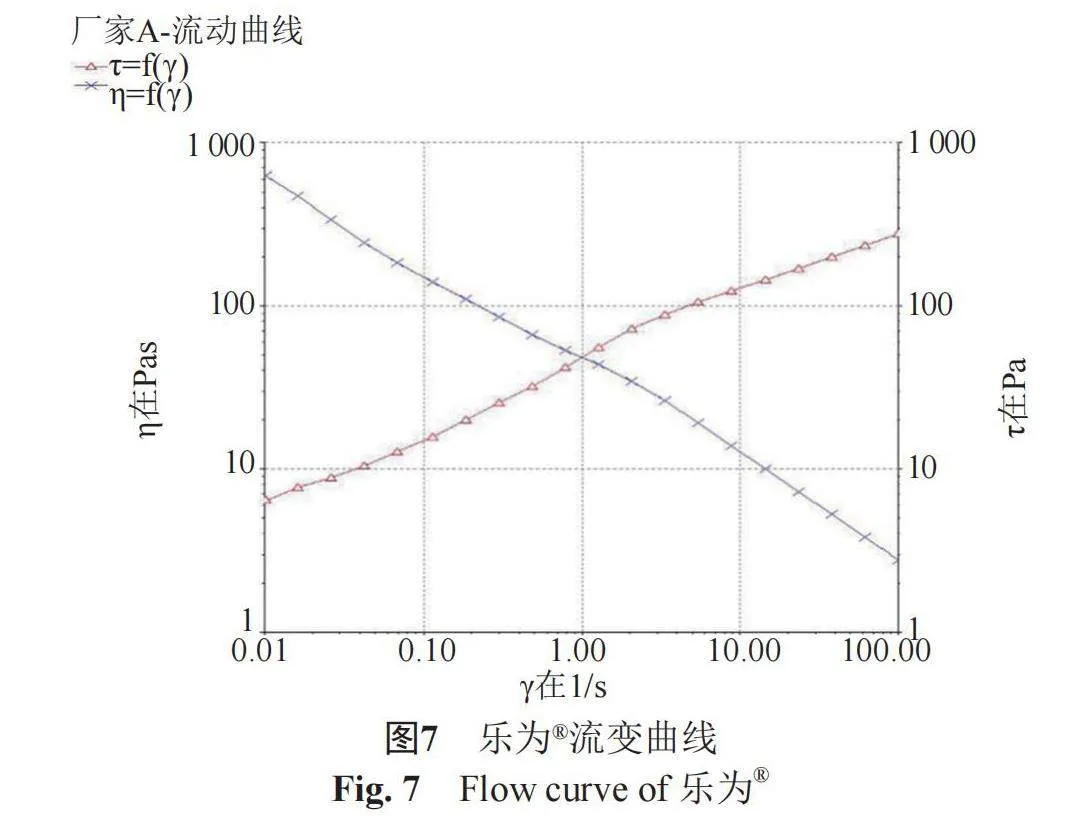
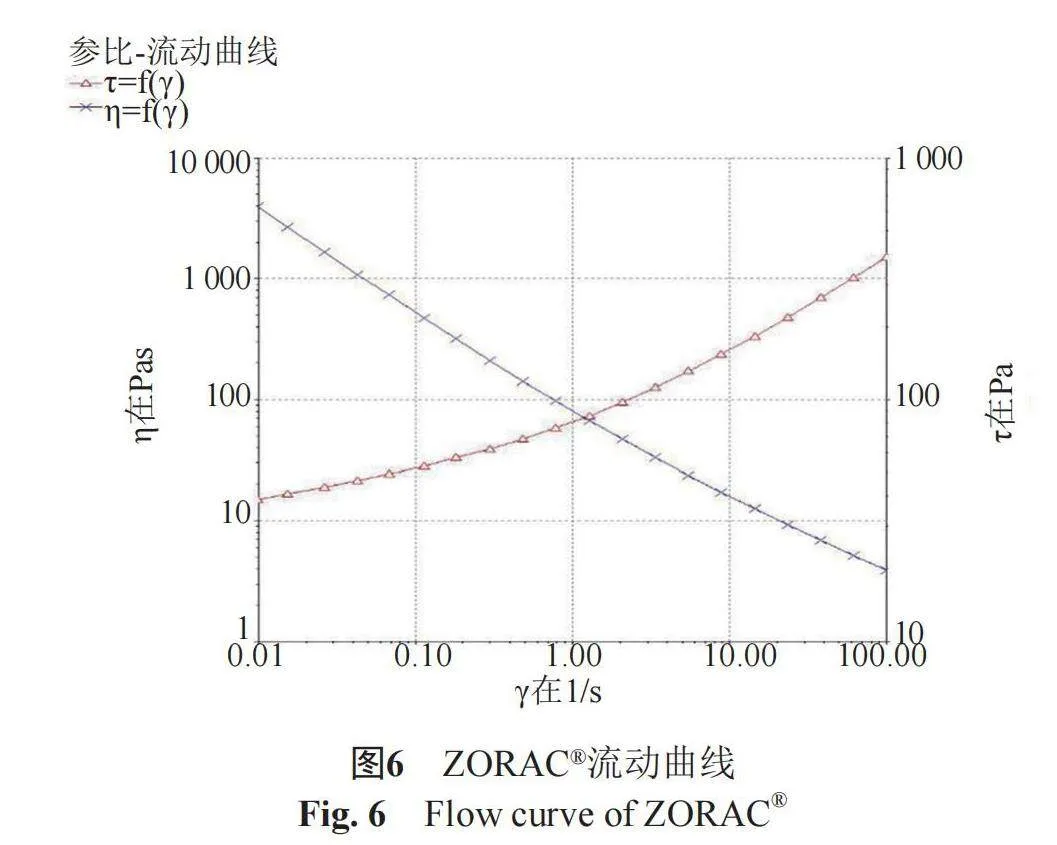
(1)" 稳态流动曲线" " 流动曲线能够反映体系黏度随剪切速率、剪切力随剪切速率的变化规律,属于静态流变学。黏度不受剪切速率影响的理想液体称作“牛顿流体”;反之,不具备这种“理想”流动特性的其他液体称作“非牛顿流体”[7-8]。剪切速率(1/s),扫描范围为0.01~100,温度、(25±1)℃。ZORAC®及乐为®的黏度(η,Pas)、剪切力(τ,Pa)随剪切速率(γ,1/s)变化的关系曲线分别见图6~7,流动曲线对比图见图8。结果表明,2种产品的表观黏度均随剪切速率的增加而减小,剪切力均随剪切速率的增加而增大,说明两者均为“非牛顿流体”。
采用OrginPro 9.1.0软件,对两条η=f(γ)曲线采用非线性最小二乘算法(列文伯格-马夸尔特法,levenberg marquardt算法)分别进行非线性拟合,P值(Probgt;F)=0lt;0.01,即在0.05显著性水平上,两条曲线具有显著性差异,ZORAC®与乐为®静态流变学不一致。
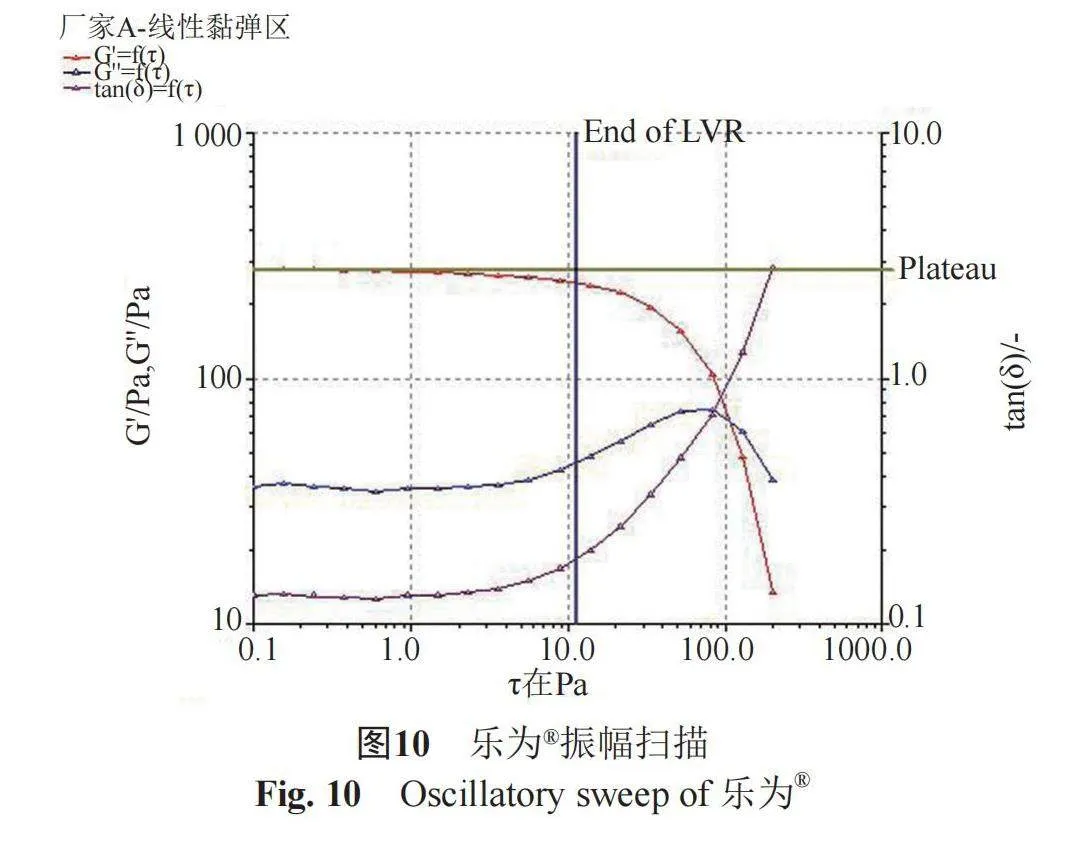
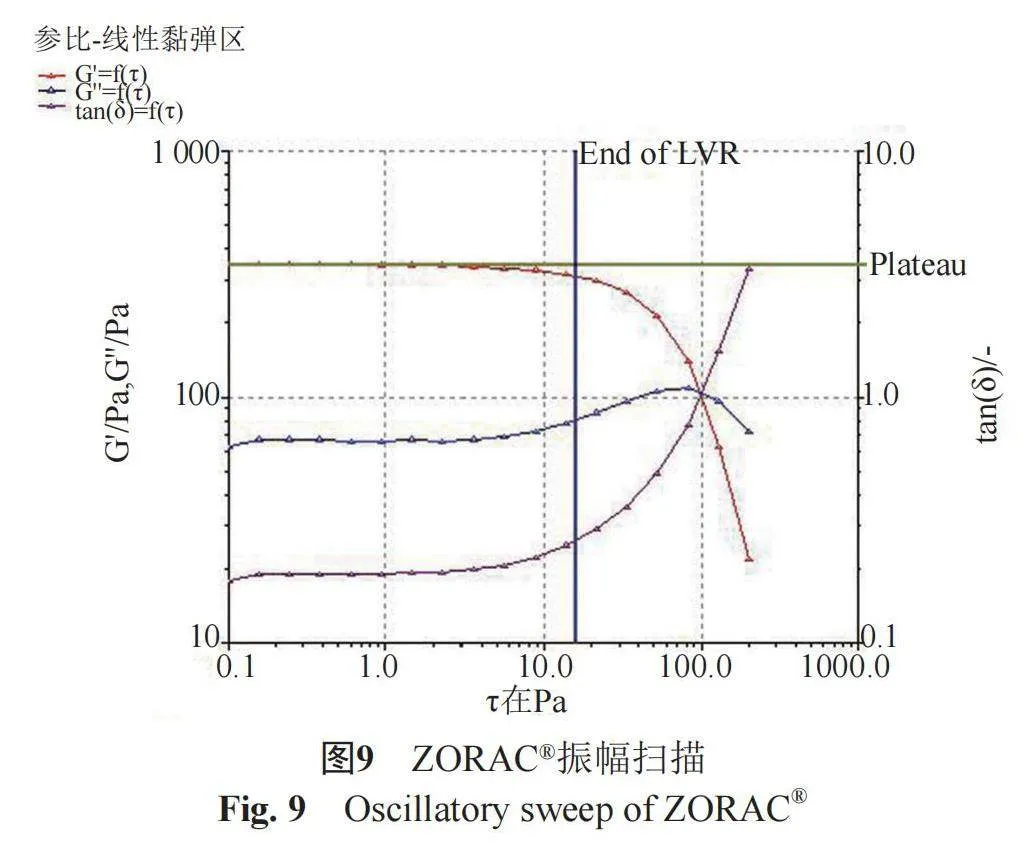
(2) 振幅扫描" " 固定扫描速率,观察弹性模量或黏性模量在不同应变条件下的变化情况,以确定样品的线性黏弹区范围,因为在线性黏弹区范围内的测量才能获得样品的特性流变学常数[7-8]。剪切力(τ,Pa)扫描范围为0.10~200 Pa,温度(25±1) ℃,采用P35/Ti型转子,振荡频率(f, Hz)为1 Hz,见图9~10。结果表明,ZORAC®在0~15.84 Pa范围内,弹性模量(G')和黏性模量(G'')均不随剪切力的改变而显著变化,提示该区域为本品的线性黏弹区;乐为®在0~11.25 Pa范围内,弹性模量(G')和黏性模量(G'')均不随剪切力(τ, Pa)的改变而显著变化,提示该区域为本品的线性黏弹区。
(3) 频率扫描" " 选择在线性黏弹区范围内的某个应变条件下,用不同的振荡频率扫描,观察线性黏弹区内G'、G''及损耗角正切值[tan(δ)]随着振荡频率(f,Hz)变化的情况,反应体系黏弹性的变化规律,属于动态流变学[4-5]。振荡频率扫描范围为0.1000~10.00 Hz,温度(25±1) ℃,采用P35/Ti型转子,剪切力为3 Pa,结果见图11~12。结果表明,随着频率增大,ZORAC®与乐为® G'、G''及tan(δ)均呈增大趋势,两种产品G'均大于G'',表明形成的凝胶为均弱凝胶,均以弹性为主,tan(δ)值越小,表明样品弹性越高,黏性越低[9]。
采用OrginPro 9.1=f(f)曲线采用非线性最小二乘算法(列文伯格-马夸尔特法,levenberg marquardt算法)分别进行非线性拟合,结果为P值(Probgt;F)=0lt;0.01,即在0.05显著性水平上,两条曲线具有显著性差异,说明ZORAC®与乐为®动态流变学不一致。
2.3.3 pH值
取本品各约2 g,分别加水30 mL溶解后,依法操作。ZORAC®与乐为®pH值分别为6.2和7.5,乐为®pH值更高,差异显著。
3 讨论
3.1 Q1与Q2的差异
根据国家药监局药审中心2021年3月16日发布的《皮肤外用化学仿制药研究技术指导原则(试行)》的通告(2021年第23号)[10],其中将处方中抑菌剂含量及抗氧剂含量作为关键质量属性之一,并指出仿制药与参比制剂的辅料在定性(Q1)和定量(Q2)上应相同,辅料的浓度差异不应超过±5%,会有助于保证仿制药与参比制剂质量的一致性。①根据ZORAC®说明书[11]公开的结果,ZORAC®中苯甲醇、丁羟基茴醚、丁羟基甲苯的处方用量分别为1.0%(g/g)、0.05%(g/g)、0.05%(g/g),处方设计中苯甲醇既为抑菌剂又为助溶剂,丁羟基茴醚和丁羟基甲苯作为抗氧剂,用于保护产品受辅料中残留过氧化物的影响,本研究测得结果分别为1.03%(g/g)、0.049%(g/g)、0.049%(g/g),与说明书一致;②国产仿制药乐为®均未检出苯甲醇、丁羟基茴醚和丁羟基甲苯,与调研结果一致,进一步说明乐为®与参比制剂抑菌剂及抗氧剂种类不一致。由于本品含炔基稳定性较差,提示处方中抑菌剂及抗氧剂差异可能引起产品质量的稳定性不一致;③另外,参比制剂处方中其他关键功能性辅料如聚山梨酯40、泊洛沙姆407与己二醇,其处方用量与体外释放性能的关系笔者将另外撰写文章分析。
3.2 Q3的差异
根据武余波等[12]对皮肤局部外用制剂Q3等同性研究技术要点解析,指出药物晶型表征、流变学、黏度、粒径、pH值等均属于Q3的关键质量属性,故本文对以上几个指标进行重点考察,结果表明:①虽然乐为®与参比制剂ZORAC®处方中均使用了助溶剂,但根据显微镜观察结果,两者基质中均存在未溶解的活性成分,ZORAC®基质内药用活性成分的晶体为细长柱状晶体,而国内仿制药乐为®中为粗大不规则形状的晶体,说明二者的晶体形态不同;另外,ZORAC®产品中5 µm以下的颗粒比率明显高于邦力®,且颗粒平均直径更小。②流变学研究结果表明,乐为®与参比制剂ZORAC®均为“非牛顿流体”,均属弱凝胶,但两者体系在静态流变学和动态流变学均存在显著差异,进一步说明两者辅料属性、处方工艺设计不同引起流变特性差异。另外,虽然已有相关文献报道了流变学评价在皮肤外用半固体制剂的应用[8,12],但仍缺乏标准化开发方法,本研究建立的凝胶剂流变特性测定方法,可为表征同类型制剂的流变学研究提供参考。③pH测定结果表明,乐为®产品中pH值明显高于ZORAC®,ZORAC®说明书[1-2]中指出在最后一步用氨丁三醇调节pH值,而乐为®产品是在第一步用氨丁三醇调节pH值(企业提供的处方工艺信息);④综上表明,两者产品Q3的差异可能是由于Q1、Q2以及工艺不同引起的。
3.3 小结
国产仿制药乐为®与参比制剂ZORAC®Q1和Q2明显不一致,因而Q3也存在显著性差异。特别是ZORAC®处方中使用的3种关键辅料聚山梨酯40、泊洛沙姆407与己二醇,已有专利报道该3种辅料会影响药物的溶解度和释放[13]。笔者已采用流通池法测定乐为®与ZORAC®体外释放度,结果表明,二者释放曲线存在显著性差异,体外释放行为不一致,ZORAC®体外释放明显快于乐为®,推测处方中助溶剂种类以及部分未溶解的活性成分晶体形态和颗粒平均直径是影响本品体外释放的因素之一,该研究结果与文献报道一致[13],笔者将另撰写文章分析其相关性。综上表明,按照《皮肤外用化学仿制药研究技术指导原则(试行)》[10]要求,建议国产他扎罗汀凝胶生产企业开展本品一致性评价研究,优化处方工艺,最大可能保持与参比制剂ZORAC®的Q1、Q2与Q3一致性,以申请豁免复杂的体内生物等效性研究,确保产品安全性和有效性。
参 考 文 献
Shah, Yacobi V P, Radulescu A, et al. A science based approach to topical drug classification system (TCS)[J]. Intern J Pharm," 2015, 491(1-2): 21-25.
郭涤亮, 徐萍蔚, 王亚敏. 皮肤局部外用仿制药质量等同性评价的一般考虑[J]. 中国新药杂志, 2018, 27(18): 2116-2120.
国家药品监督管理局药品审评中心. 新注册分类的皮肤外用仿制药的技术评价要求(征求意见稿)[EB/OL]. https://www.cde.org.cn/main/news/viewInfoCommon/bec4520b9d49718ce022c1e96fb6a450.2018-07-11/2020-10-22.
Allergan Pharmaceuticals Ireland. Summary of product characteristics for ZORAC 0.05%, gel[EB/OL]. http://www.mhra.gov.uk, 2018-08-31.
Allergan Pharmaceuticals Ireland. Summary of product characteristics for ZORAC 0.1%, gel[EB/OL]. http://www.mhra.gov.uk, 2018-08-31.
沈丹丹, 吴群, 沈川, 等. 曲安奈德益康唑乳膏处方及微观结构特性评价的比较研究[J]. 中国抗生素杂志, 2022, 47(7): 691-696.
郭佳欣, 张慧君, 刘鑫宇, 等. 玉米淀粉和马铃薯淀粉糊化后的流变性及热力学性质比较[J]. 中国果菜, 2022, 42(3): 1-5.
黄乐乐, 马晋隆, 王嘉明, 等. 流变学评价在皮肤局部外用半固体制剂处方开发中的应用进展[J]. 中国医药工业杂志, 2022, 53(5): 611-620.
Souto E B, Wissing S A, Barbosa C M, et al. Evaluation of the physical stability of SLN and NLC before and after in corporation into hydrogel formulations[J]. Eur J Pharm Biopharm, 2004, 58(1): 83-90.
国家药品监督管理局药品审评中心.《皮肤外用化学仿制药研究技术指导原则(试行)》的通告(2021年第23号)[EB/OL]. https://www.cde.org.cn/main/news/viewInfoCommon/4e790f4ad1cb21091e5a8bf4a107c535.2021-03-03/2023-03-16.
Allergan USA, Inc. Full prescribing information for TAZORAC®[EB/OL]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/020600s010lbl.pdf, 2018-04-16.
武余波, 黄乐乐, 卢望丁, 等. 皮肤局部外用制剂Q3等同性研究技术要点解析[J]. 中国医药工业杂志, 2022, 53(5): 601-610.
Charu P M, Calif F. Stable gel formulation for topical treatment of skin conditions: US, 5914334[P]. 1996-03-28.
