不同类型土壤接种根瘤菌对大豆共生固氮和根际氮转化的影响
2024-12-31张宗祥王军赵强尚文鼎金文俊车钊吴巩王晓波宋贺

关键词: 根瘤菌; 结瘤固氮; 硝化; 反硝化; 自生固氮
大豆是人类植物蛋白的重要来源,占世界所有植物蛋白产量的60% 以上[1]。大豆植株内氮素除了来自肥料氮和土壤氮外,还有40%~70% 来自其自身根瘤所固定的氮[2]。因此,科研人员试图通过接种高效根瘤菌来提高大豆的共生固氮能力,从而实现减少肥料氮的投入。在巴西和阿根廷等主要大豆生产国,80% 以上的大豆在种植过程中都会接种根瘤菌[ 3 − 4 ]。尽管多项研究发现接种根瘤菌能促进大豆氮吸收并提高产量[5],但也有研究表明接种根瘤菌并未对大豆氮利用产生显著影响,甚至会产生负面影响[6−7]。可见接种根瘤菌对大豆生长和氮利用的影响存在一定差异。有研究发现,即使同一大豆品种,接种同一根瘤菌种和在同一气候下,但不同类型土壤中种植的大豆,其生长和氮利用仍然存在显著差异[4]。这些接种效果的不确定性,给大豆根瘤菌接种的应用和推广造成了很大挑战。因此,以不同土壤类型的影响为切入点,研究接种根瘤菌对大豆共生固氮、根际氮转化等氮利用过程的影响机制,对实现根瘤菌的高效接种和更广泛的应用具有重要意义。
大豆共生固氮能力与根瘤的数量、鲜重和固氮酶活性密切相关[8]。大豆能够与土著根瘤菌建立共生关系形成根瘤。与土著根瘤菌相比,接种竞争结瘤和固氮能力更强的根瘤菌能显著提高大豆的共生固氮能力[9];反之,接种竞争力弱的根瘤菌无法提高固氮能力甚至会产生抑制效果[10]。不同类型土壤中土著根瘤菌的菌群组成存在差异,因而接种根瘤菌与各类型土壤中土著菌之间的竞争强弱决定着接种效果[11]。此外,土壤理化性状也会影响根瘤菌接种效果。例如无机氮含量低的土壤能够有效促进大豆根系生长,进而促进根瘤的形成[12]。但无机氮含量高的土壤往往会抑制根瘤的形成。如高浓度的NO3−会抑制根瘤菌的侵染、根瘤的发育和固氮酶活性;高浓度NH4+甚至可以导致接种根瘤菌的大豆基本上不结瘤[13−14]。可见,接种的根瘤菌菌种、土著根瘤菌菌群和土壤理化性状会综合影响不同土壤类型中根瘤菌接种效果。但目前将三者综合在一起的研究较少,相关信息缺乏。
根际氮素转化对根瘤菌接种效果至关重要,是决定接种是否成功的另一重要因素。根际氮素转化主要包括硝化、反硝化和自生固氮过程,分别由硝化菌、反硝化菌和自生固氮菌主导。氨氧化古菌(AOA)和氨氧化细菌(AOB) 主导了硝化过程的限速步骤,受到广泛关注。携带narG 基因和nifH 基因的微生物,则分别是反硝化菌和自生固氮菌的典型代表。NH4+和NO3−分别是硝化和反硝化的底物,同时也会对自生固氮菌产生深刻影响[15]。接种根瘤菌能够改变根际土壤中NH4+和NO3−含量。一些研究表明,接种根瘤菌会增强大豆根系活力,促进根系氮素吸收,造成根际土壤NO3−和NH4+含量的降低[16]。但也有研究认为,接种根瘤菌提高了大豆共生固氮能力,满足了大豆氮素需求,减少了土壤氮吸收,促进了根际NH4+和NO3−积累[17]。此外,接种根瘤菌能够改变根构型,而根构型也会影响大豆的氮吸收,进而间接的影响根际土壤NO3−和NH4+浓度[18]。除土壤无机氮外,接种根瘤菌还会影响根际土壤可溶性有机碳和磷钾浓度,这些也会对硝化、反硝化和自生固氮过程产生影响[18−19]。差异性土壤类型为大豆根际提供了不同的氮素转化微生物菌群和土壤理化性状,使得接种根瘤菌对硝化、反硝化和自生固氮的影响变得更为复杂,然而,目前尚未有相关研究明确影响这3 个过程的主导因素。
淮河流域是我国重要的农业生产区域,其耕地面积占中国总面积的10%,贡献了国家农作物总产量的20%[20]。大豆是该区域主要种植作物之一,常年种植面积在50 万hm2 以上。砂姜黑土和黄褐土为该区典型土壤类型。本研究采用盆栽试验,选取黄褐土和砂姜黑土两种类型土壤,并在前期筛选的1株根瘤菌(Bradyrhizobium japonicum) 基础上,设置大豆接菌和不接菌处理。通过比较各处理间大豆植株氮积累量、结瘤固氮能力、根际土壤氮转化关键过程(硝化、反硝化、自生固氮) 及相关微生物群落组成(AOA、AOB、narG、nifH) 等指标的差异,以期阐释不同类型土壤中根瘤菌接种效果差异的机制,为根瘤菌的广泛应用提供理论依据。
1 材料和方法
1.1 试验材料与试验设计
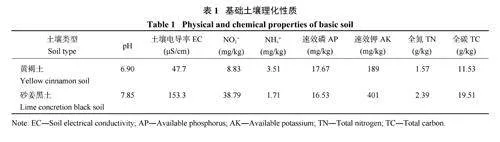
试验于2021 年在安徽农业大学农萃园试验基地(31°87′N、117°26′E) 进行。该地区属于亚热带季风气候,年平均降水量为998 mm,年平均温度为15.7℃。供试土壤为黄褐土和砂姜黑土。黄褐土取自安徽农业大学大杨店基地(31°88′N、117°26′E)。砂姜黑土取自安徽农业大学皖北试验站(33°69'N,117°09'E),这两种土壤均取自长期冬小麦−夏玉米轮作农田。试验开始前的0—20 cm 耕层土壤理化性质见表1。供试大豆品种与供试菌种分别为中黄13 和慢生根瘤菌(Bradyrhizobium japonicum)。
试验为盆栽试验(盆高20 cm,内径28 cm),依据根瘤菌接种与否和土壤类型分为4 个处理:黄褐土+接种根瘤菌(YGL)、黄褐土+不接种根瘤菌(YCK)、砂姜黑土+接种根瘤菌(MGL) 和砂姜黑土+不接种根瘤菌(MCK)。每个处理6 次重复,播种时每盆播种6 粒,间苗时每盆留苗3 株。接种前将活化的菌株接种于酵母甘露醇液体培养基(YMA) 后,放置于28℃、160 r/min 的恒温振荡培养箱培养5 天得到菌悬液,而后,将菌悬液浓度调至1.0×108 cfu/mL。播种前将需接种的大豆种子放入该菌悬液浸泡30 min。与此同时,不接种的大豆种子也放入灭菌的菌悬液浸泡30 min,作为对照。氮、磷和钾肥种类分别为尿素、过磷酸钙和硫酸钾。氮肥施用量为N 35.71mg /kg 鲜土,按照1∶1 的比例分别作为基肥和初花期(R1) 追肥施用。磷(P) 和钾(K) 施用量均为24.29mg /kg 鲜土,作为基肥一次性施入。
1.2 取样方法与测定指标
分别于初花期(R1) 和花荚期(R4) 取大豆植株和土壤样品。将植株样品在105℃ 下杀青30 min 后,在80℃ 下烘干至恒重并称重。用毛刷扫下附着于根部1~2 mm 的土壤,收集起来作为根际土壤。过2 mm 筛后一部分放在−80℃ 冰箱储藏,用于微生物DNA 提取。剩余部分存放于4℃ 冰箱,用于室内培养试验以及土壤理化性状的测定。将根部放入尼龙网袋中,用清水缓慢清洗干净后用根系扫描仪WinRhizo Program (Regent Instruments Inc. Canada) 进行扫根,测定总根长、根表面积、根体积和根尖数。用吸水纸擦干根系表面水分后,取下根瘤并记录根瘤鲜重与数量。部分根瘤用于固氮酶活性测定和根瘤内生固氮菌的提取。
1.2.1 植株全氮含量与根瘤和土壤固氮酶活性测定
将大豆植株各部分样品粉碎后,过0.25 mm (60目) 筛。采用H2SO4−H2O2 溶液消煮样品后,采用凯氏定氮仪(KN520 ALVA 中国) 测定氮含量。
采用乙炔(C2H2) 还原法测定根瘤固氮酶活性。称取约1 g 根瘤于100 mL 血清瓶中,密封后用无菌注射器抽出10 mL 气体,再注入等体积乙炔,28℃培养1 h。抽取10 mL 气体,使用气相色谱(Agilent7890A,Agilent Technologies,USA) 测定C2H4 浓度。固氮酶活性[mL/(g·h)]=还原乙烯量(C2H4 mL)/根瘤质量(g)/反应时间(h);根瘤固氮潜力[mL/(plant·h)]=根瘤固氮酶活性[mL/(g·h)]×根瘤鲜重(g/plant)。
取相当于10 g 干土的鲜土采用和根瘤相同的方法培养1 天后,依据上述方法测定土壤固氮酶活性。1.2.2 根际土壤理化性质测定用pH 计(ST3100,奥豪斯,中国) 和电导率仪(IS228-Basic) 按照水土比5∶1 测定土壤pH 和土壤电导率(EC);采用全自动间断化学分析仪(Germany,CleverChem380plus)测定NO3−和NH4+含量;采用Multi C/N 3100 TOC 分析仪(德国,Analytik Jena) 测定可溶性有机碳(DOC)含量;采用火焰光度计(WGH6431,上海) 测定速效钾(AK) 含量;采用钼锑抗比色法测定速效磷(AP)含量[ 2 1 ];采用凯氏定氮仪(KN520) 测定土壤全氮(TN) 含量;参照Nelson 等[22]的方法测定土壤全碳(TC) 含量。
1.2.3 硝化势和反硝化能力测定 参照Taylor 等[23]的方法测定根际土壤硝化势(nitrification potential,NP)。每个处理取相当于10 g 干土的鲜土,放入100 mL的血清瓶中,用无菌注射器注入50 mL 培养液 (1 mol/LNH4+),之后在恒温振荡培养箱(29℃,200 r/min) 中培养48 h。在第 0、6、12、24、36、48 h各取1 次样。每次吸取4 mL 悬浮液于离心管,离心后取上清液,采用全自动间断化学分析仪(Germany,CleverChem380plus) 测定土壤NO3−和NO2−的含量,并计算硝化势。
采用Šimek 等[24]的方法测定根际土壤反硝化能力(denitrification capacity,DC)。取相当于10 g 干土的鲜土置于血清瓶中,用无菌注射器加入5 mL KNO3培养液(42.9 mmol/L NO3−),盖紧瓶塞后对血清瓶进行抽真空。用He 气反复冲洗血清瓶3 次。用无菌注射器抽出10 mL 气体,再注入等体积乙炔,平衡大气压后将血清瓶放于恒温培养箱25℃ 培养48 h。分别在第24h 和48 h 时抽取10 mL 瓶内气体(取样后会补充等量的氦气)。采用气相色谱仪(Agilent 7890A,Agilent Technologies,USA) 测定N2O 浓度。依据24 h 到48 h 的N2O 浓度计算土壤反硝化能力。
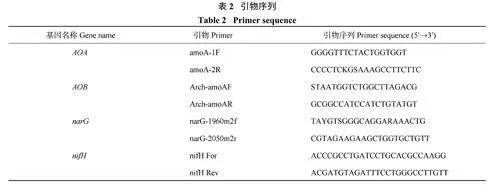
1.2.4 Real-time qPCR 分析和高通量测序 称取0.5 g 土样,用土壤 DNA 试剂盒(Fast DNA SPIN KitFor Soil, USA) 提取土壤微生物总 DNA。称取约0.5 g 根瘤放入2 mL 离心管,用全自动样品快速研磨仪(JXFSTPRP-64L,中国) 粉碎混匀后,准确称取0.1 g 采用FT Plant DNA Kit 试剂盒(南京建成生物工程研究所) 提取根瘤总DNA。采用实时荧光定量PCR 系统(StrataGene Mx3005P,美国) 测定AOA (ammonia-oxidizing archaea)、AOB (ammoniaoxidizingbacteria)、narG 和nifH 的丰度,所用引物见表2。微生物PCR 的体系都是20 mL,包括:1 μL 目标DNA,10 μL 的2×SG Green qPCR Mix,0.5 μL 的10 μM 上下游引物,8 μL 蒸馏水。qPCR 的反应程序为:95℃ 预变性10 min;95℃ 变性20 s,60℃ 复性30 s,72℃ 延伸30 s,45 个循环。将含有目标基因片段的质粒以10 倍梯度稀释,生成AOA、AOB、narG 和nifH 功能基因的标准曲线。最终AOA、AOB、narG 和nifH 的扩增效率分别为106%、100%、107% 和97%。
通过高通量测序测定根瘤内生固氮菌和根际自生固氮菌。扩增引物和PCR 条件与上述相同。将目标PCR 产物经1% 琼脂糖凝胶电泳,用GenElute 凝胶提取试剂盒(Sigma-Aldrich,美国) 纯化。用纯化后的PCR 产物进行测序(Illumina Novaseq,美国)。
原始序列使用Vsearch 进行质量过滤、去嵌合体和聚类等步骤后,用FrameBot (https://github.com/rdpstaff/Framebot) 进行矫正,最终获得高质量序列。在97%相似度水平对高质量序列聚类,并分别输出代表序列和可操作的分类单元(OTU)。使用NCBI 数据库对nifH 功能基因的OTU 进行注释后用于后续分析。
1.3 数据处理分析
通过高通量测序测定根瘤内生固氮菌和根际自生固氮菌。扩增引物和PCR 条件与上述相同。将目标PCR 产物经1% 琼脂糖凝胶电泳,用GenElute 凝胶提取试剂盒(Sigma-Aldrich,美国) 纯化。用纯化后的PCR 产物进行测序(Illumina Novaseq,美国)。原始序列使用Vsearch 进行质量过滤、去嵌合体和聚类等步骤后,用FrameBot (https://github.com/rdpstaff/Framebot) 进行矫正,最终获得高质量序列。在97%相似度水平对高质量序列聚类,并分别输出代表序列和可操作的分类单元(OTU)。使用NCBI 数据库对nifH 功能基因的OTU 进行注释后用于后续分析。
1.3 数据处理分析
使用Excel 2016 和R 软件进行数据整理和作图。使用SPSS 23 进行相关性分析和配对样本t检验(Plt;0.05 为差异显著)。优势OTUs 的相对丰度(相对丰度gt;1%) 通过Circos 柱状累积图进行可视化。使用SmartPLS 4.0 构建偏最小二乘路径模型(PLS-PM)。
2 结果与分析
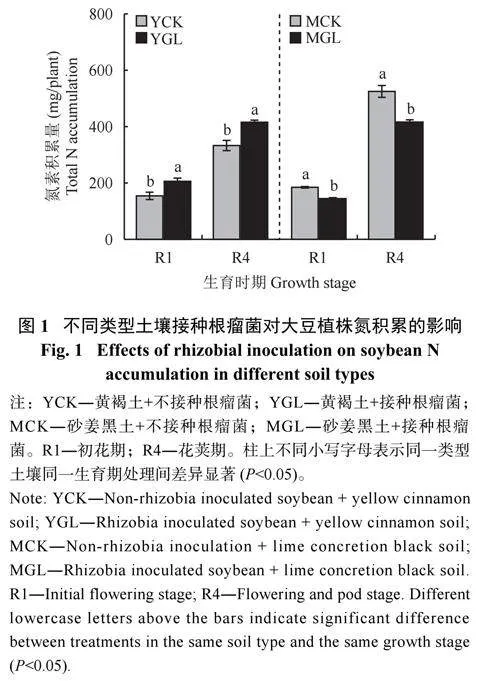
2.1 不同类型土壤中接种根瘤菌对大豆植株氮积累的影响
由图1 可知,接种根瘤菌在两种土壤中对植株氮积累产生的效果相反。在黄褐土中,接种根瘤菌能显著提高植株氮积累量。相比于YCK 处理,YGL处理下大豆植株氮素积累量在初花期(R1) 和花荚期(R4) 分别提高了33.6% 和24.9%。在砂姜黑土中,接种根瘤菌则导致植株氮积累量显著降低。与MCK相比,MGL 处理植株氮素积累量在R1 和R4 期分别下降了21.7% 和20.7%。
2.2 不同类型土壤中接种根瘤菌对大豆结瘤固氮的影响
由表3 可知,接种根瘤菌在两种土壤中对大豆结瘤固氮能力的影响不同。在黄褐土中,接种根瘤菌能够提高大豆结瘤固氮。与YCK 相比,YGL 处理在R1 和R4 期分别提高了38.5% 和29.6% 的根瘤鲜重、35.8% 和22.2% 的根瘤数量、14.6% 和13.0%的固氮酶活性、58.6% 和46.5% 的根瘤固氮潜力。在砂姜黑土中,接种根瘤菌则会对大豆结瘤固氮产生抑制作用。与MCK 相比,MGL 处理在R1 和R 4 期分别降低了3 7 . 2% 和1 5 . 8% 的根瘤鲜重、32.8% 和20.0% 的根瘤数量、23.9% 和15.6% 的固氮酶活性、51.3% 和28.9% 的根瘤固氮潜力。
2.3 植株氮素积累与结瘤固氮指标的相关性与PLS 分析
由表4 可知,在黄褐土中,R1 和R4 期的根瘤鲜重、固氮酶活性和根瘤固氮潜力与植株氮积累均呈显著正相关。根瘤数量仅在R4 期与植株氮积累显著正相关。在砂姜黑土中,R1 和R4 期的根瘤鲜重、根瘤数量、固氮酶活性和根瘤固氮潜力与植株氮积累均呈显著正相关。
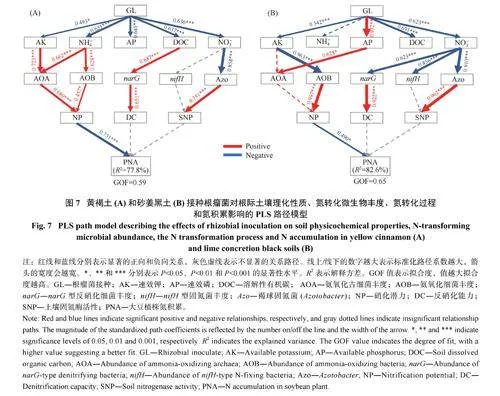
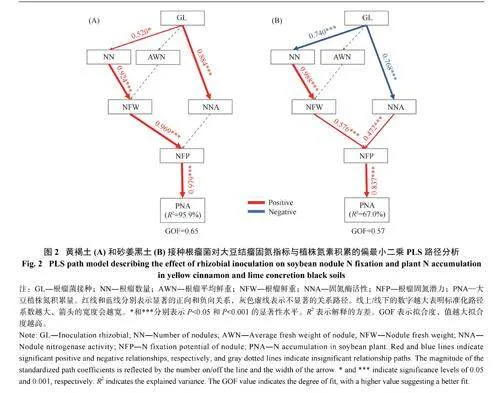
采用PLS 评估了接种根瘤菌对黄褐土和砂姜黑土中大豆根瘤数量、单个根瘤平均鲜重、根瘤鲜重、酶活性、固氮潜力和氮积累的影响。在黄褐土中,接种根瘤菌通过增加根瘤数量促进了根瘤鲜重、固氮潜力和氮积累的提高(图2A)。在砂姜黑土中,根瘤数量和酶活性是影响根瘤鲜重、固氮潜力和氮积累的主要因素(图2B)。
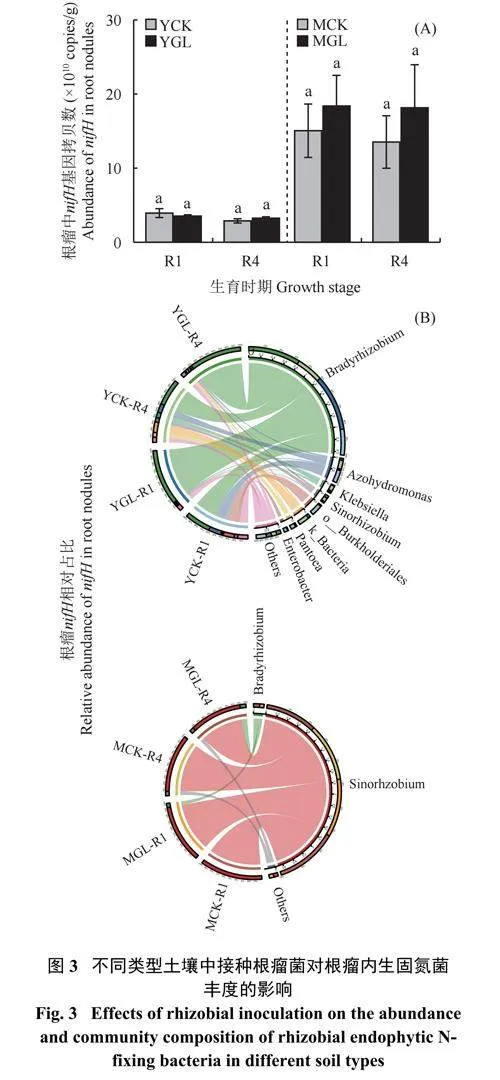
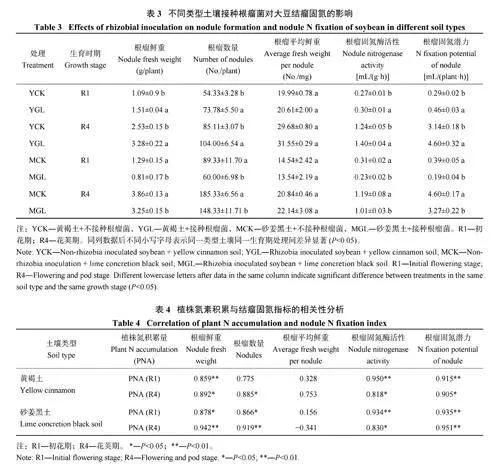
2.4 不同类型土壤中接种根瘤菌对根瘤内生固氮菌丰度和结构的影响
由图3A 可知,接种根瘤菌在两种土壤中均未显著改变根瘤内生固氮菌(nifH) 丰度。在根瘤内生固氮菌结构方面,两种类型土壤存在显著差异(图3B)。在不接菌条件下,黄褐土中Bradyrhizobium 占据主导地位,在R1 和R4 期其相对占比分别为39.6% 和40.5%,接种根瘤菌能够显著提高Bradyrhizobium 相对占比,相比于YCK,YGL 在R1 和R4 期分别增加114.4% 和40.5%。在砂姜黑土中Sinorhizobium 占据主导地位,不接菌条件下,未发现Bradyrhizobium的存在,接种根瘤菌后,其结构发生一定改变,相比于MCK,MGL Sinorhizobium 相对丰度占比在R1和R4 期分别降低6.7% 和10.1%,Bradyrhizobium相对丰度占比在R1 和R4 期分别为6.9% 和9.7%。
2.5 不同类型土壤中接种根瘤菌对大豆根际硝化、反硝化和自生固氮的影响
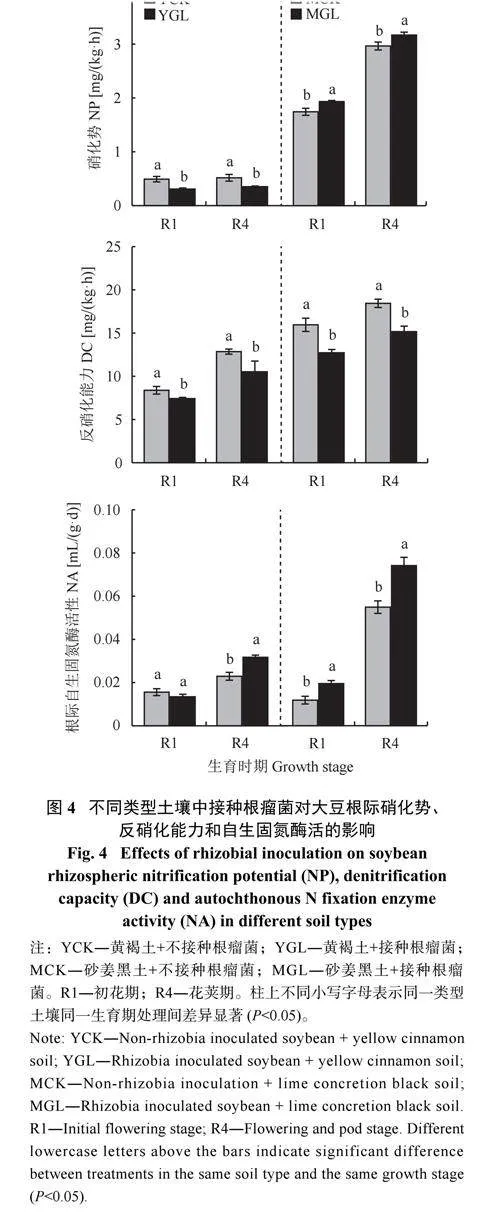
由图4 可知,接种根瘤菌在两种土壤中对硝化势的作用效果相反。在黄褐土中,接菌会使大豆根际土壤硝化势显著降低,相比于YCK,YGL 处理的硝化势在R1 和R4 期分别降低36.7% 和32.3%。在砂姜黑土中,接种根瘤菌则会导致硝化势显著增强,相比于MCK,MGL 处理的硝化势在R1 和R4期分别增加10.9% 和6.7%。接种根瘤菌在两种土壤中均能使根际反硝化能力显著降低。在黄褐土中,相比于YCK,YGL 处理的反硝化能力在R1 和R4期分别降低11.5% 和18.2%。在砂姜黑土中,相比于MCK,MGL 处理的反硝化能力在R1 和R4 期分别降低25.5% 和16.2%。
接种根瘤菌在两种土壤中对根际固氮酶活性的影响有所不同。在黄褐土中,接种根瘤菌对R1 期根际固氮酶活性未产生显著影响,但在R4 期却使其活性显著增高,相比于YCK,YGL 处理的根际固氮酶活性在R4 期增加38.4%。在砂姜黑土中,接种根瘤菌则会使根际固氮酶活性显著增高,相比于MCK,MGL 处理的根际固氮酶活性在R1 和R4 期分别增加64.8% 和35.0%。
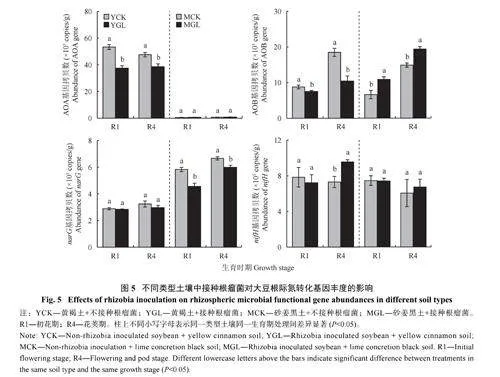
2.6 不同类型土壤中接种根瘤菌对大豆根际土壤氮转化基因丰度的影响
由图5 可知,接种根瘤菌对两种根际土壤中AOA 丰度的影响不同。在黄褐土中,接种根瘤菌能够显著降低AOA 丰度,相比于YCK,YGL 处理的AOA 丰度在R1 和R4 期分别降低29.7% 和18.9%。在砂姜黑土中接种根瘤菌并未显著影响AOA 丰度。接种根瘤菌对两种土壤中AOB 丰度产生的影响相反。在黄褐土中,接种根瘤菌能够显著降低根际AOB 丰度,相比于YCK,YGL 在R1 和R4 期分别降低33.2% 和24.4%。在砂姜黑土中,接种根瘤菌能够显著提高AOB 丰度,相比于MCK,MGL 在R1 和R4 期分别提高64.5% 和30.3%。
接种根瘤菌对两种土壤中narG 丰度的影响不同。在黄褐土中,接种根瘤菌并未显著影响narG丰度。而在砂姜黑土中接种根瘤菌则会使narG 丰度显著降低,相比于MCK,MGL 在R1 和R4 期分别降低14.2% 和31.3%。接种根瘤菌对两种土壤中nifH 丰度的影响也不相同。在黄褐土中,接种根瘤菌对R1 期根际nifH 丰度并未产生显著影响,但在R4 期却使其丰度显著提高,相比于YCK,YGL 处理的nifH 丰度在R4 期提高了32.4%。在砂姜黑土中,接种根瘤菌对两时期nifH 丰度均未产生显著影响。
2.7 不同类型土壤中接种根瘤菌对大豆根际土壤固氮菌群落结构的影响
由图6 可知,接种根瘤菌对两种土壤中褐球固氮菌(Azotobacter) 的相对丰度占比均产生了影响。在黄褐土中,接种根瘤菌对R1 期褐球固氮菌相对丰度占比未产生显著影响,但显著提高了R4 期褐球固氮菌相对丰度占比,与YCK 处理相比,YGL 处理在R4 期褐球固氮菌相对丰度占比增加了182.9%。在砂姜黑土中,接种根瘤菌显著提高R1 和R4 期褐球固氮菌的相对丰度占比,相比于MCK,MGL 处理褐球固氮菌在R1 和R4 期的相对丰度占比分别增加了76.3% 和16.4%。
2.8 不同类型土壤中接种根瘤菌对根际土壤理化性质的影响
由表5 可知,接种根瘤菌对两种土壤中大豆根际土壤理化性质的影响不同。在黄褐土中,接种根瘤菌会使AK、AP、DOC 和NO3−显著降低;相比于YCK,YGL 在R1 和R4 期的AK 分别降低8.6% 和8.3%,AP 分别降低10.6% 和11.1%,DOC 分别降低15.7% 和9.9%,NO3−分别降低9.7% 和13.0%。NH4+和TC 在两时期同样均降低,相比于YCK,Y G L 在R 1 和R 4 期的N H 4+分别降低1 8 . 1% 和5.3%,TC 分别降低4.5% 和1.1%。接种根瘤菌对两时期根际土壤pH 均未产生显著影响。
在砂姜黑土中,接种根瘤菌会降低AK、DOC和NO3−,但会增加AP 的含量,相比于MCK,MGL在R1 和R4 期的AK 分别降低6.8% 和6.6%,DOC分别降低7.9% 和8.8%,NO3−分别降低21.4% 和10.7%,AP 分别升高27.2% 和31.2%;NH4+在R1 期显著升高,在R4 期显著降低,相比于MCK,MGL的NH4+在R1 期增加17.7%,在R4 期减少10.3%。此外,接种根瘤菌对两时期的pH 和TC 均未产生显著影响。
2.9 不同类型土壤中接种根瘤菌对大豆根系的影响
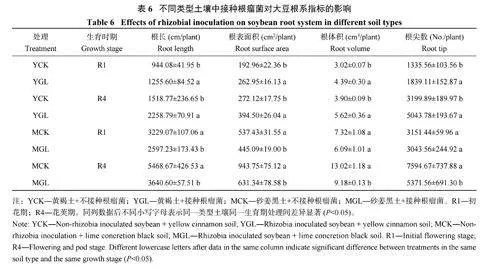
由表6 可知,接种根瘤菌在两种土壤中对根系生长发育状况的影响不同。在黄褐土中,接种根瘤菌能够促进根系生长发育,相比于YCK,YGL 在R1 和R4 期分别提高了33.0% 和48.7% 的根长、36.3% 和45.0% 的根表面积、45.6% 和44.0% 的根体积和37.7% 和57.6% 的根尖数。而在砂姜黑土中,接种根瘤菌会抑制根系生长发育,相比于MCK,MGL 在R1 和R4 期分别降低了16.0% 和33.4% 的根长、17.2% 和33.1% 的根表面积、16.8% 和29.5% 的根体积与3.4% 和29.3% 的根尖数。
2.10 结构方程模型
用PLS 评估了接种根瘤菌对黄褐土和砂姜黑土中根际土壤理化性质、氮转化微生物丰度、氮转化过程和氮积累的影响(图7)。在黄褐土中,接种根瘤菌对硝化、反硝化和自生固氮过程均产生了显著影响。其中,硝化过程是决定大豆氮素积累的主要因素。AOA 和AOB 是主导硝化潜势的主要因子。接种根瘤菌通过影响根际AK 和NH4+调控AOA 丰度,通过影响NH4+调控AOB 丰度。对反硝化过程来说,narG 影响了DC,而接种根瘤菌导致DOC 的变化是影响narG 丰度的主要因素。褐球固氮菌(Azotobacter)相对丰度占比与SNP 存在显著联系,而接种根瘤菌导致NO3−的变化是影响褐球固氮菌相对丰度占比的主要因素(图7A)。
与黄褐土类似,在砂姜黑土中接种根瘤菌也对硝化、反硝化和自生固氮过程均产生一定影响。其中,硝化过程同样也是决定大豆氮素积累的主要因素。接种根瘤菌分别通过影响根际AP 和AK 调控AOA 和AOB 丰度。AOB 而非AOA 是影响硝化过程的主导因子。对反硝化过程来说,narG 影响了DC,而接种根瘤菌导致NO3−的变化是影响narG 丰度的主要因素。在自生固氮方面,与黄褐土类似,NO3−也是影响褐球固氮菌相对丰度占比的主要因素(图7B)。
3 讨论
3.1 不同类型土壤中接种根瘤菌对大豆氮积累和结瘤固氮的影响
本研究发现,无论在黄褐土还是砂姜黑土中,接种根瘤菌均能显著影响大豆植株氮积累,但作用效果相反。在黄褐土中,接种根瘤菌能够显著促进大豆植株氮积累,而在砂姜黑土中,则抑制大豆植株氮积累(图1)。前人也报道在不同土壤类型条件下,接种根瘤菌会促进或抑制大豆的氮积累[25]。一般而言,大豆根瘤固氮潜力是影响大豆植株氮素积累的重要因素。大豆固氮潜力主要受到根瘤鲜重和固氮酶活性的影响[26]。对于根瘤鲜重来说,接种根瘤菌可能会通过增加单个根瘤鲜重或根瘤数提高根瘤总鲜重(图2)。我们研究发现,在两种土壤类型中接种根瘤菌均没有提高单个根瘤鲜重,但显著影响了根瘤数量。在黄褐土和砂姜黑土中分别表现出促进和抑制作用。可见,接种根瘤菌主要通过影响根瘤数量而非单个根瘤鲜重来改变根瘤总鲜重,这与前人[27]研究结果类似。根瘤数量受到根系与根际土壤根瘤菌的交互影响[28−29]。不接种情况下,根瘤主要由土著优势根瘤菌通过侵染根系形成。接种后,接种根瘤菌会对根际土著根瘤菌结构产生一定影响。在黄褐土中,接种根瘤菌增加了根际土著优势根瘤菌的相对丰度,因此会增加根系侵染位点,促进根瘤数量的增加。但在砂姜黑土中,接种根瘤菌减弱了土著优势根瘤菌的相对丰度,可能对其侵染产生了负面影响,降低了侵染位点和根瘤数[30]。可见,接种菌与土壤土著优势根瘤菌的正向或负向影响是决定侵染位点数和根瘤数的关键所在。此外,根系是影响根瘤数的另一重要因素[31]。本研究发现,在黄褐土和砂姜黑土中,接种根瘤菌分别促进和抑制了根系长度和根表面积(表6)。根系长度和根表面积的增加或降低会相应影响根瘤菌的侵染位点数,进而影响根瘤数量。
固氮酶活性是影响大豆根瘤固氮潜力的另一重要因素[13]。本研究发现,接种根瘤菌显著提高了黄褐土中的根瘤固氮酶活性,但却降低了砂姜黑土的根瘤固氮酶活性(表3)。通过检测根瘤内生固氮菌丰度,发现在两种土壤中接种根瘤菌并没有显著提高其丰度。由此推测,根瘤菌固氮酶活性可能与其根瘤内生固氮菌结构存在一定关系。通过分析其结构发现接种根瘤菌可显著影响根瘤中优势固氮菌相对丰度,进而改变其菌群结构。在黄褐土中,接种根瘤菌显著增加了优势固氮菌的相对丰度。而在砂姜黑土中接种根瘤菌却降低了其优势固氮菌的相对丰度。这可能与接种的根瘤菌与黄褐土中的固氮菌属于同一属,而与砂姜黑土的固氮菌则遗传距离较远有关。有研究表明,微生物菌群中优势微生物是决定功能酶活性的关键因素[32]。因此,接种根瘤菌增强了黄褐土中优势微生物的占比,但减弱了砂姜黑土中优势微生物的占比,进而相应的增强或减弱了根瘤固氮酶活性。
3.2 不同类型土壤中接种根瘤菌对大豆根际氮转化及其相关微生物的影响
根际氮转化是调控植物氮积累的另一重要因素。本研究发现,接种根瘤菌会显著影响根际硝化、反硝化和自生固氮过程(图4)。在这3 个过程中,根际硝化过程与大豆氮素积累密切相关(图7)。接种根瘤菌显著降低了黄褐土根际硝化过程,但却显著增加了砂姜黑土的硝化过程。硝化过程的减弱有利于增加根际氮素保持时间,进而有利于植物的氮吸收和积累,相反亦然。因此,接种根瘤菌减弱黄褐土的硝化过程和增强砂姜黑土的硝化过程会分别促进和抑制大豆氮素积累。在黄褐土中,硝化过程主要受到AOA 和AOB 的共同影响。接种根瘤菌会通过显著影响根际AK 和NH4+调控AOA 丰度,并会通过影响NH4+调控AOB 丰度。NH4+作为硝化过程的底物会显著影响AOA 和AOB 的丰度[ 3 3 − 3 4 ]。与NH4+相比,AK 并非硝化过程的底物,但却是氨氧化微生物的主要养分来源。黄褐土为弱酸性土壤,而在这类土壤中硝化过程主要由AOA 主导。因此,AK会通过调控AOA 影响根际硝化过程,这与Chen 等[35]的研究结果类似。在砂姜黑土中,硝化过程主要受到AOB 而非AOA 的影响(图7)。这可能与砂姜黑土的pH 值有关。与黄褐土不同,砂姜黑土呈弱碱性。研究发现,弱碱性土壤中AOB 在硝化过程中占据主导作用[36]。
对反硝化而言,接种根瘤菌也会显著影响根际反硝化能力。narG 丰度与反硝化能力显著正相关(图7 )。在黄褐土中接种根瘤菌会通过降低根际DOC 含量影响narG 丰度,而在砂姜黑土中则会通过调节NO3−含量影响narG 丰度。DOC 是反硝化的电子供体,控制着反硝化强度。本研究发现,接种根瘤菌后均降低了砂姜黑土和黄褐土中根际DOC 含量,但作用机理不同。在黄褐土中,接种根瘤菌促进了结瘤固氮,可能消耗了大豆植株中大量的碳,因此降低了碳向土壤的输出,导致根际DOC 的下降[ 3 7 ]。而在砂姜黑土中,接种根瘤菌抑制了结瘤固氮,可能限制了大豆植株的生长,因此降低了碳向根际的运输量。由于黄褐土中DOC 含量显著低于砂姜黑土,接种根瘤菌进一步降低了其DOC 含量,使DOC 成为narG 型反硝化微生物的主要限制因素[ 3 8 ]。在砂姜黑土中narG 型反硝化菌丰度不受电子供体DOC 含量的限制,但却受电子受体NO3−的显著影响。本研究发现,接种根瘤菌后会显著降低砂姜黑土中大豆根际NO3−含量。主要原因可能是该土壤中接种根瘤菌抑制大豆结瘤固氮能力,大豆会从土壤中吸收更多的NO3−,导致其含量显著降低。
在自生固氮方面,接种根瘤菌能够刺激根际自生固氮酶活性(图4)。nifH 型固氮菌的结构而非丰度与自生固氮酶活性密切相关(图7)。褐球固氮菌是土壤中最具代表性的自生固氮细菌之一[39]。本研究发现,在砂姜黑土和黄褐土中其相对丰度占比均与自生固氮酶活性呈显著正相关(图7)。在这两种土壤中接种根瘤菌均可提高褐球固氮菌的相对丰度占比(图6)。褐球固氮菌相对丰度占比的提高可能与接种根瘤菌后两种土壤根际NO3−含量的降低有关。研究发现,褐球固氮菌对NO3−含量极其敏感,较高的NO3−含量会对其产生抑制效果[40]。
4 结论
接种根瘤菌能显著影响大豆结瘤固氮能力、根际土壤自生固氮能力、硝化和反硝化过程。大豆植株氮素积累主要受到大豆结瘤固氮能力和根际硝化过程的影响,影响效果在黄褐土和砂姜黑土中的表现不同。在黄褐土中,接种根瘤菌通过提高根瘤数量和降低硝化强度的途径来分别提高大豆结瘤固氮能力和根际氮素保持能力,增加大豆植株氮素积累。在砂姜黑土中,接种根瘤菌增加硝化过程强度,降低根瘤数量和固氮酶活性,减弱结瘤固氮能力,进而降低大豆氮素积累量。
