1.5T磁共振成像可有效监测缺血性脑卒中大鼠模型不同时期的颅脑病变动态
2024-12-31李雪琪索比努尔·亚库甫唐斌胡鑫旗邵华姜磊
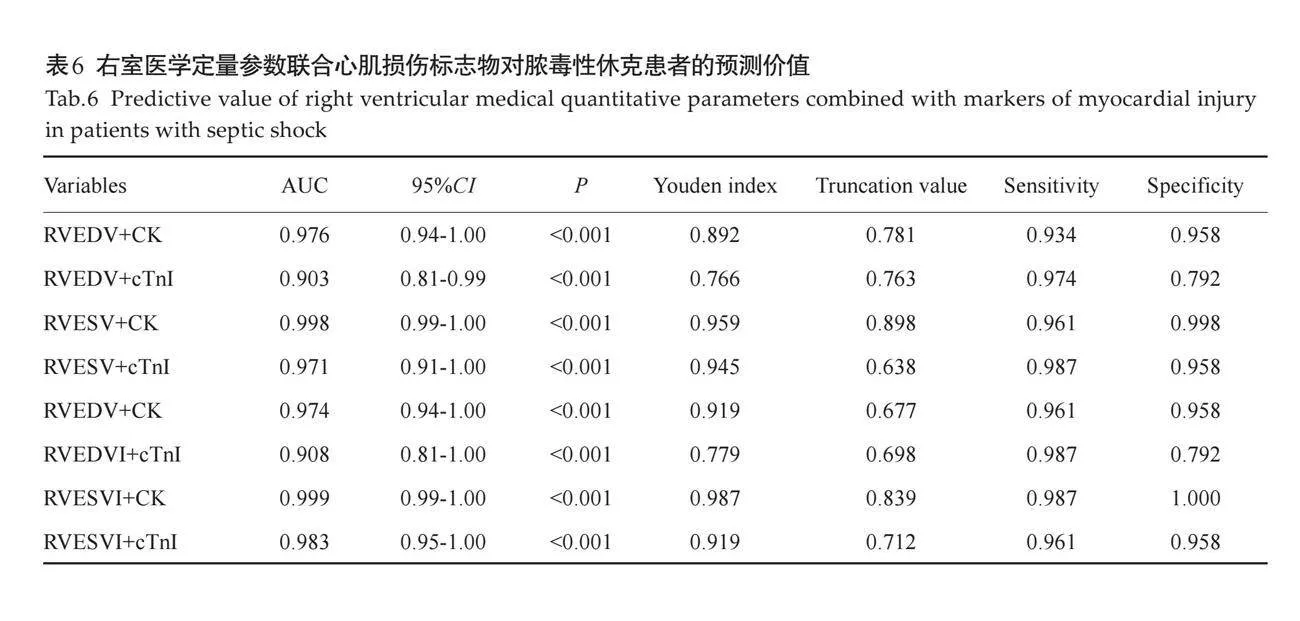
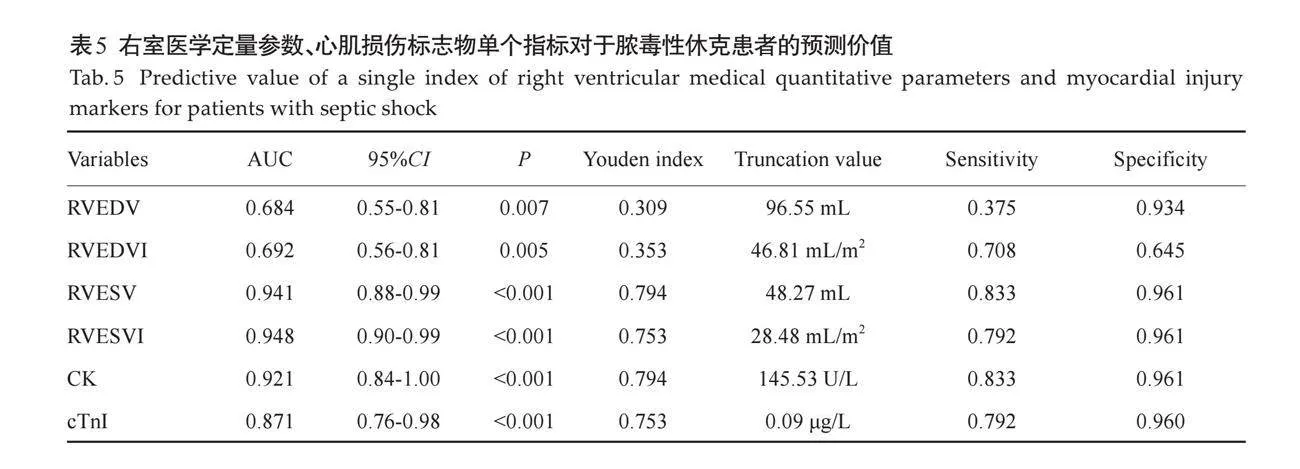
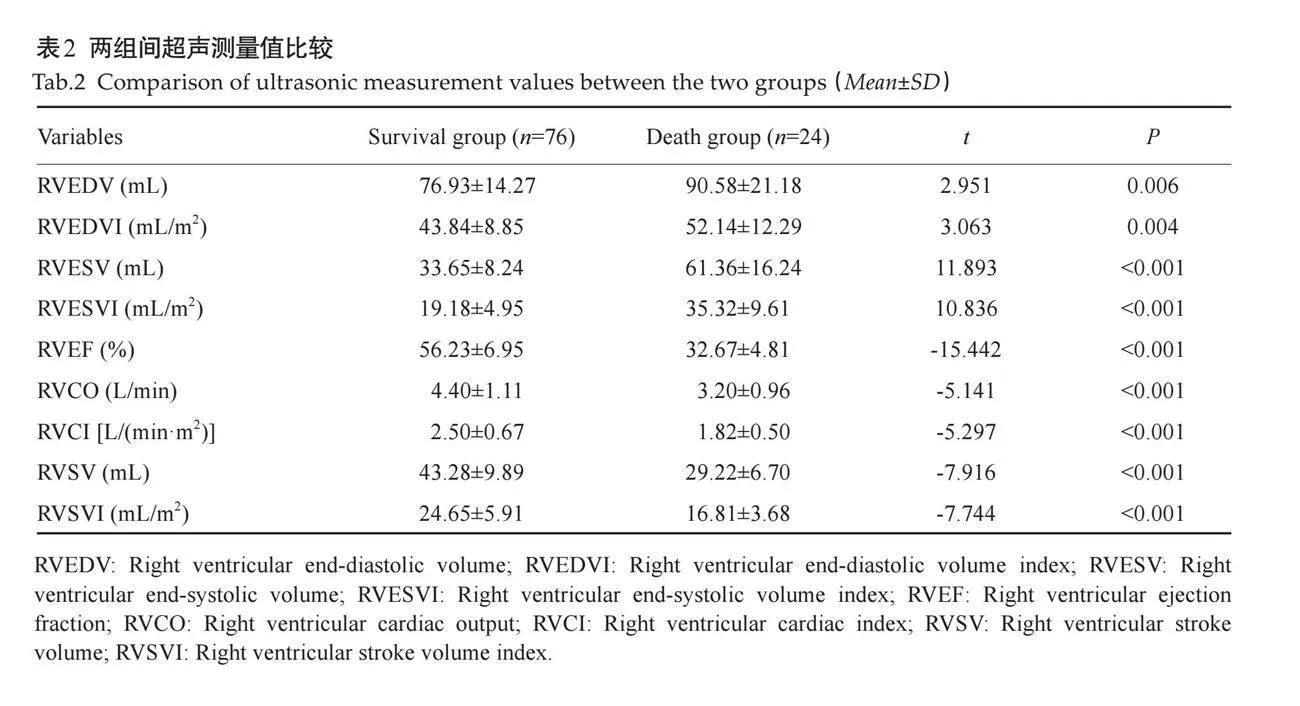
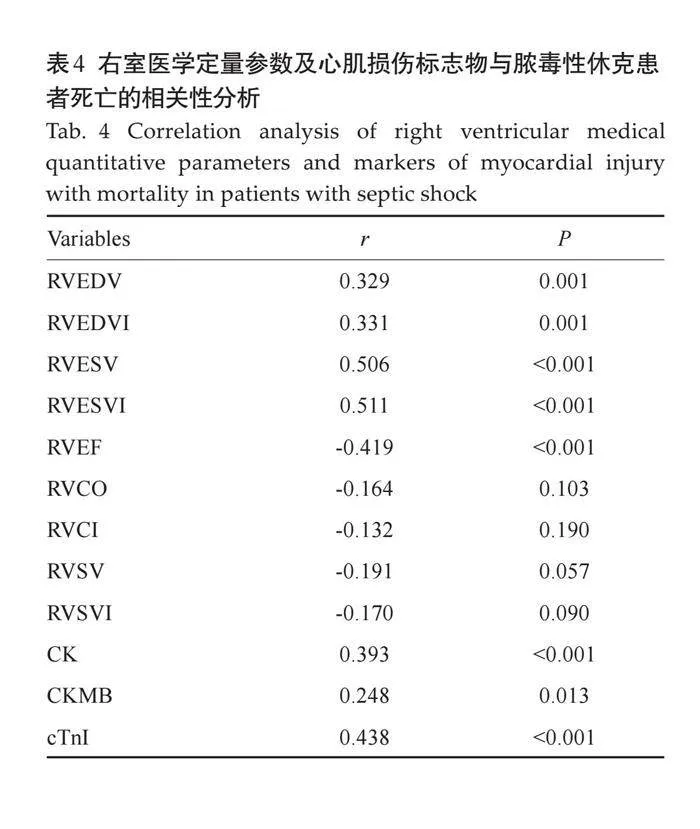
摘要:目的 评估临床医用1.5T磁共振成像技术在不同时间点(6 h、3 d、5 d、7 d、14 d)对急性缺血性脑卒中大鼠模型颅脑病变成像的可行性及其影像学特征变化。方法 随机选择健康雄性SD大鼠10只(10~12周龄),通过线拴法建立永久性SD大鼠的大脑中动脉阻塞模型,使用医用1.5T MR成像仪在不同时间点(6 h、3 d、5 d、7 d、14 d)对大脑中动脉阻塞模型大鼠进行T1WI、T2WI、T2 FLAIR、DWI成像扫描,观察不同分期梗死大鼠脑磁共振图像形态及信号强度变化。结果 1.5T MR成像仪所作DWI图像可以用于诊断大鼠超急性期脑梗死,并直观表现梗死程度和范围;模型鼠脑梗死病灶在不同分期呈现不同的影像学改变,随着时期进展,常规核磁序列呈现的大鼠梗死病灶信号强度及病灶形态有所改变。结论 临床医用1.5T磁共振成像技术能够有效监测不同时间点缺血性脑卒中大鼠模型的颅脑病变动态变化,特别是DWI序列在超急性期梗死诊断中表现出色,为进一步的临床研究和治疗决策提供了有价值的影像学依据。
关键词:缺血性脑卒中;临床医用核磁共振;大脑中动脉阻塞大鼠模型;弥散加权成像
1.5T magnetic resonance imaging caneffectively moniter the dynamic changes of cerebral
lesions in different stages of ischemic stroke in SD rats
LI Xueqi 1 , YAKUFU Suobinuer 1 , TANG Bin 1 , HU Xinqi 2 , SHAO Hua 1 , JIANG Lei 2
1 Imaging Center," 2 Department of Neurosurgery, The First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, China
Abstract: Objective To assess the feasibility and imaging characteristics of clinical 1.5T MRI in visualizing cerebral lesions atdifferent time points (6 h, 3 d, 5 d, 7 d, 14 d) in an acute ischemic stroke rat model. Methods Ten healthy male Sprague-Dawley rats, aged 10-12 weeks, were randomly selected and subjected to permanent middle cerebral artery occlusion via thefilament method to induce ischemic stroke. MRI scans, including T1WI, T2WI, T2 FLAIR, and DWI, were conducted using a1.5T clinical MRI scanner at the specified time intervals (6 h, 3 d, 5 d, 7 d, 14 d), capturing morphological and signal intensitychanges across infarction stages in the rats. Results The DWI sequence obtained from the 1.5T MRI scanner facilitateddiagnosis of ultra-acute cerebral infarction in rats, effectively delineating infarction extent and scope. Infarct lesions in themodel rats exhibited distinct imaging changes across stages, with signal intensity and morphology alterations becomingapparent in conventional MRI sequences as the infarction progressed. Conclusion The clinical 1.5T MRI technique proveseffective in monitoring time-dependent dynamic changes in cerebral lesions in the ischemic stroke rat model. DWI, inparticular, exhibits outstanding diagnostic capacity in ultra-acute infarction, thus providing valuable imaging support foradvanced clinical research and therapeutic planning.
Keywords: ischemic stroke; clinical medical magnetic resonance imaging; rat model of middle cerebral artery occlusion;diffusion weighted imaging
大脑中动脉闭塞是引起临床缺血性脑卒中最常见的原因之一[1, 2] 。大鼠由于拥有与人类脑血管解剖、生理学相似性及其较强的可操作性而在脑血管疾病动物实验中被广泛使用[3, 4] 。相比常用的动物模型建立与评价的方式如神经行为学评定或脑组织病理学评估,影像学检查能够提供直观、无创、可持续的监测过程[5]。鼠的脑血管疾病模型研究及颅脑精细解剖成像所专用的高场强动物成像仪国内尚不普及。近年来临床型1.5T核磁机成像被少许研究作为辅助手段,用于鼠的肝癌及转移瘤成瘤的简单诊断与监测[6, 7] ,而鲜少用于脑血管疾病模型研究,高场强专用核磁机普及率低限制了影像学在大鼠脑血管疾病研究尤其是病灶持续性监测中的应用进展。本研究通过线拴法制备脑卒中模型,使用医用1.5T MRI成像仪活体对造模鼠行颅脑T1WI、T2WI、T2FLAIR、弥散加权成像(DWI)成像,探讨临床医用1.5TMRI成像仪活体显示SD大鼠颅脑结构以及观察不同时期脑梗死范围和信号的变化的可行性与准确性,以期为低场强核磁机在大鼠脑血管疾病模型研究中的应用提供依据。
1 材料与方法
1.1 实验动物
10只SD雄性大鼠(10~12周龄,250±30 g)购自新疆医科大学动物中心,饲养室温度为20~25℃,湿度为50%~65%,昼夜明暗交替时间为 12 h/12 h,室内通风,可自由进食与饮水,手术前12 h禁食不禁水,术后恢复正常饮食。所有动物实验均通过新疆医科大学动物伦理委员会审核批准(伦理审批号:20210301-113),所有手术过程在麻醉下进行,遵循伤害最小化原则。所有实验均根据《实验动物护理和使用指南》第8版(2011年)和《动物研究:体内实验报告》指南(http://www.nc3rs.org.uk/arrive-guidelines)进行。
使用线拴法制作大鼠大脑中动脉闭塞模型,并于手术清醒后进行神经功能评估(NSS)[8] ,分别在脑梗死后6 h、3 d、5 d、7 d、14 d进行NSS评分,NSS评分gt;7分为急性脑梗死大鼠模型建立成功,分值越高体现神经功能越差,选用评分相同的10只模型鼠进行磁共振功能成像。
1.2 MR检查
使用磁共振扫描仪器为国产联影1.5T磁共振成像系统(uMR560),使用腕关节线圈接收行以下序列成像。造模成功后的SD大鼠在不同时间点进行3%的戊巴比妥钠(30 mg/kg)腹腔注射麻醉,俯卧放置在腕线圈中固定进行核磁扫描。扫描层面的定位参考大鼠脑立体定位图谱[9],选择双侧对耳线和中线作为轴位定位点(图1)。
扫描序列具体参数如下:T1WI:TR 671 ms,TE13.22 ms,层数15,层厚2.0 mm,间距10,FOV 120,激发翻转角90°,回聚翻转角150°,读出分辨率272,相位分辨率80。
T2WI:TR 3201ms,TE 80.36 ms,层数15,层厚2.0mm,间距10, FOV 120,激发翻转角90°,回聚翻转角150°,读出分辨率304,相位分辨率80。
FLAIR:TR 5000 ms,TE 110 ms,层数 15,层厚2.0 mm,间距10, FOV 120,激发翻转角90°,回聚翻转角150°,读出分辨率256,相位分辨率70。
DWI:采用 SS-SE-EPI序列,b=0、1000 s/mm,TR3800 ms,TE 150.8 ms,层数15,层厚2.0 mm,间距10,FOV 120,激发翻转角90°,回聚翻转角150°,读出分辨率128,相位分辨率100。
2 结果
2.1 MR显示正常SD大鼠颅脑解剖及信号
T2WI显示解剖层次最清楚,可观察到大脑半球,脑干和小脑等,其次为T2 FLAIR、T1WI,信噪比T2WI、T1WI较高,T2 FLAIR次之。皮层区、纹状体T1WI、T2WI、T2 FLAIR均为灰色信号,丘脑T1WI呈灰色信号,T2WI与T2 FLAIR信号低于皮层区,以T2WI信号对比差较大;皮层下白质信号呈类似改变。脑脊液T1WI及 T2 FLAIR 序列为低信号、T2WI为高信号;DWI脑组织均为灰黑色信号(图2)。
2.2 不同分期大鼠卒中模型颅脑信号的改变
6 h内磁共振扫描可见DWI序列大鼠大脑半球高信号病灶,ADC图为低信号,部分T2WI及T1WI序列扫描未见明确异常信号,T2WI及T2 FLAIR序列呈等信号或边缘模糊的稍高信号,范围小于DWI所示(图3);第3天大鼠DWI显示病灶范围变化不大,信号未见明显减低,ADC图依旧为低信号,但部分信号较前增高,T2WI及T2 FLAIR序列可见明显高信号病灶,边界清晰,T1WI序列可见低信号区,边界模糊(图4);第5天大鼠DWI病灶呈稍高信号,ADC图为稍低信号,T2WI及T2 FLAIR序列病灶面积及信号未见明显异常改变(图5);第7天大鼠DWI信号进一步减低或等信号,ADC图为稍低信号或等信号,部分T1WI、T2WI及T2FLAIR序列可见软化灶形成(图 6);第14天全部大鼠颅脑DWI图像未见明显高信号区(图7),软化灶显示清楚。此外,少数大脑中动脉阻塞大鼠6 h内T2 FLAIR序列上可见与灰质表面相邻的蛛网膜下腔中条状高信号影,周围脑脊液围绕,第3天后基本消失不见,怀疑为高信号血管征(FVHs)(图8)。
3 讨论
DWI通过施加扩散敏感梯度场前后受检组织内水分子的变化,反映人体组织内水分子的功能变化,从而实现活体检测与组织含水量改变相关的生理学变化,能够及时快速实现病灶定位,对脑梗死的治疗和诊断有重要意义[10]。有病理学研究证实,经过大脑中动脉闭塞造模成功的大鼠颅内梗死区病理学改变与同期脑梗死患者相符,但IS动物模型病理分期暂无统一标准,多以临床IS患者发病时间长短为依据分期为超急性期、急性期、亚急性期及慢性期[11] 。本研究根据临床分期分别进行磁共振扫描,发现模型鼠梗死区域影像学表现与过往研究中脑梗死患者相符,并可以观察到梗死区域随时间改变的连续性影像学变化。行为学测试提示模型鼠于缺血6 h内即出现明显的神经功能缺失症状,早期缺血缺氧使得细胞膜上钠钾泵失活,大量水分子进入细胞内,造成梗死区细胞毒性水肿,细胞外水分子运动受限而病灶区结合水量无显著改变[12] 。此时T1、T2弛豫时间不受显著影响,DWI可以敏锐发现脑组织水分子弥散受限而呈现高信号。本次实验中所有造模成功的大鼠早期影像学检查梗死侧大脑半球均呈现DWI明显高信号,其他常规序列扫描未见明显异常信号,与过往研究相符,再次验证DWI对于早期诊断脑梗死具有重要意义。本实验中所有造模成功的大鼠于超急性期均可观察到DWI-FLAlR不匹配区,此时脑梗死区可分为梗死核心区和周围半暗带,半暗带的存在提示梗死区脑组织存在低灌注区,指导临床通过恢复血流供应来拯救该部分脑组织,恢复部分生理功能[13] 。DWI-FLAlR不匹配区可以一定程度取代PET,作为临床评判缺血半暗带的标准,用于避免由于时间窗界定不准确或者超出传统治疗时间窗而导致错过最佳治疗时间的情况[14, 15] 。此外,相较于PWI-DWI不匹配区域,DWI及FLAIR成像扫描时间较短,不需要高场强核磁共振机,不需要注射对比剂及后处理,对病情变化影响小,在发病3~4 h的特异性及准确性较高[16]。本研究中,急性期及亚急性期梗死区FLAIR信号强度逐渐增高,提示可被挽救的缺血半暗带逐渐减少,验证了过往研究认为的缺血发生的6 h后,已经基本超过了一般溶栓治疗时间窗的观点[17, 18] 。脑梗死患者急性期梗死区血脑屏障破坏逐渐加重,细胞毒性水肿逐渐发展成为血管源性水肿,局部脑组织含水量在1~3 d逐渐增加[19, 20] 。此时,T1、T2弛豫时间延长,在急性期核磁扫描观察到模型鼠梗死区呈现T2高信号,T1等信号或稍低信号,FLAIR高信号,DWI信号逐渐减低并边缘趋于模糊,常规序列可见脑回肿胀、脑沟变窄消失等征象。随着缺血时间继续延长,脑梗死患者神经功能缺失和运动功能失调逐渐恢复,损伤侧液化坏死区炎细胞浸润,胶质细胞增生坏死细胞被逐渐清除,新生毛细血管增加,此时组织水分子运动不受限[21]。本研究在亚急性期核磁扫描中观察到T1、T2上病灶边界显示更清晰,DWI信号趋于正常。最终梗死区趋向于液化坏死,脑脊液向梗死区中心填充,此时基本判定该部分脑组织已经失去神经活性[22] 。本研究显示慢性期进行核磁扫描时在T1上观察到边界清晰的低信号区域,T2上显示高信号,FLAIR呈现以高信号为主的混杂信号,T1对于提示脑软化灶形成特异性更好。通过观察常规序列梗死区信号,发现T1、T2可以判断病灶内游离水含量,延长核磁信号以观察到一定程度的细胞毒性水肿现象,发现部分早期梗死灶,但其特异性及准确性相对DWI及FLAIR较低,有一定的漏诊风险,这与既往研究相符[23, 24] 。临床患者大面积脑梗死对应较为严重的神经功能损伤,患者可能存在不同程度感觉异常或神经功能障碍[25] 。对大鼠各个阶段神经功能评分的结果显示,大面积脑梗死造成大鼠神经功能缺陷情况明显,然而梗死后期大部分大鼠的神经功能缺陷症状出现明显好转,考虑源于大鼠相比于人类更高的大脑可塑性,但运动缺陷是大鼠脑卒中模型中相对客观的观点,可以进行评估[26]。
本研究发现,部分大鼠早期FLAIR图像上梗死半球临近脑灰质表面发现条状高信号,而健侧未见,怀疑为FVHs。FVHs形成的病理生理机制不详,既往研究认为最常见于大脑中动脉分布区域,最多见于大脑外侧裂处,为脑梗死时局部脑血流发生障碍而形成高信号区[27] 。临床认为FVHs作为一项特征性的改变,可能预示着颅内大动脉闭塞或存在严重狭窄及发生脑梗死的可能,且这种特殊征象多出现在梗死早期,或可认为是急性脑梗死的早期重要征象[28]。FVHs提示软脑膜侧支逆行血流缓慢以及梗死后侧支循环形成,侧面反应了脑血流动力学异常,可作为预测侧支状态及患者预后的替代指标[29, 30]。过往实验认为FVHs在早期脑梗死中发现并不是一定的[31],与本研究仅发现部分大鼠早期出现此征象的情况相符,因此FVHs不能完全替代判断侧支循环的金标准—减影血管造影检查,FVHs预测预后这一观点尚存在争议,需要进一步研究证实[32, 33] 。次实验造模选用拴塞一侧大脑中动脉形成大面积脑梗死,理论上符合FVHs形成条件,我们认为扩大样本量并控制变量后,或许可以提高FVHs在模型鼠中的发生率,以实现FVHs在动物实验中的研究。
综上,在缺乏超高场小动物专用磁共振成像仪的情况下,临床医用1.5T磁共振机可以准确检出大脑中动脉闭塞大鼠超急性期梗死灶,对脑梗死灶不同时期面积及信号的变化情况显示良好,可以为部分动物实验评估造模效果、病灶变化情况等提供及时有效无创的颅脑影像信息。1.5T低场强医用核磁机扫描得到的DWI及ADC图像颗粒较多,病灶边缘清晰度欠佳,低场强核磁机特殊序列在实验中的应用尚需进一步研究和优化。增大样本量并优化图像质量后,期望能够在大鼠脑卒中实验有关预测预后及治疗效果评估等方面得到更好的结果,这也是后续努力的方向。
参考文献:
[1] Zhou YQ, Zeng XQ, Li G, et al. Inactivation of endothelialadenosine A 2A receptors protects mice from cerebral ischaemia-induced brain injury[J]. Br J Pharmacol, 2019, 176(13): 2250-63.
[2] Nag S, Manias J, Eubanks JH, et al. Increased expression of vascularendothelial growth factor-D following brain injury[J]. Int J Mol Sci,2019, 20(7): 1594.
[3] Gómez-de Frutos MC, García-Suárez I, Laso-García F, et al.Identification of brain structures and blood vessels by conventionalultrasound in rats[J]. J Neurosci Methods, 2020, 346: 108935.
[4] Sorby-Adams AJ, Vink R, Turner RJ. Large animal models of strokeand traumatic brain injury as translational tools[J]. Am J PhysiolRegul Integr Comp Physiol, 2018, 315(2): R165-R190.
[5] Wang WZ, Liu X, Lu HT, et al. A method for predicting the successof Pulsinell’s four-vessel occlusion rat model by LDF monitoring ofcerebral blood flow decline[J]. J Neurosci Methods, 2019, 328:108439.
[6] 李 鑫, 刘凤永, 袁宏军, 等. SD大鼠原位肝癌模型构建及影像学检查[J]. 介入放射学杂志, 2018, 27(12): 1177-81.
[7] 杨 炜, 冉立峰, 周 崑, 等. Wistar大鼠CBRH-3肝癌模型的构建[J].现代医药卫生, 2018, 34(14): 2131-3.
[8] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middlecerebral artery occlusion without craniectomy in rats[J]. Stroke,1989, 20(1): 84-91.
[9] Paxinos G, Watson C. WITHDRAWN: references
[M]//The RatBrain in Stereotaxic Coordinates. Amsterdam: Elsevier, 1982: 6.
[10]Yoon MY, Park J, Cho JY, et al. Predicting biochemical recurrence inpatients with high-risk prostate cancer using the apparent diffusioncoefficient of magnetic resonance imaging[J]. Investig Clin Urol,2017, 58(1): 12-9.
[11]宁 珑, 杨 茜, 孙 航, 等. 大鼠永久性大脑中动脉闭塞模型病理进程研究[J]. 医学动物防制, 2023, 39(6): 594-600.
[12]Shahjouei S, Sadighi A, Chaudhary D, et al. A 5-decade analysis ofincidence trends of ischemic stroke after transient ischemic attack: asystematic review and meta-analysis[J]. JAMA Neurol, 2021, 78(1): 77-87.
[13]Sun XF, Kang F, Shen YX, et al. Dexmedetomidine andphosphocreatine post-treatment provides protection against focalcerebral ischemia-reperfusion injury in rats[J]. Acta HistochemCytochem, 2021, 54(4): 105-13.
[14]Kulzer MH, Chang W, Cerejo R, et al. Implementation of emergentMRI for wake-up stroke: a single-center experience[J]. EmergRadiol, 2021, 28(5): 985-92.
[15]Leigh R, Knutsson L, Zhou JY, et al. Imaging the physiologicalevolution of the ischemic penumbra in acute ischemic stroke[J]. JCereb Blood Flow Metab, 2018, 38(9): 1500-16.
[16]Scheldeman L, Wouters A, Dupont P, et al. Diffusion-weightedimaging and fluid-attenuated inversion recovery quantification topredict" diffusion-weighted" imaging-fluid-attenuated" inversionrecovery mismatch status in ischemic stroke with unknown onset[J]. Stroke, 2022, 53(5): 1665-73.
[17]Aoki J, Kimura K, Iguchi Y, et al. DWI/FLAIR mismatch basedintravenous thrombolysis in acute stroke patients with unknownonset time[J]. Nosotchu, 2012, 34(1): 51-5.
[18]肖 红, 赵 斐, 孙 岚. DWI-FLAIR不匹配对不明时间窗组急性缺血性脑卒中患者溶栓治疗的指导意义[J]. 医药论坛杂志, 2023, 44(18): 106-9, 113.
[19]殷庆龙, 葛文浩, 李 晖, 等. 磁共振弥散加权成像(DWI)技术在急性脑梗死中的应用价值[J]. 中国疗养医学, 2022, 31(6): 656-9.
[20]王一川, 张玉福, 康 杰, 等. DWI结合ADC图在超急性期脑梗死诊断中的临床应用效果观察 [J]. 影像研究与医学应用, 2019, 3(18):204-5.
[21]李韵歆, 刘振权, 李 月, 等. 缺血性脑卒中神经血管单元的研究进展[J]. 中华老年心脑血管病杂志, 2019, 21(2): 217-20.
[22]刘海静, 尹继磊, 王丽坤. 3D-ASL联合弥散加权成像、血管成像可准确评估急性缺血性脑梗死患者的缺血半暗带区域[J]. 分子影像学杂志, 2022, 45(6): 880-4.
[23]丁 薇. MRI联合CT检查对急性脑梗死的诊断价值[J]. 河南医学研究, 2019, 28(15): 2827-8.
[24]郭华峰, 王晓男, 杨 璐. 多层螺旋CT联合MRI检查在脑梗死合并脑出血诊断中的应用[J]. 实用临床医药杂志, 2020, 24(23): 8-10, 14.
[25]宋士萍, 吕 莹, 许明杰, 等. 大面积脑梗死68例临床特点分析[J]. 中国康复理论与实践, 2003, 9(10): 626-7.
[26]Durukan A, Tatlisumak T. Acute ischemic stroke: overview of majorexperimental rodent models, pathophysiology, and therapy of focalcerebral ischemia[J]. Pharmacol Biochem Behav, 2007, 87(1):179-97.
[27]Kastritis E, Dialoupi I, Gavriatopoulou M, et al. Primary treatmentof light-chain amyloidosis with bortezomib, lenalidomide, anddexamethasone[J]. Blood Adv, 2019, 3(20): 3002-9.
[28]Toyoda K, Ida M, Fukuda K. Fluid-attenuated inversion recoveryintraarterial signal: an early sign of hyperacute cerebral ischemia[J].AJNR Am J Neuroradiol, 2001, 22(6): 1021-9.
[29]Lu XD. Editorial comment: prognostic value of post-treatment fluid-attenuated inversion recovery vascular hyperintensity in ischemicstroke after endovascular thrombectomy[J]. Eur Radiol, 2022, 32(12): 8065-6.
[30]Yeo LL, Paliwal P, Teoh HL, et al. Assessment of intracranialcollaterals on CT angiography in anterior circulation acute ischemicstroke[J]. AJNR Am J Neuroradiol, 2015, 36(2): 289-94.
[31]尹剑兵, 陈海涛, 葛建兵, 等. FLAIR与SWI对急性缺血性脑卒中患者侧支循环及临床疗效的评估价值[J]. 中国研究型医院, 2024, 11(4): 19-24.
[32]Lee DK, Kim JS, Kwon SU, et al. Lesion patterns and strokemechanism in atherosclerotic middle cerebral artery disease: earlydiffusion-weighted imaging study[J]. Stroke, 2005, 36(12): 2583-8.
[33]Jeong HS, Kwon HJ, Song HJ, et al. Impacts of rapid recanalizationand collateral circulation on clinical outcome after intraarterialthrombolysis[J]. J Stroke, 2015, 17(1): 76-83.(编辑:郎 朗)
