乳腺癌放疗中的心脏保护策略:从分割技术到剂量控制
2024-12-31黄靖涵李霞麦迪娜·巴吐尔周创辉周凌宏秦耿耿
摘要:乳腺癌是女性最常见的恶性肿瘤,其发病率位居女性恶性肿瘤之首。放射治疗作为乳腺癌的重要治疗手段,能够有效降低复发率和死亡率。然而,在放疗过程中,心脏不可避免地暴露于电离辐射中,从而增加心脏毒性的风险,尤其是缺血性心肌病等并发症。因此,在乳腺癌放疗中,如何有效保护心脏并降低其受照剂量成为治疗中的关键挑战。本文将从放疗对心脏的影响、心脏剂量限值、心脏区域自动分割技术以及降低心脏受照剂量的策略四个方面进行探讨,旨在通过多种技术手段实现心脏的有效保护,从而降低心脏并发症的风险,提升患者的长期生存质量。
关键词:乳腺癌;放射治疗;深度学习;分割;心脏受照剂量
Cardiac protection strategies in breast cancer radiotherapy: from segmentation
technology to dose control
HUANG Jinghan 1 , LI Xia 2 , MAIDINA Batuer 1 , ZHOU Chuanghui 3 , ZHOU Linghong 1 , QIN Genggeng 1, 4
1 School of Biomedical Engineering, Southern Medical University, Guangzhou 510000, China;" 2 Department of Radiation Oncology,
4 Department of Radiology, Nanfang Hospital, Southern Medical University, Guangzhou 510000, China;" 3 School of Medical and Information
Engineering, Gannan Medical University, Ganzhou 341000, China
Abstract: Breast cancer is the most common malignancy among women, with the highest incidence rate of all female cancers.Radiotherapy is an essential treatment modality for breast cancer, effectively reducing recurrence and mortality rates.However, during radiotherapy, the heart inevitably gets exposed to ionizing radiation, increasing the risk of cardiac toxicity,particularly complications such as ischemic cardiomyopathy. Therefore, effective cardiac protection and minimizing heartradiation exposure are crucial challenges in breast cancer radiotherapy. This review explores four key aspects: the impact ofradiotherapy on the heart, cardiac dose constraints, automated segmentation of cardiac regions, and strategies to reducecardiac dose exposure, in order to implement effective cardiac protection through various technologies to reduce the risk ofcardiac complications and improve patients' long-term quality of life.
Keywords: breast cancer; radiotherapy; deep learning; segmentation; cardiac radiation dose
乳腺癌是全球女性中最常见的恶性肿瘤,其发病率已超过肺癌[1]。据数据统计,乳腺癌、肺癌及结直肠癌占女性新发恶性肿瘤的51%,其中乳腺癌占32%[2] 。全球每年新增乳腺癌病例超过200万例,其中约2/3的乳腺癌患者需要接受放射治疗[3] 。术后辅助放疗有助于提高局部肿瘤控制率,降低复发率和远处转移的风险,最终提高患者的生存率。与单纯的根治术相比,术后辅助放疗可显著改善预后[4-7] 。区域淋巴结放疗显著降低了乳腺癌患者的复发率、乳腺癌死亡率和全因死亡率,特别是对于有阳性腋窝淋巴结的患者[8] 。然而,乳腺癌放疗的一个重要挑战是如何在确保肿瘤控制的同时,尽量减少正常组织的辐射暴露,特别是在左侧乳腺癌患者中[9],心脏及其亚结构常常暴露在照射野内。研究表明,左侧乳腺癌放疗可能会增加心脏疾病的发生率,特别是冠状动脉疾病和心肌梗死[10] 。手动勾画心脏及其亚结构不仅复杂且耗时,并且受限于操作者的经验,可能导致勾画的精度和一致性不足。这使得精准分割心脏结构以降低心脏高危区域受照剂量,成为临床实践中亟待解决的问题。本研究旨在全面探讨乳腺癌放疗中的心脏保护策略,特别是在分割技术与剂量控制方面的应用,重点展示本文在多技术手段整合上的创新,为临床实践提供更有效的心脏保护方法。
1 乳腺癌放射治疗中心脏的不良反应
长期随访研究表明,乳腺癌放射治疗与心脏不良反应密切相关[11] 。常见的放射治疗后心脏毒性可表现为心律失常、心包炎、充血性心脏病、缺血性心肌病(心肌梗死)或瓣膜病等[12, 13] 。多项研究表明,放射治疗(尤其是涉及颈动脉、冠脉其他主要动脉的大范围暴露)显著增加了心血管疾病死亡风险[14, 15]。有研究对1970~2003年间接受放射治疗的199例浸润性乳腺癌或导管内癌患者进行研究,发现左侧乳腺癌放疗显著增加了远端左前降支管腔狭窄的风险,达4~7倍之多[16] 。这表明放射治疗与冠状动脉狭窄部位存在直接关联。有研究纳入1958~2001年间接受乳腺癌放疗的2168例患者,将接受放疗的乳腺癌患者的缺血性心脏病发生率与其受照剂量和个人心脏危险因素联系起来,发现心脏平均剂量每增加1 Gy,冠状动脉异常发生率线性增加7.4%[17] 。然而,患者没有放疗的情况下也存在患缺血性心脏病风险,但是电离辐射会使乳腺癌患者缺血性心脏病风险增加数倍[18]。因此,为了进一步降低乳腺癌患者的心脏毒性风险,可以结合乳腺癌复发率、死亡率及其他疾病风险,来更精准地预测患者在临床中面临的风险[19]。乳腺癌患者放疗时,其心脏接受的辐射剂量因人而异,导致患者之间心脏毒性风险存在显著差异[19, 20] 。一项关于乳腺癌保乳手术后放疗的荟萃分析研究了10801例女性,发现对于无心脏风险因素的患者,保乳术后放疗可将 15 年内的死亡风险从 25.2% 降低至21.4%[21]。另有研究表明,左侧乳腺癌患者放射治疗时,心脏接受2 Gy平均剂量,30年内由电离辐射导致缺血性心脏病的死亡风险低于0.1%[17] 。对于这类患者,放疗的益处显然大于其心脏毒性风险。对于心脏剂量限制无法满足靶区剂量覆盖或已有心脏病史的患者,可考虑降低心脏放疗剂量以减少辐射引发的心脏风险[21]。
2 乳腺癌患者接受放射治疗时心脏剂量限值
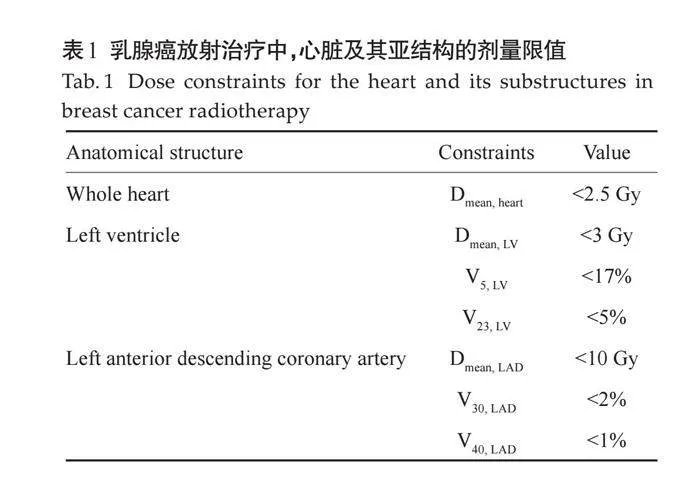
德国放射肿瘤协会乳腺癌专家小组提出剂量限值(表1)。2003~2013年间,在28个国家的149项研究报道的398种方案中,左侧乳腺癌患者的心脏平均剂量为5.4 Gy;调强放疗(IMRT)的心脏平均剂量为5.6 Gy;而呼吸控制的切线放射治疗和侧卧位治疗可将心脏平均剂量分别降至1.3 Gy和1.2 Gy;质子放疗(PT)的心脏平均剂量最低,仅为0.5 Gy。在右侧乳腺癌患者中,基于23项研究的45种方案数据,心脏平均剂量为3.3 Gy。综上所述,左侧乳腺癌放疗中评估心脏剂量差异很大,PT在左侧乳腺癌患者中提供了最低的心脏平均剂量[22]。心脏平均剂量是预测心脏毒性的重要参数,减少心脏平均剂量可有效降低心脏相关风险[16, 17, 23] 。通过现代化放疗技术,乳腺癌患者的心脏平均剂量可以降至2~3 Gy以下。有研究使用现代三维技术和切线束治疗左侧乳腺癌,发现心脏平均剂量为2.1 Gy[24] 。一项对2007~2013年间256例左侧乳腺癌患者的研究表明,心脏平均剂量在0.91~4.45 Gy间[25] 。尽管放疗技术的进步显著降低了心脏平均剂量,但左前降支等心脏亚结构仍然会暴露在高剂量下[26]。有研究指出,左心室前部相关区域最大剂量高达47.2 Gy,左前降支平均和最大剂量分别为9.2 Gy和24.6 Gy[27] 。因此,对于左侧乳腺癌患者,即使心脏平均剂量较低,心脏亚结构仍可能接受高剂量照射[28]。
IMRT与PT在减少心脏辐射剂量方面各有优势。IMRT通过优化剂量分布降低了心脏受照剂量,但其复杂性和成本较高。PT则利用布拉格峰效应实现了精确的剂量控制,显著减少了心脏暴露剂量,但设备的可及性限制了其应用范围。因此,基于患者的具体情况选择合适的技术显得尤为重要。
3 乳腺癌放疗中心脏区域的分割技术
由于放射治疗专用CT设备获取的图像难以清晰显示心脏亚结构,有研究利用MRI优越的软组织对比度,与CT图像共同优化MR/CT图谱,以提高心脏、大血管和室间隔分割精度[29] 。这一方法为放疗期间的心脏保护提供了坚实基础。然而,在冠状动脉分割方面,MRI和CT联合方法的效果仍然有限。有研究开发并测试了一种自动化算法,能够在所有图像中实时检测心脏边缘,监控乳腺癌治疗时心脏暴露在射线的区域[30] 。有研究基于图谱的自动分割方法可以准确地勾画出心脏和部分亚结构,但左前降支分割效果较差[31]。尽管这些方法在心脏整体分割中表现出色,但在亚结构的精确分割,尤其是冠状动脉左前降支(LADCA)的分割方面,仍存在不足。
基于图谱自动分割技术依赖于图像配准算法的精度,在解剖结构发生较大变化和边缘不清晰的情况下,表现并不理想[32]。随着人工智能技术的发展,深度学习在医学图像处理领域取得了巨大进展[33] 。基于深度学习的自动分割技术可以自适应地探索医学图像中的代表性特征,并具有迁移学习能力[34]。有学者利用深度学习、多图谱映射和几何建模设计了一种模型,可以在CT图像上自动分割心脏亚结构,结果显示,除LADCA外,其他所有结构的体积比接近1。该模型能够准确分割大部分心脏亚结构,然而对于LADCA的分割仍存在一定的误差[35]。有研究提出了一种基于CT图像深度学习网络的自动分割心脏亚结构的方法,该方法使用了掩模评分区域卷积神经网络,除LADCA以及二尖瓣和三尖瓣外,其他亚结构分割效果良好[36]。有学者提出了一种基于深度学习相互增强策略的自动分割方法,该模型由3个子网络组成:视网膜U-net、分类模块和分割模块。与3D U-net、掩模R-CNN、掩模评分R-CNN及不合分类模块的网络相比,所提出的方法能够提高小型亚结构(如冠状动脉)分割精度,同时保证较大亚结构的分割精度[37]。
在分割技术的讨论中,深度学习方法相比传统手动分割具有显著的优势。传统手动分割不仅耗时且易受操作者经验影响,而深度学习技术能够自动化地进行大规模数据处理,减少人为误差,提高分割精度和一致性,尤其在复杂解剖结构下具有优势。
对于乳腺癌放疗中的心脏保护策略,虽然图谱和深度学习技术在分割心脏亚结构方面取得了进展,但仍存在显著误差。有学者提出,以高风险心脏区域替代易受电离辐射影响的LADCA,可以更好地在乳腺癌放疗中保护心脏[38] 。研究纳入40例接受放疗的乳腺癌患者,勾画出LADCA和8个高危心脏区域(HRCZ)。研究表明,3.5 cm宽的HRCZ可以作为LADCA在乳腺癌放疗中的可靠替代区域,对HRCZ施加最大剂量限制可以有效减少LADCA的受照剂量,自动分割算法可准确地勾画出HRCZ[38] 。后续进一步研究,有学者提出了一个简化的功能性心脏图谱,并用HRCZ替代LADCA。这不仅减少了LADCA的勾画难度,还提高了自动分割心脏亚结构的准确性[39]。
4 降低心脏受照剂量的措施
有研究选取14例健康女性志愿者进行了心脏MRI检查,以确定典型左侧乳腺癌患者在放射治疗时心脏受照体积。在潮末容积(基线)、深吸气和强制呼气时,通过保持呼吸获取的覆盖整个心脏的连续横切片堆叠,评估放射治疗区域内的心脏容积。结果显示,深吸气屏气减少了心脏受照体积。然而,受限于样本量较小,且对长期呼吸控制的可行性缺乏明确探讨,这些因素可能影响该结论的广泛适用性[40] 。有研究选取15例中位年龄53岁的患者,在正常呼吸和深吸气后屏气时分别进行CT扫描。结果显示,深吸气后屏气时心脏容积显著降低,其中7例患者的心脏完全移出照射区域[41] 。研究证实,深吸气屏气时的心脏位置是保护心脏的理想位置[41-43] 。尽管呼吸周期对心脏暴露的影响得到证实,研究未详细讨论这种技术在更广泛患者群体中的适用性以及该群体的代表性。有研究纳入24例女性,通过持续正压通气作为辅助手段,减少乳腺癌放疗中的心脏受照剂量。结果显示,持续正压通气辅助放疗不仅可行,还能在降低心脏受照剂量的同时,保证靶区剂量覆盖,提升左侧乳腺癌患者的治疗效果[44]。然而,研究尚需验证持续正压通气技术在患者间的个体差异、通气方法的可重复性及其长期临床效果。有学者对比了30例接受多导管腔内放射治疗加速部分乳腺照射治疗的患者和22例接受深吸气屏气全乳腺照射并同步整合肿瘤增强技术的患者,证实了多导管腔内放射治疗加速部分乳腺照射更适合保护患者的心脏[45]。然而,不同治疗技术受治疗方案和患者适应症的影响较大,仍需进一步研究以验证其在更广泛人群中的适用性。
5 总结与展望
在乳腺癌放疗中,特别是左侧乳腺癌患者,心脏暴露于照射区域内会显著增加心脏毒性风险,因此,降低心脏受照剂量一直是临床关注的重点。然而,仅仅依赖心脏平均剂量来评估心脏受照风险是不够的。多项研究表明,即使在乳腺癌放疗中,心脏平均剂量未超过2 Gy,左心室及左前降支等心脏亚结构仍然可能受到高剂量照射,进而导致严重的心脏并发症。因此,更应关注高危心脏区域的受照剂量。目前,心脏保护的措施多种多样,包括:通过协调呼吸周期或采用侧卧位治疗等技术手段,避免心脏暴露于照射区域;使用更为先进的放疗技术,如IMRT或PT;利用深度学习等人工智能技术,提升高危心脏区域的自动分割精度,以便更精确地评估和控制这些区域的受照剂量。
尽管上述策略在临床实践中已展现出显著的心脏保护效果,但在实际应用中仍面临诸多挑战。IMRT能够通过优化剂量分布显著降低正常组织的辐射暴露,是目前应用最广泛的技术之一。临床数据显示,IMRT在减少心脏平均剂量方面表现出色,但仍存在部分高剂量区可能导致心脏并发症的风险。此外,IMRT的复杂性和较高的成本也是其应用的挑战。PT则因其独特的布拉格峰效应,能够更精准地控制辐射剂量,将高剂量区域集中在肿瘤部位,显著减少心脏及其他正常组织的受照剂量。临床研究表明,PT在减少心脏暴露剂量方面效果显著,尤其在左侧乳腺癌放疗中具有明显优势。然而,PT的高昂成本和设备的有限可及性限制了其广泛应用。深度学习辅助的自动分割技术为心脏亚结构的精准勾画提供了新的可能性。通过自动化分割,能够提高心脏亚结构勾画的准确性和一致性,减少人为操作的误差。尽管如此,这一技术在复杂解剖结构下的鲁棒性和适应性仍需进一步提升。当前临床数据支持其在提高勾画效率和精度方面的潜力,但在大规模推广应用前,仍需更多的验证性研究。
未来的研究应进一步关注以下几个方面:第一,如何在保证靶区剂量覆盖的前提下,进一步降低心脏及其亚结构的受照剂量,特别是对于高危心脏区域的精准保护。第二,在新技术和新方法的开发中,既要考虑技术的先进性,也要重视其在临床实践中的可操作性和可推广性。例如,PT虽然在心脏保护方面表现优异,但其高昂的成本和有限的可及性限制了其广泛应用。第三,随着人工智能技术的不断进步,基于深度学习的心脏亚结构自动分割技术将成为未来的研究热点。如何提升算法的鲁棒性和适应性,使其在各种临床场景中都能保持较高的分割精度,是未来研究的关键方向。第四,除了放疗技术的优化外,还需加强对放疗后心脏并发症的长期随访和管理,建立更加完善的预警和干预体系,以便在放疗后期及时发现和处理心脏毒性,最大限度地保护患者的生命质量。
综上所述,在乳腺癌放疗中,心脏保护仍然是一个复杂而关键的课题。未来的研究和临床实践需要进一步整合多学科力量,探索更加有效的心脏保护策略,以便在提升乳腺癌患者生存率的同时,最大限度地降低其心脏并发症的风险。这不仅关乎治疗效果,更关系到患者的长期生存质量。
参考文献:
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[2] Siegel R, Giaquinto AN, Jemal A. Cancer statistics, 2024[J]. CA ACancer J Clin, 2024, 74: 12-49.
[3] Coles CE, Bliss JM, Poortmans PM. Accelerated partial breastirradiation: more questions than answers? [J]. Lancet, 2019, 394(10215): 2127-9.
[4] Christiansen P, Carstensen SL, Ejlertsen B, et al. Breast conservingsurgery versus mastectomy: overall and relative survival-apopulation based study by the Danish Breast Cancer CooperativeGroup (DBCG)[J]. Acta Oncol, 2018, 57(1): 19-25.
[5] Corradini S, Reitz D, Pazos M, et al. Mastectomy or breast-conserving therapy for early breast cancer in real-life clinicalpractice: outcome comparison of 7565 cases[J]. Cancers, 2019, 11(2): 160.
[6] van Maaren MC, de Munck L, de Bock GH, et al. 10 year survivalafter breast-conserving surgery plus radiotherapy compared withmastectomy in early breast cancer in the Netherlands: a population-based study[J]. Lancet Oncol, 2016, 17(8): 1158-70.
[7] Vicini FA, Cecchini RS, White JR, et al. Long-term primary resultsof accelerated partial breast irradiation after breast-conservingsurgery for early-stage breast cancer: a randomised, phase 3,equivalence trial[J]. Lancet, 2019, 394(10215): 2155-64.
[8] Early Breast Cancer Trialists' Collaborative Group (EBCTCG).Radiotherapy to regional nodes in early breast cancer: an individualpatient data meta-analysis of 14 324 women in 16 trials[J]. Lancet,2023, 402(10416): 1991-2003.
[9] Wennstig AK, Wadsten C, Garmo H, et al. Long-term risk ofischemic heart disease after adjuvant radiotherapy in breast cancer:results from a large population-based cohort[J]. Breast Cancer Res,2020, 22(1): 10.
[10]Honaryar MK, Locquet M, Allodji R, et al. Cancer therapy-relatedcardiac dysfunction after radiation therapy for breast cancer: resultsfrom the BACCARAT cohort study[J]. Cardiooncology, 2024, 10(1): 54.
[11]Hooning MJ, Aleman BM, van Rosmalen AJ, et al. Cause-specificmortality in long-term survivors of breast cancer: a 25-year follow-up study[J]. Int J Radiat Oncol Biol Phys, 2006, 64(4): 1081-91.
[12]Duma MN, Molls M, Trott KR. From heart to heart for breast cancerpatients-cardiovascular toxicities in breast cancer radiotherapy[J].Strahlenther Onkol, 2014, 190(1): 5-7.
[13]Carlson RG, Mayfield WR, Normann S, et al. Radiation-associatedvalvular disease[J]. Chest, 1991, 99(3): 538-45.
[14]Kurtz JM. Radiotherapy for early breast cancer: was acomprehensive overview of trials needed? [J]. Lancet, 2000, 355(9217): 1739-40.
[15]Meattini I, Poortmans PM, Aznar MC, et al. Association of breastcancer irradiation with cardiac toxic effects: a narrative review[J].JAMA Oncol, 2021, 7(6): 924-32.
[16]Nilsson G, Holmberg L, Garmo H, et al. Distribution of coronaryartery stenosis after radiation for breast cancer[J]. J Clin Oncol,2012, 30(4): 380-6.
[17]Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart diseasein women after radiotherapy for breast cancer[J]. N Engl J Med,2013, 368(11): 987-98.
[18]Milo MLH, Thorsen LBJ, Johnsen SP, et al. Risk of coronary arterydisease after adjuvant radiotherapy in 29, 662 early breast cancerpatients: a population-based Danish Breast Cancer Group study[J].Radiother Oncol, 2021, 157: 106-13.
[19]Taylor CW, Kirby AM. Cardiac side-effects from breast cancerradiotherapy[J]. Clin Oncol (R Coll Radiol), 2015, 27(11): 621-9.
[20]Vandewinckele L, Claessens M, Dinkla A, et al. Overview ofartificial" intelligence-based" applications" in" radiotherapy:recommendations for implementation and quality assurance[J].Radiother Oncol, 2020, 153: 55-66.
[21]Early Breast Cancer Trialists' Collaborative Group (EBCTCG),Darby S, McGale P, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancerdeath: meta-analysis of individual patient data for 10, 801 women in17 randomised trials[J]. Lancet, 2011, 378(9804): 1707-16.
[22]Taylor CW, Wang Z, MacAulay E, et al. Exposure of the heart inbreast cancer radiation therapy: a systematic review of heart dosespublished during 2003 to 2013[J]. Int J Radiat Oncol Biol Phys,2015, 93(4): 845-53.
[23]Taylor CW, Nisbet A, McGale P, et al. Cardiac doses from Swedishbreast cancer radiotherapy since the 1950s[J]. Radiother Oncol,2009, 90(1): 127-35.
[24]Piroth MD, Petz D, Pinkawa M, et al. Usefulness of a thermoplasticbreast bra for breast cancer radiotherapy: Aprospective analysis[J].Strahlenther Onkol, 2016, 192(9): 609-16.
[25]Chang JS, Chen J, Weinberg VK, et al. Evaluation of heart dose forleft-sided breast cancer patients over an 11-year period spanning thetransition from 2-dimensional to 3-dimensional planning[J]. ClinBreast Cancer, 2016, 16(5): 396-401.
[26]Munshi A, Khataniar N, Sarkar B, et al. Spatial orientation ofcoronary arteries and its implication for breast and thoracicradiotherapy-proposing \"coronary strip\" as anew organ at risk[J].Al, 2018, 194(8): 711-8.
[27]Tan WY, Liu D, Xue CB, et al. Anterior myocardial territory mayreplace the heart as organ at risk in intensity-modulated radiotherapyfor left-sided breast cancer[J]. Int J Radiat Oncol Biol Phys, 2012,82(5): 1689-97.
[28]Piroth MD, Baumann R, Budach W, et al. Heart toxicity from breastcancer radiotherapy: current findings, assessment, and prevention[J]. Strahlenther Onkol, 2019, 195(1): 1-12.
[29]Morris ED, Ghanem AI, Pantelic MV, et al. Cardiac substructuresegmentation and dosimetry using a novel hybrid magneticresonance and computed tomography cardiac atlas[J]. Int J RadiatOncol Biol Phys, 2019, 103(4): 985-93.
[30]Poulsen PR, Thomsen MS, Hansen, et al. Fully automated detectionof heart irradiation in cine MV images acquired during breast cancerradiotherapy[J]. Radiother Oncol, 2020, 152: 189-95.
[31]Kaderka R, Gillespie EF, Mundt RC, et al. Geometric and dosimetricevaluation of atlas based auto-segmentation of cardiac structures inbreast cancer patients[J]. Radiother Oncol, 2019, 131: 215-20.
[32]Shen JJ, Gu PH, Wang Y, et al. Advances in automatic delineation oftarget volume and cardiac substructure in breast cancer radiotherapy(Review)[J]. Oncol Lett, 2023, 25(3): 110.
[33]Fu YB, Lei Y, Wang TH, et al. A review of deep learning basedmethods for medical image multi-organ segmentation[J]. PhysMed, 2021, 85: 107-22.
[34]Sahiner B, Pezeshk A, Hadjiiski LM, et al. Deep learning in medicalimaging and radiation therapy[J]. Med Phys, 2019, 46(1): e1-e36.
[35]Finnegan RN, Chin V, Chlap P, et al. Open-source, fully-automatedhybrid cardiac substructure segmentation: development andoptimisation[J]. Phys Eng Sci Med, 2023, 46(1): 377-93.
[36]Harms J, Lei Y, Tian SB, et al. Automatic delineation of cardiacsubstructures using a region-based fully convolutional network[J].Med Phys, 2021, 48(6): 2867-76.
[37]Momin S, Lei Y, McCall NS, et al. Mutual enhancing learning-basedautomatic segmentation of CT cardiac substructure[J]. Phys MedBiol, 2022, 67(10). doi: 10.1088/1361-6560/ac692d.
[38]Loap P, Tkatchenko N, Nicolas E, et al. Optimization and auto-segmentation of a high risk cardiac zone for heart sparing in breastcancer radiotherapy[J]. Radiother Oncol, 2020, 153: 146-54.
[39]Loap P, De Marzi L, Kirov K, et al. Development of simplified auto-segmentable functional cardiac atlas[J]. Pract Radiat Oncol, 2022,12(6): 533-8.
[40]Chen MH, Chuang ML, Bornstein BA, et al. Impact of respiratorymaneuvers on cardiac volume within left-breast radiation portals[J].Circulation, 1997, 96(10): 3269-72.
[41]Lu HM, Cash E, Chen MH, et al. Reduction of cardiac volume in left-breast treatment fields by respiratory maneuvers: a CT study[J]. IntJ Radiat Oncol Biol Phys, 2000, 47(4): 895-904.
[42]Sixel KE, Aznar MC, Ung YC. Deep inspiration breath hold toreduce irradiated heart volume in breast cancer patients[J]. Int JRadiat Oncol Biol Phys, 2001, 49(1): 199-204.
[43]Remouchamps VM, Vicini FA, Sharpe MB, et al. Significantreductions in heart and lung doses using deep inspiration breath holdwith active breathing control and intensity-modulated radiationtherapy for patients treated with locoregional breast irradiation[J].Int J Radiat Oncol Biol Phys, 2003, 55(2): 392-406.
[44]Allen AM, Ceder YK, Shochat T, et al. CPAP (Continuous PositiveAirway Pressure) is an effective and stable solution for heart sparingradiotherapy of left sided breast cancer[J]. Radiat Oncol, 2020, 15(1): 59.
[45]Knippen S, Schönherr S, Schwedas M, et al. Low doses to the heartin daily practice for treating left-sided breast cancer usingaccelerated partial-breast irradiation by multicatheter brachytherapyand deep-inspiration breath-hold using a SIB[J]. StrahlentherOnkol, 2023, 199(4): 389-95.(编辑:郎 朗)
