基于自噬相关的基因及CT影像特点构建肾细胞癌患者预后模型
2024-11-20李亚县吴伟宙王琼仁詹雄宇郑明星谭万龙

摘要:目的 "探究自噬相关基因在肾细胞癌发展中的作用,基于自噬相关的基因及CT影像特点构建肾细胞癌患者预后模型。方法 "从TCGA数据库下载肾透明细胞癌患者相关资料,结合自噬相关基因集,探索基于自噬相关基因的肾癌分子亚型及构建个体化自噬评分系统;通过分析TCIA数据库中肾细胞癌患者CT资料,构建自噬相关基因风险模型及影像组学模型预测肾癌患者预后。结果 "将肾透明细胞癌分为两种新的分子亚型,预后较差的亚型患者伴有大量免疫细胞浸润(Plt;0.05),且临床分级更高、分期更晚(Plt;0.05)。高自噬评分患者的肿瘤基因突变频率明显增加、肿瘤体积更大、更晚期、预后更差(Plt;0.05)。影像组学联合自噬相关基因模型可较准确预测肾癌患者预后(曲线下面积0.922, 95% CI:0.852~0.993)。结论 "自噬评分高的肾癌患者预后较差,影像组学联合自噬相关基因模型在预测肾癌患者预后中有较好前景。
关键词:肾细胞癌;自噬;影像组学;预后模型
Construction of a prognostic model for renal cell carcinoma patients based on autophagy-related genes and CT imaging characteristics
LI Yaxian1, 2, WU Weizhou2, WANG Qiongren2, ZHAN Xiongyu2, ZHENG Mingxing2, TAN Wanlong1
1Department of Urology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China; 2Department of Urology, Affiliated Maoming Hospital, Southern Medical University (Maoming People's Hospital), Maoming 525000, China
Abstract: Objective To explore the role of autophagy-related genes in the development of renal cell carcinoma and construct a prognostic model for renal cell carcinoma patients based on autophagy-related genes and CT imaging characteristics. Methods The relevant data of patients with renal clear cell carcinoma were downloaded from the TCGA database. Combined with the autophagy-related gene set, the molecular subtypes of renal carcinoma based on autophagy-related genes and the construction of an individualized autophagy scoring system were explored; by analyzing the CT data of patients with renal cell carcinoma in the TCIA database, the autophagy-related gene risk model and the imaging omics model were constructed to predict the prognosis of patients with renal cancer. Results Renal clear cell carcinoma was divided into two new molecular subtypes. Patients with poor prognosis are accompanied by a large number of immune cell infiltration (Plt;0.05), and have higher clinical grades and more advanced stages (Plt;0.05). Patients with high autophagy scores have significantly increased tumor gene mutation frequencies, larger tumor volumes, more advanced stages, and worse prognoses (Plt;0.05). Radiomics combined with autophagy-related gene model can accurately predict the prognosis of patients with renal cancer (AUC: 0.922, 95% CI: 0.852-0.993). Conclusion Renal cancer patients with high autophagy scores have a poor prognosis. Radiomics combined with autophagy-related gene model has good prospects in predicting the prognosis of patients with renal cancer.
Keywords: renal cell carcinoma; autophagy; radiomics; prognostic model
肾细胞癌(RCC)是最常见的肾恶性肿瘤,肾透明细胞癌(ccRCC)是其最主要的病理类型[1]。由于早期缺乏明显的症状,大部分ccRCC患者通常是偶然被发现,约20%患者初诊即为晚期[2]。阐明ccRCC发生发展机制对ccRCC防治策略以及改善疾病预后具有重要的临床意义。
自噬作为一种II型程序性细胞死亡方式,是真核细胞生物的细胞内分解代谢过程[3],在肿瘤进程中既可以起到抑制或促进的双重效果。研究发现自噬发生时肾癌细胞系表现出较高的自噬水平[4],且自噬标志物LC3高表达时可促进多种肾癌细胞系的细胞迁移[5]。动物实验表明抑制自噬关键蛋白LC3B的表达可明显抑制裸鼠肾肿瘤的生长[5]。多因素分析提示自噬效应蛋白Beclin1的表达水平与ccRCC无复发生存率呈显著的正相关[6],且Benlin1基因低表达患者的预后明显差于高表达患者[7-8]。此外也有研究通过公共数据库基于自噬相关基因建立ccRCC预后风险模型[9-10]。以上研究均提示自噬的表达水平对肾细胞癌患者的疾病进发挥了重要作用。
既往研究表明,基于病理TNM 分期等常见的临床资料对多种肿瘤具有一定的预后预测价值,但由于个体差异,即使相同的TNM分期的患者的肿瘤微环境也可能存在较大差异,其预后也不同。肾细胞癌异质性明显,生物学行为复杂多变[11]。90%的肾透明细胞癌存在肿瘤内及肿瘤间异质性,其中50%表现出了免疫特征的异质性[12],因此仅靠TNM分期不足以准确评估肾癌患者的疾病进展和预后。影像组学可通过对患者影像学的采集、勾画、分割、特征提取和量化、建模等更无创、相对廉价且便捷的方式在宏观上展示肿瘤整体观[13]。而基因组学则可在分子的微观层面阐释肿瘤的进展及相关可能的机制。因此基因联合影像组学有助于患者分层、提供更全面的临床特征及预后信息以指导制定精准的治疗决策[14]。
目前尚未见有关量化肾细胞癌患者个体自噬表达水平及基于自噬水平的CT影像学特点评估预后的研究。本研究通过收集、分析TCGA数据库肾透明细胞癌患者相关数据,结合患者肿瘤分级分期、预后及TCIA数据库中影像学资料等临床信息,探讨自噬相关基因在肾正常组织与肿瘤组织中表达情况,筛选出具有差异的自噬相关基因及影像组学特征,根据自噬相关基因特征构建新的肾癌分子亚型并分析其免疫浸润情况,随后构建基于个体的自噬水平的评分系统,探究自噬评分与肿瘤突变、肿瘤体积、预后的相关性。通过构建自噬相关基因和CT影像特征构建RCC预后模型,探讨该模型在RCC癌患者中的应用价值,为辅助肾癌患者预后的评估及精准靶向治疗提供科学实验依据和理论基础。
1 "资料与方法
1.1 "数据来源
在TCGA数据库(https://portal.gdc.cancer.gov/)中下载肾透明细胞癌患者的肿瘤组织及癌旁正常组织的转录组、体细胞突变组和临床资料。自噬相关基因集来源于人类自噬数据库(http://www.autophagy.lu/clustering/)。在TCIA数据库(http://www.cancerimagingarchive.net/)中下载TCGA中肾透明细胞癌患者的CT影像学资料,测量病灶在CT中最长的长径、短径、高度,计算肿瘤体积。肿瘤体积计算公式:
体积=长×宽×高×[π6]。
从TIMER2.0数据库(http://timer.cistrome.org//)下载TCGA-KIRC队列的免疫细胞浸润数据。
1.2 "TCIA数据库影像图像处理
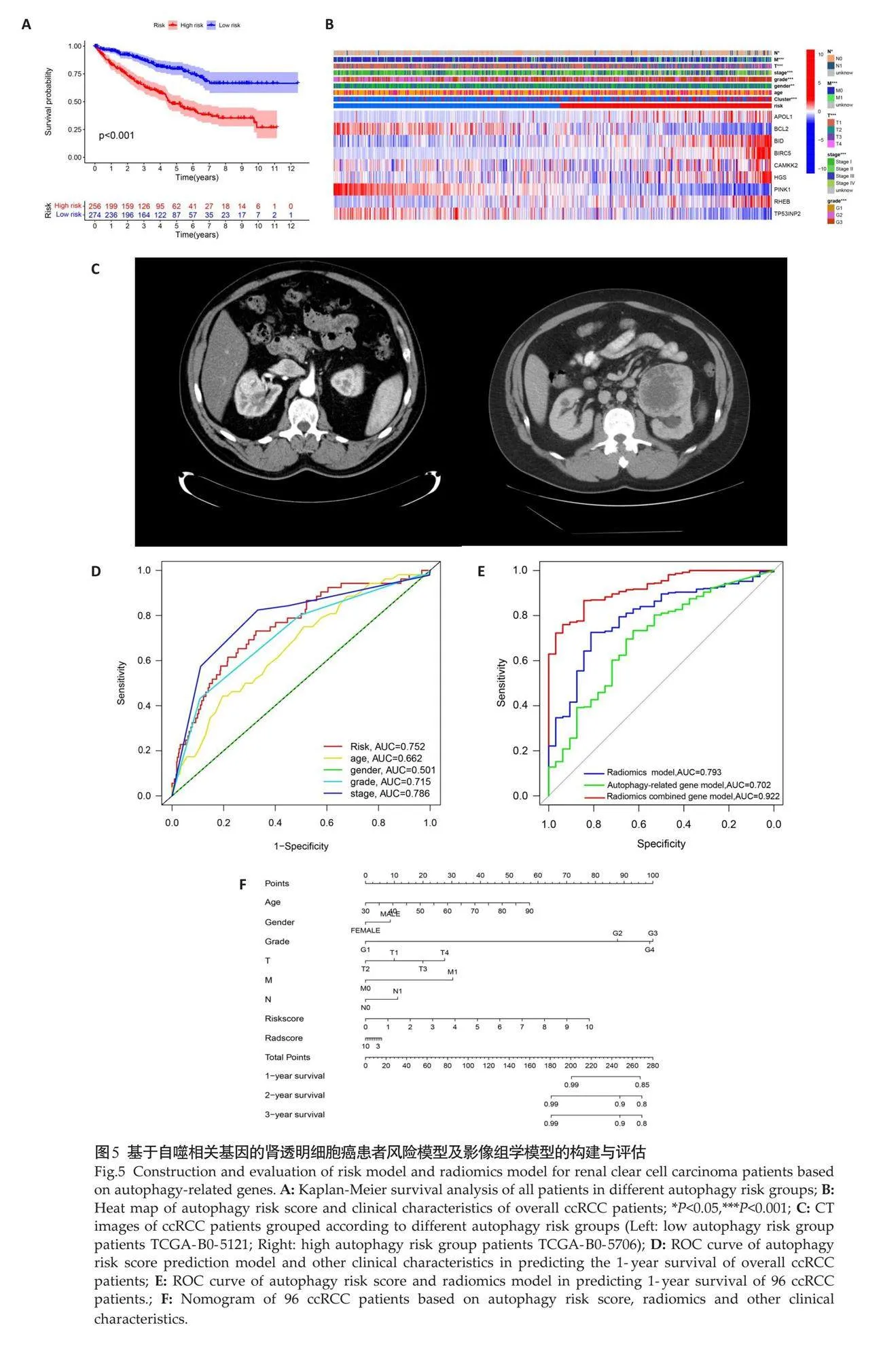
参考既往研究[15]方法,从TCIA数据库下载TCGA-KRIC患者中具有腹部增强CT且成像质量良好的图像,纳入包括平扫期、皮质-髓质期、实质期、排泄期的病例,排除仅有平扫或仅有增强CT图像的病例,结果共纳入96例。由2位从业10年以上的高年资影像科医师及泌尿外科医师手动在皮质-髓质期图像距离肿瘤边缘2 mm沿着肿瘤的边界勾画感兴趣区域,过程需避开肾周脂肪、正常肾组织。使用3D-Slicer 软件及PyRadiomics包提取包括一阶统计特征、形状特征、灰度游程矩阵特征、灰度共生矩阵特征、灰度相关矩阵特征、灰度大小区域矩阵特征和邻域灰度差异矩阵特征等影像组特征。通过Z-score将影像组特征数据标椎化,并将96例患者均分为训练组及验证组,随后联合自噬相关基因构建预后模型。
1.3 "ccRCC患者自噬相关的基因与预后的相关性及其表达情况
为探究自噬相关的基因对患者预后的影响,结合自噬相关基因表达量及生存时间进行单因素分析,筛选出与预后相关的自噬基因。通过|log2(Fold Change) |gt;1,FDRlt;0.05阈值分析具有预后价值的自噬相关基因在患者中肿瘤组织与正常组织的表达差异。
1.4 "构建基于自噬相关基因集的ccRCC分子亚型及与临床相关特征分析
基于上述筛选出的具有预后价值的自噬相关基因对530例肾透明细胞癌患者进行分子亚型分析。利用ConsensusClusterPlus包进行一致性聚类分析,确定最佳分类的K值。通过结合临床信息对亚型进行特征分析,并进行亚型的生存分析。使用CIBERSORT包、limma包探究亚型的免疫景观差异。
1.5 "量化ccRCC患者个体化自噬水平及其与基因突变、临床特征的相关性
ccRCC具有极强的异质性[11-12],为了更好地评价个体自噬水平,本研究构建了一套评分系统来评估单个肾癌患者的自噬基因特征,称为自噬评分。通过1.4方法,已成功将ccRCC患者分为2个分子亚型,采用主成分分析降维方法探究2个亚型患者的自噬水平。参考基因表达分级指数评分[16]、免疫微环境评分[17]及m6A评分[18]的定义方法定义自噬评分:自噬评分= ∑(PC1i + PC2i)。其中i是自噬相关基因的表达水平,PC1i、PC2i分别表示自噬相关基因的表达水平在主成分1、2的得分。根据中位自噬评分,将患者划分为高、低自噬评分组。探究自噬评分对预后的影响,并分析亚型间的自噬评分差异。采用maftools包分析患者体细胞基因突变水平,并分析自噬评分与临床特征之间的相关性。
1.6 "构建基于自噬相关基因的ccRCC患者风险模型及评估预测能力
由于基因之间、影响特征之间存在共线性问题致使预后模型容易发生过拟合的现象。为减少过拟合的可能,结合患者生存时间,使用LASSO回归降维、筛选方法计算各个自噬相关基因的风险系数及最佳影像组学特征,并根据交叉验证Lambda.min值进一步筛选出与患者总体生存率相关的自噬相关基因。随后根据筛选出来的风险基因计算各患者的预后风险评分,并以中位预后风险评分为界将530例患者划分为低风险组和高风险组。预后风险评分=∑coef(RNAn)×exp(RNAn),coef(RNA)代表相应RNA的风险系数,exp(RNA)为相应RNA的表达量。探究不同风险评分的患者的预后差异并结合患者临床信息,可视化风险评分与临床相关性。影像组学评分(Radscore)=∑coef(影像组学特征)×影像组学特征,coef(RNA)代表相应影像组学特征的系数。通过TCIA数据库信息比较不同风险组患者的肿瘤体积。使用multiROC包比较基于自噬相关基因预后模型、影像组学模型与其他临床信息预测的准确性。最后,进一步将此风险模型与患者影像组学特征及临床信息结合,构建新的列线图来预测患者生存率。
1.7 自噬风险与免疫浸润的相关性
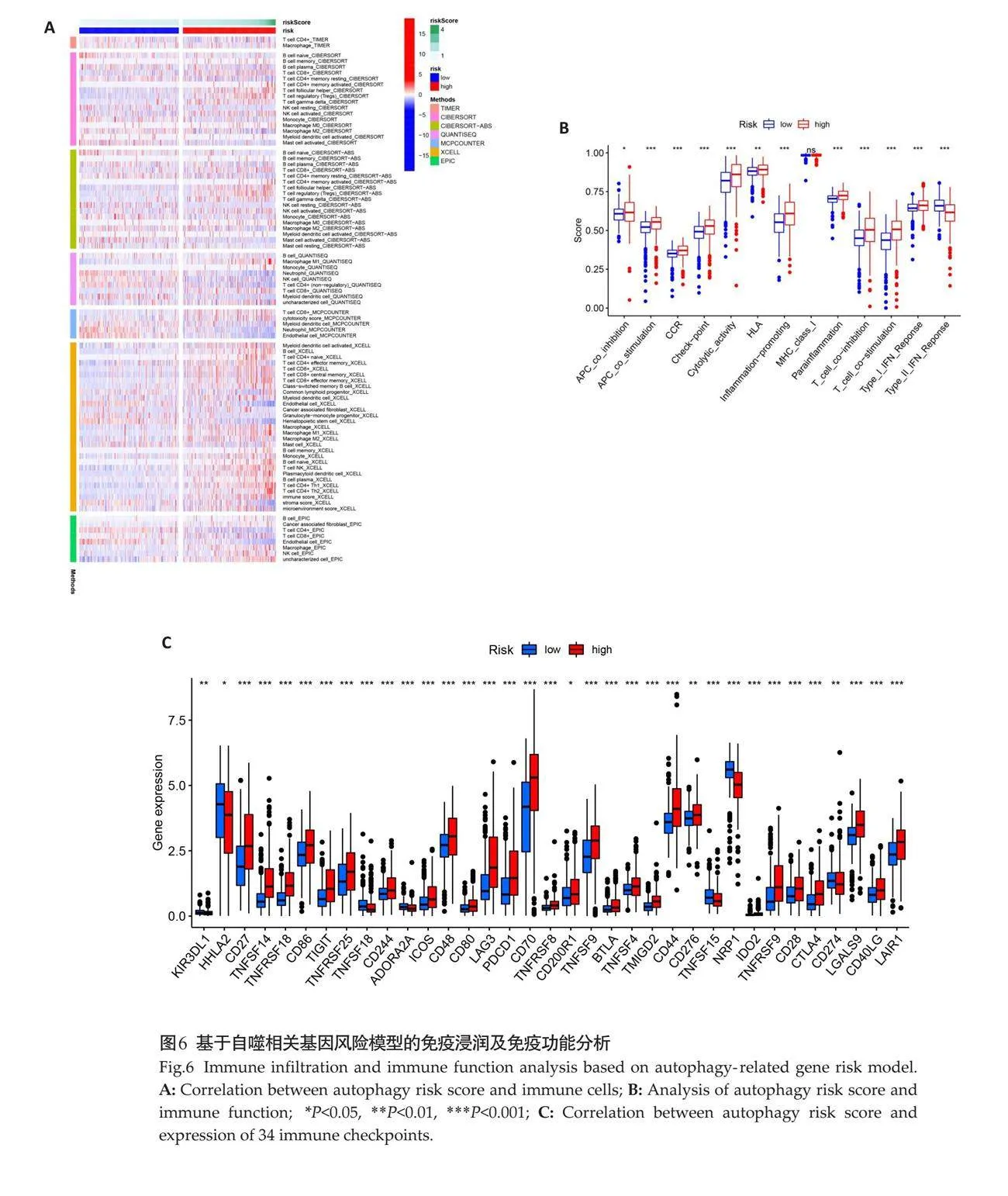
通过7种算法的免疫细胞浸润结果,分析2个风险组的35个免疫检查点相关基因的表达差异。通过分析13种免疫功能,探讨高风险组与低风险组患者之间免疫功能的差异[19]。
1.8 "统计学分析
采用软件SPSS 22.0对数据进行统计分析,采用R studio及GraphPad Prism进行可视化绘图。符合正态分布且方差齐的计量资料以均数±标准差的形式表示,组间比较采用t检验;不符合正态分布的以中位数(四分位数间距)表示,组间比较采用Mann-Whitney U检验;计数资料以n(%)表示,组间比较采用χ2检验。以Plt;0.05为差异有统计学意义。
2 "结果
2.1 "筛选具有预后价值的自噬相关基因
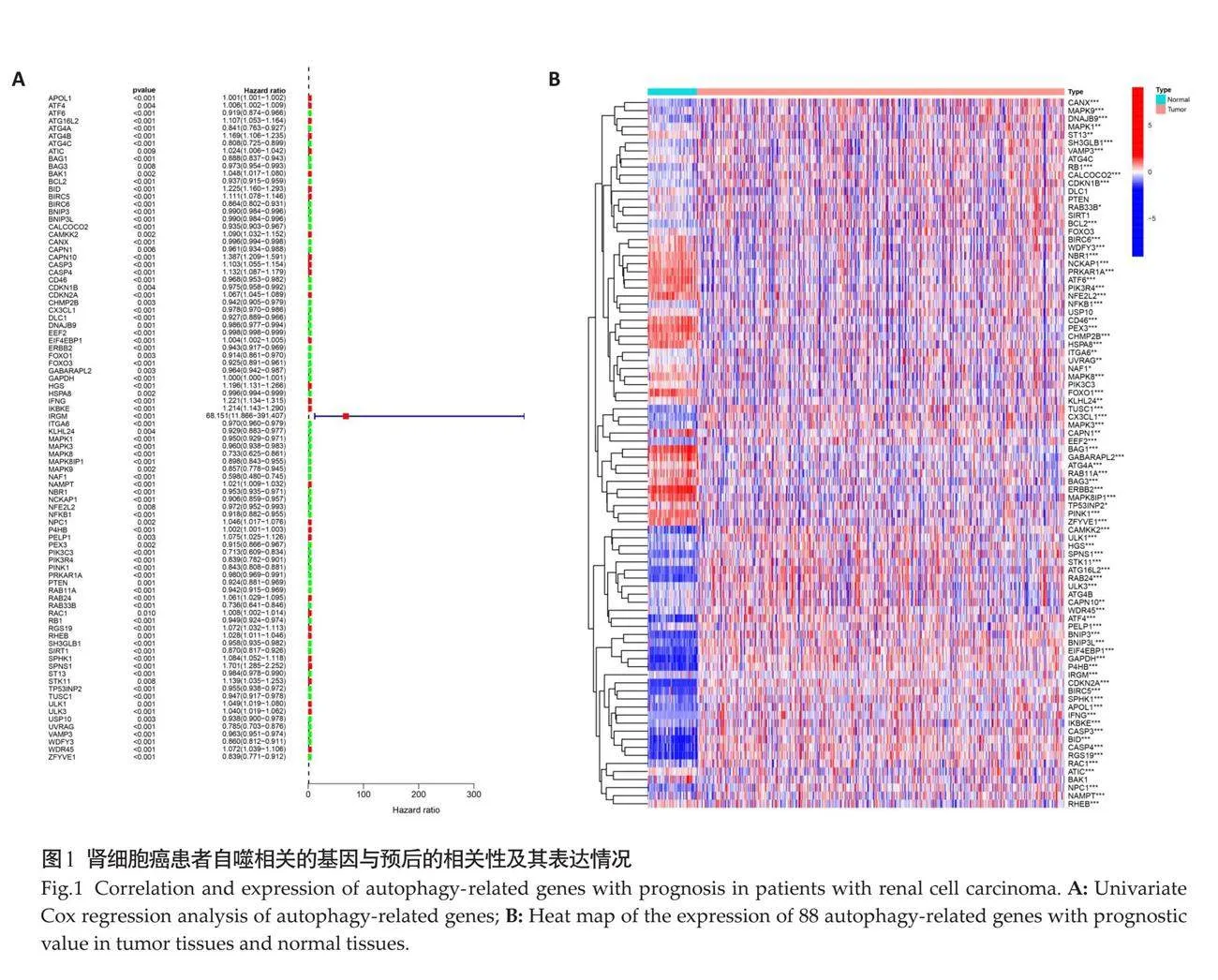
单因素Cox回归结果表明共88个自噬相关基因与预后有关(Plt;0.01),其中33个是危险性基因,55个是保护性基因(图1A)。49个自噬相关基因在肿瘤组织内表达上调,30个自噬相关基因表达下调(Plt;0.05,图1B)。
2.2 "构建基于自噬相关基因集的ccRCC分子亚型及与临床相关特征分析
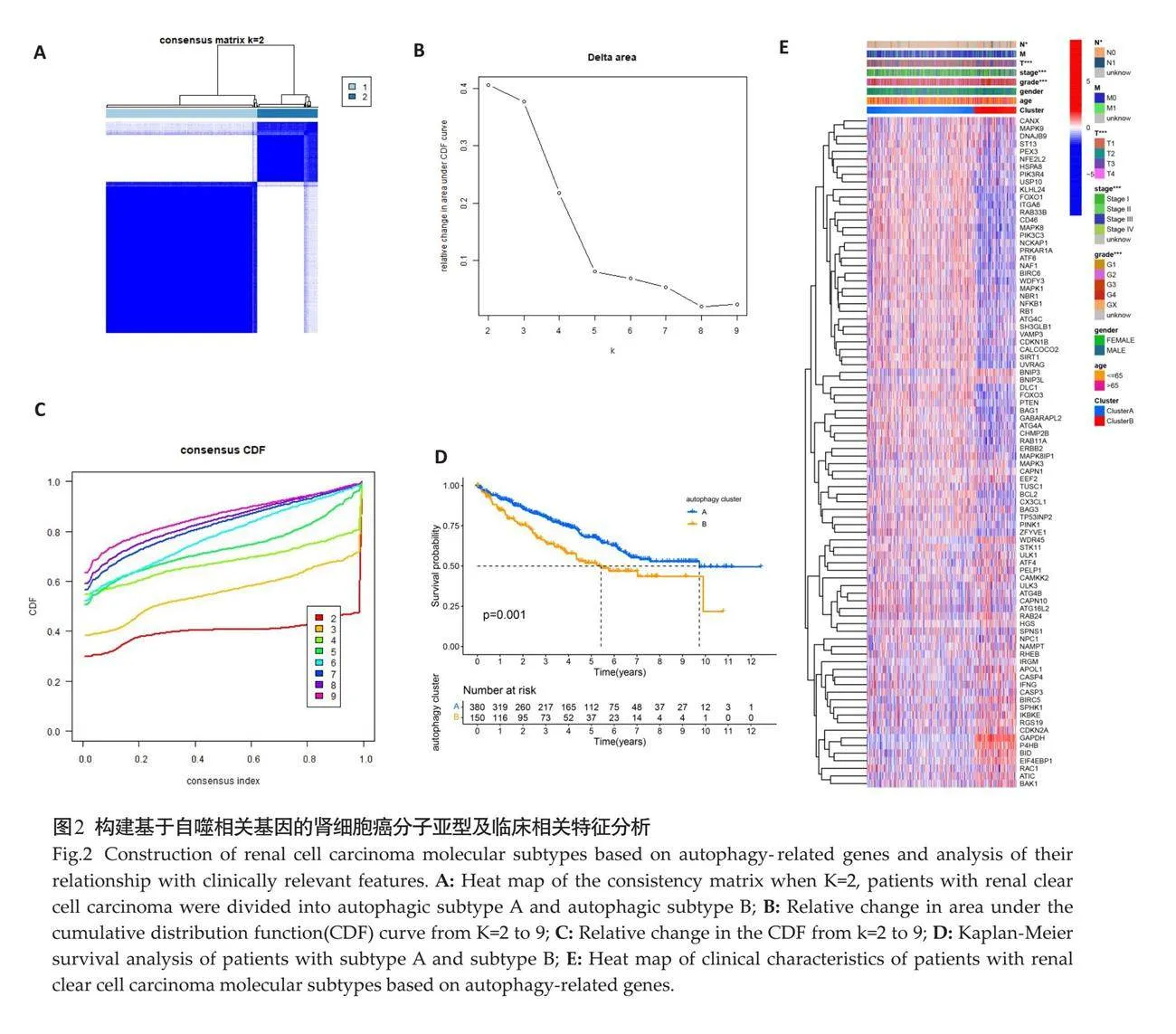
一致性聚类分析结果显示最佳分类K=2时,530例ccRCC患者可分为2种分子亚型A和B(图2A~C),自噬亚型A患者的总体生存率明显优于B组 (P=0.001,图2D),自噬亚型B组具有较晚期的临床分级、分期(高级别及T、N分期的患者比例更多)等特点(图2E)。
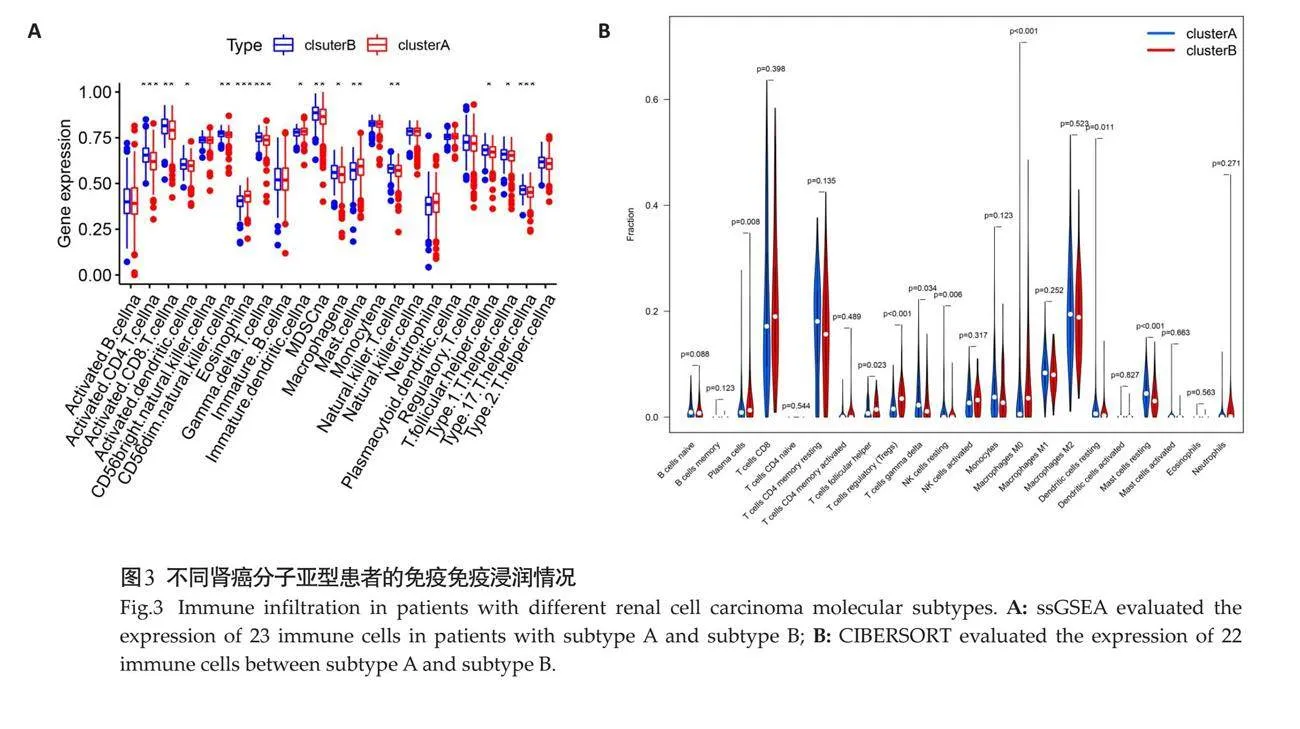
2.3 "不同肾癌分子亚型患者的免疫全景观
活化的CD4 T细胞、Tfh细胞等在自噬亚型B患者中的比例高于自噬亚型A,而嗜酸性粒细胞等自噬亚型A患者中更常见(Plt;0.05,图3A)。浆细胞、辅助T细胞、Tregs细胞等在自噬亚型B患者中更常见(Plt;0.05,图3B)。
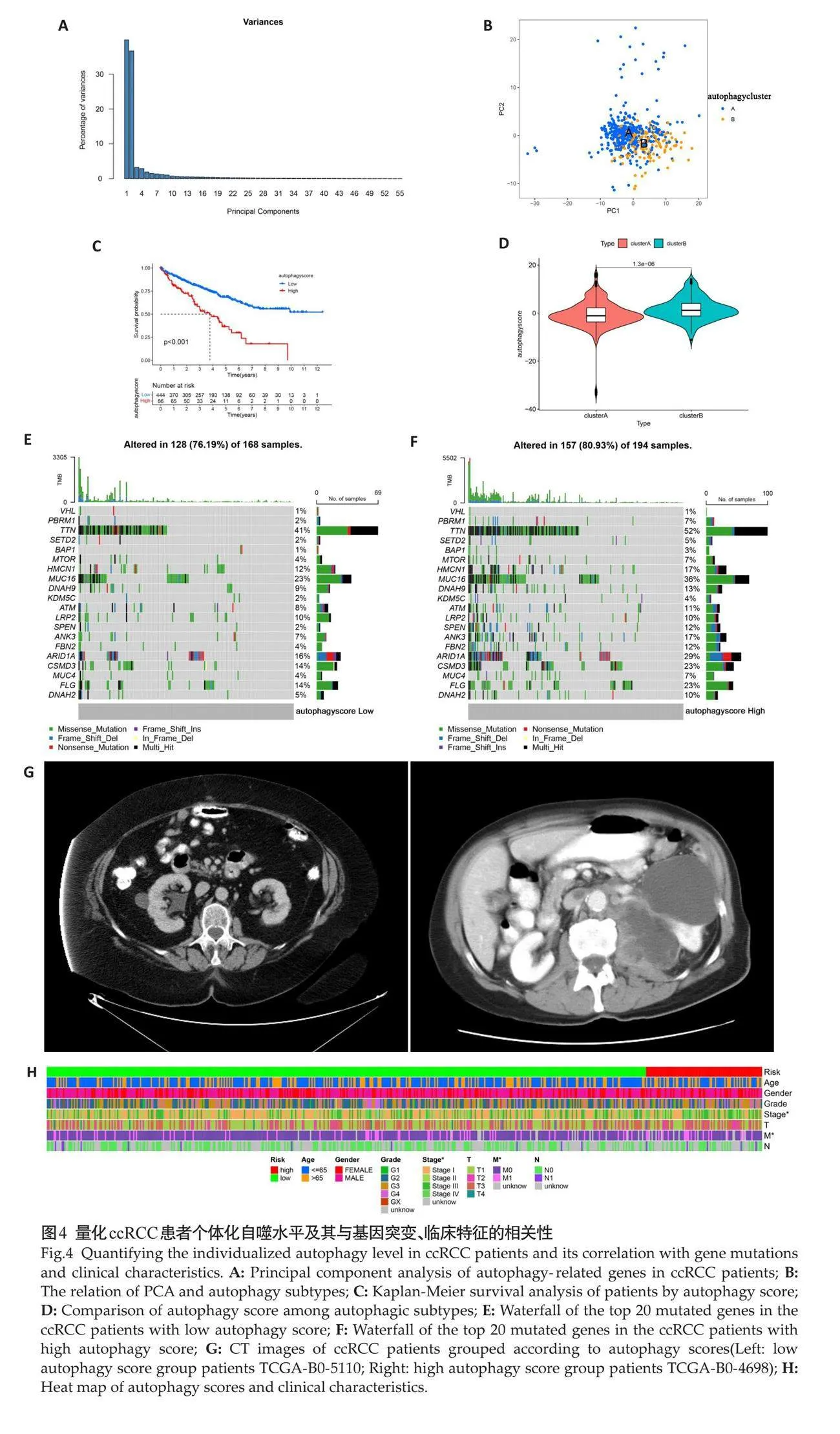
2.4 "量化ccRCC患者个体化自噬水平及其与基因突变、临床特征的相关性
主成分分析结果表明,主成分1、2可以解释92%的全部方差(图4A),因此选择主成分1和2作为特征成分。根据主成分1、2可以较好地区分自噬亚型A、B 2组患者(图4B)。高自噬评分组患者的预后更差(Plt;0.001,图4C),自噬亚型B组患者的自噬评分更高(Plt;0.001,图4D)。高自噬评分组患者的肿瘤相关基因MUC16、ARID1A、CSMD3、FLG、PBRM1、SPEN、ANK3等突变频率高于低自噬评分组(Plt;0.05,图4E~F),自噬可能与基因突变频率有关。高自噬评分组患者肿瘤体积明显大于低自噬评分组[190.96(124.18, 245.49)cm3 vs 43.13 (12.73, 75.06) cm3, Plt;0.001,图4G],晚期患者占比更多(Plt;0.05,图4H)。
2.5 "基于自噬相关基因的肾透明细胞癌患者风险模型及影像组学模型的构建与评估
采用LASSO回归分析筛选出9个自噬相关基因、5个影像学相关特征用于建立肾透明细胞癌患者的风险模型。根据自噬中位风险评分确立亚组,包括低风险组和高风险组,结果显示高风险组的患者预后较低风险组更差(Plt;0.001,图5A)。结合临床资料,高风险组患者多为高等级的TNM分期及G分级的患者(Plt;0.001,图5B),同时也是自噬亚型B组患者的主要构成,且高风险组患者预后往往较差。结合TCIA数据库分析患者CT资料,结果表明高风险组患者的肿瘤体积较低风险组患者更大[122.88 cm3 (81.93 cm3, 210.87 cm3) vs 21.86 cm3 (52.54 cm3, 90.16 cm3),Plt;0.001,图5C]。ROC曲线分析显示,对530例ccRCC患者中1年总生存率进行预测,自噬相关基因风险模型AUC为0.752,其预测能力优于年龄(0.662)、性别(0.501)、分级(0.715)等临床因素,稍差于病理分期(0.785)(图5D)。而在98例具有CT影像学资料的患者中,进一步联合影像组学模型预测患者1年总生存率,结果显示影像组学联合自噬相关基因模型AUC可高达0.922,明显高于影像组学模型(0.793)及自噬相关基因模型(0.702)(图5E)。利用患者自噬风险评分、影像组学得分、年龄、性别、TNM分期、G分级作为预测因素构建预后列线图(图5F)。
2.6 "不同自噬风险对患者的免疫浸润的影响
不同风险组的免疫细胞亚群比例结果表明,高风险组患者中性粒细胞减少,其免疫细胞类型以单核细胞等为主,其免疫微环境评分更高,而低风险组患者免疫细胞主要为初始B细胞等,其基质评分更高(图6A)。高低风险组患者的预后差异与免疫功能差异密切相关。在高风险组中,85%的免疫检查点呈高表达状态(Plt;0.05,图6B)。进一步免疫功能分析结果表明,除了大部分免疫检查点在高风险组中高表达,APC的抑制、T细胞抑制及I、II 型干扰素反应等现象在高风险组中更常见(Plt;0.05,图6C)。
3 "讨论
RCC是泌尿外科常见肿瘤,即使是同一病理类型的患者,其预后及治疗效果都可能存在差异,仅依据TNM分期等临床特征已无法充分预测患者预后。已有研究基于某些分子特征以求重新对肾癌患者进行分型进而为临床治疗提供指导 [20, 21]。本研究基于自噬相关基因特征将ccRCC患者进行分型,结果显示2个分子分型患者的预后有显著差异。进一步构建自噬评分系统量化ccRCC患者的自噬水平,结果显示个体自噬评分越高的患者预后越差,且相关癌症基因的突变率越高,自噬分子分型预后较差的患者的自噬评分也更高,表明该分子亚型及个体化自噬评分系统可较好地区分不同预后的ccRCC患者。本研究首次通过影像组学结合自噬相关基因分析不同ccRCC影像学特征及预后,结果发现高自噬评分组、高自噬风险组的ccRCC患者肿瘤体积明显更大;而影像组学联合基因模型具有优秀的预测性能。
有学者通过分析TCGA、ONCOMINE数据库的ccRCC数据集发现BIRC5、 CAPS等是具有独立预后价值的自噬相关基因,并构建了基于它们的风险预后模型[10]。但由于RCC具有较强的异质性[11, 12],目前在ccRCC中鲜见基于某类基因个体化评分的研究报道,更未见评估ccRCC患者个体自噬水平的研究。有学者使用m6A评分量化个体胃癌患者m6A修饰模式,并证实低m6A评分患者对PD-1/L1免疫治疗反应及预后更好[18]。因此,本研究通过主成分分析方法成功构建自噬评分系统,并揭示高自噬评分是ccRCC预后不良的重要因素。本自噬评分系统不仅可以衡量单个ccRCC患者自噬水平,更能评估ccRCC患者肿瘤突变负荷、临床特征及预后等情况。研究结果还提示自噬分子分型预后较差组与高自噬自噬评分组患者基本吻合,且这些患者的APOL1、BIRC5、BID、CAMKK2、HGS等基因表达明显升高。有研究证实HIF-2α/LINC02609/APOL1 轴可调节APOL1的表达从而影响ccRCC 肿瘤细胞的脂质储存,促进内质网稳态及肿瘤生长[22]。另有研究表明过表达BIRC5可以增加肾癌细胞的活力及细胞迁移、侵袭能力[23]。BID则通过调控PD-1、LAG3和CTLA4等免疫调节分子表达水平,介导免疫浸润的不同特征进而影响ccRCC的发展[24]。CAMKK2可在TRPM3 作用下激活自噬标志物LC3B并促进ccRCC的生长[25]。本研究进一步分析证实APOL1、BIRC5、BID、CAMKK2、HGS等基因在高自噬风险组中表达升高,这与既往研究[9]结果符合,提示这些基因在ccRCC进展中发挥了关键作用,但具体作用机制仍需进一步分子及动物实验验证。
CT是确定肾脏肿块特征和分期的首选方法,其在肾癌的诊断、分期中起着关键作用。研究表明,基于CT影像大数据的分析模型在术前评估肾癌的性质、分型以及预后方面均发挥了精准的判断和预测作用。有学者通过提取肾透明细胞癌3D多相增强CT影像组学特征并采用影像组学特征稳定性选择法提出了将临床特征与CT图像相结合为预测肾透明细胞癌分级的最佳方法的观点,其模型简单有效,同时降低了辐射暴露,为肾透明细胞癌的临床决策提供了有效的实用工具[26]。一项回顾性研究通过提取肾癌患者术前肾脏MRI不同序列的图像特征,精准区分了肾透明细胞癌、乳头状肾细胞癌及嫌色性肾细胞癌,通过分析不同MRI序列的ROC曲线得到显著差异的AUC,精准区分了3种亚型的肾细胞癌,并为预测不同亚型肾细胞癌的预后风险提供了可靠依据[27]。可见多种影像组学对肾癌的精确诊断具有高度敏感性,在肾癌的术前评估、术后预测中起到举足轻重的作用,并且因其无创、成本低、可及性强等优点,在未来的临床工作中将会更一步普及。本研究通过结合TCIA数据库中肾癌患者的CT影像学资料证实自噬评分高的患者的肿瘤体积更大。进一步联合自噬相关基因的风险回归模型及影像组学模型分析,结果筛选出9个自噬相关基因、5个影像学相关特征是ccRCC患者预后不佳的独立危险因素。该模型预测ccRCC患者预后能力明显强于单纯使用影像学资料、一般临床资料及自噬相关基因模型。此外,影像组学证实了高自噬风险患者的肿瘤体积相对更大,提示自噬相关基因在肾癌进展中起到了促进的作用。
本研究结果还显示自噬高、低风险组患者存在显著的免疫分布差异,尤其是中性粒细胞和单核细胞的差异分布,这与既往研究[9, 10]结果一致,它们可能作为关键的免疫细胞类型对预后产生了影响。中性粒细胞是外周血中最常见的细胞类型,目前认为它的抗肿瘤免疫应答是通过自身大量募集和激活而发挥作用。中性粒细胞可分为包括低密度、正常密度、高密度中性粒细胞3个亚群。在肿瘤微环境中,低密度中性粒细胞主要起到抑制T淋巴细胞作用。而髓源性抑制细胞作为低密度中性粒细胞前体,具有较强的免疫抑制及促进肿瘤的效应[28]。研究表明,中性粒细胞的大量浸润是肾癌原发灶及其肺转移灶发生进展的重要原因[24]。晚期ccRCC经常引起全身炎症,肿瘤细胞通过分泌细胞因子或趋化因子来重塑免疫微环境[29], 而ccRCC相关炎症可改变中性粒细胞表型,致使细胞趋化因子1、2、5、8等4种趋化因子表达增高,且这些趋化因子的表达上调被认为是ccRCC患者的预后不良的原因之一[30]。单核细胞是血液中最大的血细胞与白细胞,占白细胞的3%~8%,是机体防御系统的重要组成部分,可吞噬异物产生抗体,具有识别和杀伤肿瘤细胞的能力。中性粒细胞和单核细胞在自噬高风险组患者中的高表达可能是导致患者预后较差的另一重要因素。本研究独立发现高自噬风险组患者中大部分免疫检查点均过度表达,且免疫功能分析提示大部分免疫功能处于抑制状态,更容易阻断肿瘤免疫中的提呈抗原过程,发生免疫逃逸现象。临床上,对于高自噬风险或晚期RCC患者可针对这些免疫检查点开发新的免疫检查点抑制剂以达到更好的精准治疗。
综上,本研究构建了ccRCC自噬评分系统,并联合影像组学建立相关风险预后模型,该模型在预测肾癌患者预后及治疗中有较好前景;发现并证实了ccRCC中高表达的自噬相关基因可促进肿瘤进展。但本研究未能深入揭示潜在分子机制,只是在理论上提出自噬相关基因与肾癌的发展之间可能存在联系,未来可进一步探究9个高风险基因在ccRCC发病中的具体机制,为肾癌的防治提供新的依据。
参考文献:
[1] " Moch H, Cubilla AL, Humphrey PA, et al. The 2016 WHO classification of tumours of the urinary system and male genital organs-part A: renal, penile, and testicular tumours[J]. Eur Urol, 2016, 70(1): 93-105.
[2] " Capitanio U, Montorsi F. Renal cancer[J]. Lancet, 2016, 387(10021): 894-906.
[3] " Levine B, Klionsky DJ. Development by self-digestion: molecular mechanisms and biological functions of autophagy[J]. Dev Cell, 2004, 6(4): 463-77.
[4] " Peng YF, Shi YH, Shen YH, et al. Promoting colonization in metastatic HCC cells by modulation of autophagy[J]. PLoS One, 2013, 8(9): e74407.
[5] " Chaffer CL, Weinberg RA. A perspective on cancer cell metastasis[J]. Science, 2011, 331(6024): 1559-64.
[6] " Nishikawa M, Miyake H, Liu B, et al. Expression pattern of autophagy-related markers in non-metastatic clear cell renal cell carcinoma: association with disease recurrence following radical nephrectomy[J]. J Cancer Res Clin Oncol, 2015, 141(9): 1585-91.
[7] " Liang L, Yang Z, Deng Q, et al. Expression and mechanism of autophagy gene Beclin1 in tumor microenvironment of renal cell carcinoma[J]. Minerva, 2022, 113(1): 210-2.
[8] " "范大为, 刘 "凯, 袁成刚, 等. Beclin-1在肾癌组织中的表达及其临床意义[J]. 中华腔镜泌尿外科杂志: 电子版, 2015, 9(2): 96-100.
[9] " "Zhang GY, Zhang L, Sun S, et al. Identification of a novel defined immune-autophagy-related gene signature associated with clinical and prognostic features of kidney renal clear cell carcinoma[J]. Front Mol Biosci, 2021, 8: 790804.
[10] He MX, Li MR, Guan YB, et al. A new prognostic risk score: based on the analysis of autophagy-related genes and renal cell carcinoma[J]. Front Genet, 2022, 12: 820154.
[11] Warren AY, Harrison D. WHO/ISUP classification, grading and pathological staging of renal cell carcinoma: standards and controversies[J]. World J Urol, 2018, 36(12): 1913-26.
[12] Li YZ, Lih TS M, Dhanasekaran SM, et al. Histopathologic and proteogenomic heterogeneity reveals features of clear cell renal cell carcinoma aggressiveness[J]. Cancer Cell, 2023, 41(1): 139-63. e17.
[13] "Lambin P, Leijenaar RTH, Deist TM, et al. Radiomics: the bridge between medical imaging and personalized medicine[J]. Nat Rev Clin Oncol, 2017, 14(12): 749-62.
[14] "Gullo RL, Daimiel I, Morris EA, et al. Combining molecular and imaging metrics in cancer: radiogenomics[J]. Insights Imaging, 2020, 11(1): 1.
[15] "张海捷, 殷 "夫, 陈梦林, 等. 基于3D增强CT影像组学的肾癌亚型三分类预测模型[J]. 分子影像学杂志, 2021, 44(3): 427-34.
[16] Sotiriou C, Wirapati P, Loi S, et al. Gene expression profiling in breast cancer: understanding the molecular basis of histologic grade to improve prognosis[J]. J Natl Cancer Inst, 2006, 98(4): 262-72.
[17]Zeng DQ, Li MY, Zhou R, et al. Tumor microenvironment characterization in gastric cancer identifies prognostic and immunotherapeutically relevant gene signatures[J]. Cancer Immunol Res, 2019, 7(5): 737-50.
[18] "Zhang B, Wu Q, Li B, et al. m6A regulator-mediated methylation modification patterns and tumor microenvironment infiltration characterization in gastric cancer[J]. Mol Cancer, 2020, 19(1): 53-73.
[19] He Y, Jiang ZH, Chen C, et al. Classification of triple‑negative breast cancers based on Immunogenomic profiling[J]. J Exp Clin Cancer Res, 2018, 37(1): 327.
[20] Liu BT, Chen XN, Zhan YH, et al. Identification of a gene signature for renal cell carcinoma-associated fibroblasts mediating cancer progression and affecting prognosis[J]. Front Cell Dev Biol, 2020, 8: 604627.
[21] "Malouf GG, Flippot R, Dong YY, et al. Molecular characterization of sarcomatoid clear cell renal cell carcinoma unveils new candidate oncogenic drivers[J]. Sci Rep, 2020, 10(1): 701.
[22] Xiao HB, Qu Y, Li HL, et al. HIF‑2α/LINC02609/APOL1-mediated lipid storage promotes endoplasmic reticulum homeostasis and regulates tumor progression in clear-cell renal cell carcinoma[J]. J Exp Clin Cancer Res, 2024, 43(1): 29.
[23] "Hong SH, Lee YJ, Jang EB, et al. Therapeutic efficacy of YM155 to regulate an epigenetic enzyme in major subtypes of RCC[J]. Int J Mol Sci, 2023, 25(1): 216.
[24] "Zeng JY, Ke CB, Tian KW, et al. Highly expressed of BID indicates poor prognosis and mediates different tumor microenvironment characteristics in clear cell renal cell carcinoma[J]. Discov Oncol, 2024, 15(1): 176.
[25] "Hall DP, Cost NG, Hegde S, et al. TRPM3 and miR-204 establish a regulatory circuit that controls oncogenic autophagy in clear cell renal cell carcinoma[J]. Cancer Cell, 2014, 26(5): 738-53.
[26] Zhang HJ, Yin F, Chen ML, et al. CT-based radiomics model using stability selection for predicting the World Health organization/International society of urological pathology grade of clear cell renal cell carcinoma[J]. Br J Radiol, 2024, 97(1158): 1169-79.
[27] Wang W, Cao KM, Jin SM, et al. Differentiation of renal cell carcinoma subtypes through MRI-based radiomics analysis[J]. Eur Radiol, 2020, 30(10): 5738-47.
[28] "Moses K, Brandau S. Human neutrophils: their role in cancer and relation to myeloid‑derived suppressor cells[J]. Semin Immunol, 2016, 28(2): 187-96.
[29] "Chen XQ, Meng FQ, Jiang RC. Neutrophil-to-lymphocyte ratio as a prognostic biomarker for patients with metastatic renal cell carcinoma treated with immune checkpoint inhibitors: a systematic review and meta-analysis[J]. Front Oncol, 2021, 11: 746976.
[30] Shen JW, Wang RJ, Chen Y, et al. Prognostic significance and mechanisms of CXCL genes in clear cell renal cell carcinoma[J]. Aging, 2023, 15(16): 7974-96.
(编辑:林 "萍)
