2-18F-氟丁酸的自动化合成及荷前列腺癌裸鼠PET/CT显像评价
2024-11-01董伟璇秦开心胡文豪沈聪牛晨段小艺



摘要:目的" 研究2-18F-氟丁酸(2-18F-FBA)自动化合成工艺小柱纯化方法,使其能满足GMP生产要求缩短合成时间提高产率,并对其进行荷前列腺癌裸鼠PET/CT显像评价。方法" 以GE TRACERlab FX-FN模块为基础,用“一锅法”和“柱水解法”合成2-18F-FBA。两种方案均使用2-溴丁酸甲酯为前体,经氟化、纯化和水解得终产品2-18F-FBA。荷前列腺癌裸鼠尾静脉注射2-18F-FBA后于不同时间点行micro-PET/CT显像,PMOD软件勾画感兴趣区并计算最大标准化摄取值。结果" “一锅法”和“柱水解法”合成2-18F-FBA的时间分别为35 min和27 min,未校正放化产率为(34±5.2)%和(41±3.7)%。Micro-PET/CT显示,注射2-18F-FBA 30 min肿瘤处放射性摄取明显,60 min后,肿瘤/肌肉比相对较高。两种方案均能合成2-18F-FBA,“柱水解法”合成时间相对更短、产率更高。结论" 2-18F-FBA荷前列腺癌裸鼠肿瘤处显像清晰,60 min时有较高的靶本比。
关键词:2-18F-FBA;micro-PET/CT;前列腺癌;放化合成
Automated production of 2-18F-fluorobutyric acid and as a PET imaging agent for prostate cancer
DONG Weixuan1, QIN Kaixin2, HU Wenhao2, SHEN Cong1, NIU Chen1, DUAN Xiaoyi1
1Department of PET/CT, the First Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710061, China; 2Department of Nuclear Medicine, First Hospital of Shanxi Medical University, Taiyuan 030001, China
Abstract: Objective To investigate the automatic synthesis process of 2-18F-fluorobutyric acid (2-18F-FBA) and its C18 column purification method, so as to meet the production requirements of Good Manufacturing Practice of Medical Products (GMP), shorten the synthesis time and improve the yield. To evaluate the PET imaging of 2-18F-FBA in nude mice with prostate tumor." Methods Based on the GE TRACERlab FX-FN module, 2-18F-FBA was automatically synthesized by 'one-pot method' and 'column hydrolysis method', respectively. Both schemes used methyl 2-bromobutyrate as a precursor, which was fluorinated, purified and hydrolyzed to obtain 2-18F-FBA. Micro-PET/CT was performed at different time points after tail vein injection of 2-18F-FBA in nude mice bearing prostate tumor, and the PMOD software was used to outline the region of interest and calculate the maximum standardized uptake value. Results The synthesis time of 2-18F-FBA by 'one-pot method' and 'column hydrolysis method' was 35 min and 27 min, respectively, and the uncorrected radiochemical yield was (34±5.2)% and (41±3.7)%. Micro-PET/CT showed significant radio-concentration at the tumor at 30 min after injection of 2-18F-FBA, and the tumor / muscle ratio was relatively high at 60 min. Both schemes were able to synthesize 2-18F-FBA, with the 'column hydrolysis' method having a relatively shorter synthesis time and higher yield. Conclusion The 2-18F-FBA is clearly visualized in tumor of prostate tumor bearing nude mice with a high target/non-target ratio at 60 min.
Keywords: 2-18F-FBA; micro-PET/CT; prostate cancer; radiosynthesis
PET/CT是解剖和功能成像于一体的较为先进的影像学检查设备,由于较高的空间分辨力和定量分析能力而被临床和科研广泛应用[1] 。最常用的正电子显像剂18F-FDG为葡萄糖的结构类似物,可被大多数肿瘤细胞摄取而被临床用于肿瘤的早期筛查、分期以及预后评估。但任何类型的显像剂均有不足之处,如18F-FDG对于某些病灶摄取并不明显,甚至呈假阴性,如某些类型的前列腺癌、肝癌等,由于此类肿瘤主要的能量物质并不是葡萄糖,对18F-FDG摄取不高,临床易漏诊[2-4] 。于是,核素标记的氨基酸、糖类、短链脂肪酸等小分子显像剂相继被开发。研究发现,核素标记的短链脂肪酸在某些特殊类型的肿瘤细胞中较18F-FDG有更高摄取[5-8] ,如早期有研究利用11C标记的乙酸盐(11C-ACE)进行心肌代谢显像[9] ,随后将其应用于前列腺癌,发现肿瘤细胞也有较高摄取[10] ,但由于11C较短的半衰期(20 min),并不利于临床大规模应用和药厂远距离配送。之后国内外研究人员相继合成了18F-标记的乙酸盐(18F-FAC),但18F-FAC在体内代谢途径与11C-ACE不同[11, 12] ,其作为11C-ACE的替代仍有待进一步验证。随后18F-标记的丙酸(2-18F-FPA)、丁酸(4-18F-FBA)以及特戊酸(18F-FPIA)相继被合成。2-18F-FPA和18F-FPIA在多种不同类型肿瘤模型中均有较高摄取[13-16] ,而4-18F-FBA在体内外均脱氟,因此不适合作为PET显像剂继续开发[17] 。为改变4-18F-FBA脱氟的不利影响以及进一步开发18F-标记短链脂肪酸,本课题组前期手动成功合成了2-18F-FBA,通过增加空间位阻使其结构稳定,并在荷S180肉瘤模型小鼠显示出较高的靶/本比[18] 。但手动标记对合成人员存在一定放射性损害,且该方法用到高效液相色谱仪(HPLC),致使合成时间相对较长,影响产率。目前,未见报道2-18F-FBA用于模块的自动化合成以及荷前列腺癌裸鼠模型的PET/CT显像研究,而建立符合GMP要求的商业化生产,无论对于降低合成人员的辐射剂量还是促进18F-标记短链脂肪酸的深入研究都具有十分重要的意义。基于此,本研究通过2-溴丁酸甲酯为前体,利用GE TRACERlab FX FN 自动化合成模块实现2-18F-FBA的合成并对其在荷前列腺癌裸鼠模型中的应用进行初步探讨。
1" 材料与方法
1.1" 仪器与材料
MINI trace回旋加速器和TRACERlab FX-FN自动化合成模块(GE);Micro-PET/CT扫描仪(inviscan);HPLC配备高能放射性检测器、201型紫外检测仪和薄层色谱扫描仪(radio-TLC,岛津);9790Ⅱ型气相色谱仪配备氢火焰离子化检测器(FID,浙江福立);CRC-15R型放射性活度计(西门子);C18色谱分析柱(5 µm,250 mm×4.6 mm,Hichrom);Sep-pak QMA柱、lC-H柱、Sep-pak C18柱、Sep-pak Al2O3柱以及Oasis HLB柱(Waters);FDG纯化柱(ABX);除菌滤膜(Millex-GS,0.22 μm,Millipore);硅胶60薄层层析铝板(Merck)。
1.2" 实验动物及细胞
BALB/c型无特殊病原体(SPF)级裸鼠[北京华阜康生物技术有限公司,许可证号:SCXK (京) 2009-0015],雄性,鼠龄4周,体质量15~20 g。PC3前列腺癌细胞(中科院上海细胞库)。
1.3" 自动化合成
为GE TRACERlab FX-FN 自动化合成模块,由于两种方案均不使用HPLC系统,因此短接V14和V17,余管路不改变(图1)。根据合成方案分别编写程序,总结如下:
首先活化小柱:将Sep-pak QMA柱用10 mL NaHCO3和10 mL纯水活化并吹干;FDG纯化柱、Oasis HLB柱以及Sep-pak C18用20 mL EtOH和20 mL纯水活化并吹干;IC-H和Sep-pak Al2O3用10 mL纯水活化吹干并连接于产物瓶除菌滤膜上。之后在模块中正确添加化学试剂和柱子(表1)。
氟化反应:由回旋加速器通过18O(p, n)核反应生成18F-,之后靶水经Sep-pak QMA柱18F-被捕获,在He气作用下,V1号管K222/K2CO3乙腈水溶液将18F-淋洗到总反应管,90℃条件下反应5 min进行第1次除水,之后V2号管中1 mL乙腈进入总反应管100℃进行第2次除水,减压得到干燥的[K/K222] +18F-复合物,以上反应产生的废液均由置于液氮中的冷阱吸收。在He气作用下,V3号管前体2-溴丁酸甲酯/乙腈溶液被压入总反应管,100℃条件下氟化反应10 min。
方案A(一锅法):氟化反应结束后,将V4号管中2N NaOH加入总反应管,60℃条件下水解2 min并冷却,之后V5号管中2N HCl加入总反应管中和NaOH。最终反应液通过FDG纯化柱,用1% NaHCO3淋洗并通过无菌滤膜得2-18F-FBA。
方案B(柱水解法):氟化反应结束后,将V4号管中10 mL纯水加入总反应管稀释反应液,之后He气将反应液压出并通过Oasis HLB柱,此时中间体2-18F-氟丁酸甲酯被吸附,V7号管10 mL纯水冲洗Oasis HLB柱,除去杂质,V8号管2N NaOH注入Oasis HLB柱,常温条件下在柱水解2 min。最终2-18F-FBA经V9号管纯水淋洗并通过IC-H、Sep-pak C18、Sep-pak Al2O3复合柱以及无菌滤膜至产物瓶。
1.4" 产品的质量控制
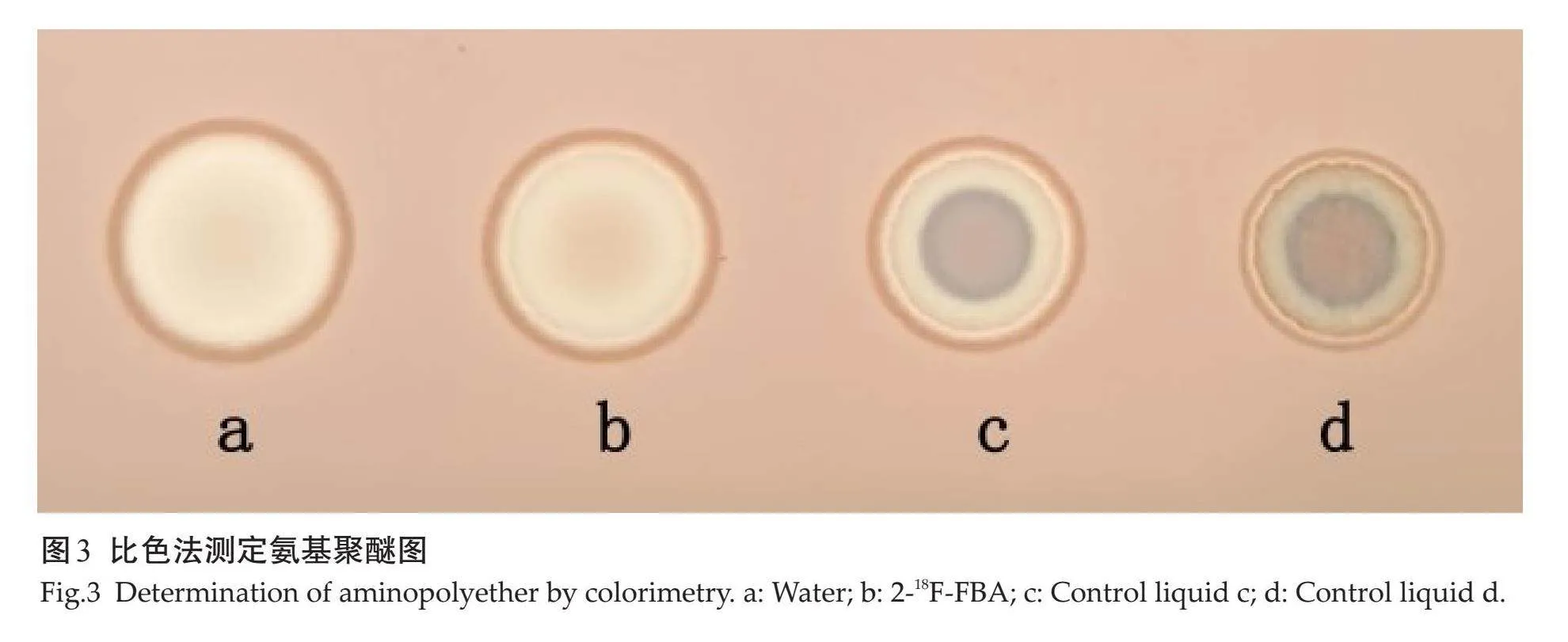
目测产品的颜色和澄清度,用精密pH试纸测定2-18F-FBA的pH值。用带有放射性检测器的HPLC测定其保留时间,色谱条件:使用C18色谱分析柱,流动相为乙腈和水的混合液,流速为1 mL/min,紫外检测波长为254 nm,流动相中乙腈梯度条件:0~2 min 10%、2~15 min 80%、15~25 min 80%、25~35 min 10%。Radio-TLC测定2-18F-FBA的放射化学纯度,分析条件:硅胶铝板,展开剂为95 %乙腈水溶液。用气相色谱检测产品残留溶剂,分析条件:RBX-FFAP (30 m×0.32 mm×0.25 μm)毛细管柱,柱温70 ℃,进样口温度为200 ℃,检测器温度为250 ℃,顶空瓶温度为85℃,进样体积500 μL。对照品溶液配置:精密称取乙腈、乙醇、丙酮各43.2 mg、515.7 mg、510.1 mg,加入容量瓶中纯水稀释至100 mL,制成对照品溶液浓度分别为0.432 mg/mL、5.157 mg/mL、5.101 mg/mL。按照外标法以峰面积计算残留溶剂量。通过比色法检测K222含量,具体方法:首先配置硅胶板浸泡液:取氯铂酸溶液3 mL(100 g/L),加水97 mL与碘化钾溶液100 mL(60 g/L)混匀,硅胶G薄层浸泡上述液体10 s后取出,常温避光干燥12 h待用。之后取K222 25.6 mg加水稀释至250 mL,取该溶液0.5 mL,分别与0.5 mL水(对照液体c)和0.5 mL 2-18F-FBA(对照液体d)混匀,吸取水(a)、2-18F-FBA (b)、对照液体c以及对照液体d各2.5 μL,分别点在经过处理的硅胶G薄层板上,1 min后视检。无菌检测、细菌内毒素检测、异常毒性试验参照《中华人民共和国药典》2020年版二部所述进行。
1.5" 正辛醇-磷酸盐缓冲液分配系数测定
通过测量2-18F-FBA在正辛醇/磷酸盐缓冲液中的放射性计数,确定其在pH值为7.0、7.5和8.0时的脂水分配系数。将2-18F-FBA(7.5 MBq,0.2 mL)添加到磷酸盐缓冲液/正辛醇(1:1 v/v,6 mL)的混合液中,涡旋1 min,500×g离心5 min,每层取100 μL,γ-放射性计数仪测量放射性计数,计算logP。公式如下:logP=lg(100 μL正辛醇中的放射性计数/100 μL磷酸盐缓冲液中的放射性计数,n=3)。
1.6" 细胞培养和肿瘤模型制备
将购得的PC3前列腺癌细胞用含有10 %胎牛血清及1%双抗(青霉素100 U/mL,硫酸链霉素 100 U/mL)的DMEM作为培养基,置于37℃和5 % CO2培养箱中培养,培养基每周常规更新3次。选择对数生长期的癌细胞,调整细胞浓度至2×106/mL,取若干只BALB/c型裸鼠,每只裸鼠在右前肢皮下接种0.2 mL,并饲养于SPF级动物房。定期观察肿瘤的生长情况,待其生长至1 cm×1 cm×1 cm时,选取肿瘤处无溃烂的动物模型行micro-PET/CT显像。
1.7" 荷前列腺癌裸鼠micro-PET/CT显像
动物模型成像前均禁食12 h。随机选取荷前列腺癌裸鼠3只,固定在37℃的Minerve小鼠动物室中,同时给予2 L/min空气和2%异氟烷混合气体持续吸入麻醉。尾静脉注射2-18F-FBA(0.2 mL,7 MBq)后分别行30、60、90、120 min PET/CT静态扫描,实验动物许可证编号:SCXK(晋) 2015-0001。PET图像扫描:单床位、400个投影数、10 min旋转扫描方式进行采集,预处理执行衰减校正及随机事件校正,图像重建采用蒙特卡罗系统模型的3D OSEM算法。CT图像扫描:管电压80 kV、管电流1 mA、曝光时间40 s,预处理选择160 μm层厚,重建采用Feldkamp滤波反投影算法,并执行射束硬化校正及环形伪影校正。图像处理使用PMOD 4.2版本软件勾画感兴趣区(VOI)并计算最大标准化摄取值(SUVmax)。
1.8" 统计学分析
应用SPSS 22.0软件进行统计学分析。符合正态分布且方差齐的计量资料以均数±标准差表示,组间比较采用Student t检验。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 2-18F-FBA的合成
比较合成总时间及产率,“柱水解法”(Method B)明显优于“一锅法”(Method A)(表2)。
2.2" 质量控制
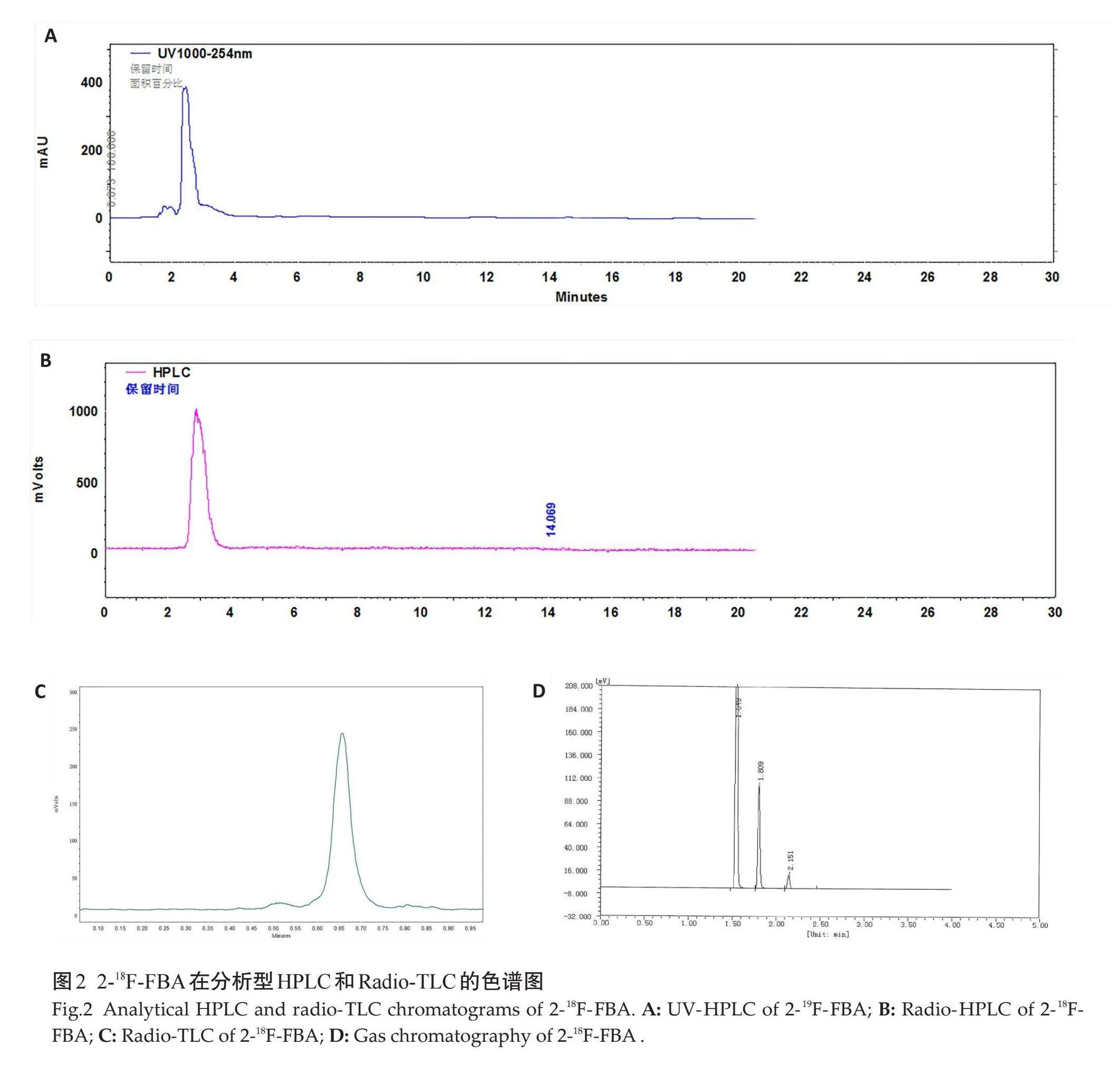
肉眼观察显示,上述两种方案合成的2-18F-FBA均为无色透明液体,无颗粒。精密pH试纸测定2-18F-FBA值为7.0~7.8,与人体血液的pH值相近。异常毒性实验表明,尾静脉注射2-18F-FBA观察48 h,小鼠正常无不良反应。无菌实验、细菌内毒素实验均为阴性。2-18F-FBA HPLC保留时间与标准品2-19F-FBA一致(UV检测,图2A~B)。Radio-TLC测定放射化学纯度,2-18F-FBA的Rf值为0.6~0.7(在相同的TLC条件下,18F-的Rflt;0.05,图2C)。按外标法计算乙腈残留量lt;0.041 %、乙醇lt;0.5 %、丙酮lt;0.5 %均小于药典规定值(图2D)。视检水 (a)和2-18F-FBA (b)的斑点中心显浅棕色,而对照液体c和对照液体d斑点中心呈深棕色,2-18F-FBA中K222含量小于规定值(图3)。
2.3" logP值测定
在pH值为7.0、7.5、8.0时,2-18F-FBA的logP值分别为1.02±0.08、0.92±0.12、0.74±0.07(n=3)。
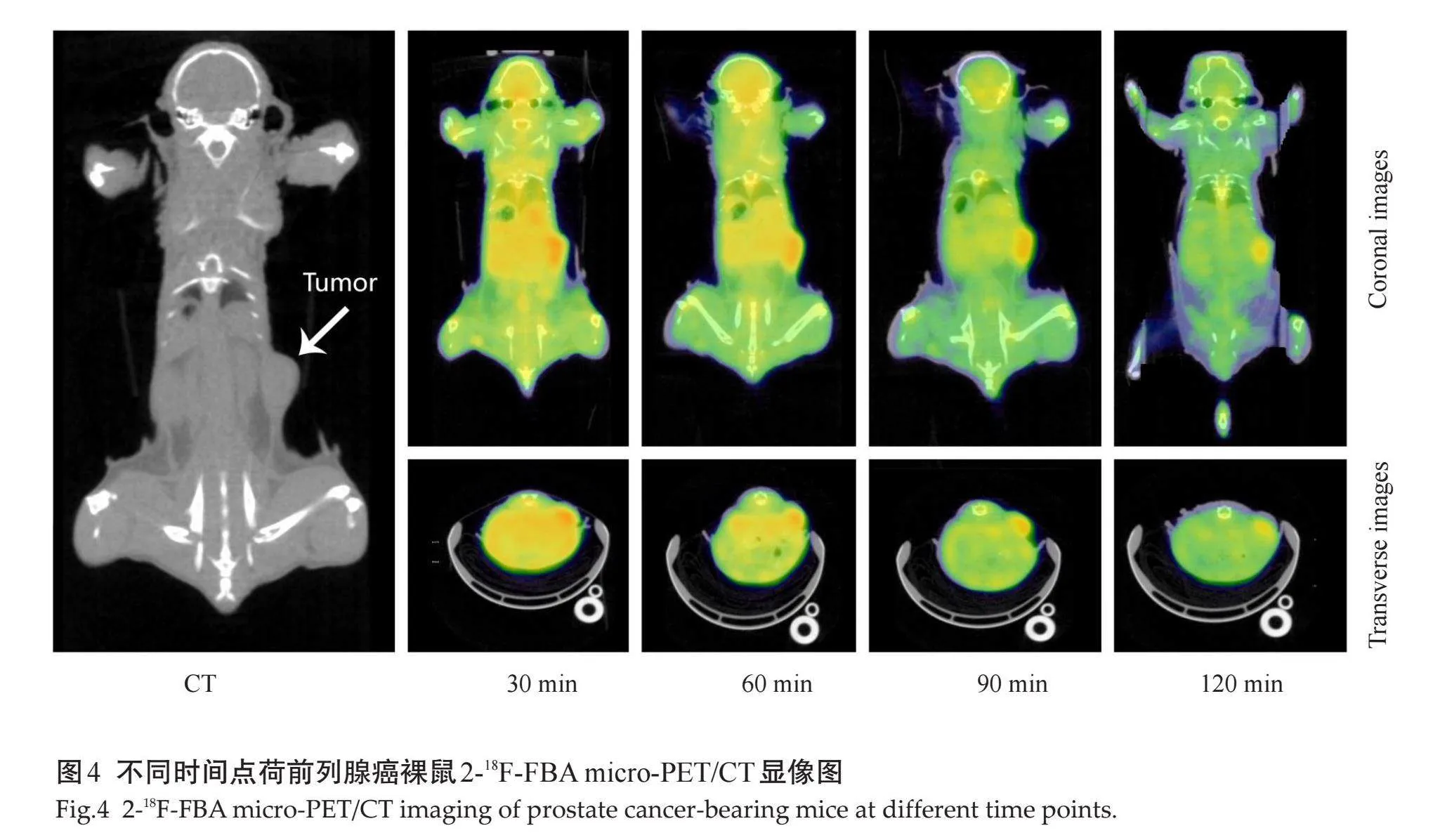
2.4" Micro-PET/CT显像
不同时间点荷前列腺癌裸鼠micro-PET/CT显像图表明,尾静脉注射2-18F-FBA 30 min荷瘤鼠全身各组织器官均有不同程度摄取,以肝、胃肠道处放射性摄取明显,双肾和膀胱未见放射性浓聚。此时荷瘤处SUVmax为2.82±0.05,肿瘤与正常组织的放射性摄取比(T/NT)分别为肿瘤/脑:5.15±1.24,肿瘤/肌肉:7.82±2.53,之后随时间推移放射性逐渐减低。注射2-18F-FBA 60 min后,全身各组织器官放射性减低不明显,肿瘤处放射性浓聚依然明显,经测定SUVmax为2.15±0.12,T/NT分别为肿瘤/脑:5.68±1.10,肿瘤/肌肉:8.26±2.53。骨组织放射性摄取在各时间点均相对较低(图4)。
3" 讨论
放射性核素标记的短链脂肪酸类显像剂一直是研究关注的热点,前期研究表明该类型的显像剂可以在一定程度上补充18F-FDG的不足[19] 。因此,如何缩短合成时间,提高产率,使其满足GMP生产要求将有助于临床前以及临床研究。目前主要通过两种方法合成相应前体,即卤代烃酯或取代甲磺酸酯,具体选择哪种类型前体能提高产率,需要进一步探索。如前期本课题组分别使用2-溴乙酸苄酯和2-溴丙酸甲酯为前体合成18F-FAC和2-18F-FPA,氟化反应完成后得到的中间体在室温条件下不能完全水解,而在50 ℃加热条件即可水解完全。基于此,本课题组尝试将该实验合成的中间体2-18F-氟丁酸甲酯在室温条件下水解,结果表明其能够完全水解,这一点相比于其他18F-标记的短链脂肪酸更具优势。对于肿瘤显像而言,仅18F-FAC用于临床,2-18F-FPA、18F-FPIA以及2-18F-FBA未见用于临床研究。鉴于本课题组前期手动成功合成了2-18F-FBA并在肿瘤处有较高浓聚,提示其可进一步用于不同类型肿瘤PET/CT显像评价。
从合成方面看,快速、可靠且符合GMP要求的PET正电子显像剂是放射化学的一大挑战,模块的自动化合成有助于实现这一目标,并且能减少合成人员的辐射剂量,因此具有重要意义。前期本课题组在完成手动2-溴丁酸甲酯的氟化反应后,通过HPLC纯化获得中间体2-18F-氟丁酸甲酯,致使合成时间延长(45~60 min),由于收集到的中间体含流动相乙腈,为了更好地使其富集到Oasis HLB柱上,因此需将其中的乙腈用旋蒸仪在45℃水浴锅中加热除去,而在蒸除过程中势必会随乙腈带走一定量中间体。如果弃用旋蒸仪除乙腈,也需要用10~20倍体积的纯水稀释中间体,避免2-18F-氟丁酸甲酯在过Oasis HLB柱时随乙腈流入废液瓶,即便如此,由于流动相中乙腈含量较高,仍有部分中间体损失。基于此,本课题组首次利用GE TracerLab FXFN多功能模块自动合成2-18F-FBA并进行了两种合成方案的比较。“一锅法”和“柱水解法”均弃用HPLC系统,改用小柱完成最后的纯化工作,这样可以极大缩短总合成时间(tlt;30 min)。但弃用HPLC可能伴随微量溶剂以及K222残留,于是我们对其进行了气相色谱分析,结果表明K222、乙腈、乙醇等均符合《中华人民共和国药典》2020年版二部相关规定,提示两种合成方案均可用于临床常规制备。
从应用方面看,前列腺癌是男性最常见的恶性肿瘤之一,尤其对于晚期前列腺癌伴发骨转移的患者仍然缺乏有效的治疗手段,因此早期诊断对于前列腺癌显得十分重要。传统影像学方法,如经直肠超声、CT和MRI等都很难早期发现微小病灶[20-22] 。因此,基于前列腺特异性膜抗原(PSMA)而开发的显像剂,如18F-PSMA-1007、68Ga-PSMA等被广泛用于前列腺癌的诊断、分期以及预后评估[23-28] 。但并非所有类型的前列腺癌PSMA表达均增高[29] ,有报道称,除外PSMA脂肪酸合成酶同样高表达于前列腺癌[30, 31] 。因此,开发短链脂肪酸PET显像剂可能有助于补充上述核素标记PSMA显像剂的不足。Micro-PET/CT结果显示,注射2-18F-FBA 30 min后,放射性主要浓聚于肝脏和胃肠道,并随时间延长放射性逐渐减低,双肾和膀胱处未见明显放射性浓聚,这与正辛醇-水分配实验结果一致,表明2-18F-FBA具有一定亲脂性,主要经肝脏代谢。由于在30 min时全身各组织器官均有一定放射性摄取,考虑注射2-18F-FBA后早期成像(lt;30 min),能否获得较高的T/NT有待进一步验证。注射2-18F-FBA 60 min肝脏、胃肠道以及脑放射性明显减低,而肿瘤处依然可见明显地放射性浓聚,虽然此时肿瘤处SUVmax较30 min降低(2.82±0.05 vs 2.15±0.12),但无论肿瘤/肌肉还是肿瘤/脑均较30 min时更高(肿瘤/脑:5.15±1.24 vs 5.68±1.10,肿瘤/肌肉:7.82±2.53 vs 8.26±2.53),这一点对于脑肿瘤的诊断可能存在一定优势。骨骼未见明显放射性摄取,证实2-18F-FBA未发生脱氟,可进一步开发应用。
综上,以2-溴丁酸甲酯为前体,采用“一锅法”和“柱水解法”均能合成2-18F-FBA。与“一锅法”相比,“柱水解法”总合成时间短,产率更高。荷前列腺癌裸鼠肿瘤处放射性摄取明显,该显像剂有望进一步开发应用,特别是脑肿瘤的诊断。
参考文献:
[1]" "Townsend DW. Positron emission tomography/computed tomography[J]. Semin Nucl Med, 2008, 38(3): 152-66.
[2]" "Pillarsetty N, Punzalan B, Larson SM. 2‑18F‑Fluoropropionic acid as a PET imaging agent for prostate cancer[J]. J Nucl Med, 2009, 50(10): 1709-14.
[3]" "Asman Y, Evenson AR, Even‑Sapir E, et al. [18F]fludeoxyglucose positron emission tomography and computed tomography as a prognostic tool before liver transplantation, resection, and loco-ablative therapies for hepatocellular carcinoma[J]. Liver Transpl, 2015, 21(5): 572-80.
[4]" "Haseebuddin M, Dehdashti F, Siegel BA, et al. 11C-acetate PET/CT before radical prostatectomy: nodal staging and treatment failure prediction[J]. J Nucl Med, 2013, 54(5): 699-706.
[5]" "Tsao CH, Wu CY, Chang CW, et al. Micro-PET imaging of[18F]fluoroacetate combined with [18F]FDG to differentiate chronic Mycobacterium tuberculosis infection from an acute bacterial infection in a mouse model: a preliminary study[J]. Nucl Med Commun, 2019, 40(6): 639-44.
[6]" "Zhao J, Zhang ZW, Nie DH, et al. PET imaging of hepatocellular carcinomas: 18F‑fluoropropionic acid as a complementary radiotracer for 18F-fluorodeoxyglucose[J]. Mol Imaging, 2019, 18: 1536012118821032.
[7]" Zhang ZW, Liu SY, Ma H, et al. Validation of R‑2‑[18F]fluoropropionic acid as a potential tracer for PET imaging of liver cancer[J]. Mol Imaging Biol, 2019, 21(6): 1127-37.
[8]" Yamauchi H, Kagawa S, Kishibe Y, et al. Increase in [18F]-fluoroacetate uptake in patients with chronic hemodynamic cerebral ischemia[J]." Stroke, 2015, 46(9): 2669-72.
[9]" "Choi Y, Huang SC, Hawkins RA, et al. A refined method for quantification of myocardial oxygen consumption rate using mean transit time with carbon‑11‑acetate and dynamic PET[J]. J Nucl Med, 1993, 34(11): 2038-43.
[10] Oyama N, Miller TR, Dehdashti F, et al. 11C-acetate PET imaging of prostate cancer: detection of recurrent disease at PSA relapse[J]. J Nucl Med, 2003, 44(4): 549-55.
[11]" Ponde DE, Dence CS, Oyama N, et al. 18F-fluoroacetate: a potential acetate analog for prostate tumor imaging: in vivo evaluation of 18F-fluoroacetate versus 11C-acetate[J]. J Nucl Med, 2007, 48(3): 420-8.
[12] Ho CL, Cheung MK, Chen SR, et al. 18F]fluoroacetate positron emission tomography for hepatocellular carcinoma and metastases: an alternative tracer for [11C]acetate?[J]. Mol Imaging, 2012, 11(3): 229-39.
[13] Zhang ZW, Liu SY, Ma H, et al. Propionic acid-based PET imaging of prostate cancer[J]. Mol Imaging Biol, 2021, 23(6): 836-45.
[14]" 谭支娥, 王" 朋, 崔邦平, 等. 18F-FPA的合成及对荷前列腺癌裸鼠的显像研究[J]. 重庆医学, 2018, 47(1): 14-6, 19.
[15]" 党永红, 蔡 炯, 王" 玲, 等. 2-18F-氟丙酸在正常小鼠体内的生物学分布[J]. 医学研究杂志, 2015, 44(5): 45-7.
[16]" Dubash SR, Keat N, Kozlowski K, et al. Clinical translation of 18F-fluoropivalate‑a PET tracer for imaging short-chain fatty acid metabolism: safety, biodistribution, and dosimetry in fed and fasted healthy volunteers[J]. Eur J Nucl Med Mol Imaging, 2020, 47(11): 2549-61.
[17]" 党永红, 蔡 炯, 王" 玲, 等. 4-18F-氟代丁酸及其甲酯作为PET显像剂可行性的初步研究[J]. 国际放射医学核医学杂志, 2015, 39(3): 228-34.
[18]" 董伟璇, 赵琦南, 段小艺, 等. 2-18F-氟丁酸作为PET/CT显像剂可行性的初步研究[J]. 国际放射医学核医学杂志, 2021, 45(11): 695-700.
[19]" 张占文, 胡 平, 唐刚华. 肿瘤短链脂肪酸代谢PET显像剂研究进展[J]. 国际放射医学核医学杂志, 2017, 41(6): 430-6.
[20]" Gandaglia G, Karakiewicz PI, Briganti A, et al. Impact of the site of metastases on survival in patients with metastatic prostate cancer[J]. Eur Urol, 2015, 68(2): 325-34.
[21] Eiber M, Weirich G, Holzapfel K, et al. Simultaneous 68ga‑psma hbed-cc pet/MRI improves the localization of primary prostate cancer[J]. Eur Urol, 2016, 70(5): 829-36.
[22]" Maurer T, Gschwend JE, Rauscher I, et al. Diagnostic efficacy of (68)Gallium‑PSMA positron emission tomography compared to conventional imaging for lymph node staging of 130 consecutive patients with intermediate to high risk prostate cancer[J]. J Urol, 2016, 195(5): 1436-43.
[23]" Perera M, Papa N, Roberts M, et al. Gallium-68 prostate-specific membrane antigen positron emission tomography in advanced prostate cancer‑updated diagnostic utility, sensitivity, specificity, and distribution of prostate‑specific membrane antigen‑avid lesions: a systematic review and meta-analysis[J]. Eur Urol, 2020, 77(4): 403-17.
[24]" Sprute K, Kramer V, Koerber SA, et al. Diagnostic accuracy of 18F-PSMA-1007 PET/CT imaging for lymph node staging of prostate carcinoma in primary and biochemical recurrence[J]. J Nucl Med, 2021, 62(2): 208-13.
[25]" Sanli Y, Sanli O, Has Simsek D, et al. 68Ga‑PSMA PET/CT and PET/MRI in high-risk prostate cancer patients[J]. Nucl Med Commun, 2018, 39(10): 871-80.
[26]" Zhou X, Li YC, Jiang X, et al. Intra-individual comparison of 18F-PSMA-1007 and 18F-FDG PET/CT in the evaluation of patients with prostate cancer[J]. Front Oncol, 2021, 10: 585213.
[27]" Awenat S, Piccardo A, Carvoeiras P, et al. Diagnostic role of 18F-PSMA-1007 PET/CT in prostate cancer staging: a systematic review[J]. Diagnostics, 2021, 11(3): 552.
[28]" Rauscher I, Krönke M, König M, et al. Matched-pair comparison of 68Ga‑PSMA‑11 PET/CT and 18F‑PSMA‑1007 PET/CT: frequency of pitfalls and detection efficacy in biochemical recurrence after radical prostatectomy[J]. J Nucl Med, 2020, 61(1): 51-7.
[29]" Kuten J, Fahoum I, Savin Z, et al. Head‑to‑head comparison of 68Ga‑PSMA‑11 with 18F-PSMA‑1007 PET/CT in staging prostate cancer using histopathology and immunohistochemical analysis as a reference standard[J]. J Nucl Med, 2020, 61(4): 527-32.
[30]" Chauhan SC, Vannatta K, Ebeling MC, et al. Expression and functions of transmembrane mucin MUC13 in ovarian cancer[J]. Cancer Res, 2009, 69(3): 765-74.
[31]" Reinfeld BI, Madden MZ, Wolf MM, et al. Cell‑programmed nutrient partitioning in the tumour microenvironment[J]. Nature, 2021, 593(7858): 282-8.
(编辑:林" 萍)
