双能量CT定量参数联合CT征象预测中晚期肺腺癌表皮生长因子受体基因突变
2024-10-31于蕾陈望孙乾焦志云
摘要:目的" 探究中晚期肺腺癌患者的双能量CT定量参数联合CT征象、临床特征与表皮生长因子受体(EGFR)基因突变的相关性,预测中晚期肺腺癌EGFR基因的突变情况。方法" 回顾性收集盐城市第一人民医院2022年1月~2023年6月经病理学(纤维支气管镜、淋巴结、经皮肺穿刺)活检确诊的172例中晚期肺腺癌(临床分期Ⅲ~Ⅳ期)。采集患者的一般临床特征、CT征象及双能量CT(DECT)参数。根据EGFR基因检测结果分为阳性组和阴性组,采用独立样本t检验或秩和检验分析比较组间的差异,对有统计学意义的参数,逐步建立基于临床特征、常规CT征象、DECT定量参数及联合的二元Logistic 回归模型,评价联合模型预测效能。结果" 172例肺腺癌患者EGFR基因表达阳性者80例,阴性者92例。动脉期IC、NIC、斜率K40-100 keV及静脉期IC在两组之间的差异有统计学意义(Plt;0.001);空气支气管征及胸膜牵拉征在两组之间的差异有统计学意义(Plt;0.05);单因素Logistic回归显示动脉期IC、NIC、斜率K40-100 keV、静脉期IC、空气支气管征、胸膜牵拉征与EGFR基因突变相关;DECT联合参数模型Model1、DECT模型联合临床特征模型Model2、DECT模型联合临床特征及CT征象模型Model3的ROC曲线下面积分别为0.746(敏感度63.75%,特异度92.39%)、0.787(敏感度65.00%,特异度91.30%)、0.819(敏感度77.50%,特异度82.61%)。经DeLong检验,3个模型曲线下面积的差异无统计学意义(Pgt;0.05)。结论" 联合临床特征、CT征象的DECT模型能有效预测中晚期肺腺癌患者EGFR突变,且优于单一模型。
关键词:表皮因子生长受体;双能量CT;肺腺癌;基因突变;预测模型
Dual‑energy CT quantitative parameters combined with CT signs in predicting epidermal growth factor receptor gene mutation in advanced lung adenocarcinoma
YU Lei1, 3, CHEN Wang1, SUN Qian2, JIAO Zhiyun3
1Department of Medical Imaging, 2Department of Respiratory, Yancheng No.1 People's Hospital, Affiliated Hospital of Medical School, Nanjing University, Yancheng 224000, China; 3Department of Medical Imaging, Affiliated Hospital of Yangzhou University, Yangzhou 225000, China
Abstract: Objective To explore the correlation between the quantitative parameters of dual-energy CT combined with CT signs, clinical characteristics and epidermal growth factor receptor (EGFR) gene mutations in patients with advanced lung adenocarcinoma, and to predict the mutation in patients with advanced lung adenocarcinoma. Methods A retrospective collection was performed for 172 cases of advanced lung adenocarcinoma (clinical stage III~IV) diagnosed by pathology (fiber bronchoscopy, lymph node, percutaneous lung puncture) biopsy in the First People's Hospital of Yancheng City from January 2022 to June 2023. The patient's general clinical features, CT signs, and dual-energy CT (DECT) parameters were collected. According to the results of EGFR gene testing, they were divided into positive group and negative group. The independent samples t-test or rank-sum test were used to analyze the differences between the groups, and a binary logistic regression model based on clinical characteristics, conventional CT signs, DECT quantitative parameters and combination was gradually established for statistically significant parameters, and the prediction performance of the combined model was evaluated. Results A total of 172 patients with lung adenocarcinoma during the study period were identified, including 80 positive for EGFR gene expression patients and 92 negative patients. There were significant differences in IC, NIC, slope K40-100kev in arterial phase and IC in venous phase between the two groups (Plt;0.001); There were significant differences in air bronchogram sign and pleural traction sign between the two EGFR groups (Plt;0.05); Univariate logistic regression analysis showed that arterial phase IC, NIC, slope K40-100 keV, venous phase IC, air bronchogram sign, and pleural traction sign were associated with EGFR gene mutations. The AUC for the DECT model, the DECT model combined with clinical characteristics, and the DECT model combined with clinical characteristics and CT signs were 0.746 (sensitivity 63.75%, specificity 92.39%), 0.787 (sensitivity 65.00%, specificity 91.30%), and 0.819 (sensitivity 77.50%, specificity 82.61%), respectively. According to the DeLong test, there was no significant difference in AUC among the three models (Pgt;0.05). Conclusion The combined DECT model, incorporating clinical characteristics and CT signs, effectively predicts EGFR mutations and performs better than the single model in patients with advanced-stage lung adenocarcinoma.
Keywords:epidermal factor growth receptor; dual-energy CT; adenocarcinoma of the lung; gene mutation; prediction model
表皮生长因子受体(EGFR)突变型非小细胞肺癌是一种独特的肺癌亚型,约占肺腺癌的一半[1] ,EGFR相关的酪氨酸激酶抑制剂作为敏感突变患者临床一线用药,疗效明显高于未突变患者,故明确EGFR突变状态是治疗关键。由于有创、组织样本量不足、经济等多重因素使得真实世界中EGFR突变检出明显受限[2] 。CT作为肺癌诊断、分期及疗效评估最常用的手段,经济且无创。既往研究表明CT征象与EGFR表达存在一定相关性,可能过于依赖研究者的主观性使得部分结论不一[3-5] 。双能量CT(DECT)可以通过特定的双能扫描及图像后处理技术对病变进行客观的多参数、定量分析[6] ,在鉴别分子分型方面已取得一定进展[7-10] ,其中部分研究仅纳入单一DECT定量特征评价与EGFR突变状态的相关性[7-9] ,或在DECT定量特征基础上联合临床、肿瘤指标进行预测[10] ,但均未评估DECT定量参数与CT征象相结合建立模型能否提高EGFR突变状态的预测效能。本文拟通过DECT定量参数与常规CT征象相结合建立组合模型,探讨在预测EGFR基因突变方面的应用价值,并评估其与单一DECT定量参数、DECT定量参数联合临床特征模型之间诊断效能的差异;既往研究CT机型高能管电压均为140 kV,本研究拟通过应用SOMATOM Force CT扫描,其管电压(90 kV、150 kV)高于传统设备,可以增加能量差,减少能谱重叠,更有利于实现物质分离。现报道如下。
1" 资料与方法
1.1" 一般资料
回顾性收集盐城市第一人民医院2022年1月~2023年6月经病理学(纤维支气管镜、淋巴结、经皮肺穿刺)活检确诊的172例中晚期肺腺癌(临床分期Ⅲ~Ⅳ期)患者的临床基本信息及DECT检查资料,其中男78例,女94例,年龄45~83(66.93±8.88)岁。临床分期Ⅲ期患者52例,Ⅳ期患者120例。
纳入标准:未经任何抗肿瘤治疗前行DECT检测并在我院影像归档和通信系统(PACS)中可获得CT薄层图像的患者;病灶内无影响测量的空洞及不张;DECT检查与取得病理结果之间少于1月;病理组织行EGFR检测与患者行DECT检查时间间隔小于2周;确认患者病例资料完整,且均经病理证实,为中晚期肺腺癌。无合并其它肿瘤病史。排除标准:病理组织未行EGFR基因检测或其它临床资料不完整;图像质量差或肿瘤边界不清,存在肺不张或肺实变无法测量者;转移性腺癌;检测之前接受过抗肿瘤治疗或合并其它肿瘤病史。共收集197例患者,排除8例病灶伴肺不张且边界不清无法测量,6例合并其它恶性肿瘤或既往有恶性肿瘤病史,6例活检组织样本较小无法行EGFR检测,5例DECT资料不完整,余172例纳入本次研究。本研究采用第8版国际肺癌TNM分期标准分类[11] 确定分期。
本研究纳入患者的临床资料包括性别、年龄、吸烟史、病理学组织类型和TNM分期等信息。本研究通过盐城市第一人民医院伦理委员会许可(伦理审批号:2024-K-101)。
1.2" "检测方法及图像采集、处理
1.2.1" EGFR基因突变检测结果收集" "所有患者组织标本送上海允英医学检验所检测。通过目标区域探针捕获和二代高通量测序技术(NGS)法检测18~21号外显子。根据EGFR基因检测结果分为阳性组和阴性组。
1.2.2" DECT图像采集" 采用Siemens DECT(SOMATOM Definition Force)行胸部动脉期、静脉期增强扫描,患者取仰卧位,深吸气末扫描,扫描范围肺尖至肺底。采用Ulrich高压注射器经右肘静脉注射对比剂碘佛醇(350 mgI/mL),注射剂量为1 mL/kg,流率为2.5 mL/s,注射后以3.0 mL/s的流率冲洗30 mL生理盐水,减少静脉内对比剂残留,降低伪影。X线球管旋转时间为0.25 s,探测器准直192×0.6 mm,螺距1.0,重组层厚1.0 mm,层距1.0 mm,卷积核Qr40。应用对比剂团注跟踪技术,将感兴趣区(ROI)设在降主动脉近端,触发阈值为100 HU,达阈值自动扫描,扫描时间60~70 s,自动获取90 kV、150 kV图像,ROI双能量成分选择0.6,自动生成120 kV混合能量图像。将层厚1.0 mm的薄层图像传至Syngo. VIA后处理工作站。
1.2.3" DECT定量参数测量与处理" "由2位具有12年以上影像诊断经验医生以随机顺序独立测量所有病例图像的ROI,定义两者测量结果差值lt;10%为无差异,取两者测量平均值作为结果,反之则视为差异过大,由第3位具有20年影像诊断经验的医师帮助建立共识。
将Sn 90 kV、150 kV图像导入双能量后处理工作站(Syngo.via VB10,Dual Energy,Siemens),选择mono+模式得到病灶40~190 keV间隔为10 keV的虚拟单能量CT值;选择VNC模式得到碘图成像,对动静脉期病灶最大层面及其相应层面进行数据测量,ROI的选择尽量选择病灶的实性区域,大小约为实性成分面积1/2及以上,避开病灶的边缘、空洞、钙化、伪影及强化的大血管等,测量所选层面及上、下两层,所有数值测量3次取平均值,两期ROI位置要求保持高度一致。
需测量的相关数据:测量动脉期、静脉期碘浓度(IC),计算标准化碘浓度(NIC),计算公式为:NIC= IC病灶/ IC同层主动脉 ×100%[12] ;计算40~100 keV动、静脉期能谱曲线斜率(K),K40-100keV =(CT40 keV– CT100 keV)/60,公式中CT40 keV表示40 keV单能图上ROI对应的CT值, CT100 keV表示100 keV单能图上ROI对应的CT值。
1.2.4" 常规CT征象评估" "收集172例中晚期肺腺癌患者CT征象,包括病变类型、病灶大小、分叶、毛刺、坏死、空洞、钙化、空气支气管征、血管集束征、胸膜牵拉征、肺气肿、胸腔积液、纵隔淋巴结肿大、胸膜转移、肺转移、远处转移等16项特征,参考Fleischner学会胸腔成像术语表(2024)[13] ,其中病灶大小测量肿瘤二维最长径,以及与最长径垂直的最大短径,取二者平均值作为肿瘤的大小用于分析。将高低千伏层厚1.0 mm薄层图像导入后处理工作站Syngo VIA,选择MM Reading模式,调取120 kV混合能量图像,由2位具有12年以上胸部放射诊断经验的医师在肺窗(窗宽-400 Hu,窗位1500 Hu);纵隔窗(窗宽40 Hu,窗位400 Hu)的轴位及多平面重组上完成,以随机顺序进行双盲分析,如有不同意见,由第3位具20年影像诊断经验医生帮助建立共识。
1.2.5" 模型建立" "将组间有统计学差异的临床特征、CT征象、双能量参数纳入单因素Logistic回归分析中,以评估各因素对中晚期肺腺癌EGFR基因突变的预测能力,并计算OR及95% CI。DECT联合参数建立Logistic回归模型Model1,DECT联合参数-临床特征建立模型Model2,联合DECT定量参数、临床特征及CT征象建立模型Model3,并计算各模型的曲线下面积(AUC)、敏感度、特异度。
1.3" 统计学分析
采用SPSS26.0统计分析软件对所采集原始数据进行统计学处理。采用Kolmogorov-Smirnov检验各计量资料(动静脉期IC、NIC及能谱曲线斜率K40-100 keV)是否符合正态分布,正态分布的数据以均数±标准差表示,组间差异的比较采用独立样本t检验;非正态分布的数据以中位数(四分位间距)表示,组间差异的比较采用秩和检验;计数资料(临床特征、CT征象)以n(%)表示,组间差异的比较采用χ2检验。使用AUC、敏感度及特异度评估模型的诊断效能,并使用精确概率法计算各自的95% CI。采用Delong检验比较各AUC间的差异。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" EGFR基因突变状态
172例患者中,EGFR基因表达阳性者80例,其中男29例,女51例;外显子19和21突变最常见(约91.25%),外显子18~21分别占比3.75%(3/80)、43.75%(35/80)、3.75% (3/80)、47.50%(38/80),其它少见突变1例。EGFR基因表达阴性者92例,其中男49例,女43例。
2.2" 临床特征与EGFR基因突变的关系
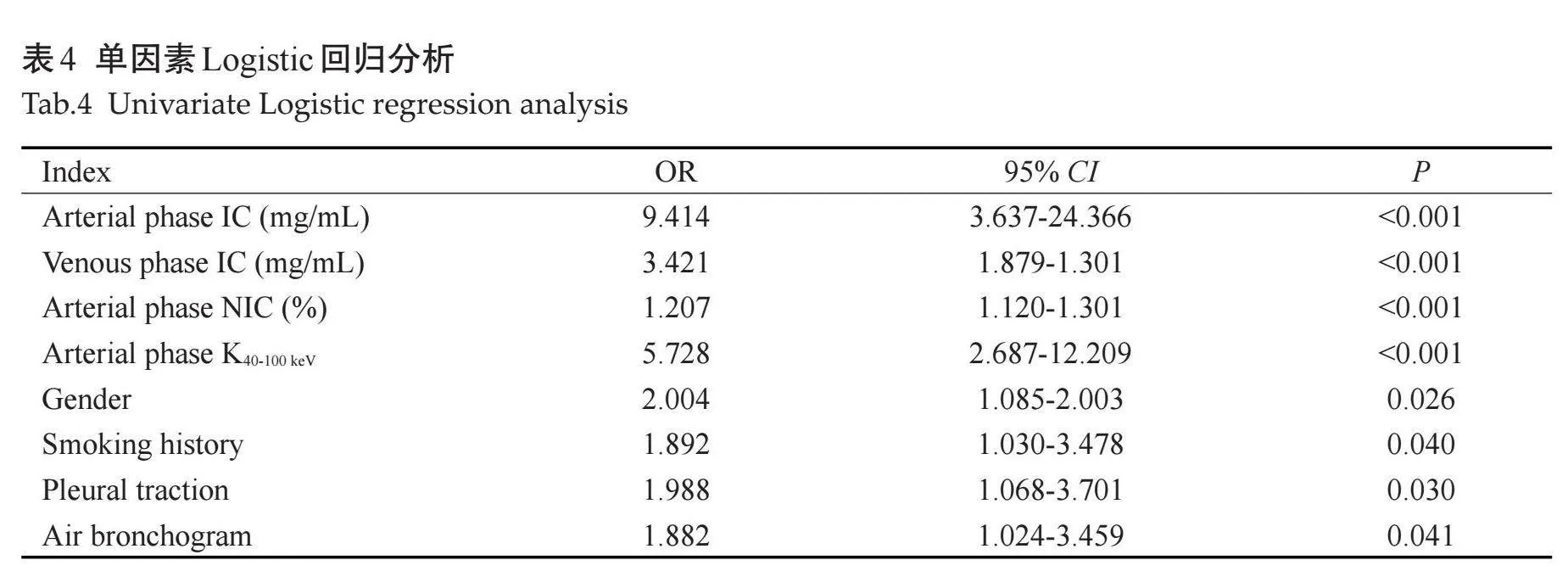
EGFR女性的发生率(63.75%)高于男性(31.25%)。两组性别和吸烟史的差异有统计学意义(P=0.025、0.039),年龄差异无统计学意义(P=0.077,表1)。
2.3" DECT定量参数与EGFR基因突变的关系
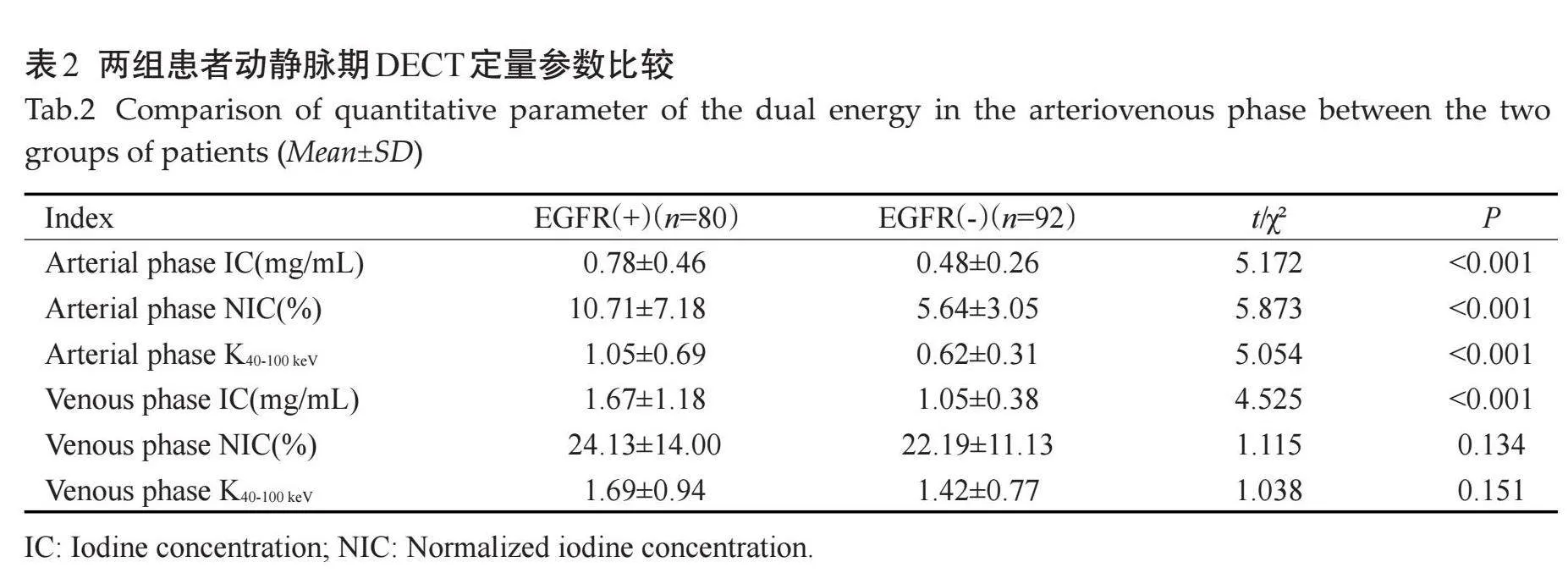
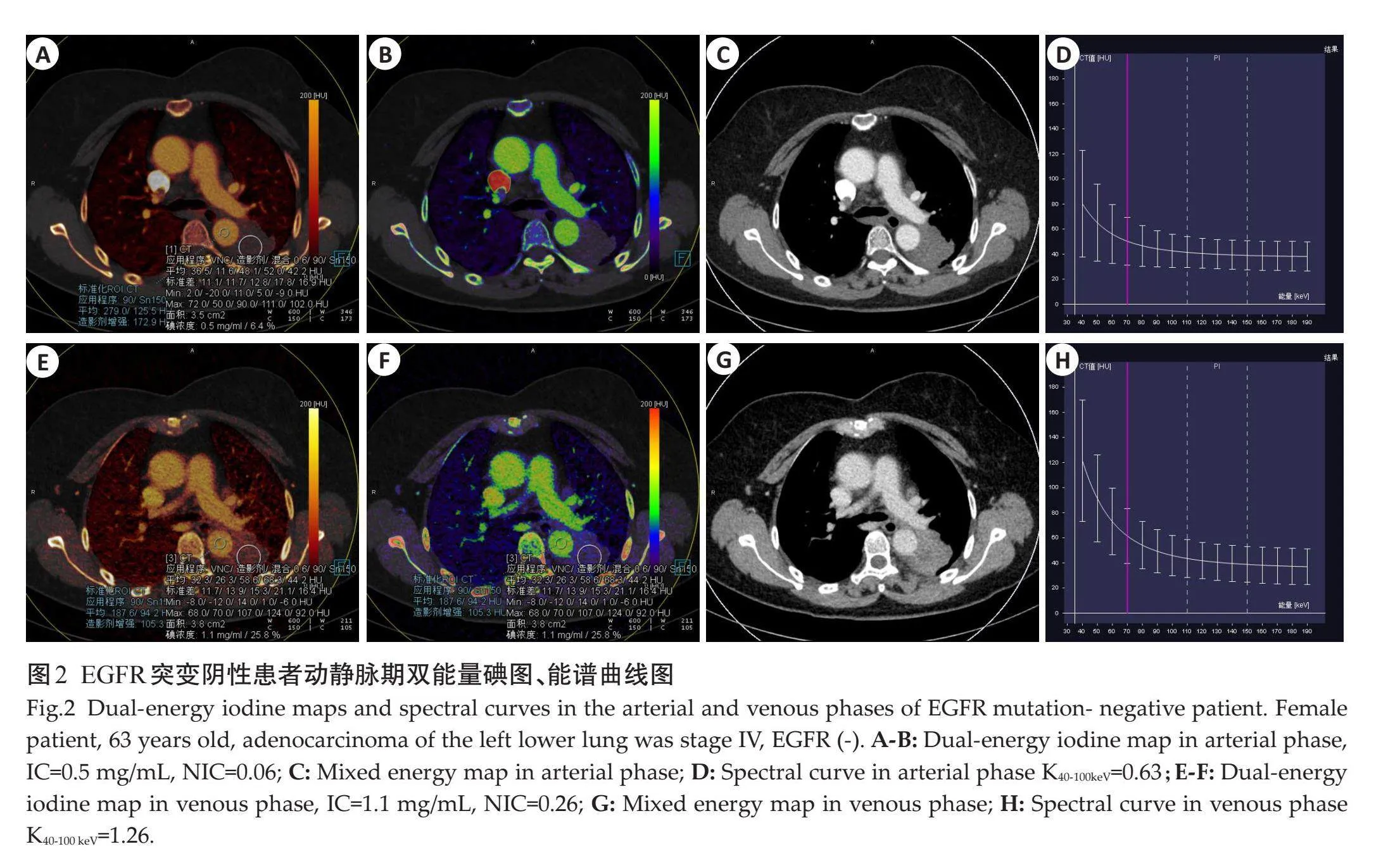
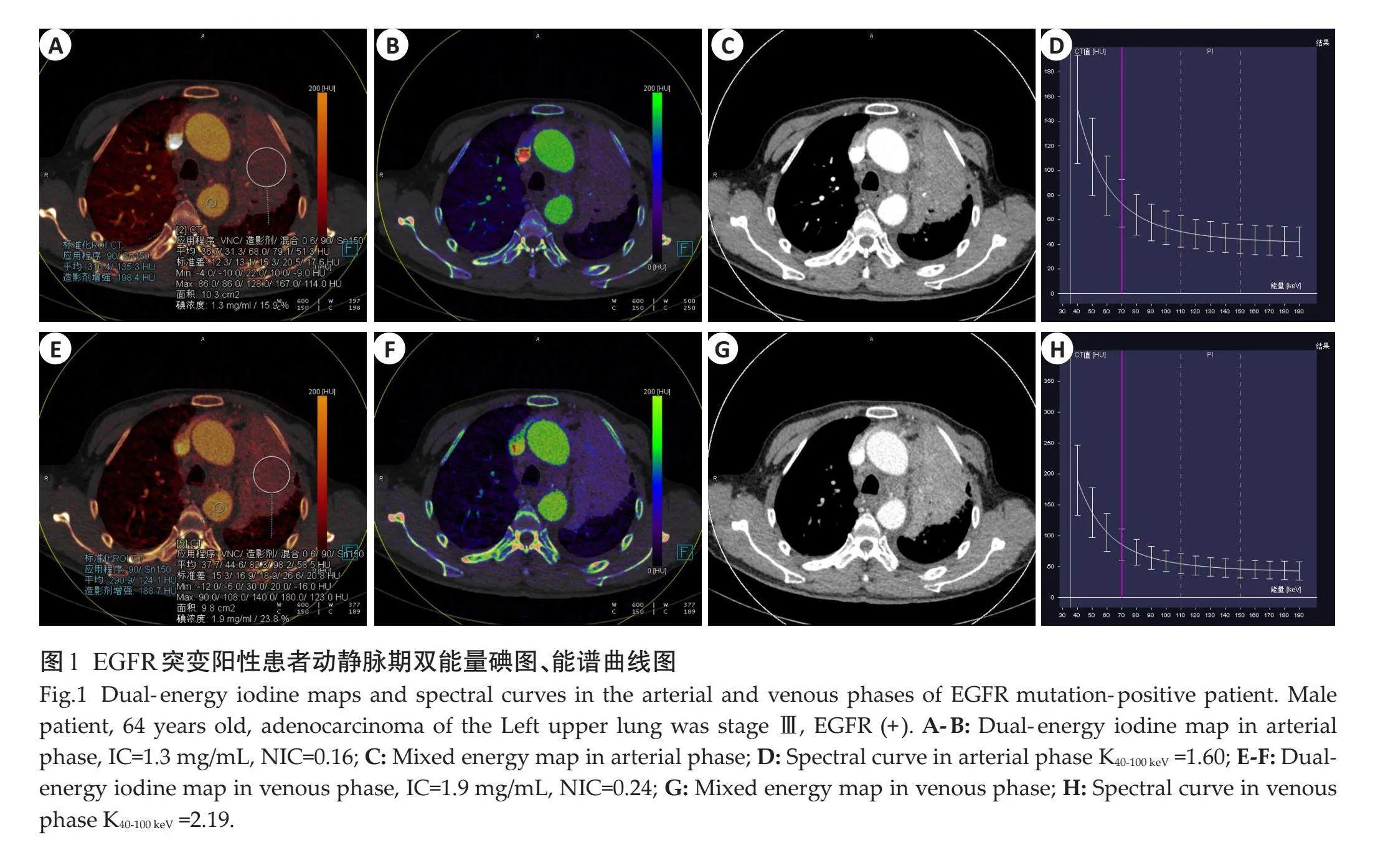
EGFR阳性组动脉期IC、NIC、斜率K40-100keV值及静脉期IC高于阴性组(Plt;0.001),静脉期NIC、斜率K40-100keV与阴性组的差异无统计学意义(Pgt;0.05,表2、图1~2)。
2.4" CT征象与EGFR基因突变的关系
172例肺腺癌患者中,EGFR阳性组肿瘤直径比阴性组略小,且周围型、毛刺征、分叶征、支气管充气征、胸膜牵拉征、坏死、钙化、胸腔积液、纵隔淋巴结肿大、空洞、胸膜转移的肺腺癌EGFR突变率较高,血管集束征、肺气肿、肺转移、远处转移的肺腺癌EGFR突变率较低。
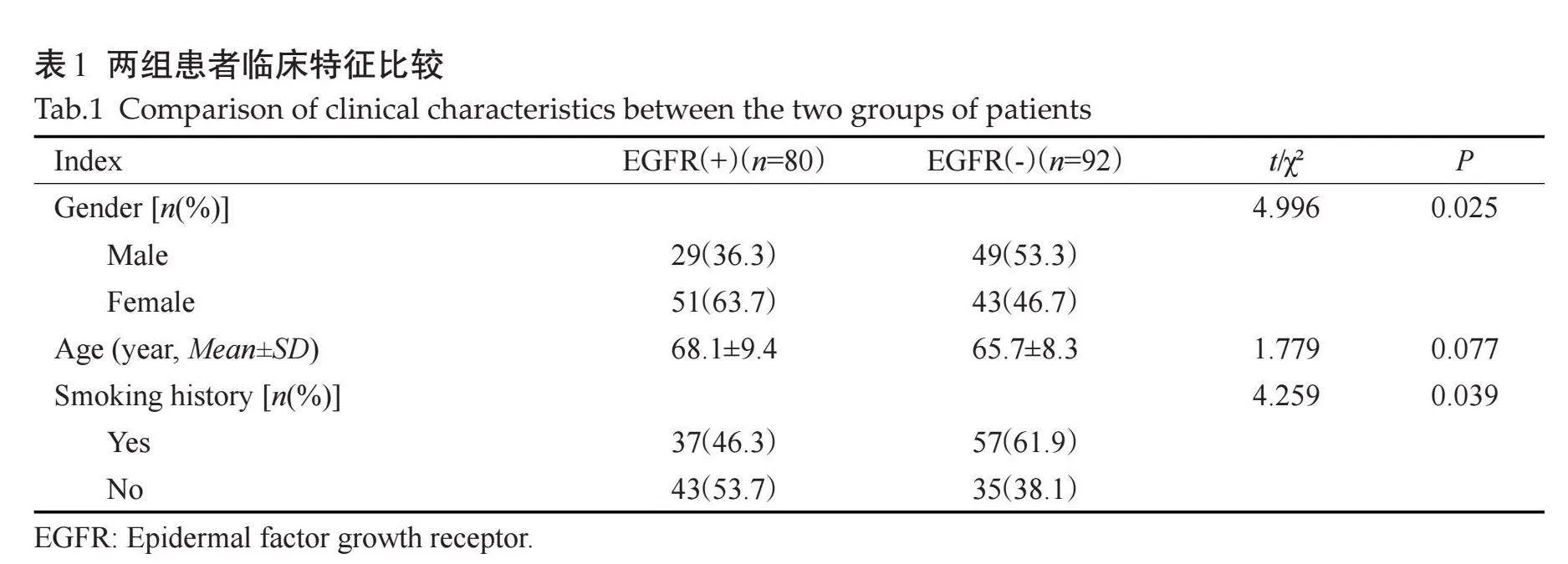
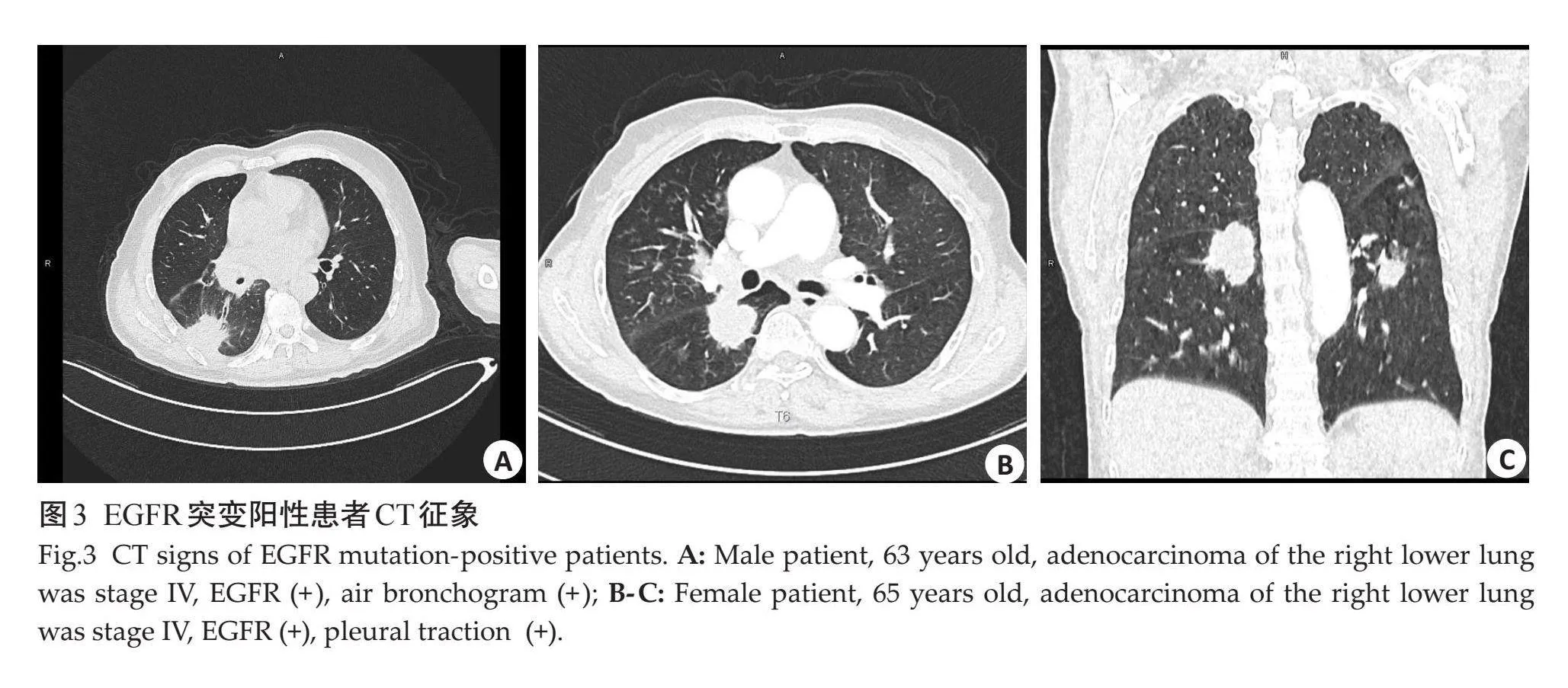
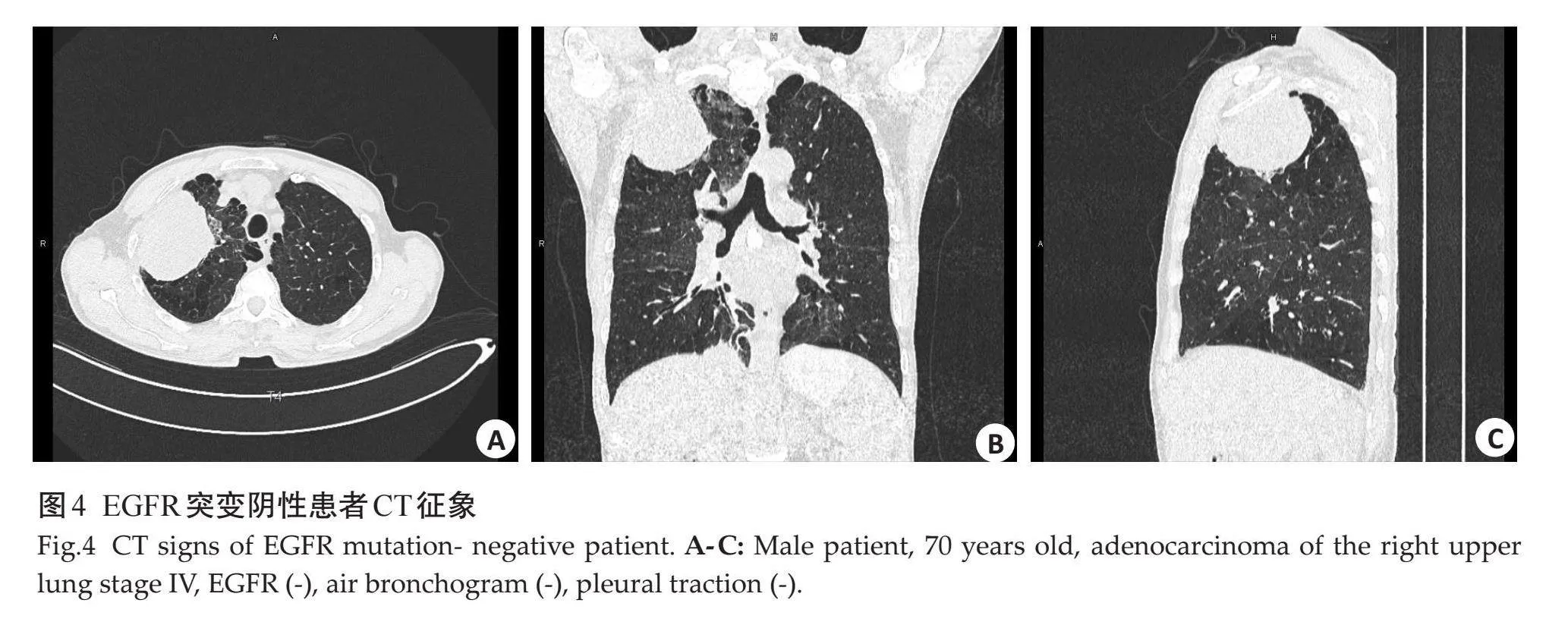
空气支气管征及胸膜牵拉征在两组间差异有统计学意义(Plt;0.05),肿瘤大小,病变类型、毛刺征、分叶征、坏死、空洞、钙化、血管集束征、肺气肿、胸腔积液、纵隔淋巴结肿大、胸膜转移、肺转移、远处转移在两组间的差异无统计学意义(Pgt;0.05,表3、图3~4)。
2.5" 模型分析
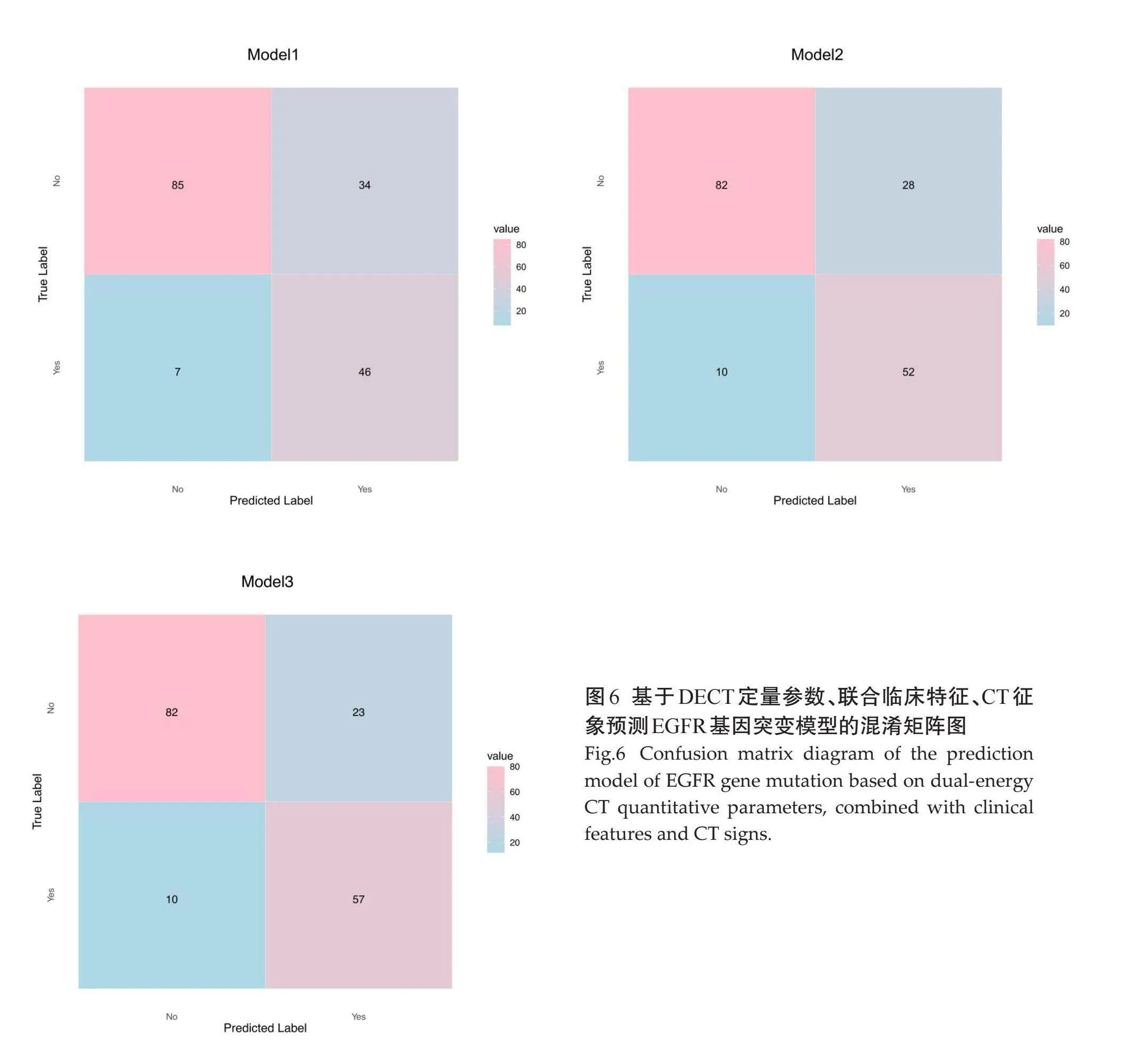
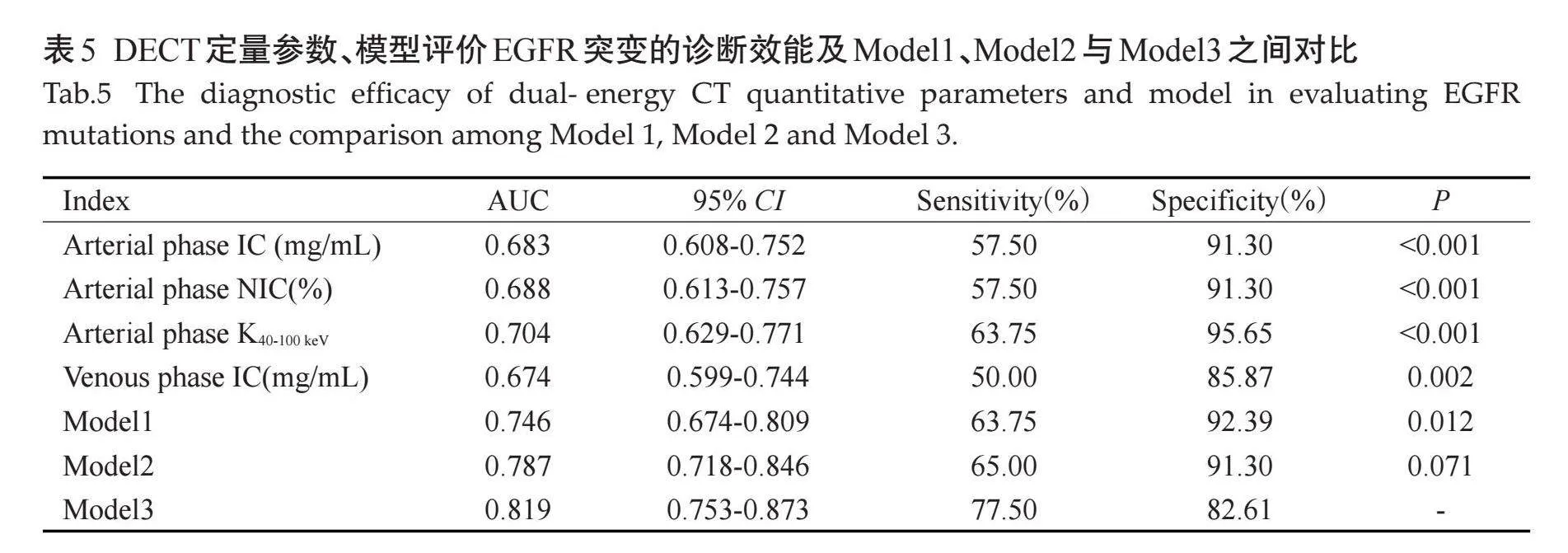
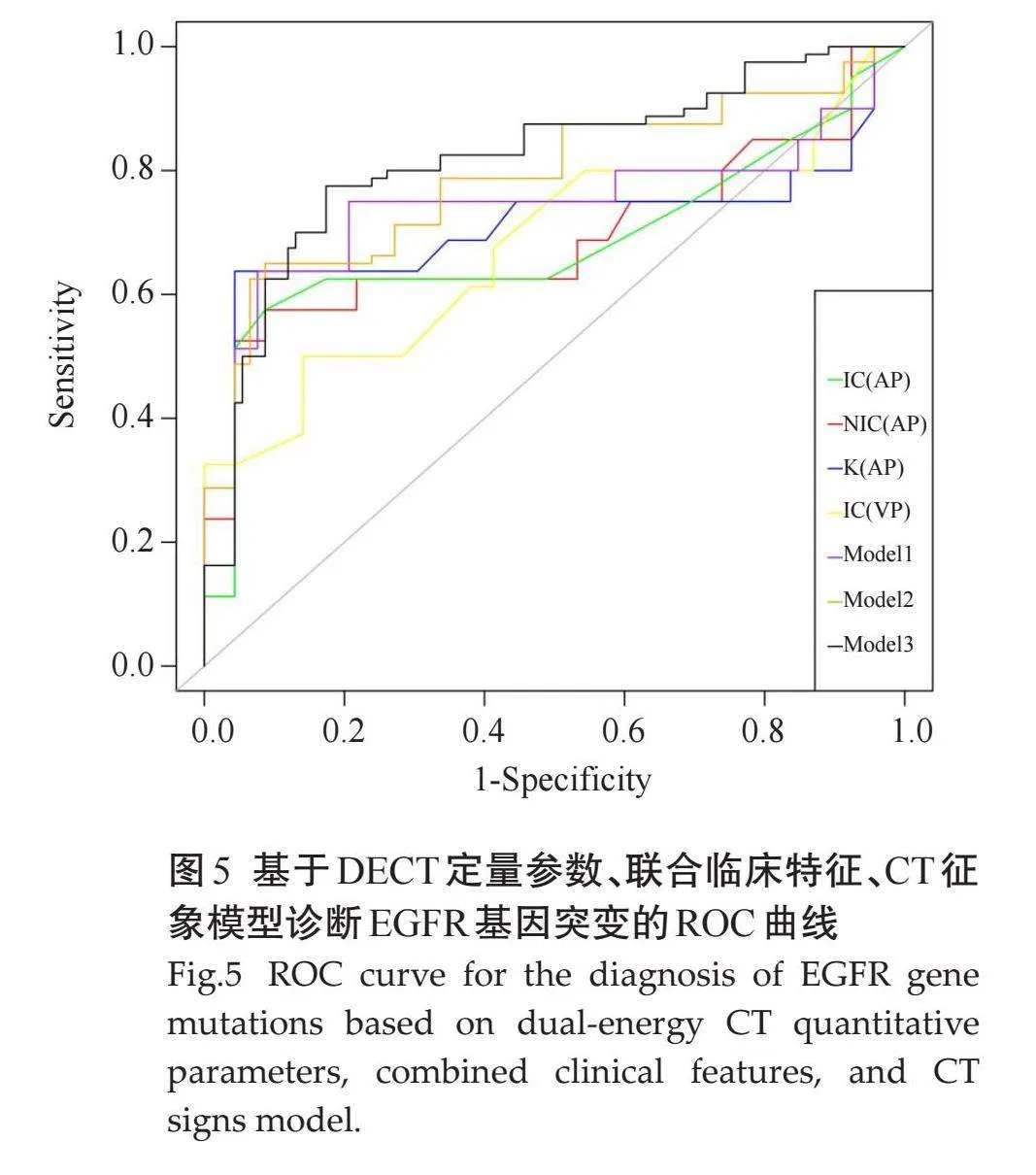
分析双能量参数中有统计学意义的单因素,即动脉期及静脉期IC、动脉期NIC及动脉期K40-100keV值。ROC曲线显示,上述指标的AUC分别为0.683、0.674、0.688、0.704,敏感度分别为57.50%、50%、57.50%、63.75%,特异度分别为91.30%、85.87%、91.30%、95.65%,联合参数建立Logistic回归模型 Model1的曲线下面积大于其他单个参数模型的曲线下面积,即联合参数预测晚期肺腺癌EGFR基因表达的效能大于单个参数,其曲线下面积为0.746,敏感度为63.75%,特异度为92.39%。由于性别和吸烟史在EGFR两组间的差异有统计学意义,将其纳入模型,Model1联合临床特征得到Model2曲线下面积为0.787,敏感度为65.00%,特异度为91.30%,较单纯联合参数模型预测效能稍高。模型Model2联合CT征象(空气支气管征、胸膜牵拉征)建立Model3的曲线下面积为0.819,敏感度为77.50%,特异度为82.61%(表5、图5)。
各模型混淆矩阵图示Model1的准确率为76.16%,Model2的准确率为77.91%,Model3的准确率为80.81%(图6)。
3" 讨论
肺癌影像表现源于病理生理及一些分子的微观特征改变[14] ,基因突变可促使细胞增殖和血管生成,一定程度上影响了肿瘤的生物学行为及血供,已有研究证明DECT定量参数可以间接反映肿瘤血供及增殖活性[15] ,碘浓度可以评估血供情况,能谱曲线斜率对肿瘤内部有较好的同源性判断,单能量成像可以增加不同组织之间的对比度[16] ,并且能更全面评价肿瘤的异质性。因此需不断探索建立影像与基因、分子特征、组织病理之间的连接,以弥补临床实践中EGFR基因突变检出不足的缺陷。
亚洲肺腺癌患者EGFR突变率约为50%[17] ,本研究中EGFR基因突变率为46.51%,其中19外显子缺失突变和21外显子L858R突变占90%以上,与既往研究结果相当。有学者对525例肺腺癌患者EGFR突变状态与CT征象进行研究,EGFR突变阳性患者中不吸烟、女性患者更多见[4] ;一项针对晚期肺腺癌的研究也发现女性、非吸烟患者更容易发生EGFR突变[18] 。本研究结果显示年龄的组间差异无统计学意义。
EGFR阳性组动脉期IC、NIC及静脉期IC值高于EGFR阴性组,组间差异有统计学意义,表明EGFR阳性组有比较丰富的血供,这与既往研究[10] 结果相符,EGFR在肿瘤发生、发展中起重要作用,促进细胞增殖及血管生成。有研究表明刺激或抑制EGFR表达会引起肿瘤血管生成差异[5] ,EGFR突变后可促进细胞VEGF分泌[19] ,从而使肿瘤的新生血管增多,代表肿瘤血容量的NIC增加。有研究通过对98例肺腺癌EGFR突变状态与能谱参数分析显示,EGFR突变组动脉期NIC及能谱曲线斜率K均高于野生组[20] ,这与本研究结果一致。造影剂中碘进入血液后经扫描-采集-后处理软件分析处理后得到的IC可以客观精准反映病灶血供,且受其它因素影响较小,NIC是肿瘤IC与同层面主动脉IC的比值,在造影剂的剂量、注射流速和循环层面上最大限度减少了个体差异。
除IC、NIC外,动脉期的能谱曲线斜率K40-100keV值在两组间的差异有统计学意义,静脉期组间差异虽无统计学意义,但阳性组的值较高,这与既往研究[7] 一致。组织CT值随X线光子能量变化的曲线称为能谱曲线,其变化情况由斜率体现,不同的化学成分和组织结构具有不同的能谱曲线[21] 。单能量水平越高,其CT值越小,100 keV以后CT值降低幅度明显减小,斜率变化平缓,因此选取40~100 keV段有显著变化区域能谱曲线计算其斜率用于研究。
常规CT征象方面,空气支气管征在EGFR在2组间差异有统计学意义,与既往研究[22-24] 结果相近,均表明空气支气管征与EGFR突变有关,癌细胞沿肺泡贴壁生长,不易破坏支气管结构而形成保留支气管形态的含气影,在鳞屑型生长为主的肺腺癌中较多见;也有研究表明EGFR基因突变多见于以鳞屑型生长的肺腺癌,由此推断空气支气管征可以预测EGFR基因突变状态[25] ;而有研究[26-27] 持不同观点,造成这一结果的原因可能与后者判断标准及样本量大小不同有关。本研究发现胸膜凹陷征与EGFR突变呈正相关,与既往大多数研究[23, 24, 27, 28] 结果一致,但是目前尚没有研究可以证实胸膜牵拉的机制与EGFR突变有实质上的关联,未来有待更多中心、更大样本量支持。
恶性肿瘤倍增速度较快,中心易缺血产生坏死,坏死物由支气管排出形成空洞。本研究发现EGFR突变阳性者更易发生坏死、空洞,EGFR突变虽可促进肿瘤内血管生成,但新生肿瘤血管内皮化不良,血管扭曲变形,成熟度较差,常因中心供血不足而产生坏死,与既往研究[29] 结果相近,推测原因可能由于样本量较少,造成选择偏倚。存在毛刺征、分叶征的病例中,突变阳性所占比例更高,分叶、毛刺都是肿瘤恶性生物学行为表现,可能与EGFR突变阳性有关,但本研究显示两组间差异无统计学意义,不能充分说明毛刺、分叶与EGFR突变的关系,可能由于判定标准主观性、单中心小样本数据偏倚较大,未来期待影像组学能更加客观地提取定性-定量特征精准分析。
有研究发现EGFR突变阳性组肿瘤直径小于阴性组[24, 29] ,本研究也得出了一致的结果,但组间差异无统计学意义,可能由于样本量比较局限所致。血管集束征,阳性患者比阴性患者占比稍低,与既往研究[30, 31] 认为血管集束征与EGFR突变状态有关的结果不符,推断可能由于纳入中晚期患者,病灶较大,血管集束征部分显示不明显。纵隔淋巴结肿大在EGFR阳性组中的发生率较阴性组稍高,与既往研究[32] 结果接近,提示EGFR在肺腺癌的高表达可能会促进淋巴结的转移。伴有肺气肿背景患者的EGFR突变率稍低,也有学者认为EGFR基因突变与肺气肿呈负相关,即存在肺气肿时,肺癌不易发生EGFR基因突变[23] 。本研究中胸膜转移特征有较高的EGFR阳性突变率,虽然在组间差异无统计学意义,但仍提示这类患者可能从EGFR相关的酪氨酸激酶抑制剂靶向治疗中获益。
与DECT定量参数模型相比,联合一般临床资料、CT征象的模型预测EGFR基因突变的效能有所提高,AUC值由0.746提升至0.787,再到0.819,证实了DECT定量参数联合CT征象辅助预测EGFR基因突变的价值。
本研究存在一些局限性:数据来自单中心,入组样本量较小,缺乏外部队列对照;未分析EGFR突变亚型与DECT定量参数及CT征象之间的关系;随访时间较短,未纳入预后随访数据,无法得出EGFR基因突变状态与预后之间关系。这也为今后研究指明了方向,未来期待多中心、更大样本量进一步研究,将在后续的研究中弥补上述不足,进一步探讨中晚期肺腺癌的DECT定量参数、CT征象与EGFR基因突变状态及预后之间的相关性。
综上所述,DECT定量参数联合CT征象及临床特征构建的组合模型在预测中晚期肺腺癌EGFR基因突变方面具有较高的预测效能,对指导肺腺癌个体化精准治疗具有重要意义。
参考文献:
[1]" " 崔久嵬, 段建春, 任胜祥, 等. 三代EGFR-TKI在EGFR突变NSCLC治疗中应用的专家共识(2022年版)[J]. 中国肺癌杂志, 2022, 25(9): 627-41.
[2]" " Douillard JY, Ostoros G, Cobo M, et al. First-line gefitinib in Caucasian EGFR mutation‑positive NSCLC patients: a phase‑IV, open-label, single-arm study[J]. Br J Cancer, 2014, 110(1): 55-62.
[3]" " 张" 群, 张" 毅, 熊" 瑶, 等. EGFR突变型肺腺癌CT特征分析[J]. 临床放射学杂志, 2022, 41(6): 1019-24.
[4]" " 杨" 赫, 刘子成, 王鸿亚, 等. 浸润性肺腺癌EGFR、ALK基因突变状态与影像学、病理学特征的相关性[J]. 中国肺癌杂志, 2022, 25(3): 147-55.
[5]" Baxa J, Ludvik J, Sedlmair M, et al. Correlation of iodine quantification and FDG uptake in early therapy response assessment of non-small cell lung cancer: possible benefit of dual-energy CT scan as an integral part of PET/CT examination[J]. Anticancer Res, 2020, 40(6): 3459-68.
[6]" " 任庆国, 滑炎卿, 李剑颖. CT能谱成像的基本原理及临床应用[J]. 国际医学放射学杂志, 2011, 34(6): 559-63.
[7]" " 张国晋, 曹云太, 张" 婧, 等. 能谱CT定量参数在鉴别肺腺癌EGFR突变状态中的价值[J]. 临床放射学杂志, 2021, 40(3): 448-52.
[8]" "Zhang GJ, Cao YT, Zhang J, et al. Epidermal growth factor receptor mutations in lung adenocarcinoma: associations between dual-energy spectral CT measurements and histologic results[J]. J Cancer Res Clin Oncol, 2021, 147(4): 1169-78.
[9]" " 余莹莹, 甘晓晶, 许晓燕, 等. 能谱CT参数Logistic回归模型预测中晚期非小细胞肺癌EGFR基因突变的价值[J]. 中国临床医学影像杂志, 2022, 33(4): 243-8.
[10]" 宋芹霞, 王祥发, 刘" 静, 等. 双能量CT成像联合肿瘤指标CEA对晚期肺腺癌EGFR突变的预测价值[J]. 临床放射学杂志, 2022, 41(5): 855-9.
[11]" Chansky K, Detterbeck FC, Nicholson AG, et al. The IASLC lung cancer staging project: external validation of the revision of the TNM stage groupings in the eighth edition of the TNM classification of lung cancer[J]. J Thorac Oncol, 2017, 12(7): 1109-21.
[12]" Ha T, Kim W, Cha J, et al. Differentiating pulmonary metastasis from benign lung nodules in thyroid cancer patients using dual-energy CT parameters[J]. Eur Radiol, 2022, 32(3): 1902-11.
[13]" Bankier AA, MacMahon H, Colby T, et al. Fleischner society: glossary of terms for thoracic imaging[J]. Radiology, 2024, 310(2): e232558.
[14] Pinheiro G, Pereira T, Dias C, et al. Identifying relationships between imaging phenotypes and lung cancer‑related mutation status: EGFR and KRAS[J]. Sci Rep, 2020, 10(1): 3625.
[15]" 赵恒亮, 孟闫凯, 窦沛沛, 等. 双能量CT预测肺癌Ki-67、TTF-1表达的价值[J]. 临床放射学杂志, 2021, 40(8): 1505-9.
[16] Lin LY, Cheng JJ, Tang DQ, et al. The associations among quantitative spectral CT parameters, Ki‑67 expression levels and EGFR mutation status in NSCLC[J]. Sci Rep, 2020, 10(1): 3436.
[17]" Suda K, Mitsudomi T, Shintani Y, et al. Clinical impacts of EGFR mutation status: analysis of 5780 surgically resected lung cancer cases[J]. Ann Thorac Surg, 2021, 111(1): 269-76.
[18]" Choi CM, Kim MY, Hwang HJ, et al. Advanced adenocarcinoma of the lung: comparison of CT characteristics of patients with anaplastic lymphoma kinase gene rearrangement and those with epidermal growth factor receptor mutation[J]. Radiology, 2015, 275(1): 272-9.
[19]" Larsen AK, Ouaret D, El Ouadrani K, et al. Targeting EGFR and VEGF(R) pathway cross-talk in tumor survival and angiogenesis[J]. Pharmacol Ther, 2011, 131(1): 80-90.
[20]" 余" 烨, 林了一, 华小兰, 等. 肺浸润性腺癌能谱CT定量参数与EGFR基因突变相关性研究[J]. 中国医学计算机成像杂志, 2020, 26(3): 242-6.
[21]" 张忠伟, 陈" 盈, 樊树峰. 不同能量段能谱曲线斜率鉴别肺腺癌亚型的诊断效能[J]. 现代实用医学, 2022, 34(8): 1041-3.
[22]" 韩" 冬, 张喜荣, 贾永军, 等. 基于CT征象构建肺腺癌表皮生长因子受体基因突变状态的列线图[J]. 临床放射学杂志, 2020, 39(12): 2447-52.
[23]Rizzo S, Petrella F, Buscarino V, et al. CT radiogenomic characterization of EGFR, K‑RAS, and ALK mutations in non-small cell lung cancer[J]." Eur Radiol, 2016, 26(1): 32-42.
[24]" 霍继文, 李" 琦, 罗天友, 等. 肺腺癌临床及CT特征在预测EGFR基因突变中的价值[J]. 放射学实践, 2021, 36(11): 1375-81.
[25]" Lee HJ, Kim YT, Kang CH, et al. Epidermal growth factor receptor mutation in lung adenocarcinomas: relationship with CT characteristics and histologic subtypes[J]. Radiology, 2013, 268(1): 254-64.
[26]" 兰文斌, 黄上萌, 马爱平, 等. 肺腺癌EGFR突变与胸部CT影像学特点的相关性研究[J]. 中国卫生标准管理, 2016, 7(36): 19-21.
[27]" 张孝先, 陈学军, 王立峰, 等. 肺腺癌CT征象与表皮生长因子受体基因突变的相关性研究[J]. 中华放射学杂志, 2016, 50(6): 416-20.
[28]" 张" 洪, 吕" 军, 徐美林, 等. 非小细胞肺癌患者EGFR基因突变与CT征象及临床特征的关系[J]. 天津医药, 2017, 45(12): 1308-12.
[29]" 王" 斌, 韩" 冬, 于" 楠, 等. 肿瘤标志物联合CT特征对肺腺癌表皮生长因子受体基因突变的预测价值[J]. 中国中西医结合影像学杂志, 2022, 20(2): 158-63.
[30] Haneda H, Sasaki H, Shimizu S, et al. Epidermal growth factor receptor gene mutation defines distinct subsets among small adenocarcinomas of the lung[J]. Lung Cancer, 2006, 52(1): 47-52.
[31]" Cao YY, Xu HB, Liao MY, et al. Associations between clinical data and computed tomography features in patients with epidermal growth factor receptor mutations in lung adenocarcinoma[J]. Int J Clin Oncol, 2018, 23(2): 249-57.
[32]" "郑" 军, 谢贵元, 李" 姣, 等. 非小细胞肺癌EGFR基因突变的临床意义研究[J]. 中国肿瘤临床, 2014, 41(14): 904-7.
[33]" Sacconi B, Anzidei M, Leonardi A, et al. Analysis of CT features and quantitative texture analysis in patients with lung adenocarcinoma: a correlation with EGFR mutations and survival rates[J]. Clin Radiol, 2017, 72(6): 443-50.
(编辑:熊一凡)
