黏液样胶质神经元肿瘤的影像、病理表现及鉴别诊断
2024-10-31毛馨怡贺鹏周长玉王宇军
摘要:黏液样胶质神经元肿瘤(MGT)是2021年WHO中枢神经系统肿瘤分类(第5版)中新定义的一种罕见的良性胶质神经元肿瘤,属于WHO Ⅰ级。过去,MGT由于在组织学形态上与胚胎发育不良性神经上皮肿瘤相似而被诊断为“透明隔中的胚胎发育不良性神经上皮瘤样肿瘤”。随着技术的发展,MGT的研究在影像学、病理学以及基因检测方面都有了新进展,尤其是PDGFRA的Lys385密码子处的热点突变,使MGT被定义为一个新的胶质瘤类型。本文对MGT的临床表现、影像学表现、病理特点以及基因检测结果进行了总结,并整合了与可能误诊的疾病的鉴别诊断,提出了该疾病可以发展的研究方向和潜在的治疗措施,旨在为MGT的诊治提供帮助,减少该疾病的漏诊、误诊。
关键词:黏液样胶质神经元肿瘤;影像学表现;病理
Imaging findings, pathological findings and differential diagnosis of myxoid glioneuronal tumor
MAO Xinyi1, HE Peng2, ZHOU Changyu1, WANG Yujun1
1Department" of Medical Imaging," The" First Affiliated Hospital of" Zhejiang" Chinese Medical University (Zhejiang Provincial Hospital of Chinese Medicine), Hangzhou 310006, China; 2Department of Imaging, Guangdong Sanjiu Brain Hospital," Guangzhou 510510," China
Abstract: Myxoid glioneuronal tumor (MGT) is a rare benign glioneuronal tumor newly defined in the 5th edition of 2021 WHO Classification of Central nervous System Tumors, which belongs to WHO grade I. In the past, MGT was diagnosed as \"dysembryoplastic neuroepithelial tumor in the septum pellucidum\" due to its histological similarity to dysembryoplastic neuroepithelial tumor. With the advancement of technology, there has been a new development in imaging, pathology, and genetic detection of the researches on MGT, especially the hot spot mutation at the Lys385 codon of PDGFRA, which defines MGT as a new type of glioma. This review summarizes the clinical manifestations, imaging manifestations, pathological characteristics and genetic test results of MGT and integrate the differential diagnosis of diseases that may be misdiagnosed, proposing research directions and potential therapeutic method of this disease, aiming to provide help for the diagnosis and treatment of MGT, and reduce the missed diagnosis and misdiagnosis of this disease.
Keywords: myxoid glioneuronal tumor; imaging findings; histopathology
黏液样胶质神经元肿瘤(MGT)是一种罕见的良性胶质神经元肿瘤,好发于透明隔和隔区,偶尔见于胼胝体、侧脑室旁,也可发生于颞叶和中脑顶盖。MGT发病年龄范围广,3~65岁均可发病[1] 。过去,MGT由于在组织学形态上与胚胎发育不良性神经上皮肿瘤相似而被诊断为“透明隔中的胚胎发育不良神经上皮瘤样肿瘤”。2018年,有学者报道了起源于透明隔和室周白质的胚胎发育不良性神经上皮肿瘤(DNET)的一个特定亚组中血小板衍生生长因子受体α(PDGFRA)的Lys385密码子处的热点突变,即p.K385突变(将K385从碱性氨基酸变为疏水性氨基酸),并将该肿瘤重新命名为MGT[2]。此后,MGT作为一种新的肿瘤类型被引入2021年WHO中枢神经系统肿瘤分类(第5版)中[3]。MGT作为一种颅内肿瘤,临床表现缺乏特异性,往往需要借助影像学和病理表现以及基因检测确定诊断。现已有对确诊患者的MGT的影像学表现和病理表现、免疫组织化学染色进行的回顾性病例分析以及对MGT的基因检测和DNA甲基化分析研究,但当前与该肿瘤相关的临床研究资料及病例分析较少,这与其罕见性与未被定义前的误诊和漏诊有关。本文旨在通过对该肿瘤的充分了解,有助于在临床上更加快速有效的诊断和提供治疗方案,减少该疾病的漏诊、误诊。
1" 临床表现
MGT表现多样,以头痛最为多见,是由于该肿瘤好发于透明隔和隔区,可压迫室间孔出现脑积水的相关症状。年龄较小的儿童通常表现为发热、惊厥、病理反射阳性,成年人可出现视力下降、精神以及行为异常。严重者可表现为突然发作的癫痫和主观认知障碍[4]。侵及穹窿的肿瘤手术切除后可出现类似海马损伤的记忆障碍[5]。部分患者没有明显临床表现,通常在体检时发现患病。
2" 影像学表现
CT表现:病灶表现为类圆形低密度影,轮廓清晰,外观呈囊性改变[6]。通常无钙化。
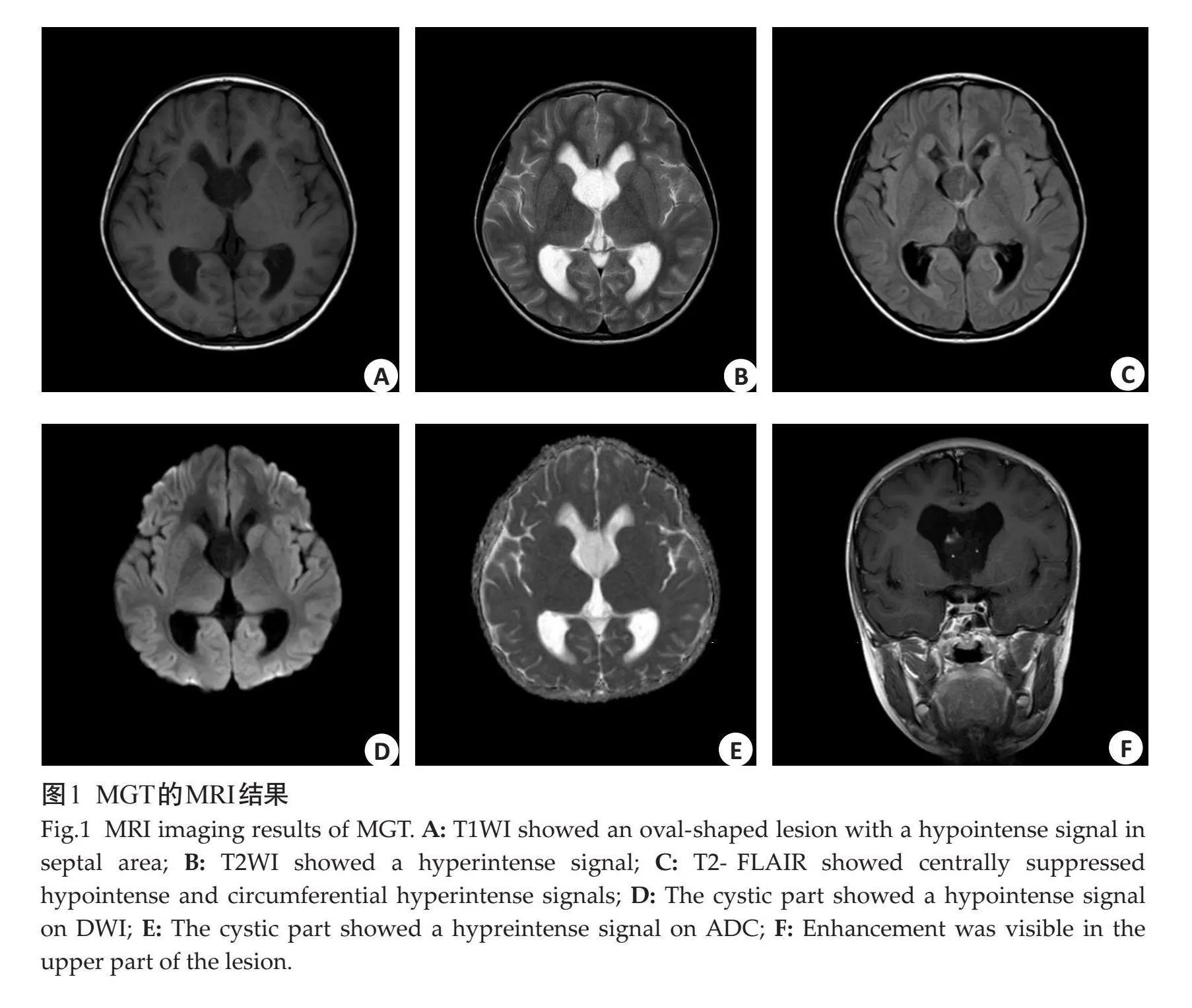
MRI表现:MGT多表现为单发类圆形病灶,形态大小与病程相关(图1)。肿瘤通常呈囊状改变,可为单囊状、多囊状或分叶状,但并不存在DNET中常见的泡沫状外观。病灶多为偏心位[7],一般不位于中线。病灶表现为囊性部分T1WI低信号,T2WI高信号,使用对比剂后囊性部分无强化,提示病灶囊性部分无血供;由于黏液的存在,T2-FLAIR成像显示部分抑制的中心信号和环绕的外周高信号边缘。囊性部分磁共振弥散加权成像(DWI)显示低信号,表观弥散系数(ADC)显示高信号;实性部分DWI显示等/稍高信号,ADC显示等/稍高信号,MRI增强扫描可见强化。动态磁化率对比上的局部脑血容量低灌注以及动脉旋转标记图上的脑血流量呈低灌注,MR波谱显示NAA峰的轻微降低[8],提示该部位神经元数量减少、损伤或功能活动异常。
有研究认为该肿瘤的主要影像学特征是其位置[8],MGT通常累及透明隔和膈区,偶尔见于胼胝体和侧脑室边缘,在偶发情况下,该肿瘤可以呈弥散性散播至脑室甚至小脑、软脑膜、颈背和胸脊髓以及脊神经根。
3" 病理表现
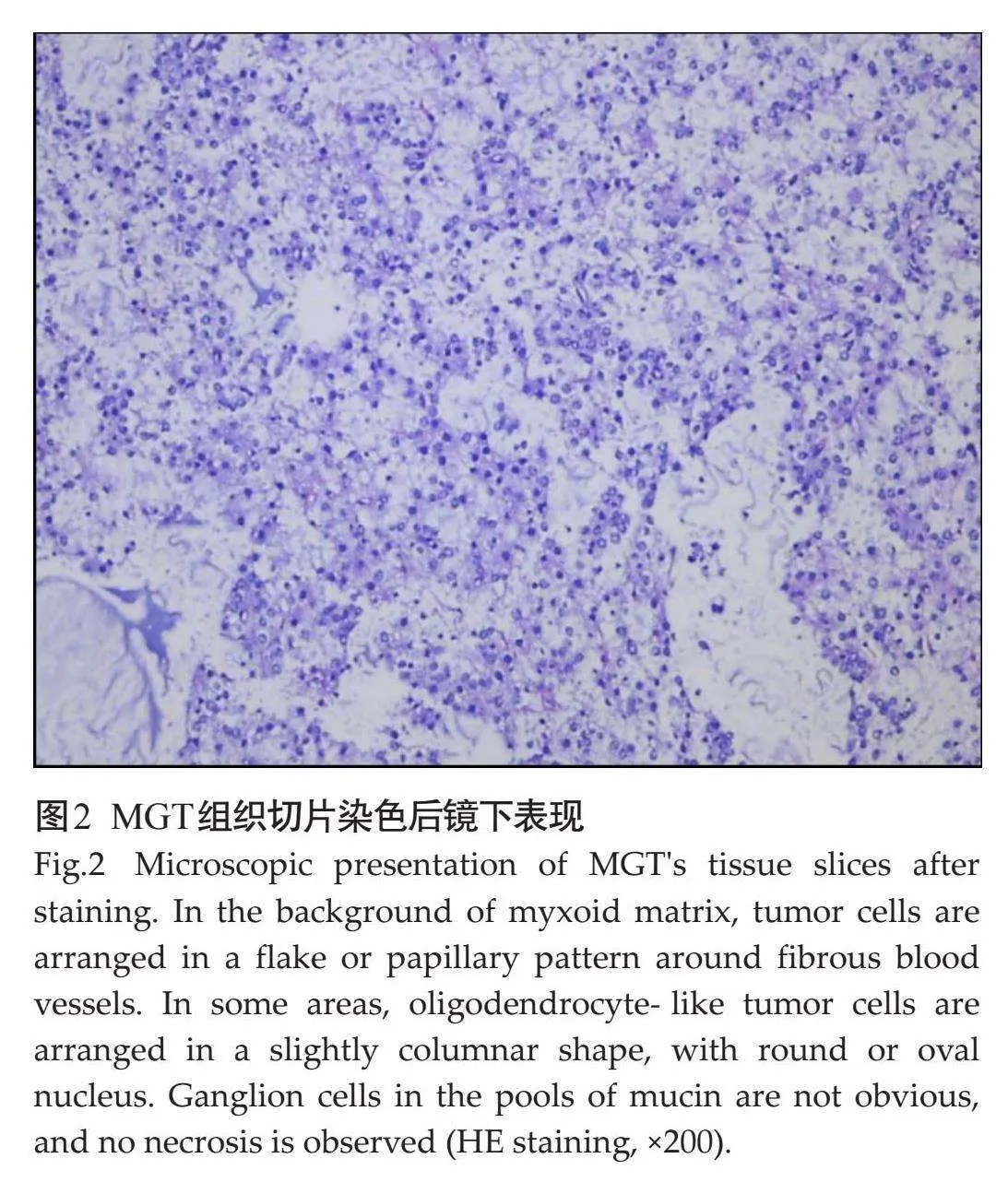
HE染色后镜下表现为均匀的小圆形少突胶质细胞样肿瘤细胞漂浮在富含黏液的基质背景中,可形成细胞柱(图2)。少突胶质细胞样肿瘤细胞核为圆形或卵圆形,核仁小,染色质细腻。黏液湖中可见漂浮的神经元和小血管影。此外,部分病例显示了神经细胞菊形团,肿瘤细胞以用突触素染色的嗜酸性纤维物质为核心形成菊形团,有时以血管为中心聚集或沿血管线性排列[9]。MGT组织学形态与DNET相似,通常包括皮层内的少突胶质细胞样肿瘤细胞、漂浮在黏液样基质中的神经元,但值得注意的是,MGT没有皮质DNET特有的黏蛋白结节[2]。绝大多数病例罗森塔尔纤维或嗜酸性粒体通常缺失,不存在畸形神经元或神经节细胞。通过这些基本病理表现可以鉴别MGT和DNET等其他低级别胶质瘤。
少突胶质细胞样肿瘤细胞表现出弥漫性OLIG2和SOX10染色细胞核阳性[10]以及特征性的胶质纤维酸性蛋白(GFAP)免疫染色强阳性[11],提示该肿瘤为胶质细胞来源。大多数少突胶质细胞样肿瘤细胞MAP2表达阳性,有丝分裂活性缺失,表现出低度增殖,MIB1的活性小于1%,Ki67标记指数一致较低,通常观察不到坏死或微血管增殖等特征,提示MGT为低级别肿瘤,预后良好。CD34免疫组化染色反应仅限于血管内皮细胞,其他细胞阴性[12, 13]。漂浮在黏蛋白湖里的某些细胞NeuN免疫组化染色呈阳性,证实了其神经元性质。这些免疫组织化学染色表现证实了MGT的惰性,解释了MGT侵袭性低的原因,也为MGT手术后是否应该进行放疗和化疗提供了依据。
4" 基因检测
MGT最主要的一个特征就是PDGFRA的Lys385密码子处的热点突变,即p.K385突变(将K385从碱性氨基酸变为疏水性氨基酸)。在该肿瘤的基因检测中,胶质瘤通常具有的临床显著突变或基因融合呈阴性,包括IDH1/2、组蛋白基因H3F3A、H3F3B、HIST1H1C、HIST3H3B或HIST1H3C[14]。MGT在NGS中BRAF、FGFR1、FGFR2、FGFR3[15]、NF1、PIK3CA和PIK3R1的改变进一步呈阴性,这些基因改变通常在低级别神经胶质或胶质神经元肿瘤中发现,如毛细胞星形细胞瘤、神经节胶质瘤、年轻的多形性低级别神经上皮肿瘤(PLNTY)或DNET。在中枢神经系统肿瘤诊断中,全基因组甲基化已被证明可以降低观察者间的变异性并提高诊断精度[16]。而MGT除了突变不同外,在许多研究中的DNA甲基化聚类分析也不同。PDGFRA p.K385L的改变是MGT唯一确定的遗传改变,这种改变可能是MGT产生的根本原因。
5" 鉴别诊断
5.1" 第三脑室胶质囊肿
有研究认为,透明隔MGT最重要的鉴别诊断是第三脑室胶质囊肿[5]。胶质囊肿通常好发于第三脑室顶的前上部分,与MGT好发部位相近,且二者均为圆形或类圆形的囊状结构,可能容易产生混淆。首先,胶质囊肿在CT上通常表现为高密度肿块。其次,在磁共振图像中,第三脑室胶质囊肿在T1加权图像上通常呈高信号,且T2加权图像上表现出可变性,静脉注射造影剂后未观察到病态增强[17]。另外,胶质囊肿起源于原始神经上皮的异常折叠,在组织学上表现为黏液杯状细胞和分散的纤毛细胞穿插在内嵌的单层至假复层柱状上皮细胞之间[18]。由此可见,根据影像学表现和病理表现可以将第三脑室胶质囊肿和MGT区分开来。
5.2" DNET
过去,黏液样肿瘤由于在组织学形态上与胚胎发育不良性神经上皮肿瘤相似而被诊断为“透明隔的胚胎发育不良神经上皮瘤样肿瘤”,而在2021年WHO新发表的第5版世界卫生组织中枢神经系统肿瘤分类中,MGT被重新定义为一种新的肿瘤类型,因此在临床上两者的鉴别也至关重要。
DNET在儿童和青少年中多见,好发于大脑皮层尤其是颞叶,因此极易发生癫痫发作。MRI T1WI呈低信号,T2WI和T2-FLAIR高信号,均与MGT相似。但与之区别的是:DNET通常具有MGT不具有的气泡状或爆米花状多结节状形状[19];DNET钆增强扫描后多无强化,MGT囊性部分不强化,实性部分强化。
组织学上,DNET以皮层的少突胶质细胞样肿瘤细胞、漂浮在黏液样基质中的神经元和皮质内富含黏蛋白的结节为特征。而MGT缺乏特有的黏蛋白结节[20]。
在基因检测方面,大多数DNET具有低级别神经胶质或胶质神经元肿瘤通常存在的FGFR1、BRAF、MYB和MYBL1等基因的改变,而在MGT中这些改变却并不常见,PDGFRA p.K385L的改变是MGT唯一确定的遗传改变,通过这一点可以明确将DNET和MGT区分开来。
5.3" 形成菊形团的胶质神经元肿瘤(RGNT)
RGNT起源于室管膜下的多能干细胞,该肿瘤常见于第四脑室壁,沿中线缓慢生长。T1WI呈等低或低信号,T2WI呈高信号,DWI显示病灶无扩散受限。RGNT的强化特点为肿瘤实性成分呈环状强化,中央黏液成分缺乏强化,周围疏松肿瘤组织弱或无强化,被称为“青椒切面征”[21]。
肿瘤的组织病理学检查显示为双相肿瘤,神经胶质成分主要呈毛细胞星形细胞瘤样结构,可见不同数量的Rosenthal纤维和嗜酸性颗粒体,混合有排列成紧密菊形团和血管周围假菊形团,肿瘤细胞分化程度高,无明显异型性及核分裂象。突触素在菊形团的中心高度表达,GFAP在类似毛细胞星形细胞瘤的梭形细胞中高度表达[22]。Ki-67增殖指数通常较低。
分子遗传学分析表明,主要的分子变化涉及FGFR1突变和PIK3R1突变[23]。
5.4" PLNTY
PLNTY通常位于颞叶,边界清楚,由混合的实性成分、中心钙化和周围囊肿组成,瘤周皮质CD34免疫染色呈典型的强弥漫性[24, 25]。
5.5nbsp; 节细胞胶质瘤
节细胞胶质瘤好发于颞叶,属于WHOI级,MRI表现为T1WI稍低信号和T2WI等或稍高信号。节细胞胶质瘤通常表现为伴有壁结节的囊性病灶[26],且壁结节可明显强化,钙化常见。
5.6" 中枢神经细胞瘤
中枢神经细胞瘤是好发于侧脑室和第三脑室的小细胞神经元肿瘤,其主要发生部位在透明隔近室间孔处。MRI表现为T1WI中等强度或略低强度,T2WI高强度,静脉注射造影剂后表现为部分增强[27]。在T1和T2加权序列中,一个病变内可能有许多流动空隙,这表明其血管性增加,而多个信号脱落病灶的存在则表明病变内钙化。MR波谱中的NAA峰上升有助于确定中枢神经细胞瘤的诊断[28]。常见征象为皂泡征、扇贝征和宽基底征。
临床初步诊断颅内病灶主要依靠影像学表现,而初步的鉴别诊断决定了对疾病的预后判断和治疗方式的选择。MGT的主要需要与脑室内囊肿、原发性中枢神经系统淋巴瘤和其他类型胶质瘤进行鉴别。在治疗方案的选择上,三者有着很大的不同。MGT作为低级别胶质瘤,主要的治疗方法是手术切除以及并发症的治疗。高级别胶质神经元肿瘤除外最大范围安全切除手术,还要在术后进行放、化疗联合治疗[29]。脑室内囊肿主要是依靠囊液引流和内镜下囊壁切除进行治疗[30]。误诊可能导致延误病情和治疗不当,对病人病情的预后不利,所以对该疾病鉴别诊断尤为重要。
6" 结论
MGT好发于透明隔和隔区,CT表现为囊性改变的类圆形低密度影,MRI表现为T1WI低信号、T2WI高信号,T2-FLAIR显示部分抑制的中心信号和外周高信号边缘。动态磁化率对比和动脉旋转标记显示为低血流灌注,MR波谱提示该部位神经元减少或受损。病理学上表现为黏液湖中丰富的少突胶质细胞样肿瘤细胞,可见少量漂浮的神经元细胞和小血管影。免疫组化表现出弥漫性OLIG2和SOX10染色细胞核阳性以及特征性的GFAP免疫染色强阳性,以及表现出低度增殖和有丝分裂活性缺失。在基因方面,MGT最突出的特征就是PDGFRA的Lys385密码子处的热点突变,即p.k385突变,而大多数胶质瘤通常具有的基因改变在MGT中常不存在。
未来研究可以定位于该肿瘤发病基因的调控网络以及遗传、免疫微环境等因素,探究该疾病的好发人群和预防措施。在临床治疗方面,由于MGT属于WHO Ⅰ级肿瘤,表现为良性,因此若无任何症状,可以选择观察治疗和随访,目前主要的方法是以手术切除为主,放疗和化疗对MGT的治疗作用尚存在争议,无较为明确的循证医学证据,未来研究可以从该肿瘤的放、化疗入手,由于基因突变在该肿瘤的发病上起着决定性的作用,靶向治疗可以成为该疾病治疗的研究方向。
MGT作为一种新定义的肿瘤类型,在组织学方面与DNET和RGNT相似,过去常与这两者混淆而导致误诊,因此对该病的鉴别诊断至关重要。毋庸置疑的是,通过对该疾病好发部位、影像学、病理学、基因检测方面的了解,抓住该病的特点,可以更好地对该并进行诊断,减少漏诊和误诊的几率。
参考文献:
[1]" " 张旭静, 王梅云, 关舒元, 等. 黏液样胶质神经元肿瘤的影像表现与病理对照分析[J]. 中华放射学杂志, 2023, 57(12): 1368-70.
[2]" "Solomon DA, Korshunov A, Sill M, et al. Myxoid glioneuronal tumor of the septum pellucidum and lateral ventricle is defined by a recurrent PDGFRA p.K385 mutation and DNT-like methylation profile[J]. Acta Neuropathol, 2018, 136(2): 339-43.
[3]" "李" 智. 2021年世界卫生组织中枢神经系统肿瘤分类(第五版)新增肿瘤介绍[J]. 中国现代神经疾病杂志, 2021, 21(9): 769-82.
[4]" "Zhou J, Qu KX, Lv MX, et al. A 4-year-old boy with a ventricular mass[J]. Brain Pathol, 2022, 32(5): e13081.
[5]" "Stasenko A, Kaestner E, Rodriguez J, et al. Memory deficit following resection of an intraventricular myxoid glioneuronal tumor impinging on the bilateral fornix: a case report[J]. Front Oncol, 2023, 13: 1263556.
[6]" "Gonçalves FG, Mahecha-Carvajal ME, Desa A, et al. Imaging of supratentorial intraventricular masses in children: a pictorial review- part 1[J]. Neuroradiology, 2024, 66(5): 677-98.
[7]" Zamora C, Castillo M. From dysembryoplastic neuroepithelial tumors to myxoid glioneuronal tumors, a new entity[J]. AJNR Am J Neuroradiol, 2021, 42(11): E77-E78.
[8]" "Narvaez EO, Inada BSY, de Almeida PRSF, et al. Myxoid glioneuronal tumour-report of three cases of a new tumour in a typical location and review of literature[J]. BJR Case Rep, 2021, 7(4): 20200139.
[9]" "Lucas CG, Villanueva-Meyer JE, Whipple N, et al. Myxoid glioneuronal tumor, PDGFRA p.K385-mutant: clinical, radiologic, and histopathologic featuresvBrain Pathol, 2020, 30(3): 479-94.
[10]" 施黎银, 冯" 莎, 黄文亭. 黏液样胶质神经元肿瘤伴PDGFRA p.K385突变1例[J]. 中国临床案例成果数据库, 2023, 5(1): E00977.
[11] Caporalini C, Scagnet M, Giunti L, et al. Myxoid glioneuronal tumor: Histopathologic, neuroradiologic, and molecular features in a single center series[J]. Neoplasia, 2023, 37: 100885.
[12] Kleinschmidt-DeMasters BK, Chiang J, Donson AM, et al. Myxoid glioneuronal tumor, PDGFRA p.K385L‑mutant, arising in midbrain tectum with multifocal CSF dissemination[J]. Brain Pathol, 2022, 32(1): e13008.
[13]" 王孟泽, 杨" 雷, 赵迁浩. 儿童黏液样胶质神经元肿瘤一例[J]. 中国现代神经疾病杂志, 2022, 22(5): 439-43.
[14]" Gilani A, Siddiq Z, Kleinschmidt-DeMasters BK. Temporal lobe myxoid glioneuronal tumor, PDGFRA p.K385L-mutant with DNA methylation confirmation[J]. Brain Pathol, 2022, 32(5): e13079.
[15]" de Blank P, Fouladi M, Huse JT. Molecular markers and targeted therapy in pediatric low-grade glioma[J]. J Neurooncol, 2020, 150(1): 5-15.
[16] Perez E, Capper D. Invited Review: DNA methylation-based classification of paediatric brain tumours[J]. Neuropathol Appl Neurobiol, 2020, 46(1): 28-47.
[17]" Marshman LA, Chawda SJ, David KM. Change in CT radiodensity of a colloid cyst of the third ventricle: case report and literature review[J]. Neuroradiology, 2004, 46(12): 984-7.
[18] Kabashi A, Dedushi K, Ymeri L, et al. Colloid Cyst of the ThirdVentricle: case report and Literature Review[J]. Acta Inform Med, 2020, 28(4): 283-6.
[19] Rahim S, Din NU, Abdul‑Ghafar J, et al. Clinicopathological features of dysembryoplastic neuroepithelial tumor: a caseseries[J]. J Med Case Rep, 2023, 17(1): 327.
[20] Phi JH, Kim SH. Dysembryoplastic neuroepithelial tumor: a benign but complex tumor of the cerebral cortex[J]. Brain Tumor Res Treat, 2022, 10(3): 144-50.
[21]" 王宇军, 郑学军, 李建业. 神经影像征象解析-肿瘤篇[M]. 北京: 科学技术文献出版社, 2022: 165-7.
[22]" Park YW, Vollmuth P, Foltyn-Dumitru M, et al. The 2021 WHO classification for gliomas and implications on imaging diagnosis: part 3-summary of imaging findings on glioneuronal and neuronal tumors[J]. J Magn Reson Imaging, 2023, 58(6): 1680-702.
[23]" Liu J, Lin F, Sun YH, et al. Clinicopathological analysis of rosette-forming glioneuronal tumors[J]. Diagn Pathol, 2024, 19(1): 39.
[24]" Armocida D, Berra LV, Frati A, et al. Radiological and surgical aspects of polymorphous low-grade neuroepithelial tumor of the young (PLNTY)[J]. Acta Neurol Belg, 2023, 123(2): 327-40.
[25] Bale TA, Rosenblum MK. The 2021 WHO Classification of Tumors of the Central Nervous System: an update on pediatric low-grade gliomas and glioneuronal tumors[J]. Brain Pathol, 2022, 32(4): e13060.
[26]" 罗和川, 程维琴, 高思婕, 等. 儿童胶质神经元和神经元肿瘤的影像学表现[J]. 放射学实践, 2023, 38(4): 490-6.
[27]" Yang I, Ung N, Chung LK, et al. Clinical manifestations of central neurocytoma[J]. Neurosurg Clin N Am, 2015, 26(1): 5-10.
[28] Choudhari KA, Kaliaperumal C, Jain A, et al. Central neurocytoma: a multi-disciplinary review[J]. Br J Neurosurg, 2009, 23(6): 585-95.
[29]" 国家卫生健康委员会医政医管局, 中国抗癌协会脑胶质瘤专业委员会, 中国医师协会脑胶质瘤专业委员会. 脑胶质瘤诊疗指南(2022版)[J]. 中华神经外科杂志, 2022, 38(8): 757-77.
[30] Stachura K, Grzywna E, Krzyżewski RM, et al. Retrospective evaluation of endoscopic treatment in colloid cyst of the third ventricle[J]. Videosurgery Other Miniinvasive Tech, 2021, 16(3): 604-11.
(编辑:郎" 朗)
