基于血清学标记物和CT特征模型预测肝细胞癌组织分化程度
2024-10-30黄翔何畅陈莲环凌文峰张志强朱志强陈小凤杨志企
摘要:目的" 探讨基于联合血清学标记物和CT特征模型在评估肝细胞癌(HCC)组织分化程度中的应用价值。方法" 回顾性收集梅州市人民医院2015年11月~2023年10月共206例HCC患者的临床及CT资料,其中训练组144例(包括42例低分化HCC和102例中高分化HCC),验证组62例(包括21例低分化HCC和41例中高分化HCC)。比较低分化HCC和中高分化HCC组间血清学标记物及CT特征差异。采用多因素筛选HCC分化程度独立危险因素并构建模型。结果" 相比中高分化HCC,低分化HCC的AFP阳性率(P=0.001)、乙肝发生率(P=0.003)、低密度环征(P=0.015)和癌栓发生率(P=0.001)较高,平扫CT值较低(P=0.010)。多因素分析显示AFP(OR=0.269,P=0.027)、低密度环征(OR=0.273,P=0.047)、癌栓(OR=0.191,P=0.005)和肿瘤平扫CT值(OR=1.091,P=0.009)是HCC组织分化程度的独立危险因素。基于联合AFP、低密度环征、癌栓和肿瘤平扫CT值的联合模型诊断效能最高,其在训练组和验证组中的曲线下面积分别为0.780和0.620。结论" AFP、低密度环征、癌栓和肿瘤平扫CT值是HCC组织分化程度的独立危险因素,基于上述特征构建的联合模型对HCC组织分化程度具有较好诊断价值。
关键词:肝细胞癌;组织分化程度;CT;血清学标记物;诊断效能
Serological markers and CT features‑based model for predicting histological grade of hepatocellular carcinoma
HUANG Xiang1, HE Chang1, CHEN Lianhuan2, LING Wenfeng1, ZHANG Zhiqiang1, ZHU Zhiqiang1, CHEN Xiaofeng1, YANG Zhiqi1
1Department of Radiology, Meizhou People's Hospital, Meizhou 514031, China; 2Department of Radiology, Meizhou Railway Bridge Hospital, Meizhou 514031, China
Abstract: Objective To ascertain utility of the model that combines serum markers and CT features in assessing the differentiation degree of hepatocellular carcinoma (HCC). Methods A total of 206 cases of HCC clinical and CT data were collected retrospectively and the patients were divided into training set (including 42 cases of low-differentiated HCC and 102 cases of middle-high differentiated HCC) and testing set (including 21 cases of low-differentiated HCC and 41 cases of middle-high differentiated HCC). The underlying differences between low-differentiated HCC group and middle-high differentiated HCC group in terms of clinical and CT features were meticulously compared. Applying multivariate Logistic regression, we isolated independent risk factors for HCC differentiation degree and construct the prediction models. Results Compared with medium-high differentiated HCC, low-differentiated HCC had statistically significant higher rate of AFP positivity (P=0.001), occurrences of hepatitis B (P=0.003), low-density ring sign (P=0.015), cancer thromboembolism (P=0.001), and lower CT values during plain scan (P=0.010). Further multivariate logistic regression analysis revealed that AFP (OR=0.269, P=0.027), low-density ring sign (OR=0.273, P=0.047), cancer thromboembolism (OR=0.191, P=0.005), and plain scan CT value of tumor (OR=1.091, P=0.009) act as risk factors for HCC differentiation degree. The optimal diagnostic performance was achieved by the model that integrated AFP, low-density ring sign, cancer thromboembolism, and CT value of tumor during plain scan, as demonstrated by the area under the curve of 0.780 and 0.620 in the training and testing set, respectively. Conclusion AFP, low-density ring sign, cancer thromboembolism, and CT value of tumor during plain scan are independent risk factors for the differentiation degree of HCC tissue. when amalgamated into the model, the joint model constructed based on these features can provide a high-accuracy diagnosis for HCC differentiation degree.
Keywords: hepatocellular carcinoma; histologic differentiation; CT; serological markers; diagnostic efficiency
肝细胞癌(HCC)是国内发病率和死亡率均较高恶性肿瘤,因此早期诊断和治疗对患者预后至关重要[1-3]。手术切除目前是唯一根治性手段,但术后复发率较高且预后较差[4-8]。研究表明HCC组织分化程度与预后相关[9-11]。一般来说,低分化HCC患者术后转移发生率较高,生存预后多不佳。目前HCC组织分化程度诊断需要依靠病理,但获得组织标本需要采用有创方法才能获得。因此寻找术前无创HCC组织分化程度评估替代方法具有一定可行性。血清学标记物甲胎蛋白(AFP)在HCC诊断、疗效评价及预后评估中具有重要价值,同时与HCC病理组织学特性具有一定关联性[12-16];然而单一血清生物标志物在上述研究中显示出较低的敏感度和特异性[1, 2]。CT已经广泛应用于HCC术前诊断及鉴别诊断,同时还能为HCC患者的个体化治疗提供参考[17-20]。目前关于CT在评估HCC组织分化程度中的研究主要是基于CT影像组学特征研究[9, 11, 21],但是影像组学研究存在特征提取耗时和特征临床解释困难的缺点。相比上述影像组学的缺点,CT特征提取更为简单,且临床可解释性较高。然而关于CT特征在评估HCC组织分化程度研究尚未见相关报道,其诊断效能尚不明确;且既往研究表明基于单一特征模型诊断效能相对较低,联合其他参数将可能提高模型的分类诊断效能[22]。基于此,本研究拟探讨基于联合血清学标记物和CT特征联合模型在评估HCC组织分化程度中的应用价值。
1" "资料与方法
1.1" "一般资料
回顾性收集梅州市人民医院2015年11月~2023年10月经病理确诊为HCC患者的资料。纳入标准:病理确诊为HCC并有组织分化程度结果;行肝脏三期CT增强检查。排除标准:CT检查前行其他辅助治疗者;CT图像质量不佳;HCC合并其他恶性肿瘤。共收集144例HCC患者作为训练组,年龄34~82(57.92±10.72)岁,其中女性16例,男性128例;依据HCC病理组织分化结果,训练组中包括42例低分化HCC和102例中高分化HCC。另随机收集同期62例HCC患者作为验证组对模型诊断效能进行内部验证,包括21例低分化HCC和41例中高分化HCC。收集患者性别、年龄、是否合并肝硬化、乙肝、AFP和癌胚抗原(CEA)情况。本研究已获得梅州市人民医院伦理委员会批准(审批号:梅市伦审 2023-C-73)。
1.2" "扫描方法
采用SOMATOM Force(第3代)CT扫描仪,扫描范围膈定至脐水平。扫描采用CARE Dose 4D技术,参考管电压100 kV,螺距1.0,探测器宽度192×0.6 mm,层厚5.0 mm。平扫后采用高压注射器以3.0~3.5 mL/s团注碘海醇。当造影剂触发监测点超过100 Hu后延迟11 s行动脉期扫描,门脉期扫描时间为动脉期扫描后延迟28 s,延迟期扫描时间一般为注药后3 min。
1.3" 影像特征分析
由1位放射科副主任医师在医院图像与存储系统上在未知临床病理结果下对HCC患者进行独立分析,收集CT定量特征包括大小、肿瘤各期CT值和定性特征包括位置、生长方式、形态、生长方式、边缘、包膜中断、瘤周卫星灶、动脉期环形强化、低密度环征(门脉期HCC周边出现的低密度影)、癌栓情况,同时计算肿瘤各期强化程度(增强与平扫CT差值)和强化率(增强与平扫比值)。选取肿瘤最大层面实性部分测量CT值,测量时尽量避开明显出血、囊变、坏死和钙化区域,同一层面测量3次后取平均值作为最终结果。
1.4" 统计学分析
采用SPSS25.0和R语言对数据进行统计学分析,以Plt;0.05为差异有统计学意义。服从正态分布的计量资料以均数±标准差表示,组间差异的比较采用独立样本t检验,如非正态分布则用秩和检验比较。分类变量用频数和百分比表示,其在低分化HCC与中高分化HCC间比较采用卡方检验。采用多因素回归筛选HCC分化程度独立危险因素并构建预测模型。
2" 结果
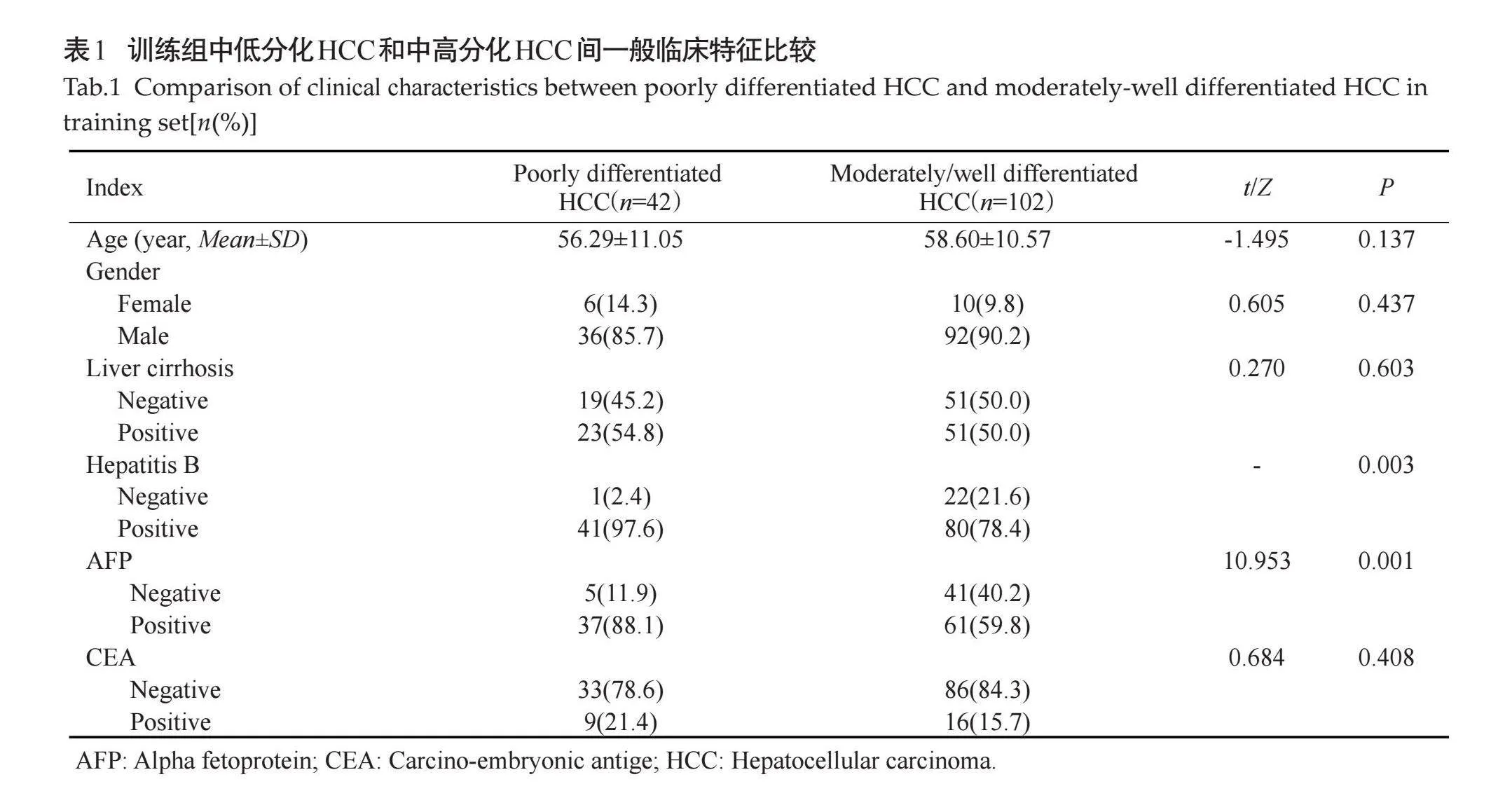
2.1" 训练组中低分化和中高分化HCC临床特征比较
在训练组中,低分化HCC患者的AFP阳性率和乙肝发生率较中高分化HCC高(Plt;0.01,表1)。低分化HCC和中高分化HCC组间患者的CEA、性别、年龄和肝硬化的差异均无统计学意义(Pgt;0.05,表1)。
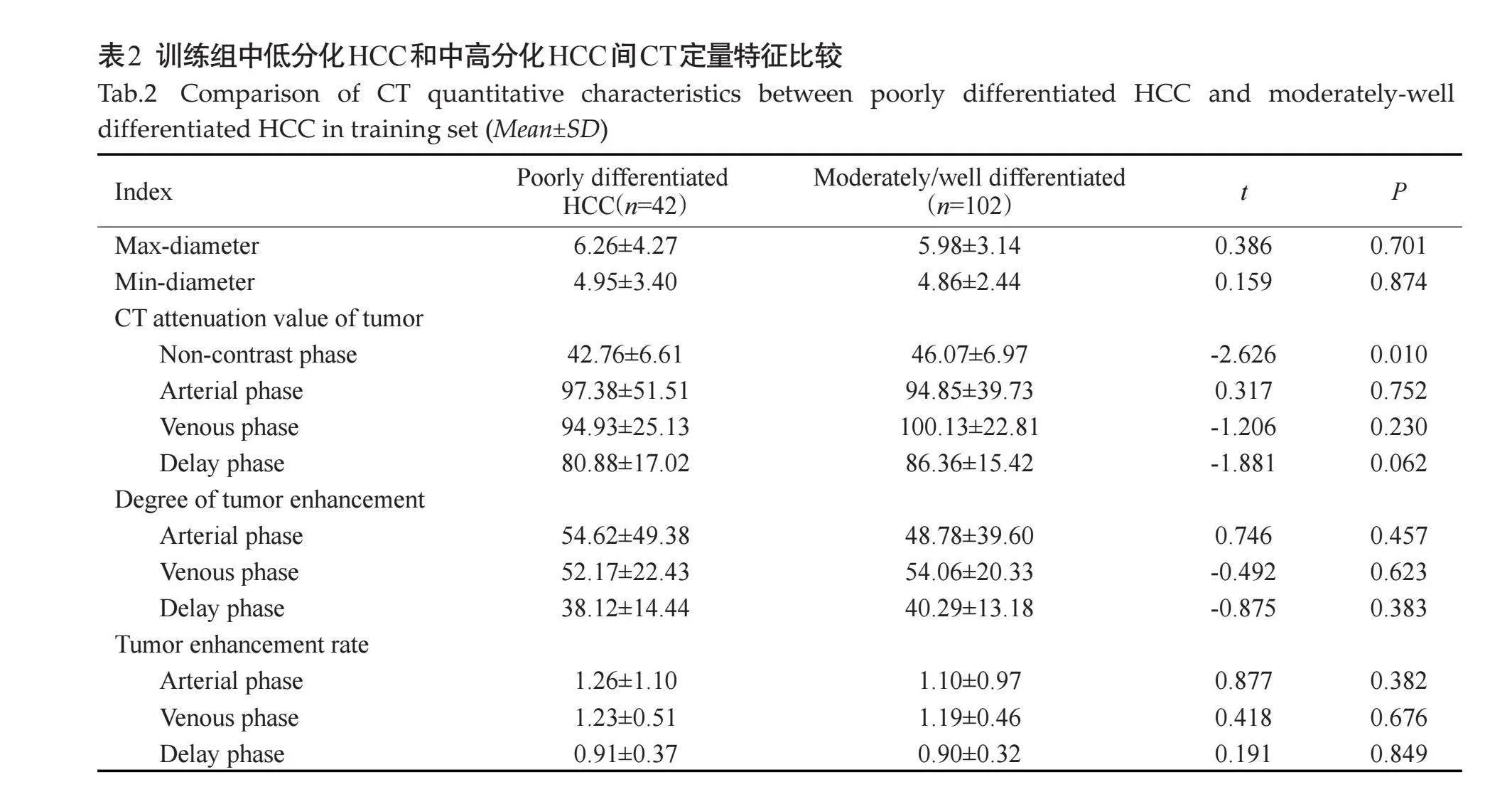
2.2" 训练组中低分化HCC和中高分化HCC患者CT定量特征比较
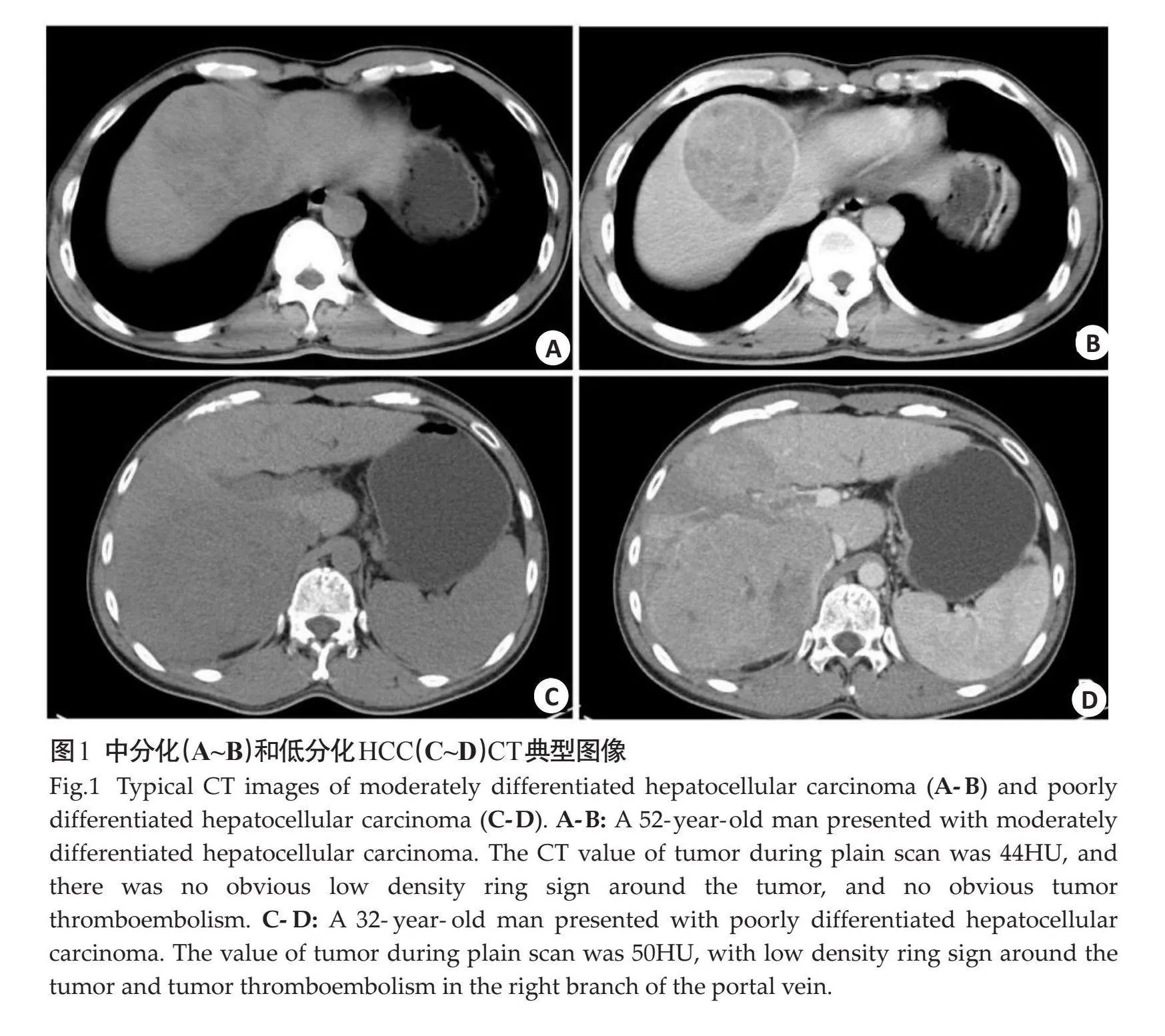
在训练组中,对比中高分化HCC(图1A),低分化HCC(图1C)平扫CT值较低(Plt;0.05,表2)。在训练组中,直径、短径、肿瘤增强各期CT值、各期强化程度和强化率在低分化HCC和中高分化HCC间的差异均无统计学意义(Pgt;0.05,表2)。
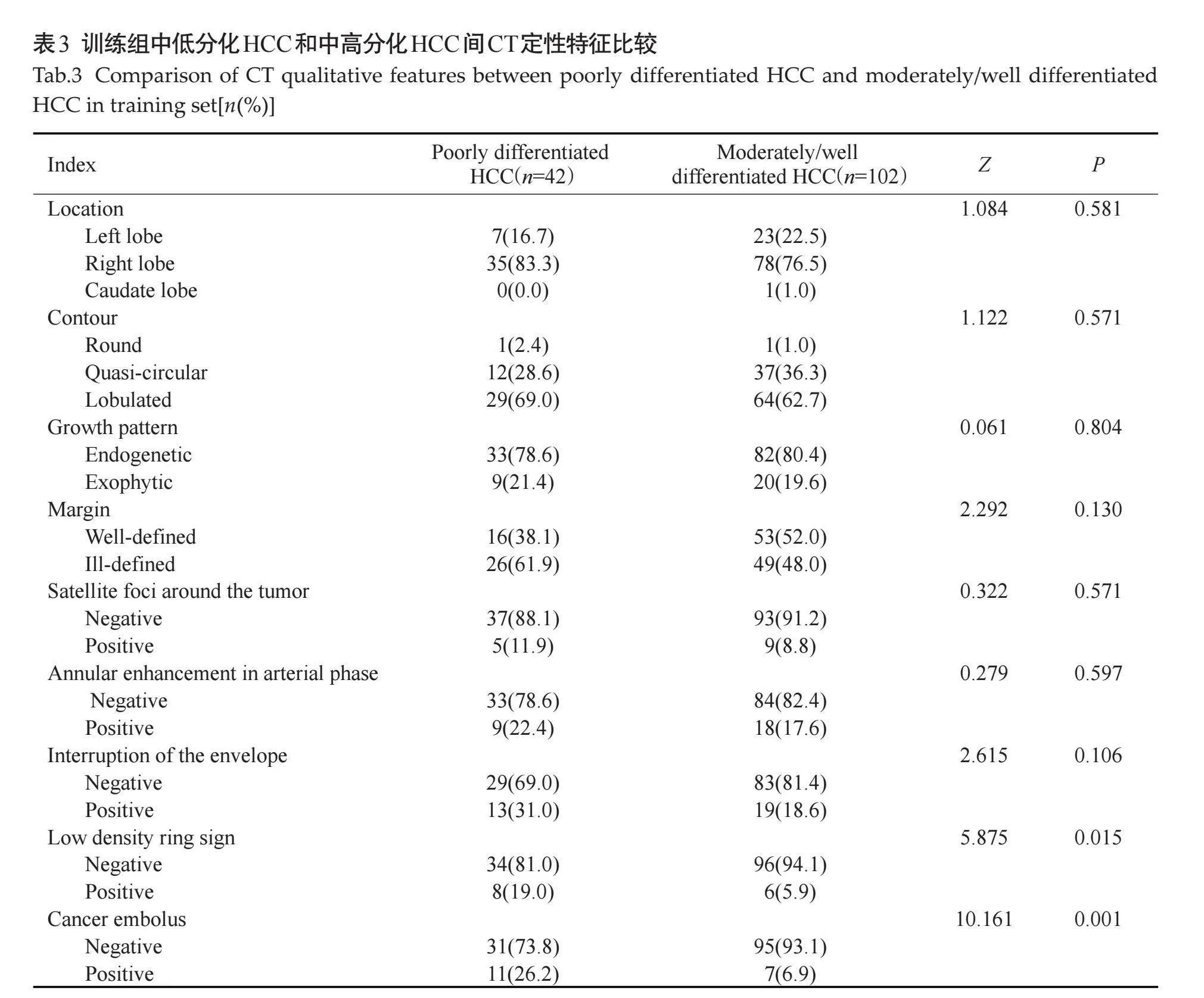
2.3" 训练组中低分化HCC和中高分化HCC患者CT定性特征比较
在训练组中,对比中高分化HCC(图1B),低分化HCC(图1D)低密度环征和癌栓发生率较高(Plt;0.05,表3)。在训练组中,肿瘤位置、形状、生长方式、边缘、瘤周卫星灶、动脉期环形强化和包膜中断在低分化HCC和中高分化HCC组间的差异均无统计学意义(Pgt;0.05,表3)。
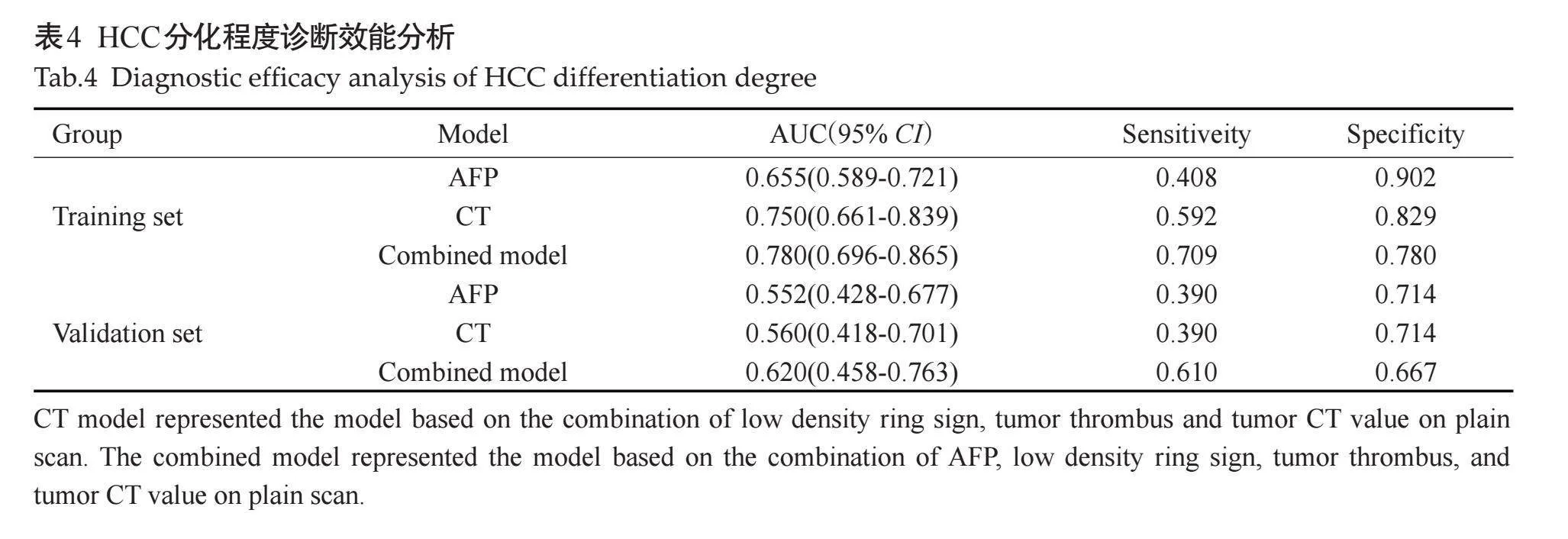
2.4" HCC组织分化程度诊断效能分析
多因素分析显示AFP (OR=0.269,P=0.027)、低密度环征(OR=0.273,P=0.047)、癌栓(OR=0.191,P=0.005)、肿瘤平扫CT值 (OR=1.091,P=0.009)是中高分化HCC的独立危险因素。在训练组和验证组中,基于联合低密度环征、癌栓和肿瘤平扫CT值的影像模型预测中高分化HCC的AUC分别为0.750和0.560(表4)。基于联合低密度环征、癌栓、肿瘤平扫CT值和AFP的联合模型诊断效能最高,其在训练组和验证组中的AUC分别为0.780和0.620(表4)。
3" 讨论
本研究初步探讨了低分化HCC与中高分化HCC间血清生物学标记物及CT特征差异,结果显示AFP、乙肝、低密度环征、肿瘤平扫CT值、癌栓在低分化HCC与中高分化HCC组间的差异有统计学意义;多因素分析显示AFP、低密度环征、肿瘤平扫CT值和癌栓是HCC组织分化程度独立危险因素。基于联合AFP、低密度环征、肿瘤平扫CT值和癌栓的联合模型在训练组和验证组中预测HCC分化程度的AUC分别为0.780和0.620,稍高于既往一项基于MRI 影像组学预测HCC分化程度的研究[23]]结果。本研究基于上述特异CT特征和血清学标记物建立一种客观、简便模型应用HCC组织分化程度的术前预测,能为患者个体化方案的制定提供参考;将该模型应用于日常临床工作中,能提升临床整体效率。
血清AFP是HCC诊断和治疗疗效监测最常用的临床指标之一。研究表明AFP与HCC恶性程度、疗效及预后有关[24-26]。一般恶性程度越高的HCC其瘤细胞合成AFP就越多,因此AFP阳性率就越高。本研究中,低分化HCC患者AFP阳性率为88.1%,较中高分化HCC患者AFP阳性率59.8%高,且差异有统计学意义。多因素分析显示AFP是HCC组织分化程度独立危险因素,这与既往研究[1, 25]结果相同,符合低分化HCC恶性程度较中高分化HCC高的改变,分析其原因可能是由于中高分化HCC瘤细胞的形态及功能与正常肝细胞相似,故较少合成AFP,进而AFP阳性率就较低。相反,低分化HCC瘤细胞的形态及功能与胎儿肝细胞相似,合成AFP较多故AFP阳性率增高。
一般来说,分化程度高肿瘤其瘤细胞与正常细胞形态、功能及排列相似。相反,分化程度越差肿瘤其瘤细胞与正常细胞差异就越大,侵袭性就越明显[27]。在本研究中,低分化HCC患者发生癌栓的概率高于中高分化HCC且差异有统计学意义,且多因素分析显示癌栓是HCC组织分化程度独立危险影像,这与既往研究[9, 27]结果相仿,符合低分化HCC浸润性生长改变。分析原因可能是由于低分化HCC恶性程度较高,侵袭性较明显,肿瘤向周围肝实质浸润生长进而导致瘤周血管受累,血管内癌栓形成。低密度环征是由于肿瘤膨胀性生长对瘤周正常组织压迫所形成的,在CT上表现为瘤周低密度环,多在动脉晚期和门脉期显现。在本研究中,低分化HCC瘤周低密度环征阳性率高于中高分化HCC且差异具有统计学意义,这与部分研究[6, 28]结果一致,分析其原因可能是本组低分化HCC体积较中高分化HCC大,生长速度相对较快,肿瘤压迫周边正常肝组织形成低密度环征。另外,本研究发现低分化HCC平扫密度较中高分化HCC高且差异具有统计学意义,这与既往研究[5]结果相反,原因可能是本研究中低分化HCC体积较大,瘤内较容易出现缺血、坏死,因此造成测量时肿瘤CT值减低,这需后期扩大样本量进一步验证。基于上述特征构建的影像模型在训练组中具有中度预测HCC分化程度的效能,而基于联合低密度环征、癌栓、肿瘤平扫CT值和AFP的模型诊断效能最高,这与既往一项应用联合特征评估乳腺癌分化程度的研究结果[29]相似。
本研究的局限性:本研究为单中心较小样本研究,尤其是入组的低分化HCC患者,需要扩大样本量和利用其他中心数据对研究结果进行验证。本研究未考虑不同测量位置和感兴趣区大小对CT特征的影响,后续需要进一步细化研究。
综上所述,AFP、低密度环征、癌栓和肿瘤平扫CT值是HCC组织分化程度的独立危险因素,基于上述特征构建的联合模型对HCC组织分化程度具有较好诊断价值。
参考文献:
[1]" "Piñero F, Dirchwolf M, Pessôa MG. Biomarkers in hepatocellular carcinoma: diagnosis, prognosis and treatment response assessment[J]. Cells, 2020, 9(6): 1370.
[2]" Wang ZX, Qin HJ, Liu S, et al. Precision diagnosis of hepatocellular carcinoma[J]. Chin Med J, 2023, 136(10): 1155-65.
[3]" "Nishida N. Long-term prognosis and management of hepatocellular carcinoma after curative treatment[J]. Clin Mol Hepatol, 2020, 26(4): 480-3.
[4]" "Wei JW, Ji Q, Gao Y, et al. A multi-scale, multi-region and attention mechanism‑based deep learning framework for prediction of grading in hepatocellular carcinoma[J]. Med Phys, 2023, 50(4): 2290-302.
[5]" "Tong X, Li J. Noninvasively predict the micro-vascular invasion and histopathological grade of hepatocellular carcinoma with CT-derived radiomics[J]. Eur J Radiol Open, 2022, 9: 100424.
[6]" " 吕志彬, 杜艳妮, 闫" 铄, 等. 增强MRI在评估肝细胞癌病理组织分级中的价值[J]. 实用放射学杂志, 2021, 37(8): 1298-301.
[7]" " 钟文新, 刘海峰, 邹立秋, 等. 基于MRI肝脏影像报告和数据系统特征构建的列线图预测符合Milan标准肝细胞癌微血管侵犯的价值[J]. 中华放射学杂志, 2023, 9(12): 1346-52.
[8]" " 路志伟, 赵渊博, 张少斌, 等. 肝脏影像报告和数据系统2018版征象在预测肝细胞癌微血管侵犯中的价值[J]. 实用放射学杂志, 2024,40: 244-8.
[9]" " 曾凤霞, 刘仁懿, 曾" 辉, 等. 临床、CT影像组学及融合模型预测肝细胞癌分化程度[J]. 中国医学影像技术, 2021, 37(7): 1029-33.
[10] Chen XY, Lu YW, Shi XL, et al. Epidemiological and clinical characteristics of five rare pathological subtypes of hepatocellular carcinoma[J]. Front Oncol, 2022, 12: 864106.
[11]" 彭诗涵, 卢再鸣, 由英宁, 等. 基于门脉期CT影像组学预测肝癌病理分化程度的价值[J]. 中国临床医学影像杂志, 2022, 33(5): 334-8, 349.
[12]Shan QG, Chen JB, Zhang TH, et al. Evaluating histologic differentiation of hepatitis B virus-related hepatocellular carcinoma using intravoxel incoherent motion and AFP levels alone and in combination[J]. Abdom Radiol (NY), 2017, 42(8): 2079-88.
[13] Yaprak O, Akyildiz M, Dayangac M, et al. AFP level and histologic differentiation predict the survival of patients with liver transplantation for hepatocellular carcinoma[J]. Hepatobiliary Pancreat Dis Int, 2012, 11(3): 256-61.
[14]Özdemir F, Baskiran A. The importance of AFP in liver transplantation for HCC[J]. J Gastrointest Cancer, 2020, 51(4): 1127-32.
[15] She WH, Chan ACY, Cheung TT, et al. Survival outcomes of liver transplantation for hepatocellular carcinoma in patients with normal, high and very high preoperative alpha‑fetoprotein levels[J]. World J Hepatol, 2018, 10(2): 308-18.
[16] Edoo MIA, Chutturghoon VK, Wusu‑Ansah GK, et al. Serum biomarkers AFP, CEA and CA19-9 combined detection for early diagnosis of hepatocellular carcinoma[J]. Iran J Public Health, 2019, 48(2): 314-22.
[17] Li JP, Feng GL, Li DQ, et al. Detection and differentiation of early hepatocellular carcinoma from cirrhosis using CT perfusion in a rat liver model[J]. Hepatobiliary Pancreat Dis Int, 2016, 15(6): 612-8.
[18] Jeon TY, Kim SH, Lim HK, et al. Assessment of triple-phase CT findings for the differentiation of fat-deficient hepatic angiomyolipoma from hepatocellular carcinoma in non-cirrhotic liver[J]. Eur J Radiol, 2010, 73(3): 601-6.
[19] Takayasu K, Furukawa H, Wakao F, et al. CT diagnosis of early hepatocellular carcinoma: sensitivity, findings, and CT-pathologic correlation[J]. AJR Am J Roentgenol, 1995, 164(4): 885-90.
[20]Okamura S, Shimose S, Niizeki T, et al. Association between contrast enhancement on contrast-enhanced CT and lenvatinib effectiveness in hepatocellular carcinoma[J]. Mol Clin Oncol, 2022, 16(1): 8.
[21] Ravina M, Mishra A, Kote R, et al. Role of textural analysis parameters derived from FDG PET/CT in differentiating hepatocellular carcinoma and hepatic metastases[J]. Nucl Med Commun, 2023, 44(5): 381-9.
[22] Chen XF, Yang ZQ, Yang JD, et al. Radiomics analysis of contrast-enhanced CT predicts lymphovascular invasion and disease outcome in gastric cancer: a preliminary study[J]. Cancer Imaging, 2020, 20(1): 24.
[23]" 赵" 莹, 刘爱连, 武敬君, 等. 基于增强MRI影像组学术前预测肝细胞癌病理分化程度[J]. 中国医学影像学杂志, 2021, 29(6): 570-6.
[24] Campani C, Bamba-Funck J, Campion B, et al. Baseline ALBI score and early variation of serum AFP predicts outcomes in patients with HCC treated by atezolizumab-bevacizumab[J]. Liver Int, 2023, 43(3): 708-17.
[25] Rong DL, Liu WM, Kuang SC, et al. Preoperative prediction of pathologic grade of HCC on gadobenate dimeglumine-enhanced dynamic MRI[J]. Eur Radiol, 2021, 31(10): 7584-93.
[26] 单钰莹, 汪春年, 毛书奇, 等. 粗梁实体型肝细胞癌的强侵袭性临床特征与不良预后分析[J]. 中华肝脏病杂志, 2023(12): 1318-25.
[27]" 岑永义, 农海洋, 李" 传, 等. 基于CT增强扫描动脉期图像的纹理分析在肝细胞癌病理分化程度预测中的价值研究[J]. 临床放射学杂志, 2022, 41(8): 1476-81.
[28]" 姚" 蓬, 黎学兵, 李小军. CT及MRI影像学检查对原发性肝癌患者微血管浸润的诊断价值[J]. 中国CT和MRI杂志, 2021, 19(1): 117-9.
[29]" 陈小凤, 范伟雄, 陈湘光, 等. 定量DCE-MRI参数联合ADC值评估乳腺浸润性导管癌的组织分级[J]. 实用放射学杂志, 2019, 35(7): 1058-61.
(编辑:郎" 朗)
