高血压脑小血管病患者抑郁与影像学标志物及认知功能相关性
2024-10-30曹佳丽韩永昌张月李璠李圣年沈蒙蒙姚皓月张仙虎刘冲


摘要:目的" 探讨高血压脑小血管病(HT-CSVD)患者抑郁与影像学标志物及总负荷的关系,并分析抑郁与认知功能的相关性。方法" 纳入2023年5~12月保定市第一中心医院收治的141例HT-CSVD患者,依据汉密尔顿抑郁量表将患者分为抑郁组(n=49)与非抑郁组(n=92)。收集患者人口学信息、既往病史、MRI图像、实验室检查及认知功能评分等临床资料,分析HT-CSVD患者抑郁的危险因素以及抑郁与认知功能的关系。结果" 抑郁组患者腔隙、基底节区扩大的血管周围间隙(BG-EPVS)、CSVD影像学总负荷高于非抑郁组,白蛋白水平低于非抑郁组,差异有统计学意义(Plt;0.05)。多因素Logistic回归分析结果显示腔隙、BG-EPVS是HT-CSVD患者抑郁的独立危险因素(Plt;0.05)。HT-CSVD患者抑郁与认知功能的关系分析结果显示,抑郁组MoCA总评分与视空间与执行功能、命名、注意力、语言、延迟回忆和定向力等认知领域的单项评分均低于非抑郁组,差异有统计学意义(Plt;0.05)。Spearman相关性分析结果显示,抑郁评分与MoCA评分、视空间与执行功能、命名、注意力、语言、延迟回忆、定向力呈负相关(Plt;0.05)。结论" 腔隙、BG-EPVS是HT-CSVD患者抑郁的独立危险因素。HT-CSVD患者抑郁与认知功能关系密切。HT-CSVD患者抑郁与总体认知功能、视空间与执行功能、命名、注意力、语言、延迟回忆、定向力功能下降相关。
关键词:脑小血管病;高血压;抑郁;影像学标志物;认知功能
The correlation of depression with imaging markers and cognitive function in patients with hypertensive-cerebral small vessel disease
CAO Jiali1, 2, HAN Yongchang1, 2, ZHANG Yue2, LI Fan2, LI Shengnian1, 2, SHEN Mengmeng2, YAO Haoyue2, ZHANG Xianhu2, LIU Chong2
1Graduate School of Chengde Medical University, Chengde 067000,China; 2Department of Medical Imaging, Baoding No.1 Central Hospital, Baoding 071000, China
Abstract: Objective To explore the relationship between depression and imaging markers as well as total burden in patients with hypertensive-cerebral small vessel disease (HT-CSVD), and" analyze the correlation between depression and cognitive function. Methods A total of 141 patients with HT-CSVD admitted to Baoding No.1 Central Hospital from May to December 2023 were divided into depression group (n=49) and non-depression group (n=92) based on the Hamilton depression scale. Demographic information, past medical history, MRI images, laboratory tests and cognitive function scores were collected to analyze the risk factors of depression and the relationship between depression and cognitive function in HT-CSVD patients. Results Lacune, basal ganglia enlarged perivascular space (BG-EPVS), and the total burden of CSVD imaging of the patients in the depression group was higher than that of the non-depression group, and albumin levels were lower in the depression group , and the difference was statistically significant (Plt;0.05). Multifactorial Logistic regression analysis showed that lacune and BG-EPVS were independent risk factors for depression in HT-CSVD patients. The results of the analysis of the relationship between depression and cognitive function in HT-CSVD patients revealed that the total MoCA score and the individual scores of the cognitive domains such as visual-spatial and executive functions, naming, attention, language, delayed recall, and orientation were lower in the depression group compared to the non-depression group, with statistically significant differences (Plt;0.05). Spearman's correlation analyses showed a negative correlation between" depression scores and MoCA scores, as well as visual-spatial and executive functions, naming, attention, language, delayed recall and orientation (Plt;0.05). Conclusion Lacune and BG-EPVS are independent risk factors for depression in HT-CSVD patients. Depression in HT-CSVD patients is closely related to cognitive function. Depression in HT-CSVD patients is associated with decreased overall cognitive function, visual space and executive function, naming, attention, language, delayed recall and orientation.
Keywords: cerebral small vessel disease; hypertension; depression; imaging markers; cognitive function
脑小血管病(CSVD)是常见衰老伴随疾病[1] ,高血压是导致CSVD的主要原因之一,长期高血压导致脑血管损伤及1型脑小血管病,亦称为高血压脑小血管病(HT-CSVD)[2] 。情感障碍是CSVD患者常见的临床表现,主要表现为抑郁。早期发现CSVD患者抑郁表现,及时采取治疗措施,有助于延缓病情发展,提高患者生活质量。既往大量研究已经证实CSVD是导致认知障碍的重要原因,认知下降也是CSVD最常见的临床表现[3-6] ,有研究分析发现CSVD患者影像学总负荷与抑郁相关,且CSVD患者抑郁症状与认知功能障碍有关[7-8]。亦有研究探讨CSVD影像学标志物与抑郁的关系[9-11] ,但结论尚不一致;HT-CSVD患者抑郁与影像学标志物及总负荷的研究相对匮乏,且尚无关于HT-CSVD患者抑郁与认知功能关系的相关报道。本研究旨在探索HT-CSVD患者抑郁与影像学标志物及总负荷的关系,分析HT-CSVD患者抑郁与认知功能的相关性。
1" 资料与方法
1.1" 一般资料
选取保定市第一中心医院2023年5~12月诊断为HT-CSVD的141例患者,本研究经保定市第一中心医院伦理委员会批准[伦理审批号:(2023)044],全部患者或其家属均已签署知情同意书。141例HT-CSVD患者中,男性77例(54.6%),女性64例(45.4%);年龄44~86(65.80±9.38)岁。根据汉密尔顿抑郁量表将患者分为抑郁组(n=49)和非抑郁组(n=92)。
纳入标准:年龄≥18岁;符合中国高血压防治指南(2018年修订版)高血压诊断标准[12] 和2013年脑小血管病国际影像标准[1] ;能配合完成抑郁、认知功能评估。排除标准:无法获取完整临床资料者;炎性脱髓鞘疾病、代谢性脑病、感染性脑病等白质病变;伴有颅内占位、感染、创伤、急性梗死等异常颅脑改变;非高血压脑小血管病患者;有磁共振检查禁忌证或无法获得清晰影像学资料的患者。
1.2" 方法
1.2.1" 资料收集" "收集患者的临床资料,包括:年龄、性别、既往史(糖尿病史、冠心病史)、吸烟史、饮酒史、入院时实验室检查指标等。
1.2.2" 仪器与扫描方法" "所有 MRI 均使用Philips Ingenia 1.5T核磁共振扫描仪,扫描序列包括:T1WI(TR 475 ms,TE 15 ms,FOV 230 mm×181 mm)、T2WI(TR 2500 ms,TE 115 ms,FOV 230 mm×230 mm)、FLAIR(TR 9000 ms,TE 130 ms,TI 2600 ms,FOV 220 mm×183 mm)、SWI(TR 51 ms,TE 11 ms,FOV 230 mm×184 mm);T1/T2WI、FLAIR层厚6.00 mm,层间距1.00 mm;SWI层间距-1.00 mm。
1.2.3" CSVD影像学标志物及总负荷评分" "收集腔隙、白质高信号(WMH)、扩大的血管周围间隙(EPVS)、脑微出血(CMB)4个特征。腔隙:直径3~15 mm,圆形或椭圆形,T1WI、T2WI和T2-FLAIR序列和脑脊液信号一致,T2-FLAIR边缘可能会有高信号环绕[13] 。WMH:T2WI和FLAIR序列上表现为高信号区,根据Fazekas评定量表,将侧脑室旁及深部WMH分别评分[14] 。EPVS:T2WI高信号、T1WI及FLAIR为低信号影,通常为边界光滑清楚,可呈椭圆形、圆形、线状或管状,直径lt;3 mm。根据4分半定量评分系统分别对基底节区(BG)及半卵圆中心EPVS进行评分,EPVS为0个计0分,1~10个计1分,11~20个计2分,21~40个计3分,gt;40个计4分 [15] 。CMB:圆形、卵圆形,SWI 上低信号影,根据解剖区域划分为幕下/深部CMB和脑叶CMB[1] 。
总负荷评分:腔隙≥1个为1分,深部WMH Fazekas评分≥2分和/或脑室旁WMH Fazekas评分为3分为1分,深部或幕下CMB≥1个为1分,BG-EPVS≥11个为1分[16] (图1)。
1.2.4" 抑郁程度及认知功能评估" "对HT-CSVD患者进行抑郁评估,采用汉密尔顿抑郁量表(HAMD)进行评估。HAMD评分≥8分被认为存在抑郁。得分越高,说明症状越严重[17] 。采用MoCA量表进行认知功能测评,如受教育时间不超过12年增加1分,以校正因受教育程度较低而导致的认知任务表现不佳。得分越高,说明认知功能越好[18] 。
1.3" 统计学分析
采用SPSS26.0软件处理数据。其中计量资料符合正态分布及方差齐性以均数±标准差表示,组间比较行两独立样本t检验;不符合正态分布者以中位数(上下四分位数)表示,组间比较行Mann-Whitney U检验。计数资料以n(%)表示,组间比较采用χ2检验; 通过二元Logistic回归分析研究HT-CSVD患者抑郁的影响因素。采用Spearman相关性分析检测抑郁与认知功能相关性。以Plt;0.05为差异有统计学意义。
2" 结果
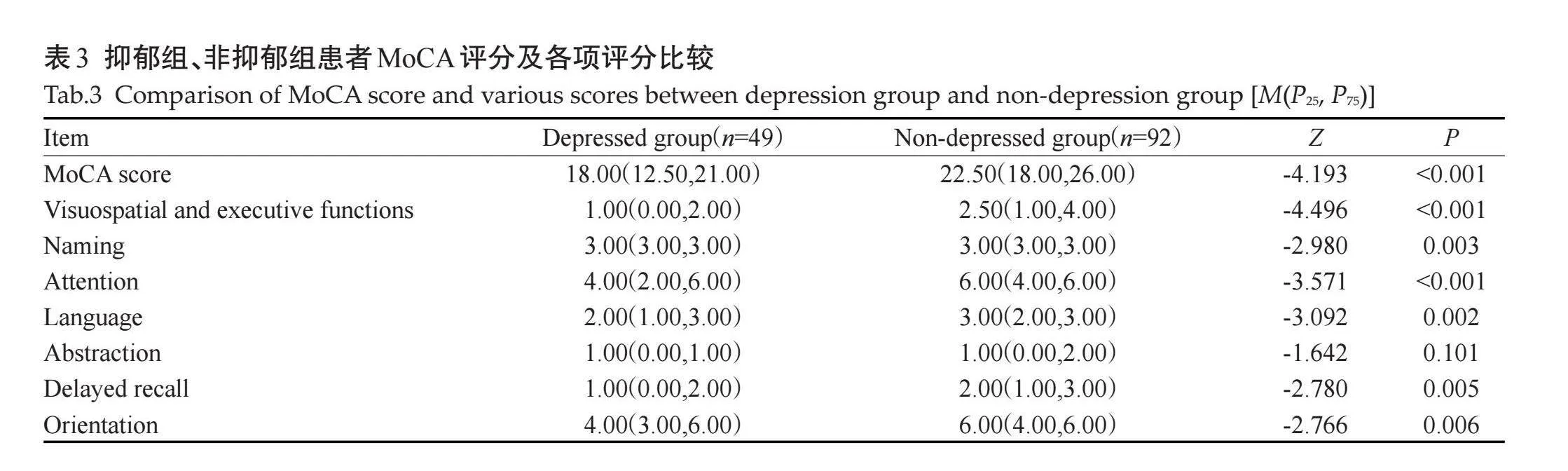
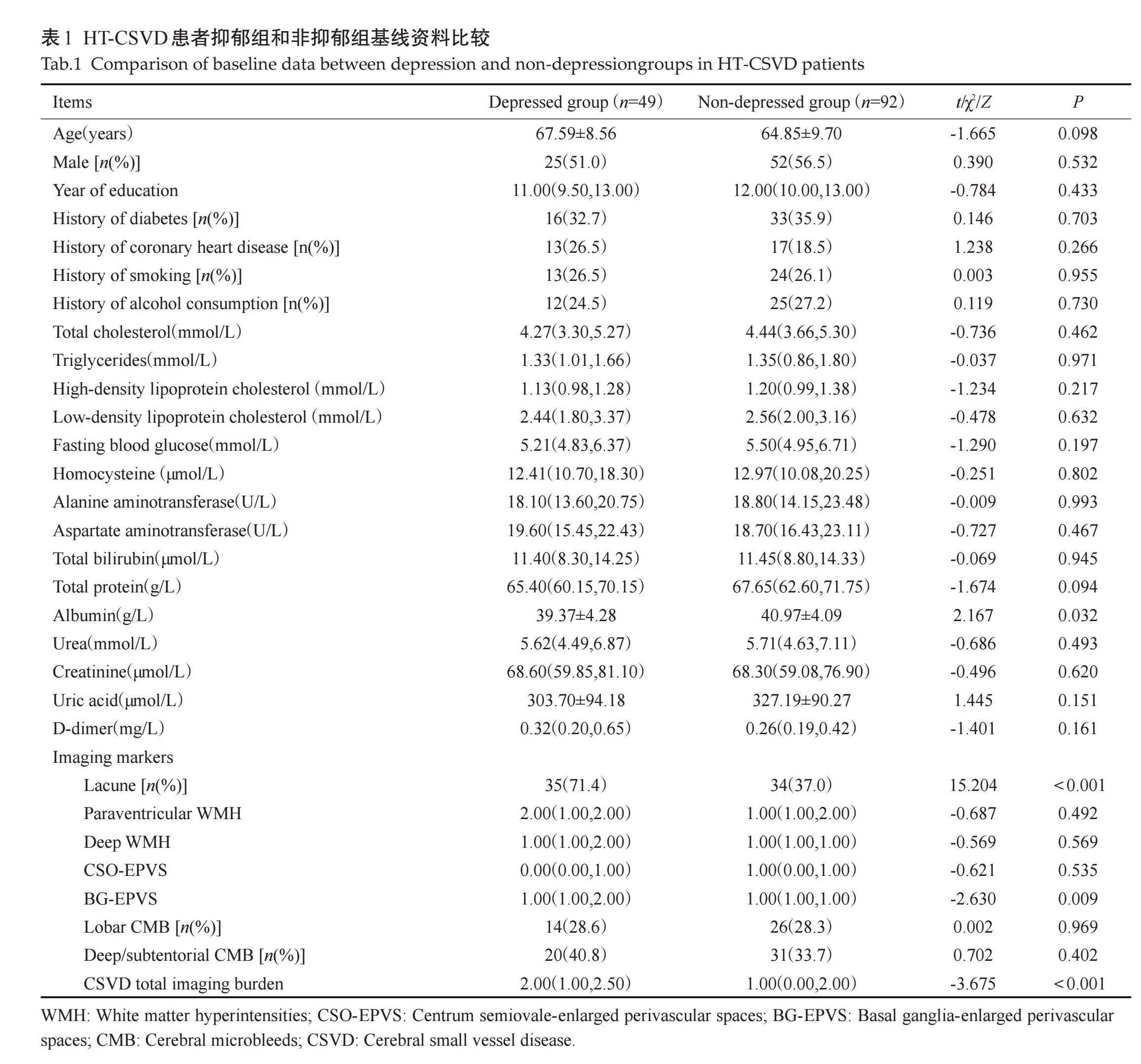
2.1" HT-CSVD患者抑郁组和非抑郁组基线资料比较
抑郁组患者腔隙、BG-EPVS、CSVD影像学总负荷大于非抑郁组,差异有统计学意义,抑郁组白蛋白水平小于非抑郁组,差异有统计学意义(Plt;0.05)。其他资料的差异无统计学意义(Pgt;0.05,表1)。
2.2" HT-CSVD患者抑郁的多因素分析
以纳入HT-CSVD患者是否抑郁分组为因变量,上述单因素分析中差异有统计学意义的指标为自变量(白蛋白、腔隙、BG-EPVS、CSVD影像学总负荷),结果显示腔隙(Plt;0.001)、BG-EPVS(P=0.022)是HT-CSVD患者抑郁的独立危险因素(表2)。
2.3" HT-CSVD患者抑郁与认知功能的关系分析
2.3.1" 抑郁组、非抑郁组患者MoCA评分及各项评分比较" "抑郁组患者MoCA评分为18.00(12.50,21.00),非抑郁组患者MoCA评分为22.50(18.00,6.00),差异有统计学意义(Plt;0.001);抑郁组视空间与执行功能、命名、注意力、语言、延迟回忆和定向力等认知领域单项评分小于非抑郁组,差异有统计学意义(Plt;0.05),抽象评分的差异无统计学意义(Pgt;0.05,表3)。
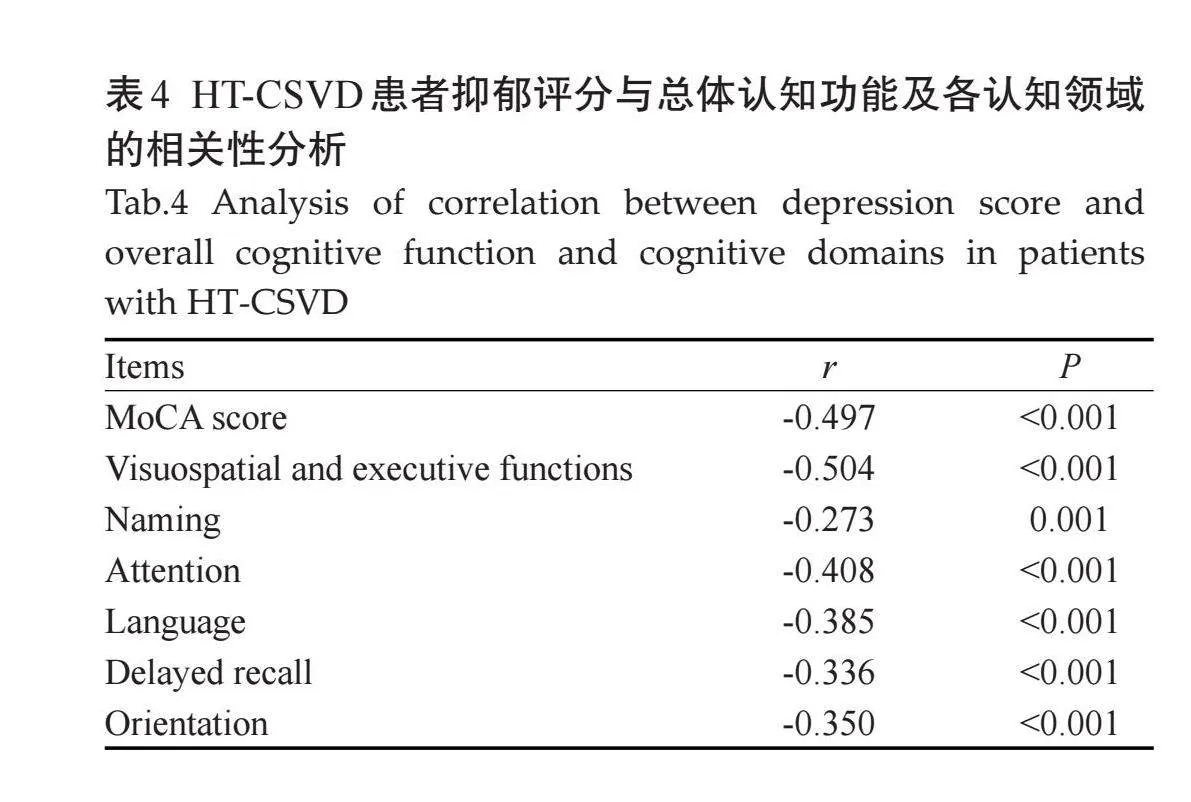
2.3.2" HT-CSVD患者抑郁程度(HAMD评分)与认知功能(MoCA及各项评分)相关性分析" "Spearman相关性分析结果显示,抑郁评分与MoCA评分、视空间与执行功能、命名、注意力、语言、延迟回忆、定向力均呈负相关(Plt;0.05,表4)。
3" 讨论
CSVD是指基于各种病理和神经过程的颅内血管疾病的总称,也是指血管和脑实质结构变化引起的不同临床表现和神经影像学特征的综合征,脑小血管疾病占所有缺血性中风的25%[19] 。HT-CSVD是CSVD最常见形式[2] 。长期高血压会导致中膜脂透明质增多和血管壁增厚,且高血压会加大血管纤维化程度,改变4型胶原及其它细胞外基质分布,使血管壁硬化和脑血流量减少,进而诱发CSVD[20]。CSVD会导致腔隙性中风和脑内出血,是血管性认知障碍最常见的病理基础,人们逐渐认识到CSVD其他临床表现的重要性,如运动障碍、(血管性)帕金森病、平衡障碍和情感障碍,情感障碍包括抑郁、淡漠和人格改变等[21] 。研究HT-CSVD患者情感障碍与影像学标志物及总负荷的关系,分析情感障碍与认知功能的相关性具有重要临床意义。
本研究结果表明腔隙、BG-EPVS是HT-CSVD患者抑郁的独立危险因素。既往国外有学者研究普通人群CSVD患者影像学标志物与抑郁的关系,发现WMH与抑郁有关[9, 10] ;亦有研究观察CSVD影像学标志物与抑郁的关系,发现CSVD的各种标志物均与抑郁症状的发生率有关[11] ,这与本研究结果不符,可能是由于人种不同和(或)本研究样本量较少所致。国内研究发现EPVS与CSVD患者抑郁有关[22] ,本研究与该研究结果一致。
证据表明,各种血管机制,尤其是脑小血管病、全身微血管和内皮功能障碍等可能通过损害额叶边缘和其他重要的神经网络而导致皮层下白质和灰质损伤,从而诱发抑郁和加重抑郁症状[23] 。本研究显示,腔隙是脑小血管病患者抑郁的独立危险因素。老化大脑中的血管负担依赖于腔隙和微血管病变的逐渐积累,而小血管和微血管慢性病理过程可能会诱导抑郁的产生[24] 。既往有学者研究腔隙和微血管病变对卒中后抑郁的影响,表明腔隙的存在与卒中后抑郁的发生之间存在显著的相关性,基底节区和丘脑核团的腔隙可能通过阻断连接脑干和大脑皮质的单胺能通路,增加临床抑郁症风险,而深部白质内腔隙是卒中后抑郁的独立相关因素,这意味着皮质回路的进行性损害也可能是抑郁产生的发病机制[24] 。
有研究发现EPVS患者更容易患抑郁症,血管周围间隙是小穿通血管周围充满间质液体的空腔。动脉血管搏动性减弱或大量血流受阻会影响血管周围的引流,导致血管周围间隙逆行扩张[25] ,BG-EPVS与高血压动脉病变关联性更强[26] 。研究表明,约1/3的抑郁症患者的一些外周炎症因子(炎症细胞因子、急性期蛋白等)水平升高,并且传统抗抑郁药对其作用效果不佳,而EPVS是神经炎症的标志物[27] ,推测EPVS可能通过参与炎症反应导致HT-CSVD患者抑郁的发生。本研究结果表明,BG-EPVS是脑小血管病患者抑郁的独立危险因素,与既往研究结论基本相符。
CSVD是血管性认知障碍的常见病因之一,有研究表明CSVD通过影响脑内血管神经单元的作用机制以及皮层下的传导,从而导致视空间和执行能力的下降[3] 。亦有研究发现CSVD会影响注意力、语言能力等多项认知域[28] ,而认知障碍经常伴随着情感障碍。CSVD患者抑郁可能会加重认知功能的下降,可能是由于CSVD会影响颅内血流灌注与神经递质,从而加重CSVD患者认知功能的下降[29] 。本研究结果发现,HT-CSVD患者抑郁与认知功能关系密切,抑郁症状评分与总认知功能评分呈负相关,对于各认知领域,抑郁评分与视空间与执行功能、命名、注意力、语言、延迟回忆、定向力呈负相关,但抑郁与视空间与执行功能相关系数绝对值大于MoCA评分及其它单一认知领域,说明抑郁与视空间与执行功能评分相关性更强。而既往有报道显示抑郁评分与认知功能评分呈负相关,亦有研究显示伴有抑郁的脑血管病患者存在更为明显的认知损害,而患者的执行功能和注意功能与抑郁更为相关[7, 30] 。本研究结果与既往研究基本相符,认知领域损害的差别可能是由于研究样本量不同、入组患者人群差异不同导致。
本研究存在局限与不足:本研究为单中心研究,样本量较小,可能会对患者的选择造成偏差;缺乏长期随访,对入选样本中抑郁患者如进行抗抑郁治疗后进一步评估认知功能,可能会除外抑郁所致的假性认知障碍;本研究采用视觉评分法,仅研究了影像学标志物与情感障碍的关系,未来仍需要从神经生理学、病理学及神经影像学等方面来探索CSVD与情感障碍的相关性,并致力于应用更多新型成像技术来研究CSVD导致情感障碍的潜在机制。
综上,抑郁在HT-CSVD患者中比较常见,BG-EPVS、腔隙是HT-CSVD患者抑郁的独立危险因素。抑郁评分与MoCA评分、视空间与执行功能、命名、注意力、语言、延迟回忆、定向力呈负相关。临床医师应重视HT-CSVD患者抑郁的早期筛查,及早改善患者抑郁情绪,提高患者认知功能。
参考文献:
[1]" "Wardlaw JM, Smith EE, Biessels GJ, et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration[J]. Lancet Neurol, 2013, 12(8): 822-38.
[2]" "Pantoni L. Cerebral small vessel disease: from pathogenesis and clinical characteristics to therapeutic challenges[J]. Lancet Neurol, 2010, 9(7): 689-701.
[3]" " 张" 恒, 杜怡峰. 脑小血管病与认知障碍的研究进展[J]. 中风与神经疾病杂志, 2024, 41(4): 298-304, 288.
[4]" "Jacob MA, Cai MF, van de Donk V, et al. Cerebral small vessel disease progression and the risk of dementia: a 14-year follow-up study[J]. Am J Psychiatry, 2023, 180(7): 508-18.
[5]" "Staals J, Booth T, Morris Z, et al. Total MRI load of cerebral small vessel disease and cognitive ability in older people[J]. Neurobiol Aging, 2015, 36(10): 2806-11.
[6]" " 刘发伟, 吉维忠. 不同影像学类型脑小血管病及其MRI总负荷与认知功能障碍的研究进展[J]. 中风与神经疾病杂志, 2024, 41(2): 179-84.
[7]" " 刘春燕, 刘俊华. 认知抑郁情绪障碍与脑小血管病总体负担的相关性分析[J]. 神经损伤与功能重建, 2021, 16(12): 710-3.
[8]" "Russo E, Leo A, Scicchitano F, et al. Cerebral small vessel disease predisposes to temporal lobe epilepsy in spontaneously hypertensive rats[J]. Brain Res Bull, 2017, 130: 245-50.
[9]" "van Agtmaal MJM, Houben AJHM, Pouwer F, et al. Association of microvascular dysfunction with late-life depression: a systematic review and meta-analysis[J]. JAMA Psychiatry, 2017, 74(7): 729-39.
[10]" Xie XF, Shi YL, Zhang JJ. Structural network connectivity impairment and depressive symptoms in cerebral small vessel disease[J]. J Affect Disord, 2017, 220: 8-14.
[11]" van Sloten TT, Sigurdsson S, van Buchem MA, et al. Cerebral small vessel disease and association with higher incidence of depressive symptoms in a general elderly population: the AGES-reykjavik study[J]." Am J Psychiatry, 2015, 172(6): 570-8.
[12]" 中国高血压防治指南修订委员会, 高血压联盟(中国), 中华医学会心血管病学分会, 等. 中国高血压防治指南(2018年修订版)[J]. 中国心血管杂志, 2019, 24(1): 24-56.
[13]" Farhat NS, Theiss R, Santini T, et al. Neuroimaging of small vessel disease in late-life depression[J]. Adv Exp Med Biol, 2019, 1192: 95-115.
[14]" Zhao H, Wei W, Liu Y, et al. Cognitive frailty among elderly Chinese patients with cerebral small vessel disease: a structural MRI study[J]. Front Med, 2020, 7: 397.
[15]" Doubal FN, MacLullich AM, Ferguson KJ, et al. Enlarged perivascular spaces on MRI are a feature of cerebral small vessel disease[J]. Stroke, 2010, 41(3): 450-4.
[16]" Chen HM, Wan HJ, Zhang MM, et al. Cerebral small vessel disease may worsen motor function, cognition, and mood in Parkinson's disease[J]. Parkinsonism Relat Disord, 2021, 83: 86-92.
[17] Tao X, Yang C, He J, et al. Serum alkaline phosphatase was independently associated with depression in patients with cerebrovascular disease[J]. Front Psychiatry, 2023, 14: 1184673.
[18] Li X, Qin RR, Chen J, et al. Neuropsychiatric symptoms and altered sleep quality in cerebral small vessel disease[J]. Front Psychiatry, 2022, 13: 882922.
[19]" Li Q, Yang Y, Reis C, et al. Cerebral small vessel disease[J]. Cell Transplant, 2018, 27(12): 1711-22.
[20] Liu Y, Dong YH, Lyu PY, et al. Hypertension-induced cerebral small vessel disease leading to cognitive impairment[J]. Chin Med J, 2018, 131(5): 615-9.
[21]" Markus HS, de Leeuw FE. Cerebral small vessel disease: recent advances and future directions[J]. Int J Stroke, 2023, 18(1): 4-14.
[22]" 蒋宇轩, 林嘉灏, 刘三鑫, 等. 动脉硬化性脑小血管病患者情感障碍与影像学标志物的相关性研究[J]. 新医学, 2022, 53(10): 774-9.
[23] Jellinger KA. Pathomechanisms of vascular depression in older adults[J]. Int J Mol Sci, 2021, 23(1): 308.
[24]" Santos M, Gold G, Kövari E, et al. Differential impact of lacunes and microvascular lesions on poststroke depression[J]. Stroke, 2009, 40(11): 3557-62.
[25]" Fang YY, Qin TT, Liu WH, et al. Cerebral small-vessel disease and risk of incidence of depression: a meta-analysis of longitudinal cohort studies[J]. J Am Heart Assoc, 2020, 9(15): e016512.
[26] Yakushiji Y, Charidimou A, Hara M, et al. Topography and associations of perivascular spaces in healthy adults: the Kashima scan study[J]. Neurology, 2014, 83(23): 2116-23.
[27] Sandu RE, Buga AM, Uzoni A, et al. Neuroinflammation and comorbidities are frequently ignored factors in CNS pathology[J]. Neural Regen Res, 2015, 10(9): 1349-55.
[28]" Salvadori E, Brambilla M, Maestri G, et al. The clinical profile of cerebral small vessel disease: toward an evidence-based identification of cognitive markers[J]. Alzheimers Dement, 2023, 19(1): 244-60.
[29]" Brookes RL, Herbert V, Lawrence AJ, et al. Depression in small-vessel disease relates to white matter ultrastructural damage, not disability[J]. Neurology, 2014, 83(16): 1417-23.
[30]" Rock PL, Roiser JP, Riedel WJ, et al. Cognitive impairment in depression: a systematic review and meta-analysis[J]. Psychol Med, 2014, 44(10): 2029-40.
(编辑:熊一凡)
