甲状腺内胸腺癌临床诊断和治疗的研究进展
2024-10-30樊妮妮马步云
摘要:甲状腺内胸腺癌是发生在甲状腺内的胸腺上皮来源的恶性肿瘤,临床以进行性增大的颈部肿块为特点,常与甲状腺肿瘤相混淆。影像学检查是最常用的检查方法,免疫组化检测CD5和CD117呈高表达,基因检测不存在BRAF基因突变,少数存在TERT启动子突变。确诊需要依靠术后病理学,辅以免疫组化检测,治疗采取以手术切除为主,术后辅以放疗和化疗,可以有效延长生存期和降低复发率。本文通过对甲状腺内胸腺癌的临床表现、影像学检查、病理组织形态学、免疫表型特点以及目前的治疗方式等作一综述,旨在帮助提高临床医生对甲状腺内胸腺癌的诊断与治疗水平。
关键词:甲状腺内胸腺癌;影像学检查;组织病理学;免疫表型
Advances in diagnosis and treatment of intrathyroid thymic carcinoma
FAN Nini, MA Buyun
Department of Ultrasound Medicine, West China Hospital, Sichuan University, Chengdu 610041, China
Abstract:" Intrathyroid thymic carcinoma is a malignant neoplasm of thymic epithelial origin occurring in the thyroid gland. thymic carcinoma is characterized by a progressive enlargement of the neck mass and is often confused with Thyroid neoplasm. Imaging was the most commonly used method, immunohistochemistry showed high expression of CD5 and CD117, gene detection without BRAF gene mutation, a small number of TERT promoter mutation. The final diagnosis depends on postoperative pathology and immunohistochemistry, and the treatment is mainly surgical resection. postoperative adjuvant therapy can effectively delay disease progression and recurernce rate. This review analyzed the clinical manifestations, imaging examination, histopathology, immunophenotypic features, and current treatment modalities of intrathyroid thymic carcinoma, aiming to improve clinicians' understanding of intrathyroid thymic carcinoma.
Keywords: intrathyroid thymic carcinoma; imaging examination; histopathology; immunophenotype
甲状腺内胸腺癌(ITTC)是一种罕见的甲状腺内恶性肿瘤,既往也被称为甲状腺显示胸腺样分化的癌,是一种甲状腺组织中具有胸腺上皮细胞来源的恶性上皮肿瘤,肿瘤主要累及甲状腺下极(甲状腺异位胸腺组织或鳃囊残余的位置),多数以颈部无痛性包块就诊,部分病例累及喉返神经而出现声嘶症状,也会因肿块较大压迫而产生呼吸困难及吞咽困难[1]。ITTC的发生率极低,通常发生在50岁以上的人群中,女性高于男性,无地区差异[2],研究显示ITTC在中国的发生率为0.15%[3]。ITTC的病因目前尚不明确,可能与遗传、种族差异或环境等因素有关[4]。ITTC是甲状腺肿瘤的一个独立的临床病理亚类,其病理特征与甲状腺原发性鳞癌、未分化癌等非常相似,其形态与胸腺上皮性肿瘤相似,特别是B3型胸腺瘤或高分化胸腺癌。ITTC的免疫表型与胸腺癌完全一致,即CD5、CD117阳性。CD5、CD117被认为是诊断ITTC的重要指标,但也有少数不表达CD5。ITTC低度恶性,可发生淋巴结转移,预后相对较好,目前的治疗方式主要以甲状腺组织在内的手术完整切除为主,术后辅助放疗和化疗,对于有区域淋巴结转移和明显周围组织侵犯的ITTC患者,术后辅助治疗可有效延缓疾病的进展。另外,ITTC患者的预后相对于胸腺恶性肿瘤较好[5]。
由于ITTC非常罕见,且目前针对其专门的研究相对较少,临床诊断上ITTC容易与甲状腺肿瘤相混淆,易发生误诊而产生不必要的治疗[6]。影像学上常被误诊为结节性甲状腺肿或甲状腺腺瘤,ITTC的确诊需要依靠术后病理学和免疫组化检测[7]。基于此,本文收集归纳国内外有关ITTC的相关研究,总结ITTC的影像学诊断和病理学表现、免疫表型和基因检测特点,为ITTC今后的诊断和治疗提供参考。
1" 临床表现
ITTC肿瘤经常发生于甲状腺组织内,常见于一侧甲状腺的下极,少数发生于甲状腺外,例如颌下腺、舌下腺和腮腺,初发于中年人,男性发病率略低于女性[8]。ITTC发病初期常无明显临床症状,随着肿瘤体积的增大,临床表现为逐渐增大的颈部无痛性肿块,由于该肿瘤进展缓慢,所以患者可能会在一段时间内没有明显症状,直到肿瘤较大时才出现明显表现,导致ITTC一般发现的时候大多数已是晚期,因此定期做颈部超声检查还是很有必要的。当肿瘤压迫或侵犯到气管、食管和喉返神经时,可出现呼吸急促、吞咽困难和声音嘶哑等压迫症状[9]。由于ITTC起病隐匿,大多数患者以肿瘤体积增大引起的压迫症状就诊。与胸腺恶性肿瘤不同,ITTC患者不会出现重症肌无力自身免疫病[10]。
2" 影像学检查
2.1" 超声检查特点
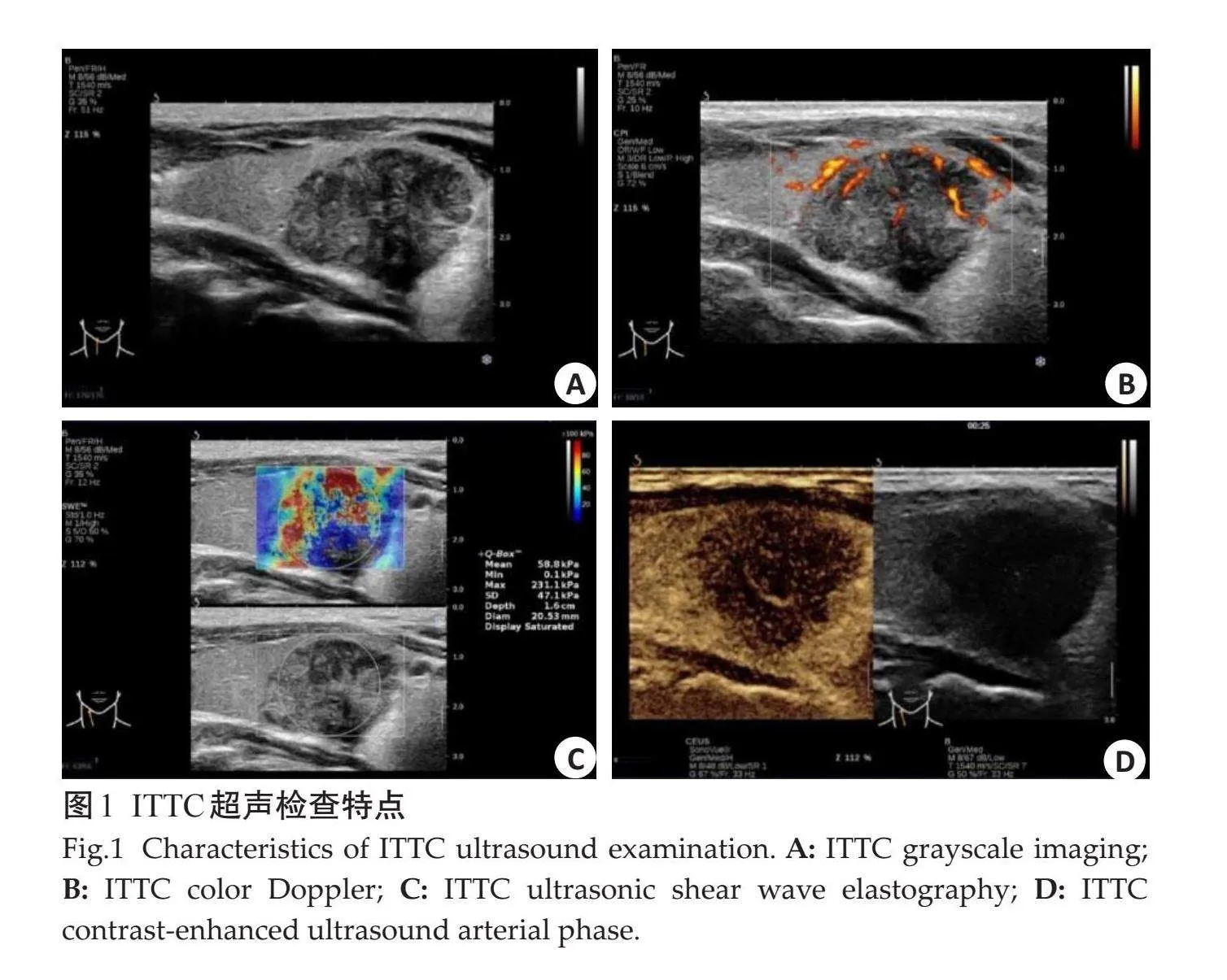
ITTC颈部彩超常提示甲状腺体积增大,实质内查见较大的低回声结节,形状欠或不规则,可呈分叶状,边界较清楚,有时也可能与被膜分界不清,肿瘤通常以实性的为主,少有囊性成分,也少有钙化信号(图1A)。在肿瘤内部和周围探及到血流信号,纵横比一般lt;1,血流分级0~3级,C-TIRADS分级4A~5级(图1B)。颈部有时可见肿大淋巴结回声[11]。超声实时剪切弹性成像系统会自动计算出病灶的杨氏模量最大值、最小值以及平均值,根据最大值诊断ITTC的准确性优于平均值(图1C)。可以根据该系统定量测量的肿块的软硬程度,初步判断肿瘤的良恶性,一般Emaxlt;45 kPa认为良性可能性大,Emaxgt;65 kPa认为倾向恶性,Emax在45~64 kPa建议临床医生结合临床[12]。在成像系统的甲状腺超声造影增强模式中,ITTC常表现为低增强模式(图1D),其与周围正常甲状腺组织比较,超声造影峰值强度低,上升斜率小[13]。而甲状腺腺瘤超声则表现为甲状腺内部发现有一个圆形或椭圆形的肿物,边界清楚,有包膜[14]。
2.2" CT检查特点
ITTC的CT平扫图像显示为边缘不清晰、密度不均匀的结节状软组织密度肿块,囊性改变也很罕见,增强CT则显示大部分肿块为轻度不均匀增强,原因是轻度不均匀强化可能是由于ITTC恶性程度较低,肿瘤生长较为缓慢,血供较少引起[15]。ITTC平扫和增强的肿块的密度均低于周围正常组织[16]。鳞状细胞癌和间变性甲状腺癌都容易发生囊性坏死、钙化,但ITTC很少发生,这在增强CT上表现与ITTC显著不同[17]。
2.3" 磁共振检查特点
MRI检查ITTC时,其与正常甲状腺组织的信号强度相比有显著的差异,因此MRI在描述ITTC肿瘤与甲状腺组织的关系方面以及确定ITTC肿瘤内部异质性程度方面具有独特的优势。ITTC在MRI T1加权图像中呈结节状等信号肿块,在MRI T2加权图像上呈高信号,肿块中间区域经造影剂处理后,在MRI T1加权像和MRI T2加权像上都可出现适度强化[18]。甲状腺癌患者的表观扩散系数显著高于ITTC,原因是甲状腺癌的病灶部位、内部微小钙化灶及甲状腺球蛋白的含量造成了表观扩散系数低。甲状腺癌患者的血流分级高,通过MRI检查并对ITTC建立临界值,可以起到鉴别价值。
2.4" PET-CT检查特点
ITTC在PET-CT上可表现为边缘不规则、低回声、不均匀肿块,伴有氟脱氧葡萄糖摄取量增加,当其发生肺、胸膜、骨转移时,转移器官的氟脱氧葡萄糖摄取量也同样增加。PET-CT对颈部淋巴结转移诊断敏感性高、特异性强,可以作为ITTC远处转移的首选方法[19]。
由于ITTC在临床非常罕见,在颈部肿物的影像学诊断时首先考虑是最常见的甲状腺肿瘤,因此经常造成误诊,影响后期的治疗方式。在超声引导下细针穿刺活检所取得的肿瘤组织通常较少,检查结果不能准确反映整个肿瘤的病理情况,同样术中冰冻切片因受取材的限制容易误诊,因此术后的石蜡切片下的病理学检查辅助免疫组织化学染色是确诊ITTC的唯一手段。
3" 病理学检查
3.1" 大体病理
ITTC是质地中等至稍硬的结节状或分叶状肿块,但弱于甲状腺乳头状癌质地,颜色呈灰白色或棕褐色,类似纵隔胸腺肿瘤。ITTC呈膨胀性推挤式生长,可伴有周边淋巴结转移,也可侵犯临近器官或组织,有时还会压迫气管、食管或喉返神经引起相应症状。
3.2" 组织病理学特点
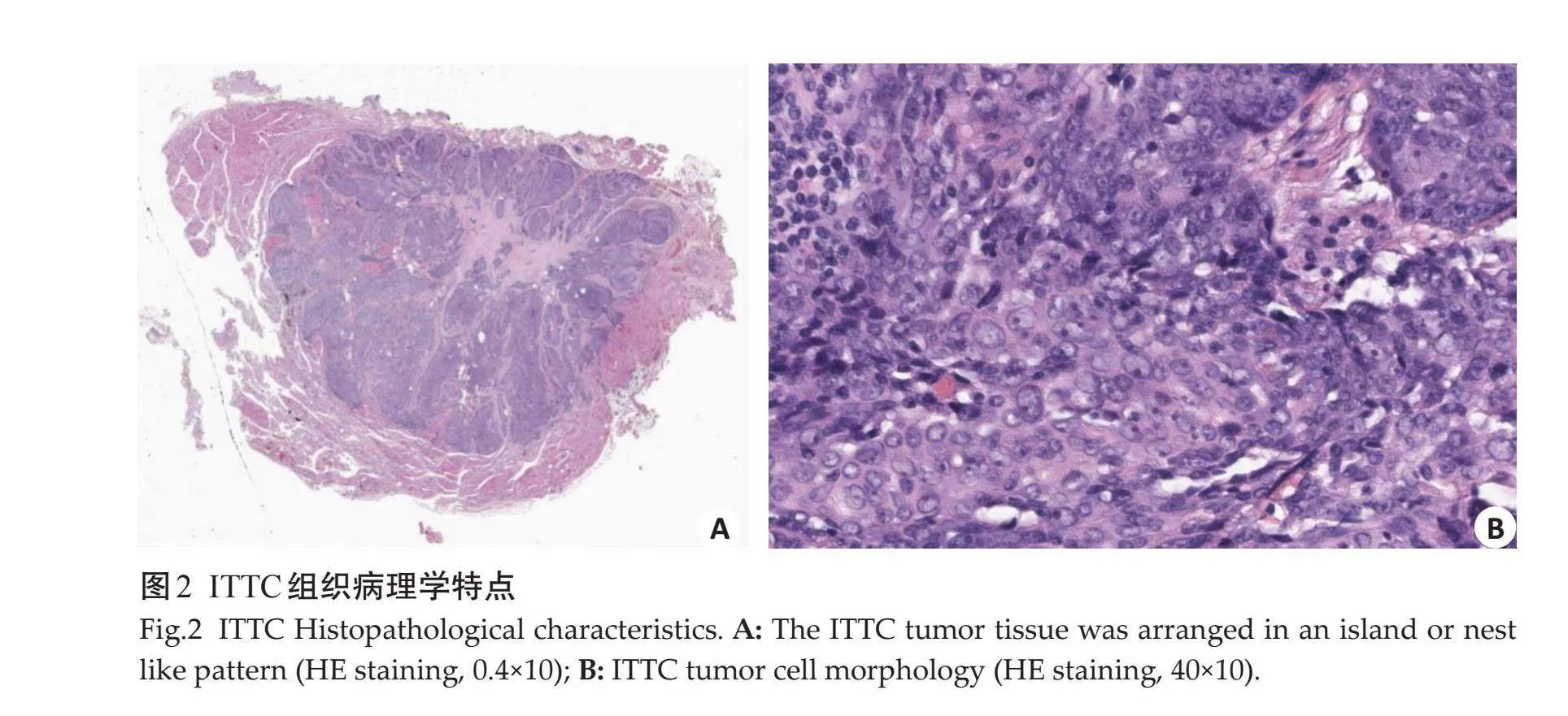
在组织学上最具特征性表现是肿瘤组织中间由纵横交错的致密纤维组织分隔,其中有淋巴细胞、浆细胞浸润,有时可见类似胸腺肿瘤分叶状结构或胸腺小体样结构[20]。ITTC可分为以下几型:鳞状细胞癌型:癌细胞大小不一,肿瘤呈巢团状结构,正常的甲状腺组织传入肿瘤中,肿瘤侵蚀甲状腺组织,癌细胞呈不同程度的角化;淋巴上皮癌型:癌细胞呈多边形,细胞核呈空泡形态,核仁小,癌细胞间界限模糊,呈合体细胞簇,肿瘤间质有大量淋巴细胞浸润;神经内分泌癌型:癌细胞呈淋巴细胞样、散在分布、核仁不明显,常见组织挤压伤。其中以淋巴上皮癌型最常见[21]。在显微镜下ITTC肿瘤组织呈条索状、岛屿状或巢状排列(图2A)。肿瘤细胞边界不清,呈三维立体结构。癌细胞巢周围可见小淋巴细胞及浆细胞浸润,胞质较少,淡染或嗜酸性,细胞核为圆形或卵圆形,核浆比高,偶见小核仁,细胞异型明显,核分裂象少见,不见肿瘤性坏死(图2B)。该肿瘤细胞常缺乏甲状腺乳头状癌或滤泡癌细胞学特征,无明显乳头状、滤泡状结构,病理标本在冰冻切片诊断中有时难以明确组织类型,因此易被误诊为甲状腺的肿瘤。
4" 免疫组化特点
由于ITTC起源于胸腺腺组织,其免疫表型与胸腺癌完全一致,即免疫组化检测CD5和CD117呈高表达,于是该两项检测指标被认为是诊断ITTC的特异性标志物[22]。究其原因是甲状腺癌表达TG、CT、TTF-1等甲状腺相关标志物,而ITTC起源于胸腺组织上皮细胞,借免疫组化检测结果可与甲状腺来源的恶性肿瘤相鉴别。当ITTC与甲状腺滤泡上皮难以区分时,尤其是甲状腺未分化癌上皮细胞无法辨别时,CD5的高表达可以为区分提供依据,CD5作为ITTC诊断的标志物,其敏感度和特异度分别为82%和100%[23]。一项82例ITTC患者的研究显示CK19、CEA和TP63的阳性率分别为100.00%、64.00%和100.00%,32例患者TP63呈阳性[24]。有研究显示ITTC患者的CD117表达率为97.30%,CD117可能是区分ITTC和其它甲状腺肿瘤的有效标志物[25]。还有研究显示Glut-1和Pax8在ITTC肿瘤组织中的表达特异性较强[26]。然而在ITTC肿瘤组织中,甲状腺球蛋白、降钙素、CT、TG和TTF-1表达呈阴性,也可用于鉴别ITTC与其它甲状腺相关肿瘤[27]。因此,联合检测CD117、TP63、CK19、EMA、Bcl-2的表达有助于ITTC的诊断[28]。
5" 鉴别诊断
在临床上ITTC早期表现为发生在颈部的肿块,需要与甲状腺肿瘤相鉴别[29-33],特别是发生在甲状腺下级的肿瘤。ITTC主要与以下5种颈部恶性肿瘤相鉴别:
5.1" 甲状腺鳞状细胞癌
甲状腺鳞状细胞癌作为一类罕见性的甲状腺癌,甲状腺鳞状细胞癌通常起源于甲状腺滤泡细胞外的上皮组织,其发病率在甲状腺恶性肿瘤中不足1%,可以发生于任何年龄,但发病年龄大多在50岁以上,男女发病率无明显差异,患者通常表现为甲状腺内肿块,随吞咽上下移动,质地较硬。部分患者可能伴有颈部淋巴结肿大。该肿瘤临床生长迅速,初诊时常表现甲状腺周围组织的局部浸润,伴有局部血管和神经浸润,易发生远处转移。通过细针穿刺活检或手术切除部分或全部甲状腺组织,进行病理组织学检查,以明确诊断,其中病理检查示癌细胞排列成巢状和片状,可观察到角化珠,嗜酸性核仁明显,嗜酸性细胞质丰富,高倍镜下可观察到细胞间桥和有丝分裂,且病理组织学检查是诊断甲状腺鳞状细胞癌的金标准。免疫组化上,肿瘤细胞表达P40、CK199阳性,但不表达CD117、CD5和Ki-67,增殖指数Ki-67一般也较低,通过免疫检测结果可与ITTC相鉴别[34]。
5.2" 甲状腺良性肿瘤
甲状腺良性肿瘤临床方面主要包括甲状腺腺瘤、结节性甲状腺肿、甲状腺囊肿、甲状腺炎和甲状腺血管瘤等。其中,甲状腺腺瘤是最常见的甲状腺良性肿瘤,多见于女性,通常是由于碘摄入过多或过少等原因所引起,一般没有明显症状,但如果肿瘤较大,可能会出现颈部疼痛、声音嘶哑等症状。如果没有明显压迫症状或者影响美观,一般不需要进行特殊治疗,只需要做好定期复查。但如果甲状腺结节造成不适感、或结节日益增大影响美观,则需要进行手术等综合治疗。颈部的甲状腺良性肿瘤与甲状腺正常组织在影像学检查上边界清楚。在增强CT上,甲状腺腺瘤以明显的不均匀性强化为特征,囊性改变或粗大的钙化样改变通常考虑结节性甲状腺肿。ITTC则表现为与正常甲状腺组织分界不清,没有囊性或钙化结节改变[34]。
5.3" 甲状腺乳头状癌
甲状腺乳头状癌作为一种常见的甲状腺恶性肿瘤,占甲状腺癌的70%~90%,特征包括形成乳头状结构、间质砂砾体和典型的癌细胞核特征。这类肿瘤分化成熟,很少发生转移,预后好。病理组织学检查主要通过细针穿刺活检或手术切除部分或全部甲状腺组织,镜下能够观察到二级以上细长乳头、纤维血管轴心、表面覆单层或复层立方状或低柱状细胞,间质内可见水肿,有数量不等的淋巴细胞、浆细胞浸润,显微镜下癌细胞有丝分裂计数高,免疫组化常表达CK7和TTF-1阳性,而BRAF表达阴性,借此可与ITTC相鉴别[34]。
5.4" 甲状腺未分化癌
甲状腺未分化癌作为甲状腺癌中恶性程度最高的一种,发病率约占全部甲状腺癌的10%~15%,多见于年老体弱者,发病迅速,早期可发生全身转移。其多发生在40岁以上,女性较多见,生长快,早期即可发生浸润和转移,恶性程度高,预后差。该肿瘤来源于未分化的卵泡状甲状腺细胞,临床特点是多发生于老年人,肿瘤迅速增长,常易侵犯周围组织器官和周围淋巴管和血管。镜下可以观察到癌细胞大小、形态、染色深浅不一,核分裂像多,与周围组织界限不清,常见坏死和出血,有时可出现梭形细胞排列成束状或席纹状。细胞学检查可见肿瘤细胞包括肉瘤样细胞、梭形细胞和巨细胞等多种未分化细胞,混在一起表现出混合性形态学组织改变。肿瘤细胞的有丝分裂率和增殖指数Ki-67较高;免疫组化TTF-1多数呈阳性,而CD5、Bcl-2、CD117呈阴性,缺少ITTC的拼图样构型,通过好发年龄、免疫组化检测结果可与ITTC相鉴别[34]。
5.5" 转移性神经内分泌癌
转移性神经内分泌癌主要起源于身体其他部位的神经内分泌组织,通过扩散或转移而形成的恶性肿瘤,这些肿瘤通常具有高度恶性的特点,生长迅速,容易发生转移和扩散。常见的转移部位包括肝脏、淋巴结、骨和肺部等。该类型肿瘤具有神经内分泌分化特征,有原发肿瘤的临床表现,例如心悸、多汗、面色潮红、血压升高等内分泌功能紊乱症状,免疫组化CD5多数为阴性[34]。转移性神经内分泌癌的内分泌症状比较明显,而ITTC无明显临床症状,借此可以鉴别两类疾病。
6" 治疗和预后
6.1" 手术治疗
手术治疗是目前ITTC首选的治疗方式,根据肿瘤的位置、大小,有无食管、气管和周围组织侵犯决定甲状腺切除的范围[35],手术方式包括甲状腺全切术、甲状腺近全切除术、甲状腺腺叶+峡部切除术及姑息切除术。局部晚期情况下,甲状腺全切除术比甲状腺腺叶切除术更常用[36]。颈部淋巴结清扫术的范围视病情综合评估而定,对于伴有颈部淋巴结转移及腺外侵犯的患者行甲状腺全切除术,行同侧颈部淋巴结清扫术。有学者发现ITTC患者的颈部淋巴结清扫术可以延长总生存期。由于具有甲状腺外侵犯的ITTC更容易发生淋巴结转移,预防性淋巴结清扫可以降低局部复发[37];也有研究建议对于临床诊断无淋巴结转移的ITTC患者也应行预防性淋巴结清扫[38]。
6.2" 辅助治疗
术后根据病理组织和临床分期决定是否采用放疗、化疗和免疫治疗。
放射治疗:在缺乏既定指南的情况下,大多数研究主张对ITTC肿瘤未完全切除且Masaoka III期的患者进行辅助放疗[39]。有研究发现术后辅助放疗可以延长ITTC患者的总生存期[20],但一项纳入82例ITTC患者的研究发现术后放疗并不能降低局部复发率[26]。此外,调强放射治疗作为近年来放射技术的突破,在头颈癌的治疗种得到普及,有研究发现14例ITTC患者接受辅助调强放射治疗,只有1例患者出现局部复发,这表明辅助调强放射治疗能有利的控制ITTC患者的局部肿瘤进展[40]。但鉴于ITTC的罕见性和临床进展的惰性,仍需要进行更多的前瞻性研究。
化学治疗:ITTC对化疗比较敏感,有研究发现对于复发或发生远处转移的晚期ITTC患者可以通过化疗延长生存期[33]。考虑到ITTC的起源,胸腺癌的化疗方式可作为ITTC患者治疗的一种策略,例如卡铂加紫杉醇治疗。另外,乐伐替尼作为一种针对VEGFR 1-3、FGFR 1-4、PDGFR-α以及RET和c-KIT信号网络的多靶点酪氨酸激酶抑制剂,能有效的减轻ITTC患者的疾病负担并减缓肿瘤的生长[41]。还有其他几种多靶点酪氨酸激酶抑制剂,例如卢西他尼、索拉非尼和卡博替尼,已在包括胸腺肿瘤和甲状腺肿瘤患者的临床试验中显示出疗效,卡博替尼显著延长甲状腺肿瘤患者的无进展生存期,卢西他尼是一种有效的口服抑制剂,抑制1型和2型成纤维细胞生长因子受体、1、2型和3型血管内皮生长因子受体以及α型和β型血小板衍生生长因子受体,这些都有望成为ITTC的靶向治疗药物[42]。
免疫治疗:ITTC免疫治疗目前正在研究中,有研究报道了ITTC患者接受PD-L1抑制剂帕博利珠单抗治疗后,肿瘤体积明显缩小,局部压迫症状得到明显好转,同时也未出现与免疫治疗有关的不良反应[34];另一项研究也同样证实PD-L1的免疫检查点抑制剂可能是ITTC的一种治疗选择[44]。综上所述,对有区域淋巴结转移和明显周围组织侵犯的ITTC患者,术后辅助治疗可有效延缓疾病进展。
6.3" 预后
ITTC是一种惰性肿瘤,病程较长,术后预后良好,少有死亡病例报道。有研究表明没有发生局部淋巴结转移和周围组织扩散的ITTC患者生存期延长,而已发生局部转移患者的5年生存率和10年生存率分别为76%和57%[45],因此局部淋巴结转移和周围组织扩散影响ITTC的生存期。手术完整切除ITTC肿瘤,包括甲状腺及周围的组织对于降低局部复发率和提高生存期有重要意义[46]。一些文献曾报道甲状腺根治术后的局部放疗可以防止局部复发而提高生存率,但这一结论有待于更多病例的确定[38, 47]。
7" 小结
ITTC是一种极其罕见的低度恶性的甲状腺原发肿瘤,可能来源于异位胸腺组织,肿瘤细胞生长缓慢,病程长,临床常表现为逐渐增大的颈部肿块。超声提示甲状腺体积增大,CT示边缘不清楚、密度不均匀的结节状软组织肿块,MRI显示肿块信号密度明显增强,PET-CT有助于发现远处转移,确诊依靠病理学检查辅助免疫组织化学染色。影像学和病理检查有助于早发现、早治疗。免疫组化CD5、CD117、P63及单克隆PAX8的组合检测有助于ITTC的诊断及鉴别诊断。BRAF基因突变不参与ITTC的发生,但是少数ITTC可以发生TERT启动子突变,可能为ITTC的基因治疗提供新的方向。目前治疗方案是手术切除,若发现明确局部淋巴结转移证据需要区域淋巴结的清扫以保证预后。术后辅以放疗和化疗,可以有效延长生存期和降低复发率。
参考文献:
[1]" "Thompson L. World Health Organization classification of tumours: pathology and genetics of head and neck tumours[J]. Ear Nose Throat J, 2006, 85(2): 74.
[2]" Lloyd RV, Osamura RV, Klöppel G, et al. World Health Organization classification of tumours of endocrine organs. 4th ed[M]. Lyon: IARC Press, 2017: 125-6.
[3]" " 李海莉, 郑时玉, 任昭军. 甲状腺内胸腺癌临床病理分析及相关文献复习[J]. 现代实用医学, 2021, 33(4): 476-8, 561.
[4]" "Liang JH, Huang M, Huang HL, et al. Intrathyroidal thymic carcinoma: a retrospective case series study[J]. Ear Nose Throat J, 2023, 102(9): 584-9.
[5]" "Gao R, Jia X, Ji T, et al. Management and prognostic factors for thyroid carcinoma showing Thymus‑like elements (CASTLE): a case series study[J]. Front Oncol, 2018, 8: 477.
[6]" "Sun YH, Xu J, Li M. Intrathyroid thymic carcinoma: report of two cases with pathologic and immunohistochemical studies[J]. Int J Clin Exp Pathol, 2018, 11(10): 5139-43.
[7]" "Gonzales‑Laguado E, Guerra‑Miller H, García‑Ruiz L, et al. Intrathyroidal thymic carcinoma misdiagnosed as a medullary thyroid carcinoma[J]. Cir Cir, 2020, 88(Suppl 1): 35-8.
[8]" "Gurizzan C, Zamparini M, Volante M, et al. Outcome of patients with intrathyroidal thymic carcinoma: a pooled analysis[J]. Endocr Relat Cancer, 2021, 28(8): 593-604.
[9]" " Zhang GJ, Liu X, Huang W, et al. Carcinoma showing thymus-like elements of the thyroid gland: report of three cases including one case with breast cancer history[J]. Pathol Oncol Res, 2015, 21(1): 45-51.
[10]" Ito Y, Miyauchi A, Hirokawa M, et al. Clinicopathological features and outcomes of intrathyroidal thymic carcinoma: a single institution study[J]. Endocr J, 2022, 69(11): 1351-6.
[11]" 冯一星, 张" 晟. 甲状腺内胸腺癌声像图特征及临床病理特点分析[J]. 中华超声影像学杂志, 2019, 28(3): 241-5.
[12]" Stasiak M, Adamczewski Z, Stawerska R, et al. Sonographic and elastographic features of extra-and intrathyroidal ectopic Thymus mimicking malignancy: differential diagnosis in children[J]. Front Endocrinol, 2019, 10: 223.
[13]" Pang TT, Huang LD, Deng YY, et al. Logistic regression analysis of conventional ultrasonography, strain elastosonography, and contrast-enhanced ultrasound characteristics for the differentiation of benign and malignant thyroid nodules[J]. PLoS One, 2017, 12(12): e0188987.
[14]" 杨文杰, 随" 涛, 程好堂. 超声检查与螺旋CT在诊断甲状腺癌中的对比分析[J]. 医学影像学杂志, 2022, 32(4): 694-6.
[15] Wu B, Sun TQ, Gu YJ, et al. CT and MR imaging of thyroid carcinoma showing thymus‑like differentiation (CASTLE): a report of ten cases[J]. Br J Radiol, 2016, 89(1060): 20150726.
[16]" 张秀兰, 钱" 勇, 樊红霞, 等. 前纵隔原发性肿瘤的MSCT诊断与鉴别诊断[J]. 中国中西医结合影像学杂志, 2016, 14(4): 447-9.
[17]" 林" 川, 刘" 建, 邱智广, 等. 多层螺旋CT诊断甲状腺肿瘤的应用价值[J]. 现代医用影像学, 2022, 31(10): 1917-9.
[18]" 姚锡虎, 周青云, 张志诚, 等. MRI纹理联合Cripto-1与SOX2蛋白对甲状腺乳头状癌颈部淋巴结转移的诊断价值[J]. 中国医学物理学杂志, 2022, 39(2): 224-8.
[19]" 汝" 琦, 王" 清, 潘林华, 等. 超声检查和PET/CT检查诊断甲状腺乳头状癌中央区淋巴结转移的对比研究[J]. 医学影像学杂志, 2020, 30(4): 552-5.
[20]Ito Y, Miyauchi A, Nakamura Y, et al. Clinicopathologic significance of intrathyroidal epithelial thymoma/carcinoma showing thymus‑like differentiation: a collaborative study with Member Institutes of The Japanese Society of Thyroid Surgery[J]. Am J Clin Pathol, 2007, 127(2): 230-6.
[21]" 屈传贵, 董晨羽. 甲状腺内胸腺癌病理组织学特征及其鉴别诊断[J]. 菏泽医学专科学校学报, 2022, 34(3): 76-8.
[22] Nakanobo R, Hamaji M, Ohsumi A, et al. Paratracheal middle mediastinal thymic carcinomas[J]. Ann Thorac Surg, 2020, 110(1): e39-e41.
[23]" Kakudo K, Bai YH, Ozaki T, et al. Intrathyroid epithelial thymoma (ITET) and carcinoma showing thymus‑like differentiation (CASTLE): CD5‑positive neoplasms mimicking squamous cell carcinoma of the thyroid[J]. Histol Histopathol, 2013, 28(5): 543-56.
[24] Ge W, Yao YZ, Chen G, et al. Clinical analysis of 82 cases of carcinoma showing thymus-like differentiation of the thyroid[J]. Oncol Lett, 2016, 11(2): 1321-6.
[25]Ishii H, Tsujikawa T, Oishi N, et al. Genomic and immune microenvironment profiling in a case of metastatic intrathyroid thymic carcinoma[J]. Clin Case Rep, 2022, 10(7): e6050.
[26] Suzuki A, Hirokawa M, Takada N, et al. Utility of monoclonal PAX8 antibody for distinguishing intrathyroid thymic carcinoma from follicular cell-derived thyroid carcinoma[J]. Endocr J, 2018, 65(12): 1171-5.
[27] Gurizzan C, Zamparini M, Volante M, et al. Outcome of patients with intrathyroidal thymic carcinoma: a pooled analysis[J]. Endocr Relat Cancer, 2021, 28(8): 593-604.
[28]" Collins JA, Ping B, Bishop JA, et al. Carcinoma showing Thymus-like differentiation (CASTLE): cytopathological features and differential diagnosis[J]. Acta Cytol, 2016, 60(5): 421-8.
[29]" Veits L, Schupfner R, Hufnagel P, et al. KRAS, EGFR, PDGFR-α, KIT and COX-2 status in carcinoma showing thymus-like elements (CASTLE)[J]. Diagn Pathol, 2014, 9: 116.
[30]Ren WH, Dong K, Huang XZ, et al. Intrathyroidal thymic carcinoma exhibiting neuroendocrine differentiation: case report with cytomorphology, immunocytochemistry, and review of the literature focusing on cytology[J]. Diagn Cytopathol, 2019, 47(11): 1197-202.
[31] Liu Z, Teng XY, Sun DX, et al. Clinical analysis of thyroid carcinoma showing thymus‑like differentiation: report of 8 cases[J]. Int Surg, 2013, 98(2): 95-100.
[32] Tahara I, Oishi N, Mochizuki K, et al. Identification of recurrent TERT promoter mutations in intrathyroid thymic carcinomas[J]. Endocr Pathol, 2020, 31(3): 274-82.
[33] Bible KC, Kebebew E, Brierley J, et al. 2021 American thyroid association guidelines for management of patients with anaplastic thyroid cancer[J]. Thyroid, 2021, 31(3): 337-86.
[34]" 郑增光, 孙文勇. 甲状腺内胸腺癌临床病理分析[J]. 中国医学科学院学报, 2021, 43(1): 42-6.
[35] Adam MA, Pura J, Gu L, et al. Extent of surgery for papillary thyroid cancer is not associated with survival: an analysis of 61, 775 patients[J]. Ann Surg, 2014, 260(4): 601-7.
[36]" Xing ZC, Qiu YX, Fei Y, et al. Protective strategy of parathyroid glands during thyroid lobectomy: a retrospective cohort and case-control study[J]. Medicine, 2021, 100(14): e21323.
[37] Adam MA, Pura J, Gu L, et al. Extent of surgery for papillary thyroid cancer is not associated with survival: an analysis of 61, 775 patients[J]. Ann Surg, 2014, 260(4): 601-7.
[38]" Inoue Y, Kohi S, Gobara M, et al. A case of carcinoma showing Thymus-like differentiation (CASTLE) of the thyroid[J]. J UOEH, 2018, 40(3): 259-66.
[39]" Kong FF, Ying HM, Zhai RP, et al. Clinical outcome of intensity modulated radiotherapy for carcinoma showing thymus‑like differentiation[J]. Oncotarget, 2016, 7(49): 81899-905.
[40] Cui AL, Du YQ, Hou CJ, et al. Case Reports: a role of postoperative radiation therapy in completely resected early stage intrathyroid thymic carcinoma: a case report and literature review of the diagnosis and treatment[J]. Front Oncol, 2023, 13: 1234961.
[41]" Yuan Y, Ke CS, Zhang GP, et al. Case report and literature review: thyroid carcinoma showing intrathyroid thymic carcinoma[J]. Front Oncol, 2022, 12: 923683.
[42]Brose MS, Robinson B, Sherman SI, et al. Cabozantinib for radioiodine‑refractory differentiated thyroid cancer (COSMIC-311): a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2021, 22(8): 1126-38.
[43]Alvarez Moreno JC, Muthukumarana P, Qiu SM. NRAS gene mutation in differentiated high-grade thyroid carcinoma with multiphenotypic metastatic pattern: a case report[J]. Cureus, 2022, 14(12): e32177.
[44] Gao YN, Pan Y, Luo Y, et al. Intrathyroid thymic carcinoma: a clinicopathological analysis of 22 cases[J]. Ann Diagn Pathol, 2023, 67: 152221.
[45] Zheng ZG, Sun WY. Clinicopathological features of intrathyroid thymic carcinoma[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2021, 43(1): 42-6.
[46] Łukasiewicz M, Śledziński M, Szymański M, et al. Therapeutic challenge: a giant, infiltrating intrathyroidal thymic carcinoma of the thyroid gland[J]. Pol Arch Intern Med, 2023, 133(6): 16475.
[47]" Abu-Salah AK, Segura S, Mesa H, et al. Cytomorphologic findings of thyroid carcinoma showing thymus‑like (CASTLE) differentiation: a case report[J]. Am J Clin Pathol, 2021, 156(Supplement-1): S42.
(编辑:孙昌朋)
