基于光谱CT各参数的甲状腺良恶性结节学习模型的构建及应用
2024-10-30李炜王金花杨忠现刘于宝
摘要:目的" 分析基于光谱CT各参数构建的机器学习模型预测甲状腺良恶性结节的可行性。方法" 回顾性分析2021年9月~2022年12月经手术病理证实的185例甲状腺结节患者资料。根据病理结果将患者分为恶性结节组(n=106)及良性结节组(n=79),提取10个光谱CT参数构建6种机器学习模型,通过ROC曲线评价各模型预测甲状腺结节良恶性的效能,比较模型曲线下面积的差异。结果" 预测甲状腺良恶性结节的极端梯度提升、随机森林、支持向量机、K最近邻学习模型、逻辑回归及决策树的AUC值分别为0.833、0.814、0.813、0.807、0.799、0.776,敏感度分别为0.833、0.833、0.800、0.733、0.767、0.733,特异度分别为0.808、0.769、0.731、0.846、0.808、0.731,准确度分别为0.821、0.804、0.768、0.786、0.786、0.732。结论" 基于光谱CT各参数构建预测甲状腺良恶性结节的学习模型效能较好,最优预测模型为XGBoost。
关键词:甲状腺结节;甲状腺癌;光谱CT;XGBoost;能谱曲线
Construction and application of thyroid nodule malignancy prediction model based on various parameters from spectral CT
LI Wei1, 2, 3, WANG Jinhua1, YANG Zhongxian1, LIU Yubao1, 2
1Medical Imaging Center, Shenzhen Hospital, Southern Medical University, Shenzhen 518100, China; 2The Third School of Clinical Medicine, Southern Medical University, Guangzhou 510500, China; 3Department of Radiology, Fuyong People's Hospital of Shenzhen Baoan, Shenzhen 518103, China
Abstract: Objective To observe the feasibility of machine learning models constructed based on various parameters of spectral CT in predicting the benign and malignant nature of thyroid nodules. Methods A total of 185 patients with thyroid nodules confirmed by surgical pathology from September 2021 to December 2022 were analyzed retrospectively. According to the pathological results, the patients were divided into malignant nodules group (n=106) and benign nodules group (n=79). Ten spectral CT parameters were extracted to establish six machine learning models. The performance of each model in predicting the benign and malignant nature of thyroid nodules was evaluated through ROC curves, and the differences in AUC of the model were compared. Results The AUC values of extreme gradient boosting, random forest, support vector machine, K-nearest neighbors, Logistic regression and decision tree models for predicting thyroid nodule malignancy were 0.833, 0.814, 0.813, 0.807, 0.799, 0.776, respectively. Their sensitivities were 0.833, 0.833, 0.800, 0.733, 0.767, 0.733, their specificities were 0.808, 0.769, 0.731, 0.846, 0.808, 0.731, their accuracies were 0.821, 0.804, 0.768, 0.786, 0.786, 0.732. Conclusion The learning models based on the parameters from spectral CT to predict benign and malignant thyroid nodules had good overall performance, the optimal prediction model was XGBoost.
Keywords: thyroid nodules; thyroid cancer; spectral CT; XGBoost; energy spectrum curve
近年来,随着生活方式的变化和环境因素的影响,甲状腺癌的全球发病率呈现出逐年上升的趋势,主要以乳头状癌为主[1-3],女性的发病率远高于男性[4]。尽管甲状腺癌被认为是一种具有相对较低恶性度的“惰性癌”,但它仍较容易发生颈部淋巴结转移,直接影响患者的预后和治疗策略。因此,精确而早期的诊断对于改善甲状腺癌患者的治疗效果至关重要。目前,超声引导下的细针穿刺活检(FNA)是诊断甲状腺癌的首选方法,但平均诊断准确率约为83%,结果很大程度依赖于采样的质量和操作者的经验[5-7]。此外,FNA存在假阴性结果的风险,可能导致患者需要接受不必要的二次活检。
双层探测器光谱CT(DLCT)利用不同能量水平的X射线对组织的不同反应,可以获得比传统CT更多的物理和化学信息[8, 9],在鉴别肺癌及胃肠道肿瘤等相关领域展现出较好的诊断价值[10-13]。当这些更详细的影像数据与机器学习模型相结合时,可以提高诊断的准确性和效率,有助于提高疾病的早期诊断和精准治疗[14, 15]。目前有关如何利用DLCT定量参数与机器学习模型结合鉴别甲状腺结节的研究还未见报道,本研究旨在探讨基于光谱CT各参数构建的机器学习模型预测甲状腺良恶性结节的可行性,为甲状腺癌的临床早期诊疗提供参考。
1" 资料与方法
1.1" 一般资料
回顾性分析2021年9月~2022年12月南方医科大学深圳医院和深圳市宝安区福永人民医院患有甲状腺结节的185例患者的临床及影像资料。纳入标准:术前行DLCT增强检查,图像质量满足诊断要求;有完整的病理学诊断结果。排除标准:检查前行活检或手术切除,或放、化疗后;甲状腺结节广泛囊变或多发钙化者。185例患者中,男性51例,女性134例,年龄25~73(46.3±12.55)岁。共收集185个结节,其中良性结节79个,包括结节性甲状腺肿74个,亚急性甲状腺炎1个,滤泡性腺瘤4个,恶性结节106个,均为甲状腺乳头状癌。本研究为回顾性研究,经本院伦理委员会审核批准(伦理审批号:KY-2024-08)。
1.2" 扫描方法
采用飞利浦IQon Spectral CT机对患者进行检查,扫描范围自第1颈椎水平至主动脉弓上缘。检查前嘱咐患者双肩尽量下垂,避免吞咽动作,以减少伪影对图像的干扰。扫描参数:管电压为120 kVp,自动管电流调制技术,采用颈部光谱扫描模式行平扫、动脉期及静脉期增强扫描,对比剂为碘普罗胺(370 mg/mL),采用双筒高压注射器及对比剂自动跟踪触发技术扫描。扫描完成后将图像传至后处理工作站,扫描及重建后的图像层厚分别为5 mm、1 mm。
1.3" 图像分析
在甲状腺结节最大层面勾画感兴趣区域(ROI),分别采集动、静脉期甲状腺结节的CT值(40 keV、100 keV)、有效原子序数(eff-Z)、碘浓度(IC)。为消除个体间差异对实验结果的影响,对数据进行标准化处理。标准化碘浓度(NIC)=结节内的碘浓度/同层面颈总动脉的碘浓度;标准化有效原子序数值(Neff-Z)=结节内的有效原子序数值/同层面颈总动脉的有效原子序数值;能谱曲线斜率(λHu)=(40 keV-100 keV)/(100-40)。勾画的ROI由2位高年资医师讨论后共同决定,主要放置在实性区域,避开明显的钙化、囊变及坏死组织。
1.4" 构建机器学习模型
通过统计学检验筛选出有统计学差异的光谱CT参数转化为Python可识别语言,构建决策树(DT)、随机森林(RF)、极端梯度提升(XGBoost)、逻辑回归(LR)、支持向量机(SVM)、K最近邻(KNN)6种学习模型执行预测甲状腺良性结节与恶性结节的二分类任务。对数据集按7:3分成训练组和测试组,训练组用于构建预测模型,同时采用10折交叉验证方法训练模型,利用测试组数据对模型的性能进行外部测试。采用ROC曲线下面积(AUC)、敏感度、特异度及准确度评价验证模型的效能,AUC越接近1,效能越高。构建学习模型过程中加入可解释技术SHAP值,可视化观察最优模型的输出结果。
1.5" 统计学分析
采用SPSS23.0软件进行分析。光谱CT参数等计量资料以均数±标准差或中位数(四分位数间距)表示,符合正态分布的计量资料组间比较采用独立样本t检验,不符合正态分布的计量资料采用非参数Mann-Whitney U检验。以Plt;0.05为差异有统计学意义。采用Delong检验进一步分析各模型的AUC值。
2" 结果
2.1" 光谱参数分析
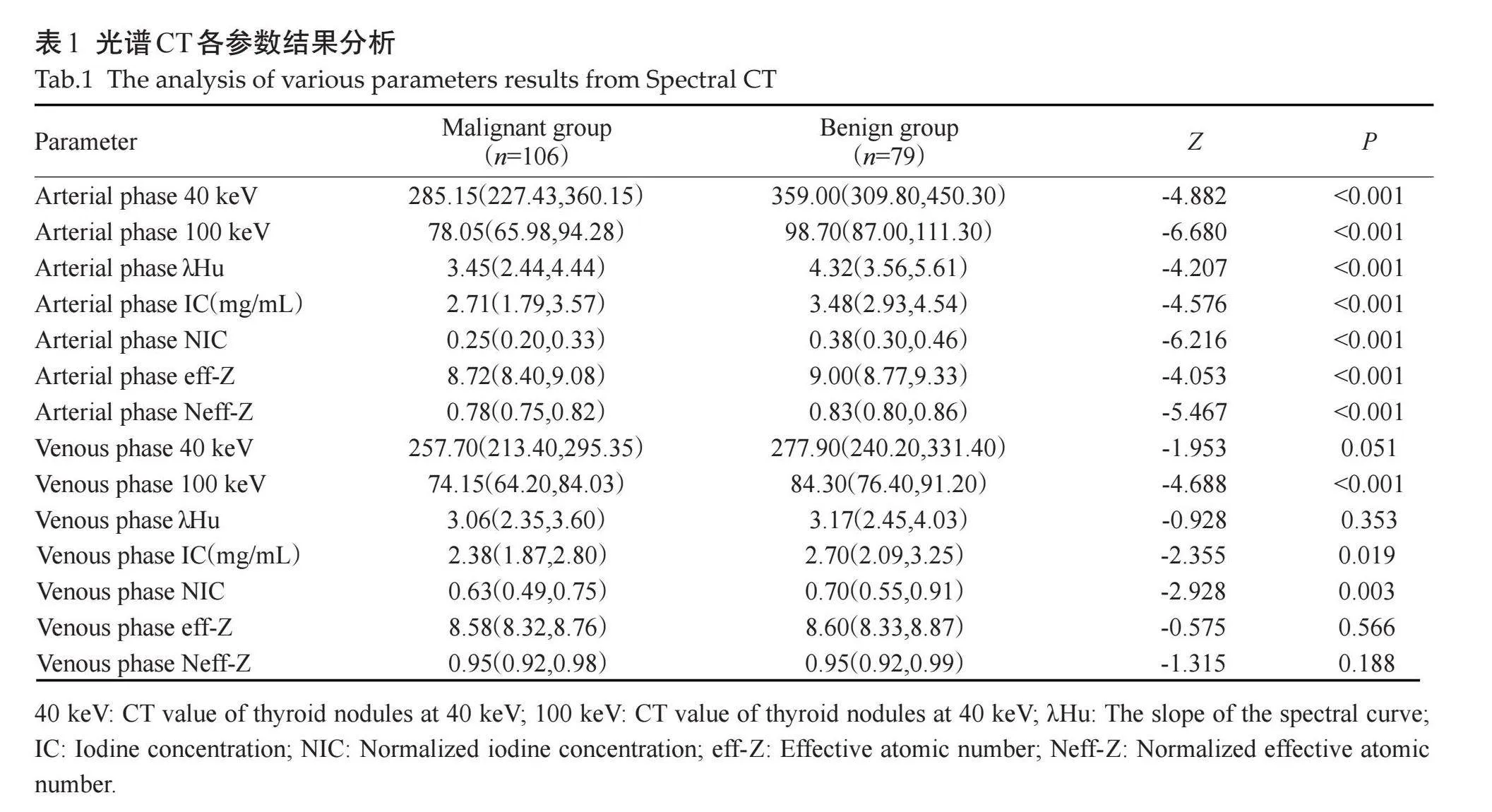
甲状腺良、恶性结节组动脉期40 keV、动脉期100 keV、动脉期λHu、动脉期IC、动脉期NIC、动脉期eff-Z、动脉期Neff-Z、静脉期100 keV、静脉期IC、静脉期NIC的差异有统计学意义(Plt;0.05,表1)。
2.2" 不同学习模型的预测效能评估
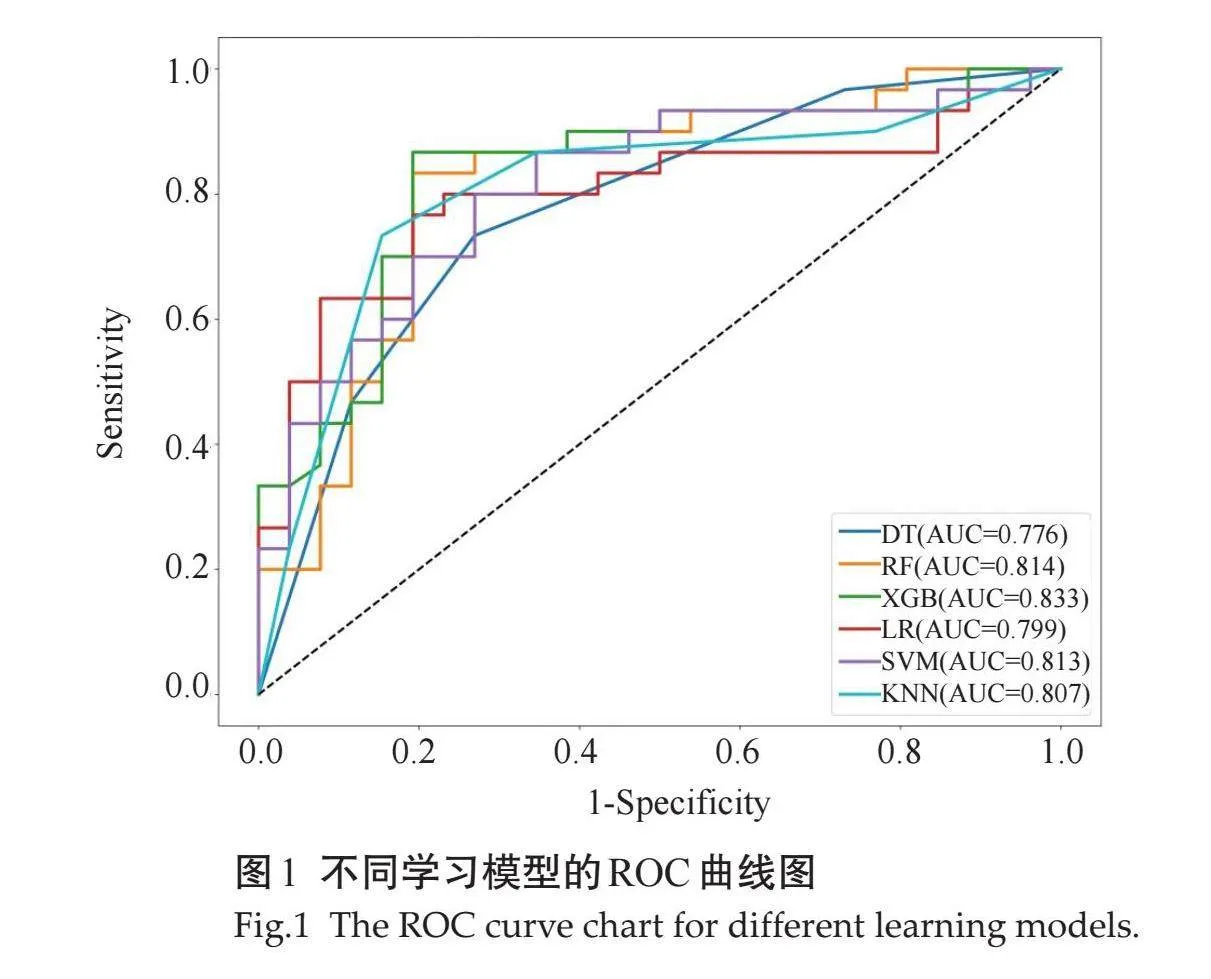
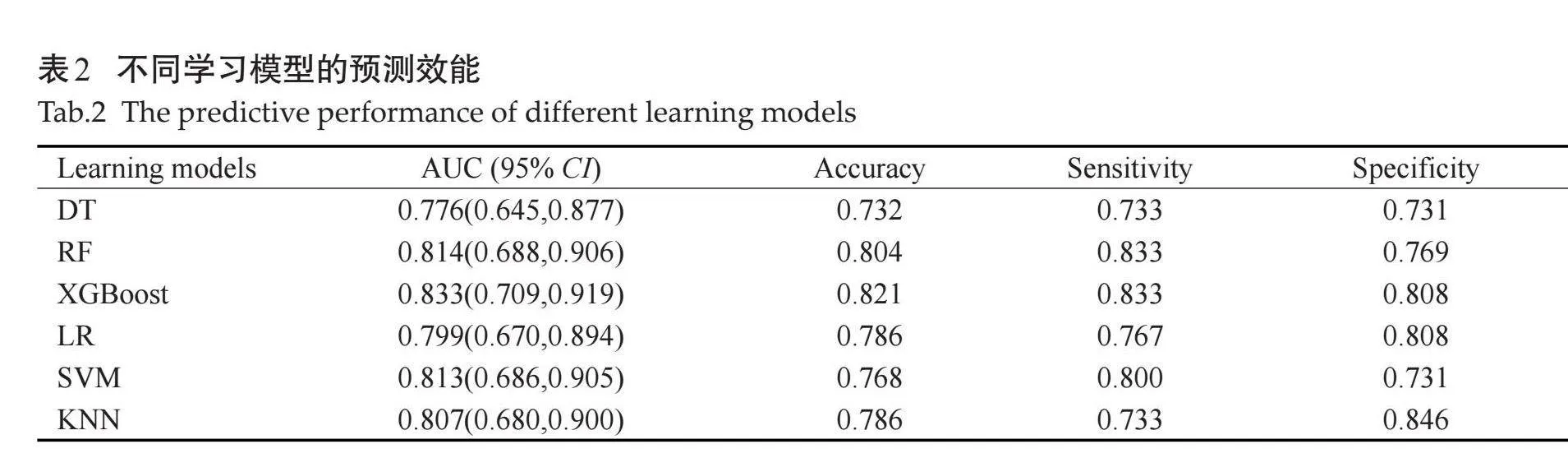
预测甲状腺良恶性结节各学习模型的效能,AUC值、准确度、敏感度、特异度均大于0.7,其中RF、XGBoost、SVM、KNN的AUC值均大于0.8。XGBoost学习模型的AUC值及准确度最高,略高于其他学习模型,且敏感度和特异度均大于0.8(表2、图1)。但XGBoost与其他学习模型差异无统计学意义。
2.3" 可解释性分析学习模型
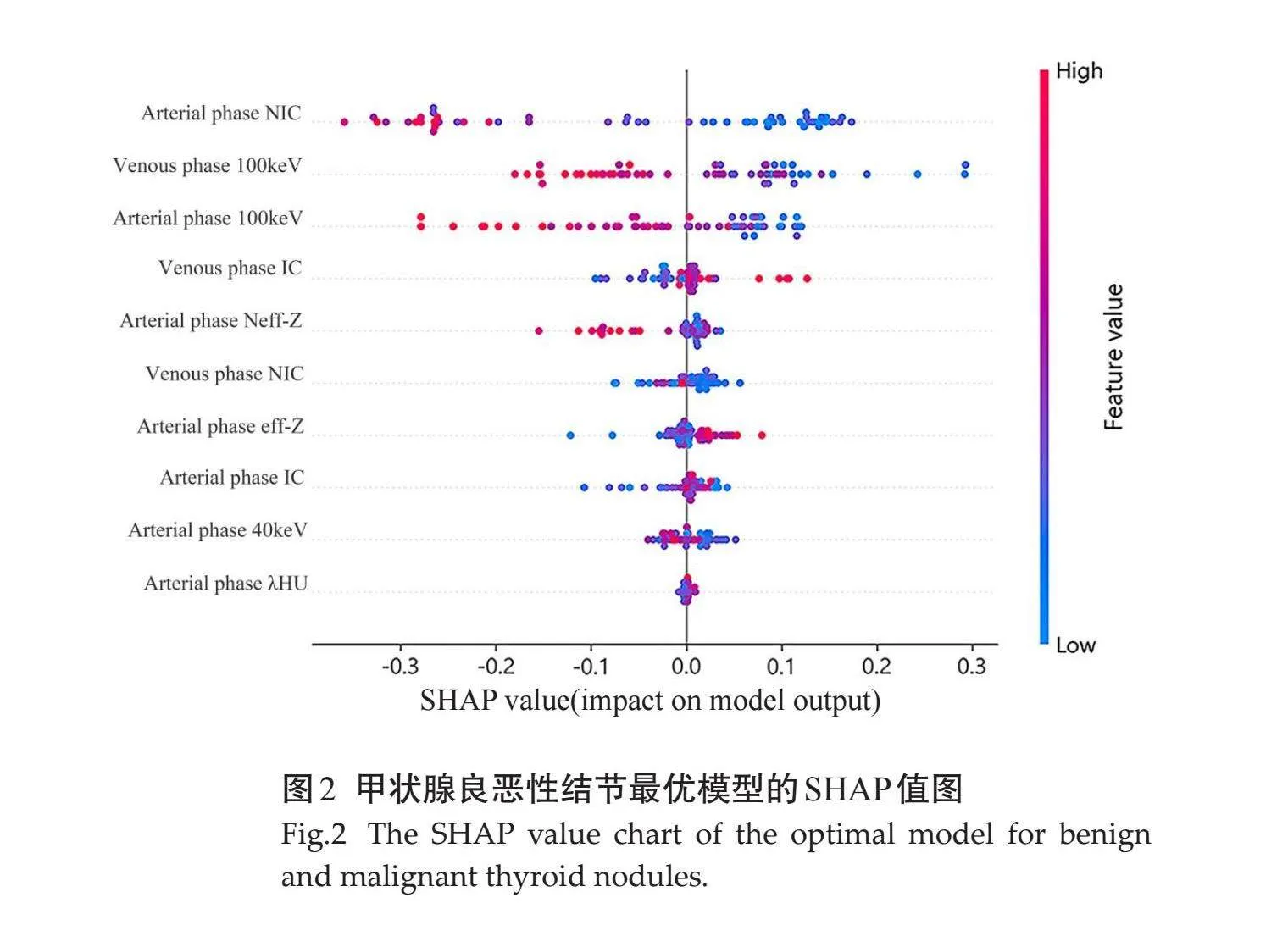
在预测甲状腺良恶性结节的最优模型XGBoost中加入可解释性技术SHAP值,可视化观察到学习模型的重要特征为动脉期NIC、静脉期100 keV的CT值、动脉期100 keV的CT值、静脉期IC、动脉期Neff-Z(图2)。
3" 讨论
甲状腺癌是较为常见的癌症之一,其中女性患者占据了绝大多数[4, 16]。目前超声检查仍是甲状腺的首选检查手段,但超声检查过度依赖于医生的临床经验,对颈部深部结构及胸骨后病灶存在盲点;FNA是一种有创检查方法,结果容易出现假阴性,患者存在二次穿刺的风险[17, 18]。甲状腺DLCT在这些方面比超声具有优势,利用物质成分分析及单能量图可以无创预测甲状腺结节及周围淋巴结情况[8, 9, 19],而且不易受结节的位置、钙化等影响,有助于临床进一步术前分期和优化手术方案。
本研究结果显示,甲状腺恶性结节在动、静脉期的碘含量明显低于良性结节,与既往研究[20, 21]结果一致。甲状腺是重要内分泌器官,其滤泡上皮细胞能够摄取并存储碘[22]。在恶性结节中,滤泡上皮细胞被纤维组织或癌细胞取代,摄取碘的能力显著降低甚至缺失。而良性的结节性甲状腺肿和腺瘤具有部分正常的滤泡结构和碘摄取能力。在DLCT检查中,IC可以通过碘基物质分解成像来测量单位体积内碘摄取量[23]。本研究对碘浓度值进行了标准化分析,排除了因为体循环的差异引起的误差,使得数据更为精确。部分研究结果显示,恶性结节IC在增强CT中高于良性结节[24],该研究假设甲状腺组织的IC反映了增强CT图像上的血供情况,这与本研究结果不同,可能是样本之间存在差异,当恶性结节血供增加引起病灶IC增加,可能部分抵消了甲状腺癌摄碘能力下降的因素,从而导致恶性结节IC增加。此外,DLCT扫描参数不同也可能是潜在误差的原因。
能谱曲线反映的是X射线透过人体内不同组织后衰减系数与单能量水平的关系[20, 24]。光谱CT单能级图像能够更有效发现微小病灶及其轮廓[24]。因此本研究中选用40 keV作为低能级图、100 keV作为高能级图来对甲状腺良恶性结节进行分析,结果显示恶性结节中动、静脉期100 keV能级图的病变CT值低于良性结节,与既往研究结果一致[25]。大多数物质能谱曲线为下降型,单能级水平越高,物质的CT值越小,曲线与物质的密度或碘摄取能力成正相关性。本研究结果显示动、静脉期100 keV病变CT值在预测甲状腺良恶性结节中有重要价值。
本研究通过对光谱CT多个定量参数筛选,以XGBoost、RF、SVM、KNN、DT及LR为分类器构建预测甲状腺良恶性结节模型。XGBoost预测精度高,处理速度快,能有效处理稀疏数据并减少过拟合风险,但它调参复杂,资源消耗大[26, 29]。RF准确性方面表现出色,能有效管理高维数据且易于解释,但在大数据集及高噪声情况下表现不佳,并且解释性会随树的数量增多而降低[30-31]。SVM在高维空间表现好,具有低泛化错误率和高未知数据预测准确性,但对大规模数据集处理效率低,且对缺失数据敏感[27, 30, 31]。KNN简单易实现,对于非线性数据有效,但对数据存储及计算复杂度要求高,对数据的局部结构非常敏感。DT易于解释,但容易过拟合,稳定性较差[30]。LR实施简单,结果易解释,但需要大量特征,对于大特征空间性能不佳,且在处理非线性问题上能力较弱[30]。研究结果显示,XGBoost模型的AUC值及准确度最高。通过SHAP值进一步分析XGBoost特征集得出动脉期NIC、静脉期100 keV的CT值、动脉期100 keV的CT值、静脉期IC、动脉期Neff-Z在预测甲状腺良恶性结节中有良好的诊断效能,其中尤以动脉期NIC效能最高。可能是因为甲状腺为摄碘储碘器官,当甲状腺发生病变时,良、恶性结节对甲状腺组织破坏程度不一,导致病变区域碘含量发生不同程度改变,增强动脉期NIC能更好地反映良恶性结节在这方面的差异。因此,动脉期NIC在XGBoost模型下预测甲状腺性质中有良好诊断效能。
尽管本研究创新地把光谱CT参数结合机器学习模型应用于甲状腺良恶性结节的鉴别,但也存在一定的局限性:首先,本研究是回顾性分析,需要更多外部验证队列来进一步验证我们的结果。其次,病例数相对较少,机器学习模型易出现过度拟合,今后应当扩充样本量并结合放射组学,以获得更好的预测结果。此外,DLCT检查时辐射暴露应当引起我们重视,未来还需要采用相应技术手段减少辐射剂量。
综上所述,本研究显示DLCT的多个定量参数可作为预测甲状腺良恶性结节的影像学指标,基于这些参数构建的XGBoost模型在鉴别良恶性方面具有良好的诊断效能,可作为鉴别甲状腺结节的一种方法,为临床进一步治疗提供更多可靠信息。
参考文献:
[1]" "Locati L, Cavalieri S, Dal Maso L, et al. Rare thyroid malignancies in Europe: data from the information network on rare cancers in Europe (RARECAREnet)[J]. Oral Oncol, 2020, 108: 104766.
[2]" "Colonna M, Uhry Z, Guizard AV, et al. Recent trends in incidence, geographical distribution, and survival of papillary thyroid cancer in France[J]. Cancer Epidemiol, 2015, 39(4): 511-8.
[3]" "Lim H, Devesa SS, Sosa JA, et al. Trends in thyroid cancer incidence and mortality in the United States, 1974-2013[J]. JAMA, 2017, 317(13): 1338-48.
[4]" "刘宗超, 李哲轩, 张" 阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-14.
[5]" "Haugen BR, Alexander EK, Bible KC, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133.
[6]" "Gharib H, Papini E, Garber JR, et al. American association of clinical endocrinologists, American college of endocrinology, and associazione medici endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: 2016 update[J]. Endocr Pract, 2016, 22(5): 622-39.
[7]" "Goundan PN, Mamou J, Rohrbach D, et al. A preliminary study of quantitative ultrasound for cancer‑risk assessment of thyroid nodules[J]. Front Endocrinol, 2021, 12: 627698.
[8]" "Forghani R. An update on advanced dual‑energy CT for head and neck cancer imaging[J]. Expert Rev Anticancer Ther, 2019, 19(7): 633-44.
[9]nbsp; "Sananmuang T, Agarwal M, Maleki F, et al. Dual energy computed tomography in head and neck imaging: pushing the envelope[J]. Neuroimaging Clin N Am, 2020, 30(3): 311-23.
[10] Hong YQ, Zhong LJ, Lv X, et al. Application of spectral CT in diagnosis, classification and prognostic monitoring of gastrointestinal cancers: progress, limitations and prospects[J]. Front Mol Biosci, 2023, 10: 1284549.
[11] Zou Y, Zheng MZ, Qi ZY, et al. Dual-energy computed tomography could reliably differentiate metastatic from non‑metastatic lymph nodes of less than 0.5 cm in patients with papillary thyroid carcinoma[J]. Quant Imaging Med Surg, 2021, 11(4): 1354-67.
[12] Li L, Cheng SN, Zhao YF, et al. Diagnostic accuracy of single-source dual‑energy computed tomography and ultrasonography for detection of lateral cervical lymph node metastases of papillary thyroid carcinoma[J]. J Thorac Dis, 2019, 11(12): 5032-41.
[13] Borges AP, Antunes C, Caseiro‑Alves F. Spectral CT: current liver applications[J]. Diagnostics, 2023, 13(10): 1673.
[14] Choy G, Khalilzadeh O, Michalski M, et al. Current applications and future impact of machine learning in radiology[J]. Radiology, 2018, 288(2): 318-28.
[15]" Albaradei S, Thafar M, Alsaedi A, et al. Machine learning and deep learning methods that use omics data for metastasis prediction[J]. Comput Struct Biotechnol J, 2021, 19: 5008-18.
[16] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[17] Zhou JQ, Yin LX, Wei X, et al. 2020 Chinese guidelines for ultrasound malignancy risk stratification of thyroid nodules: the C-TIRADS[J]. Endocrine, 2020, 70(2): 256-79.
[18] Baloch ZW, Asa SL, Barletta JA, et al. Overview of the 2022 WHO classification of thyroid neoplasms[J]. Endocr Pathol, 2022, 33(1): 27-63.
[19] Li L, Wang Y, Luo DH, et al. Diagnostic value of single-source dual-energy spectral computed tomography for papillary thyroid microcarcinomas[J]. J Xray Sci Technol, 2017, 25(5): 793-802.
[20] Yi RQ, Li T, Xie G, et al. Diagnosis of benign and malignant thyroid nodules by a dual‑layer spectral detector CT-based nomogram[J]. Front Oncol, 2023, 13: 1132817.
[21] Li F, Huang FL, Liu CM, et al. Parameters of dual‑energy CT for the differential diagnosis of thyroid nodules and the indirect prediction of lymph node metastasis in thyroid carcinoma: a retrospective diagnostic study[J]. Gland Surg, 2022, 11(5): 913-26.
[22] Dohán O, Baloch Z, Bánrévi Z, et al. RAPID COMMUNICATION: predominant intracellular overexpression of the Na+/I− symporter (NIS) in a large sampling of thyroid cancer cases[J]. J Clin Endocrinol Metab, 2001, 86(6): 2697-700.
[23] McCollough CH, Leng S, Yu LF, et al. Dual‑and multi-energy CT: principles, technical approaches, and clinical applications[J]. Radiology, 2015, 276(3): 637-53.
[24] Jiang LL, Liu DH, Long L, et al. Dual‑source dual‑energy computed tomography‑derived quantitative parameters combined with machine learning for the differential diagnosis of benign and malignant thyroid nodules[J]. Quant Imaging Med Surg, 2022, 12(2): 967-78.
[25] Li M, Zheng XP, Gao F, et al. Spectral CT imaging of intranodular hemorrhage in cases with challenging benign thyroid nodules[J]. Radiol Med, 2016, 121(4): 279-90.
[26]" 齐巧娜, 刘 艳, 陈霁晖, 等. 机器学习XGBoost算法在医学领域的应用研究进展[J]. 分子影像学杂志, 2021, 44(5): 856-62.
[27] Thomas J, Ledger GA, Mamillapalli CK. Use of artificial intelligence and machine learning for estimating malignancy risk of thyroid nodules[J]. Curr Opin Endocrinol Diabetes Obes, 2020, 27(5): 345-50.
[28] Luo XQ, Kang YX, Duan SB, et al. Machine learning‑based prediction of acute kidney injury following pediatric cardiac surgery: model development and validation study[J]. J Med Internet Res, 2023, 25: e41142.
[29] Chung H, Ko Y, Lee IS, et al. Prognostic artificial intelligence model to predict 5year survival at 1year after gastric cancer surgery based on nutrition and body morphometry[[J]. J Cachexia Sarcopenia Muscle, 2023, 14(2): 847-59.
[30] Dong JF, Xue Q, Chen T, et al. Machine learning approach to predict acute kidney injury after liver surgery[J]. World J Clin Cases, 2021, 9(36): 11255-64.
[31] Tseng PY, Chen YT, Wang CH, et al. Prediction of the development of acute kidney injury following cardiac surgery by machine learning[J]. Crit Care, 2020, 24(1): 478.
(编辑:林" 萍)
