基于MRI可视化有机小分子纳米探针IR-PEG-FA-Gd用于肝癌光热治疗研究
2024-10-30王雅飞高琴李科徐钰叶程梓荷潘奇
摘要:目的" 制备靶向肝癌的MRI纳米探针IR-PEG-FA-Gd(IPFG),评估其近红外光热转化性能,探讨其光热治疗肝癌的效果。方法" "用物理螯合法将Gd3+螯合至IR-PEG-FA纳米粒子中,制备靶向肝癌的MRI纳米探针IPFG;使用808 nm激光器监测其体内外光热升温性能;构建原位肝癌小鼠模型,利用IVIS成像和MRI监测IPFG光热治疗肝癌的效果。结果" 在808 nm激光照射下,IPFG溶液在4 min内温度可达87.3℃;皮下瘤模型中IPFG组3 min内瘤体温度达到48.0℃。即便覆盖3 mm鸡胸肉组织模拟生物环境,IPFG溶液仍能在4 min内升温至47.3℃;经光热治疗后,IPFG组肿瘤信号几乎消失,显著优于IPG组及对照组,且IPFG组MRI成像分辨率更高。结论" IPFG具有良好的近红外光热转换效能,其在肝癌光热治疗中展现出优异的MRI成像和光热治疗效果,为肝癌的精准治疗提供了新的策略。
关键词:肝癌;纳米探针;磁共振成像;光热治疗
Small molecule organic probe IR-PEG-FA-Gd for MRI-guided photothermal therapy of hepatocellular carcinoma
WANG Yafei1, GAO Qin2, LI Ke3, XU Yuye1, CHENG Zihe3, PAN Qi2
1The Second Clinical Medical College of Xi'an Medical College, Xi'an 710000, China; 2Department of Medical Imaging, The Second Affiliated Hospital, Xi'an Medical University, Xi'an 710038, China; 3Institute of Basic and Translational Medicine, Xi'an Medical College, Xi'an 710021, China
Abstract: Objective To prepare IR-PEG-FA-Gd (IPFG), an MRI nanoprobe targeting hepatocellular carcinoma, to evaluate its near-infrared photothermal conversion performance, and to explore its efficacy in photothermal therapy of hepatocellular carcinoma. Methods Gd3+ was chelated into IR-PEG-FA nanoparticles using the physical chelation method, and the MRI nanoprobe IPFG targeting hepatocellular carcinoma was prepared; the MRI nanoprobe IPFG targeting hepatocellular carcinoma was prepared; its ex vivo and in vivo photothermal heating performance was monitored using 808 nm lasers; the in situ hepatocellular carcinoma mouse model was constructed, and the effects of photothermal therapy treatment for hepatocellular carcinoma were monitored by using IVIS imaging and MRI to monitor the photothermal therapy treatment effect of IPFG for hepatocellular carcinoma. Results Under 808 nm laser irradiation, the temperature of IPFG solution could reach 87.3°C within 4 min; the tumor temperature of IPFG group reached 48.0°C within 3 min in the subcutaneous tumor model. Even when covered with 3 mm chicken breast tissue to simulate the biological environment, the IPFG solution could still warm up to 47.3°C within 4 min; after photothermal therapy treatment, the tumor signal almost disappeared in the IPFG group, which was significantly better than that in the IPG group and the control group, and the resolution of MRI imaging was higher in the IPFG group. Conclusion IPFG has good near-infrared photothermal conversion efficacy, and it demonstrates excellent MRI and photothermal treatment effects in liver cancer photothermal therapy, which provides a new strategy for precision treatment of liver cancer.
Keywords: liver cancer; nanoprobe; magnetic resonance imaging; photothermal therapy
原发性肝癌是全球第六大常见癌症[1] ,致死率居全球癌症第3位[2] ,其中肝细胞癌最常见但生存率极低[3, 4] 。由于肝癌早期诊断困难,晚期确诊导致高死亡率[5] 。目前临床上常用的治疗方法包括手术切除、肝脏移植、免疫治疗、靶向治疗及放化疗等[6] ,中晚期患者大多数采取手术切除与放化疗结合的综合治疗模式,但仍然存在靶向效果差、毒副作用强、术后易复发以及肝癌细胞耐药性等问题[7] 。因此,精准的诊疗是提高肝癌治愈率及改善患者生存质量的关键[8] 。
新型光热治疗(PTT)以其非侵入性、高选择性和副作用小的特点,为肝癌治疗提供了新的可能性。光热治疗通过注射具有高光热转换效率的光热剂,利用近红外辐射产生的热量来破坏肿瘤细胞[9-12]。既往研究报道了一种纳米探针在体内可以升温至41.0℃[13] ;有学者合成出h-PCuNF纳米探针,在近红外光照射下表现出一定的光热转换效率[14] 。这些无机纳米材料因其卓越的光热转换效率备受瞩目。然而,其生物相容性差、降解困难等局限性限制了其在肝癌光热治疗中的临床应用[15-17] 。相较于之下,有机小分子纳米探针具有结构清晰、易于调控、生物相容性良好等优势,在光热治疗肝癌中得以迅速发展[18-19] 。但其光热转化效率和成像分辨率的局限性仍亟待解决[20-22] 。如有研究报道了一种有机纳米探针在体外实验中展现了一定的光热效应,但其体内光热转化性能欠佳,影响治疗效果[23] ;另有研究的有机纳米探针虽实现了光热治疗与成像诊疗一体化,但其成像分辨率和对比度仍需进一步提升,不能满足临床需求[24] 。MRI的高分辨率成像技术能够清晰揭示肝癌的结构和病变。将MRI的诊断优势与光热治疗功能结合于有机纳米探针,可进一步清晰界定肝癌病灶边缘,为肝癌治疗提供新的视角。
基于此,本研究构建了一种兼具MRI造影和光热性能的简易靶向肝癌的纳米探针IR-PEG-FA-Gd(IPFG),监测其体外光热转化性能,验证其体内光热治疗效果,旨在探讨基于MRI可视化的有机小分子纳米探针IPFG在肝癌光热治疗中的应用,提高有机纳米探针的光热转化效率和成像清晰度,以期为肝癌的精准治疗提供新的策略。
1" 材料与方法
1.1" 试剂与仪器
本研究使用原始试剂,未行进一步纯化。IR-PEG-FA(IPF)由南华大学衡阳医学院分子影像探针实验室惠赠;DEME培养基和胰蛋白酶(Gibico);BEL-7402细胞系(美国典型培养物保藏中心);808 nm激光器(FLIR,E4-XT);IVIS成像仪(II 900/1700-H系列,苏州英瑞);0.5T核磁共振成像仪(MesoMR-00 H-I,上海纽美)。
1.2" 方法
1.2.1" MRI 靶向分子探针IPFG的构建" "在课题组前期研究[25] 的基础上,本研究采用了物理螯合法将Gd3+螯合至IPF纳米粒子中,成功构建了靶向肝癌的MRI纳米探针IPFG。具体的实验步骤如下:首先将IPF溶液(1 mg/mL)在700 r/min下搅拌3 h,以便与1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸进行自组装,然后使用1 k的透析膜对溶液进行12 h的透析。再使用0.1 mol/L的NaOH溶液调节溶液pH至7.0,并加入200 µLGdCl3溶液(10 mg/mL),在避光条件下震荡3 h。最后,将得到的溶液通过PD-10柱进行分离纯化,得到IPFG。其中IR-PEG-Gd(IPG)为对照探针。整个实验过程均需全程避光操作。
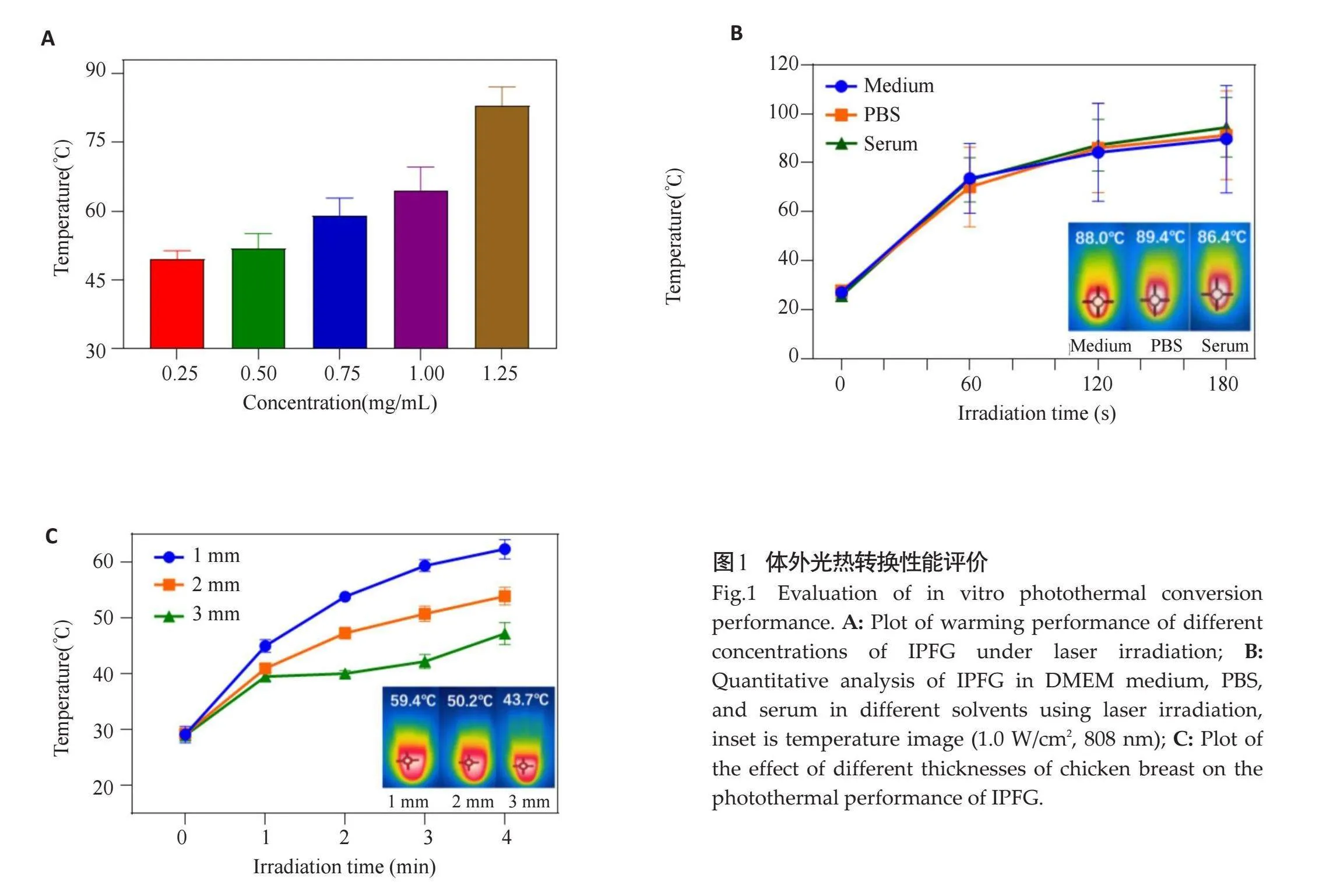
1.2.2" 体外光热性能评价" "光热转换性能评估:利用激光器件进行光热实验,使用808 nm激光器(1 W/cm2)辐照不同浓度的IPFG(1.25、1、0.75、0.5 mg/mL)纳米探针溶液,将100 μL上述不同浓度纳米溶液分别加入1.5 ml的ep管中,固定激光器高度为15 cm。连续激光照射纳米探针粒溶液直到其达到稳态温度,每组实验重复3次,记录每组4 min时刻温度。通过使用热成像相机记录温度变化来研究纳米探针的光热转化参数。
溶剂发热稳定性测试:将IPFG(1 mg/mL)分别分散于DEME培养基、PBS、血清3个溶剂中,将100 μL上述3种纳米溶液加入1.5 mL的ep管中,使用808 nm激光器(1 W/cm2)照射,每次间隔20 s记录温度,持续时间为3 min。通过使用热成像相机记录温度变化以此研究纳米探针的溶剂发热稳定性。
遮挡光热效果测试:用不同厚度(1、2、3 mm)的鸡胸肉来模拟生物组织,将100 μL的IPFG溶液(1.25 mg/mL)加入1.5 mL的ep管中,然后用不同深度的组织覆盖,用808 nm激光器(1 W/cm2)照射纳米溶液,红外热成像仪收集热图像,间隔20 s记录在808 nm激光照射下穿透生物组织后的温度变化,以此评估纳米探针的光热遮挡效果。
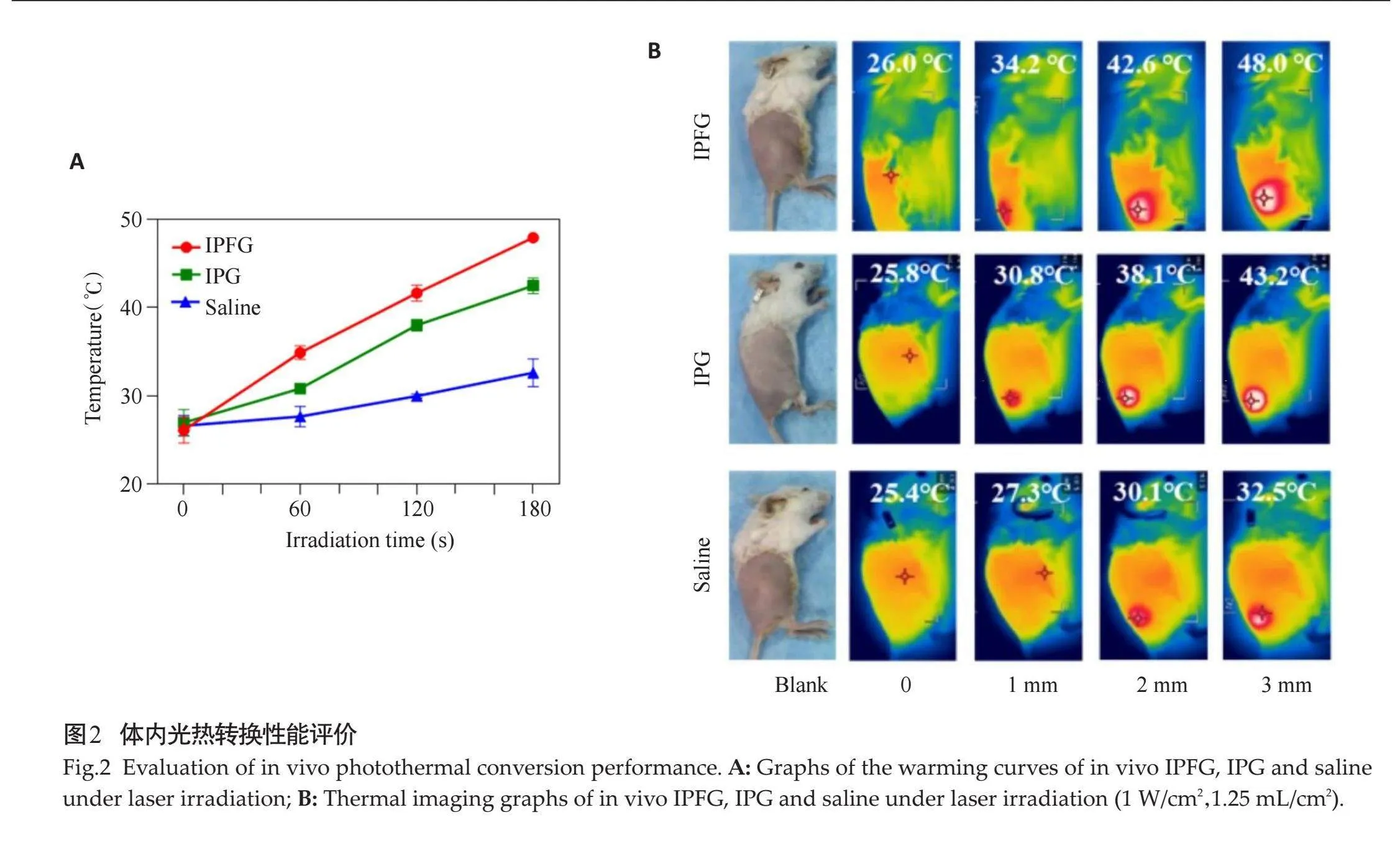
1.2.3" 体内光热性能评价" "准备6只BALB/c小鼠(20~25 g),随机分为3组,2只/组,3组小鼠单侧胯部皮下分别注射IPFG 、IPG和生理盐水溶液(1.25 mg/mL 100 μL)。将小鼠用异氟烷气体持续吸入麻醉,仰卧位固定于预先消毒的手术台面。固定808 nm激光器(1 W/cm2)高度为15 cm,激光器持续照射皮下瘤部位3 min,锡纸遮挡其他部位,每组实验用红外热成像仪间隔1min记录辐照小鼠皮下瘤的表面温度并收集热成像图,本研究动物实验经西安医学院第二附属医院医学伦理委员会批准(X2Y202418)。
1.2.4" 原位肝脏肿瘤模型的构建" "准备3只雄性BALB/C小鼠(4周,20~25 g)用于建立皮下瘤模型。在超净台中将BEL-7402细胞解冻然后离心,加入胎牛血清并接种。每只BALB/c小鼠的双胯部注射制备好的细胞悬液(150 μL/侧)。肿瘤体积(V)=(L×W2) /2,其中L为肿瘤长度,W为肿瘤宽度。小鼠双胯皮下瘤直径达到约1 cm时进行手术剥离,PBS洗涤,去除瘤体边缘其他组织,用刀片将瘤体切成约1 mm3,将完整切除下来的瘤块浸泡于DEME培养基中,放置于冰盒进行进一步研究[26] 。
准备15只雄性BALB/C小鼠(4周,20~25 g)用于建立原位肝癌模型。取出备好的瘤块,异氟烷气体将备皮小鼠进行持续吸入麻醉,仰卧位固定小鼠于消毒好的手术台。使用2%碘伏对小鼠腹部进行充分消毒,铺盖一次性洞巾,上到胸部,下至会阴部。于小鼠剑突右下侧1 cm处垂直开口,长度大约为1 cm,依次切开皮下组织和腹膜,同时观察小鼠腹腔有无出血,注意及时用棉签压迫止血;使用牵开器扩张开口,用无菌棉签将肝左叶轻柔推出,用刀片在肝左叶表面开口(长2~3 mm、深1~2 mm),将备好的新鲜瘤块组织植入开口中[27] ,电凝刀粘合肝脏上的开口,植入完成使用足量生理盐水冲洗小鼠腹腔。将腹膜和皮肤组织依次缝合,用2%碘伏充分消毒后,将小鼠置于干净的笼子中观察。每日用2%碘伏进行伤口消毒并给予高营养饲料。3 d后,通过IVIS和MRI成像检测小鼠体内的肝脏肿瘤信号。一旦发现肿瘤信号,就可将小鼠用于后续肝癌治疗实验。
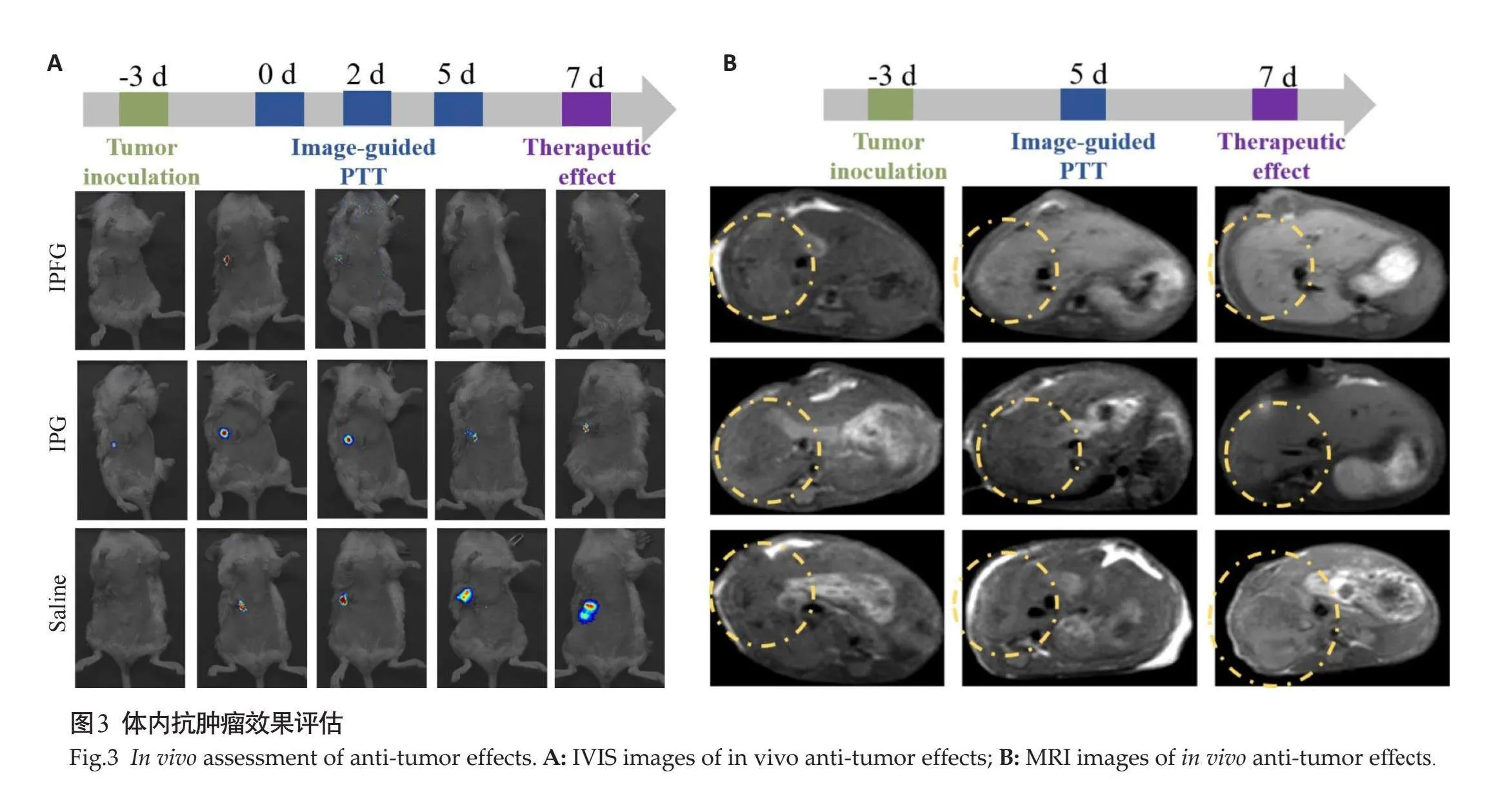
1.2.5" 体内肝癌治疗疗效测试" "将12只成功建模的原位肝癌小鼠随机分为3组:IPFG组、IPG组和对照组,4只/组。第4天开始对IPFG组和IPG组进行光热疗干预,每次光热治疗提前24 h对治疗组小鼠尾静脉注射纳米探针溶液(0.5 mg/mL 150 μL/只),光热治疗时将小鼠用异氟烷气体持续麻醉,仰卧位固定于预先消毒好的手术台面,IVIS成像确定肿瘤部位。固定808 nm激光器的高度为15 cm,间隔10 s照射肿瘤部位20 s,锡纸遮挡小鼠腹部其他部位防止灼伤,每只小鼠治疗持续3 min,使其肿瘤局部温度维持在48℃,治疗结束用0.2%碘伏对治疗部位消毒。对照组每次注射150 μL生理盐水不做光热疗干预,每天对3组小鼠进行IVIS和MRI成像,记录肿瘤信号大小。治疗7 d后处死小鼠。
2" 结果
2.1" 光热转化效果评价
光热转换性能评估结果显示,IPFG(1.25 mg/mL)4 min时刻温度达到87.3 ℃(图1A)。溶剂发热稳定性实验结果显示,在相同的辐照功率和时间长度下,IPFG(1.25 mg/mL)在DEME培养基、PBS、血清3个不同溶剂分散相中的温度分别可达88.0 ℃、89.4 ℃、86.4 ℃,红外热成像仪记录下各组的最大升温情况(图1B)。遮挡光热效果结果显示,IPFG溶液温度随鸡胸肉组织厚度的增加而逐渐降低;在相同浓度下(1.25 mg/mL),随照射时间增加,不同厚度组织(1、2、3 mm)覆盖下的IPFG溶液温度逐渐升高,经过激光器照射4 min后,1 mm、2 mm厚的组织覆盖下的IPFG溶液温度分别为59.4℃、50.2 ℃,即使被3 mm厚的组织覆盖,IPFG的温度仍能达到47.3 ℃(图1C)。
体内光热性能评价结果显示,随着时间的推移,IPFG和IPG组小鼠皮下瘤温度均上升,IPFG组升温速度和幅度均显著超过IPG组(图2A);间隔1 min记录下IPFG组皮下瘤温度分别为34.2℃、42.6℃、48.0℃;在808 nm激光器的辐照下,红外热成像仪记录下皮下瘤所在部位温度,体内IPFG和IPG(1.25 mg/mL)的温度随时间变化明显上升,对照组升温平缓,在3 min时刻,3组皮下瘤所在部位温度分别为48.0℃、43.2℃、32.5℃(图2B)。
2.2" 光热治疗效果评估
IPFG、IPG、Saline 3组小鼠未经光热治疗前,其肿瘤信号强度无明显差异;治疗后第5天成像结果显示,IPFG组和IPG组的肿瘤信号均出现明显下降趋势,其中IPFG组的肿瘤信号下降显著,几乎无明显信号出现。治疗第7天监测到IPFG组的肿瘤信号依然保持在较低水平,未见明显回升;而IPG组的肿瘤信号有所下降,但相比IPFG组仍存在一定的信号强度,对照组的肿瘤信号则持续增大,并出现了转移趋势。IPFG组相较IPG组中,肿瘤边界清晰可见(图3B)。
3" 讨论
光热治疗作为一种新型的肝癌治疗手段,选择性能优异的光热剂对于提升光热治疗的效果至关重要。传统光热剂面临一系列的问题,其中金、铜等贵金属类纳米光热剂存在吸收波长容改变[28-29] 、光热转换效率低、生物相容性差等缺点;碳基光热剂虽光热转换性能稳定,但其制备工艺复杂且容易在体内残留,不利于临床转换[30-31] 。因此,本研究制备了一种兼具MRI造影和光热性能的靶向肝癌的纳米探针IPFG,通过引入Gd3+,改善纳米探针内部电子传递效率,使其在近红外光照射条件下更迅速、高效的产生热量;另外,通过Gd3+的造影作用,进一步提高成像对比度和清晰度[31] 。通过体外与体内实验,系统评估了新型光热剂IPFG在肝癌光热治疗中的光热转换性能、抗肝癌潜能及MRI成像效果。体外实验中IPFG溶液显示出快速的升温速度和较大的升温幅度。体内实验结果显示,IPFG在小鼠皮下3 min时刻温度可以达到48.0 ℃,这一温度足以杀灭肝癌细胞。进一步的体内MRI成像和抗肝癌效果测试实验结果显示,经过1周的治疗,IPFG组小鼠肿瘤信号明显减小甚至消失,而对照组小鼠的肿瘤信号持续增大并且转移。在深入探究IPFG在光热治疗领域的应用潜力时,研究发现其体内外光热转换性能在相同实验条件下显著超越已有研究中的纳米探针。有研究报道的h-PCuNF(2 mg/mL 500 μL)[14] 和MnO2@Cur(2 mg/mL 500 μL)[32] ,经过4 min激光照射(808 nm 1 W/cm2)其温度分别为52.0℃、57.2℃,与这些纳米探针相比,当IPFG暴露于相同功率波长、时间的近红外光辐射下,其独特的光热响应表现引人注目。IPFG(1.25 mg/mL 100 μL) 经过辐射后其温度迅速升至87.3℃,远高于H-PCuNF和MnO2@Cur的升温效果,直接反映了IPFG在光热转换方面的卓越性能。另有研究显示,Au‑TTF‑1(0.3 mg/mL 200 μL)经10 min激光照射(808 nm 1 W/cm2)后小鼠皮下瘤温度为53.4℃[33] ,FeSe2-PDA NPs(20 mg/mL 20 μL)经5 min激光照射(808 nm 1 W/cm2)后其温度为56.3℃[34] ,而IPFG(1.25 mg/mL、100 μL)在3 min内能迅速升温至48.0℃,该温度不仅能有效杀死肿瘤细胞,还能减少对毗邻正常组织的潜在热损伤,从而提升了肝癌光热治疗中安全性和有效性。其他几种纳米探针光热治疗的温度达到50℃以上,其高温引发的热扩散对肿瘤周围正常组织造成一定损伤。另外,IPFG还具备良好的MRI成像性能,能够引导肝癌的精准定位和激光器的准确照射,进一步降低对正常组织的损伤以实现精准的诊疗,有望为肝癌的MRI可视化光热治疗提供新的策略。
综上,本文成功制备了靶向肝癌的有机小分子MRI纳米探针IPFG,探讨了其在肝癌光热治疗领域取得的进展。IPFG以其卓越的光热转化效率和成像性能,为肝癌光热治疗提供了高效且精准的治疗手段,这一研究成果不仅为肝癌光热治疗提供了新的策略,也为光热剂的研究和发展提供了新的思路。
参考文献:
[1]" "Siddiqui MA, Siddiqui HH, Mishra A, et al. Epidemiology of hepatocellular carcinoma[J]. Int J Pharm Sci Res, 2018, 9(12): 5050-9.
[2]" "Aquina CT, Eskander MF, Pawlik TM. Liver-directed treatment options following liver tumor recurrence: a review of the literature[J]. Front Oncol, 2022, 12: 832405.
[3]" "Zhou J, Sun HC, Wang Z, et al. Guidelines for the diagnosis and treatment of hepatocellular carcinoma (2019 edition)[J]. Liver Cancer, 2020, 9(6): 682-720.
[4]" "Zheng RS, Qu CF, Zhang SW, et al. Liver cancer incidence and mortality in China: temporal trends and projections to 2030[J]. Chung Kuo Yen Cheng Yen Chiu, 2018, 30(6): 571-9.
[5]" Huang DQ, Singal AG, Kono Y, et al. Changing global epidemiology of liver cancer from 2010 to 2019: NASH is the fastest growing cause of liver cancer[J]. Cell Metab, 2022, 34(7): 969-77.e2.
[6]" "Zeng ZM, Mo N, Zeng J, et al. Advances in postoperative adjuvant therapy for primary liver cancer[J]. World J Gastrointest Oncol, 2022, 14(9): 1604-21.
[7]" "Braunwarth E, Schullian P, Kummann M, et al. Aggressive local treatment for recurrent intrahepatic cholangiocarcinoma-Stereotactic radiofrequency ablation as a valuable addition to hepatic resection[J]. PLoS One, 2022, 17(1): e0261136.
[8]" "Ito T, Nguyen MH. Perspectives on the underlying etiology of HCC and its effects on treatment outcomes[J]. J Hepatocell Carcinoma, 2023, 10: 413-28.
[9]" Han HS, Choi KY. Advances in nanomaterial-mediated photothermal cancer therapies: toward clinical applications[J]. Biomedicines, 2021, 9(3): 305.
[10] Kumari S, Sharma N, Sahi SV. Advances in cancer therapeutics: conventional thermal therapy to nanotechnology-based photothermal therapy[J]. Pharmaceutics, 2021, 13(8): 1174.
[11]" Jiang ZY, Zhang CL, Wang XQ, et al. A borondifluoride-complex-based photothermal agent with an 80 % photothermal conversion efficiency for photothermal therapy in the NIR‑II window[J]. Angew Chem Int Ed, 2021, 60(41): 22376-84.
[12]" Zhang YG, Zhang SY, Zhang ZH, et al. Recent progress on NIR-II photothermal therapy[J]. Front Chem, 2021, 9: 728066.
[13]Qi F, Liu RZ. Tumor-targeted and biocompatible MoSe2 Nanodots@Albumin nanospheres as a dual-modality therapy agent for synergistic photothermal radiotherapy[J]. Nanoscale Res Lett, 2019, 14(1): 67.
[14]" 陈耀东, 任家仪, 曹静玮, 等. 近红外光响应性纳米颗粒h-PCuNF介导多模态疗法治疗恶性肿瘤[J]. 中国组织工程研究, 2025, 29(4): 780-8.
[15]" Li JQ, Zhu FK, Lou KL, et al. Tumor microenvironment enhanced NIR II fluorescence imaging for tumor precise surgery navigation via tetrasulfide mesoporous silica-coated Nd‑based rare‑earth nanocrystals[J]. Mater Today Bio, 2022, 16: 100397.
[16]Ge JY, Cai WW, Niu N, et al. Viscosity‑responsive NIR-II fluorescent probe with aggregation-induced emission features for early diagnosis of liver injury[J]. Biomaterials, 2023, 300: 122190.
[17]" Wang SL, Luo YN, Tian JN, et al. A mart-responsive photoacoustic sensor based on metal-organic framework as bioreactor for in situ visualization of hydrogen sulfide and tracking of drug‑induced liver injury by NIR-II imaging[J]. Sens Actuat B Chem, 2024, 408: 135561.
[18]" Vankayala R, Hwang KC. Near‑infrared‑light‑activatable nanomaterial‑mediated phototheranostic nanomedicines: an emerging paradigm for cancer treatment[J]. Adv Mater, 2018, 30(23): e1706320.
[19]" Peng T, He YJ, Wang T, et al. Discovery of a novel small-molecule inhibitor disrupting TRBP-dicer interaction against hepatocellular carcinoma via the modulation of microRNA biogenesis[J]. J Med Chem, 2022, 65(16): 11010-33.
[20]" Li CL, Liu C, Fan YF, et al. Recent development of near-infrared photoacoustic probes based on small-molecule organic dye[J]. RSC Chem Biol, 2021, 2(3): 743-58.
[21] Li ZK, Wang CY, Chen JR, et al. uPAR targeted phototheranostic metal‑organic framework nanoprobes for MR/NIR‑II imaging-guided therapy and surgical resection of glioblastoma[J]. Mater Des, 2021, 198: 109386.
[22] Yang C, Wang K, Li ZH, et al. A two‑photon metal-organic framework nanoprobe with catalytic hairpin assembly for amplified microRNA imaging in living cells and tissues[J]. Sens Actuat B Chem, 2022, 359: 131593.
[23] Ding ZL, Gu YH, Zheng C, et al. Organic small molecule‑based photothermal agents for cancer therapy: design strategies from single-molecule optimization to synergistic enhancement[J]. Coord Chem Rev, 2022, 464: 214564.
[24]Dong LN, Zhang XL, Cai LL, et al. Targeted MRI and chemotherapy of ovarian cancer with clinic available nano‑drug based nanoprobe[J]. Biomedecine Pharmacother, 2020, 130: 110585.
[25]" Pan Q, Li K, Kang XQ, et al. Rational design of NIR-II molecule-engineered nanoplatform for preoperative downstaging and imaging-guided surgery of orthotopic hepatic tumor[J]. J Nanobiotechnology, 2023, 21(1): 489.
[26]" 潘" 蕊, 喻" 锟, 张海亮, 等. 不同方法建立小鼠肝癌原位移植瘤模型差异性的探讨[J]. 中国实验动物学报, 2024, 32(3): 329-36.
[27] Li J, Wang X, Ren MD, et al. Advances in experimental animal models of hepatocellular carcinoma[J]. Cancer Med, 2023, 12(14): 15261-76.
[28] Nasseri B, Turk M, Kosemehmetoglu K, et al. The pimpled gold nanosphere: a superior candidate for plasmonic photothermal therapy[J]. Int J Nanomedicine, 2020, 15: 2903-20.
[29]" Fernandes N, Rodrigues CF, Moreira AF, et al. Overview of the application of inorganic nanomaterials in cancer photothermal therapy[J]. Biomater Sci, 2020, 8(11): 2990-3020.
[30] Fan XX, Li YR, Feng Z, et al. Nanoprobes-assisted multichannel NIR-II fluorescence imaging‑guided resection and photothermal ablation of lymph nodes[J]. Adv Sci, 2021, 8(9): 2003972.
[31] Ren Y, He SQ, Huttad L, et al. An NIR-II/MR dual modal nanoprobe for liver cancer imaging[J]. Nanoscale, 2020, 12(21): 11510-7.
[32]" 张停琳, 吴丽丽, 王" 雨, 等. 负载MnO2纳米颗粒的可得然复合水凝胶的构建及其联合光热疗法对黑色素瘤B16-F10细胞的杀伤效果[J]. 中国肿瘤生物治疗杂志, 2023, 30(8): 656-64.
[33]" Yang Z, Zhang YJ, Tang L, et al. \"All in one\" nanoprobe Au-TTF-1 for target FL/CT bioimaging, machine learning technology and imaging‑guided photothermal therapy against lung adenocarcinoma[J]. J Nanobiotechnology, 2024, 22(1): 22.
[34]" 田" 耕, 孙文博, 逯乐慧. 聚多巴胺修饰的二硒化铁纳米粒子用于磁共振成像指导的肿瘤光热治疗[J]. 分析化学, 2023, 51(5): 833-41.
(编辑:郎" 朗)
