基于MRI影像组学对评估术前直肠癌周边纤维脂肪组织浸润的应用价值
2024-10-30张冉汤永祥翟建苏昭然李石坚张金平
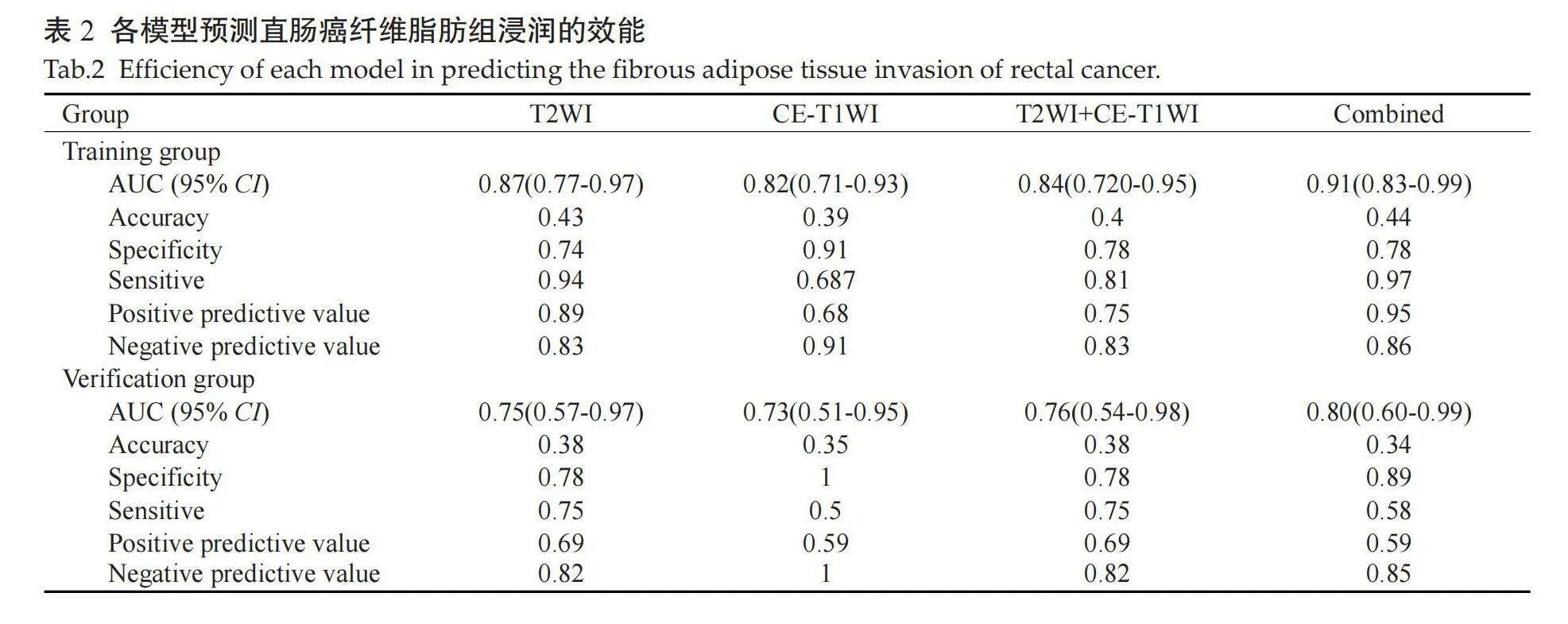
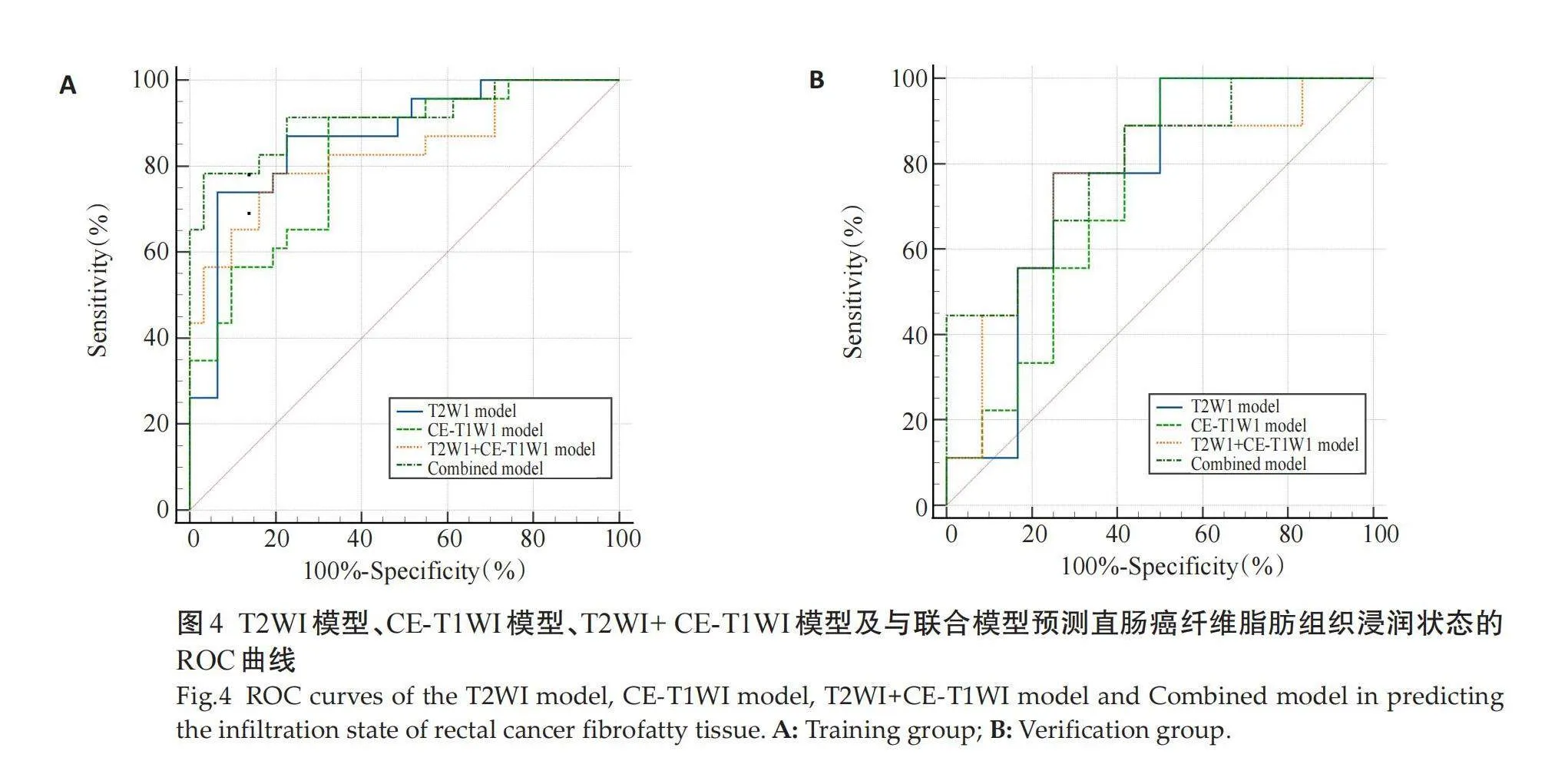
摘要:目的" 评估基于MRI影像组学模型对术前直肠癌周边纤维脂肪组织浸润的应用价值。方法" 回顾性分析2019年12月~2022年3月于铜陵市人民医院术后经病理证实直肠癌75例患者术前MRI图像资料,根据病理结果分为纤维脂肪组织浸润组(n=33)及纤维脂肪组织未浸润组(n=42)。基于T2WI及动脉期对比增强T1WI(CE-T1WI)提取影像组学特征,将数据按照7:3的比例分为训练组(n=54)与验证组(n=21),采用最大相关最小冗余和最小绝对收缩和选择算子回归的方法对训练集数据进行特征降维,并将特征降维后作为特征向量,筛选出最佳的影像组学特征,构建出T2WI模型、CE-T1WI模型及T2WI+CE-T1WI模型3种影像组学模型,根据ROC曲线确定其中最优模型;根据肿瘤上下径、肿瘤最厚径、CE-T1WI相对信号强度比值(RCE-T1WI)、T2WI相对信号强度比值(RT2)、DWI相对信号强度比值(RDWI)及ADC值多因素Logistic回归分析构建出联合模型;评估最优模型与联合模型二者效能及临床效益。结果 基于T2WI和CE-T1W1各提取851个影像组学特征,最终分别获得10个和14个最佳特征,用于构建T2WI+CE-T1WI模型。基于T2WI模型、CE-T1W1模型及T2WI+CE-T1WI模型在训练组中对判定直肠癌周边纤维脂肪组织浸润的AUC分别为0.87(95% CI:0.75~0.95)、0.82(95% CI:0.70~0.91)和0.84(95% CI:0.71~0.92),在验证组中分别为0.76(95% CI:0.53~0.92)、0.73(95% CI:0.50~0.90)和0.76(95% CI:0.52~0.92)。采用联合模型在训练组中对直肠癌纤维脂肪组织浸润的AUC为0.91(95% CI:0.80~0.97),在验证组中AUC为0.80(95% CII:0.57~0.94)。决策曲线分析提示,阈值取0~1时,联合模型的净收益高于T2WI模型。结论 基于MRI影像组学的联合模型对评估术前直肠癌周边纤维脂肪组织浸润的效能较高。
关键词:直肠癌;磁共振成像;影像组学;纤维脂肪组织浸润
Application value of fibrous adipose tissue infiltration in rectal cancer using MRI-based radiomics
ZHANG Ran1, TANG Yongxiang1, ZHAI Jian2, SU Zhaoran3, LI Shijian1, ZHANG Jinping1
1Medical Image Center, 3Department of Gastrointestinal Surgery, The People's Hospital of Tongling City, Tongling 244000, China; 2Medical Image Center, Yijishan Hospital of Wannan Medical College, Wuhu 241001, China
Abstract: Objective To evaluate the value of preoperative prediction of fibrous adipose tissue infiltration around rectal cancer using MRI-based radiomics. Methods The preoperative MRI of 75 patients with rectal cancer confirmed by pathology in The People's Hospital of Tongling City from December 2019 to March 2022 were analyzed retrospectively. According to the pathological results, the patients were divided into two groups: the fibrous adipose tissue infiltration group (n=33) and the fibrous adipose tissue noninfiltration group (n=42). The image group features for T2WI and arterial phase contrast-enhanced T1-weighted imaging (CE-T1WI) were extracted. The data were divided into a training group (n=54) and a verification group (n=21) at a ratio of 7:3. The training set data were reduced by maximum correlation minimum redundancy and LASSO regression, and feature dimension reduction was used to select the optimal imaging features. Three image group models (T2WI model, CE-T1WI model, T2WI+CE-T1WI model) were constructed. The best model had been selected in the three models. Based on the ROC curves and multivariate Logistic regression analysis in accordance with such parameters as upper and lower diameter of tumour, thickest diameter of tumour, unsmoothed edges, blurred boundary, CE-T1WI relative signal intensity (RCE-T1WI), T2WI relative signal intensity (RT2), DWI relative signal intensity (RDWI) and ADC, a combined model was constructed, and its predictive efficiency and clinical benefits were evaluated. Results In total, 851 imaging features were extracted from T2WI and CE-T1WI, and 10 and 14 optimal features were obtained, respectively, which were used to construct the combined model. In the training group, the AUC for the T2WI model, CE-T1WI model and T2WI+CE-T1WI model for predicting fibrous adipose tissue infiltration around rectal cancer were 0.87 (95% CI: 0.75-0.95), 0.82 (95% CI: 0.70-0.91) and 0.84 (95% CI: 0.71-0.92), respectively. In the verification group, the AUC were 0.76 (95% CI: 0.53-0.92), 0.73 (95% CI: 0.50-0.90) and 0.76 (95% CI: 0.52-0.92), respectively. The T2WI modle was the best model. For the combined model, the AUC for predicting fibrous adipose tissue infiltration of rectal cancer was 0.91 (95% CI: 0.80-0.97) in the training group and 0.80 (95% CI: 0.57-0.94) in the verification group. Decision curve analysis suggested that when the threshold was 0:1, the net return of combined model was higher than that of the T2WI model. Conclusion The combined model of MRI-based radiomics is effective in inevaluateing the preoperative of fibrous adipose tissue infiltration in rectal cancer.
Keywords:rectal cancer; magnetic resonance imaging; radiomics; fibrous adipose tissue infiltration
收稿日期:2023-10-27
基金项目:铜陵市卫生健康委医学科研项目(2021029)
作者简介:张" 冉,硕士,主治医师,E-mail: wtlzxr@163.com
通信作者:张金平,主任医师,E-mail: zjpmri@163.com
直肠癌是目前消化道常见恶性肿瘤,其发病率和病死率在我国各种恶性肿瘤中位居前列,并且有进位的趋势[1-3]。当直肠癌肿瘤细胞还未突破浆膜层/外膜层时,临床治疗以手术方案为主,但当肿瘤细胞突破浆膜层/外膜层向周边纤维脂肪组织浸润,即达到T3期或T3期以上时,临床上需要先进行新辅助化疗,再经临床综合评估来决定下一步可否进行手术,以减低治疗后患者的复发率,因此,直肠癌术前对于T3期准确评估十分重要,同时也是挑战[4-5]。
多年来,MRI作为直肠癌的常规检查技术,作为临床治疗前进行肿瘤分期的重要检查手段,通过MRI评估直肠癌周边纤维脂肪组织浸润对于直肠癌治疗方案选择和预后均具有重要意义[6-7];目前影像组学对直肠癌诊断及诊疗评估应用广泛,在术前预测直肠癌T分期、预测放化疗后直肠癌的完全缓解及预测局部晚期直肠癌患者的生存期,显示出非常大的优势[8-10]。但是,MRI影像组学对于直肠癌术前T2期与T3期的鉴别仍然存在着困难[11]。本研究旨在探讨通过MRI影像组学模型预测术前直肠癌周边纤维脂肪组织浸润,以解决临床在此分期中的困难,为临床个体化治疗提供更多参考。
1" 资料与方法
1.1" 一般资料
本研究已通过铜陵市人民医院医学伦理委员会批准同意(审批号:2023006),免除受试者知情同意。回顾性纳入2019年12月~2022年3月铜陵市人民医院收治的75例直肠癌患者为研究对象,其中男44例,女31例,年龄28~76(60.2±12.3)岁,并根据病理结果将其分为直肠癌周边纤维脂肪组织浸润(n=33)和纤维脂肪组织未浸润(n=42)。纳入标准:直肠癌接受手术后病理证实;术前接受直肠MRI平扫+增强检查,未接受抗肿瘤治疗。排除标准:MR图像质量不佳,无法准确勾画病灶ROI;患有其他恶性肿瘤疾病及治疗史;临床及影像学资料不完整。
1.2" 仪器与方法
采用Philips Achieva 3.0T超导型磁共振,16通道体表相控体表阵列线圈,扫描范围整个盆腔,先行常规MR扫描(T1WI轴位、T2WI轴位及矢状位),后行扩散加权成像(DWI)轴位扫描,扫描层面与轴位T2WI保持一致。DWI扫描参数:b值=1000 s/mm2,TR 6000 ms,TE 64 ms,FOV 300 mm×400 mm,矩阵136×180,NSA=2,层数24层,层厚6 mm,层间距1 mm。CE-T1WI以2 mL/s流率注射钆双胺对比剂(0.1 mmol/kg体质量)后行增强扫描,参数同T1WI。
1.3" 图像分析及处理
常规MRI特征:在冠状或矢状面测肿瘤的上下径,测量横轴面T2WI上肿瘤的最厚径,以病灶强化为界;形态是指肿瘤边缘有无显著不规则分叶状变化;边界包括肿瘤与邻近组织之间有无明显的分界。分别于横轴位对比剂对比增强T1WI、T2WI及DWI上勾画病变内部以及相邻正常臀大肌肌肉组织兴趣区(ROI)处,测定病灶及正常肌肉组织信号强度,全部ROI外形、大小一致,且面积均≥10 mm2;病灶ROI摆放时,应尽量避免肿瘤出血、坏死和囊变区。每处测量均各测3次,取平均值。分别统计病灶在T2WI、CE-T1WI及DWI中信号强度与正常肌肉信号强度的比值即相对信号强度,分别获得直肠癌病灶的CE-T1WI相对信号强度(RCE-T1WI)、T2WI相对信号强度(RT2)、DWI相对信号强度(RDWI);另从表观扩散系数(ADC)图中获取病灶的ADC值。
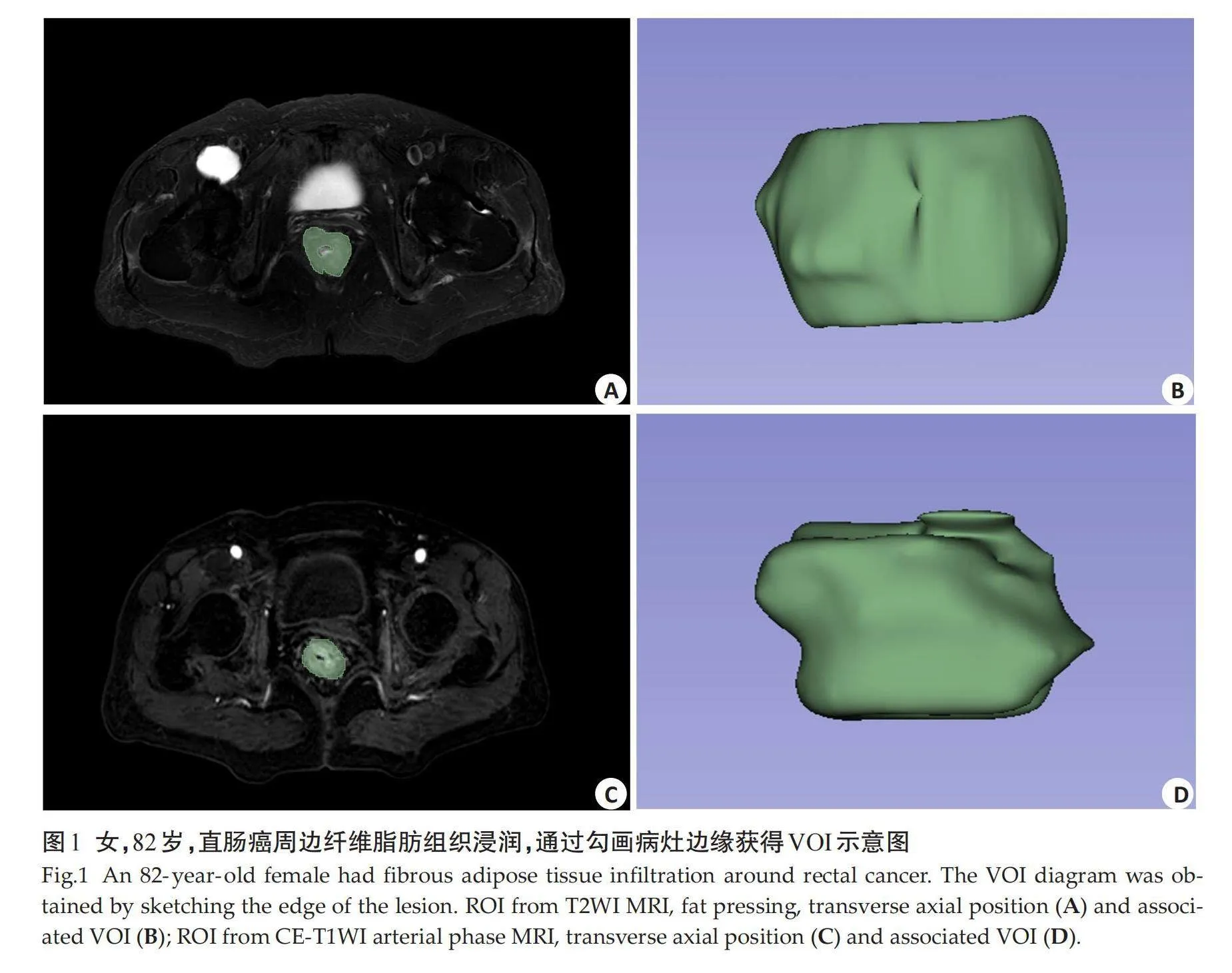
将轴位T2WI及CE-T1WI的DICOM格式导入3D-slicer软件,由1位主治医师与1位副主任医师进行阅片后共同讨论后确定瘤体边界,随后沿病灶边缘逐层手动勾画病灶的ROI,要求避开周边血管及肿大淋巴结,同时为避免容积效应影响,需要舍弃病灶上下显示不完整层面,3D-slicer软件自动生成瘤体的体积感兴趣区(VOI)(图1)。采用通过3D-slicer软件的radiomics插件提取影像组学特征,通过原始图像及小波变换滤波器之后提取影像特征,包含形态特征、一阶特征值、灰度依赖矩阵、灰度共生矩阵、灰度游程矩阵及灰度区域大小矩阵等特征。
采用组内相关系数(ICC)来评价2位医师所提取的影像组学特征的一致性,保持一致性良好的(ICCgt;0.80)特性。基于T2WI及CE-T1WI序列提取影像组学特征,将数据按照7:3的比例划分为训练组与验证组, 采用最大相关最小冗余(mRMR)和最小绝对收缩和选择算子(LASSO)回归的方法对训练集数据进行特征降维,并将特征降维后作为特征向量,筛选出最佳的影像组学特征,构建出T2WI模型、CE-T1WI模型和T2WI+CE-T1WI模型3种影像组学模型;根据肿瘤上下径、肿瘤最厚径、RCE-T1WI、RT2、RDWI及ADC值多因素Logistic回归分析构建出联合模型。
1.4" 统计学分析
采用SPSS26.0、MedCalc20.0和R4.2软件对数据进行统计学分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;不符合正态分布的数据以中位数(上下四分位数)表示,组间比较采用Mann-Whitney U检验。计数资料的比较采用Pearson检验或Fisher精确概率法。等级资料的比较采用秩和检验。绘制出各个预测模型对直肠癌周边纤维脂肪组织渗透的ROC曲线,计算相应曲线下面积(AUC),并采用DeLong检验对比差异。采用多因素Logistic回归分析,建立了预测直肠癌周边纤维脂肪组织浸润联合模型。通过决策曲线分析(DCA)评价该模式的临床效益。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 训练组与验证组患者特征比较
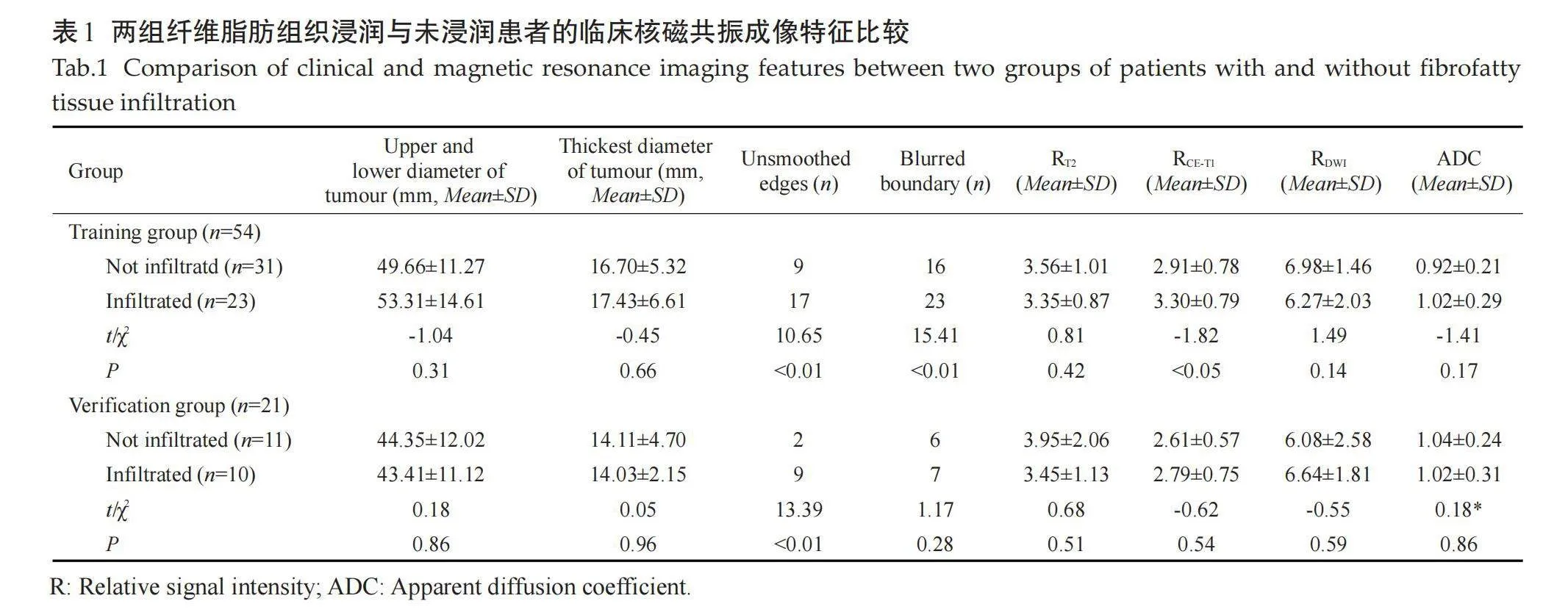
训练组中纤维脂肪组织浸润23例、纤维脂肪组织未浸润31例,验证组中纤维脂肪组织浸润12例、纤维脂肪组织未浸润9例。训练组边缘欠光整及边界模糊差异有统计学意义(Plt;0.05),验证组间边缘欠光整差异有统计学意义(Plt;0.05),肿瘤上下径、肿瘤最厚径、RCE-T1WI、RT2、RDWI及ADC值差异均无统计学意义(Pgt;0.05,表1)。
2.2" 筛选影像组特征并建立预测模型
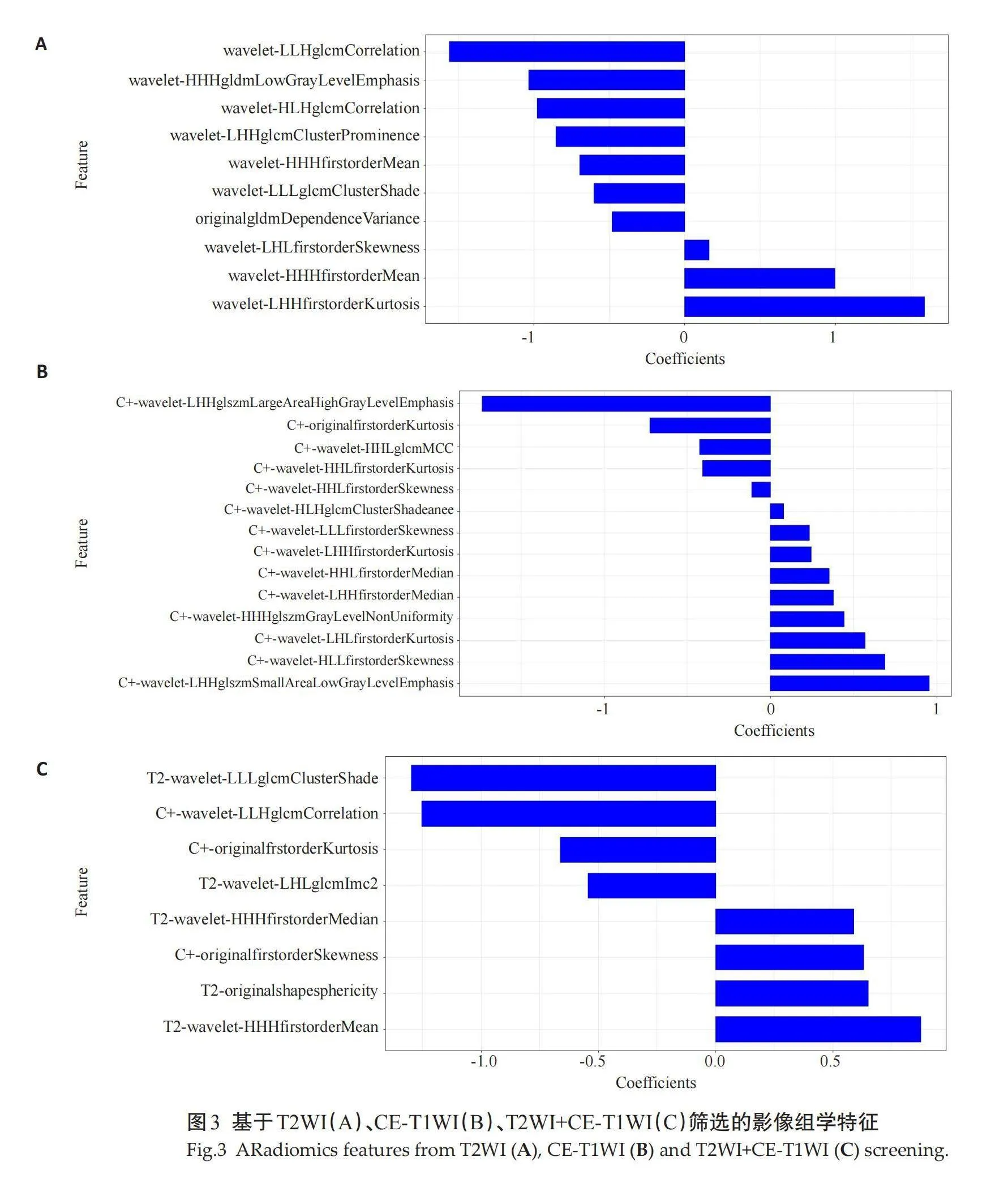
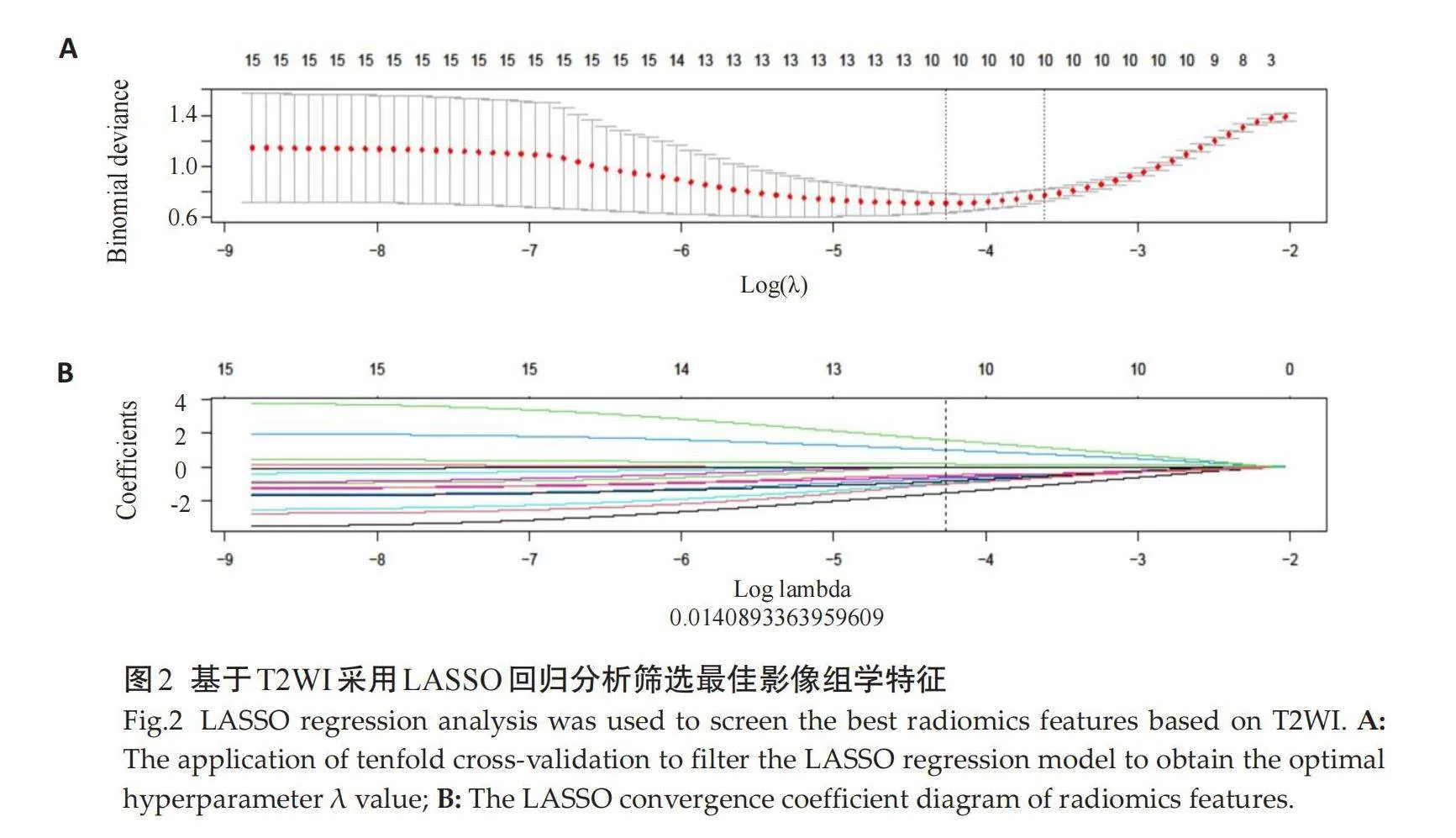
根据T2WI与动脉期CE-T1WI分别提取851个的影像组学特征;经过剔除冗余特征和回归降维(图2A~B)后,分别得到10和14个的最佳影像组学特征,分别应用于T2WI模型(图3A)和CE-T1WI(图3B)模型的构造。根据T2WI和CE-T1WI选择影像组学特征,以此构建联合序列预测T2WI+CE-T1WI模型(图3C)。
2.3" 影像组学模型之间诊断效能比较
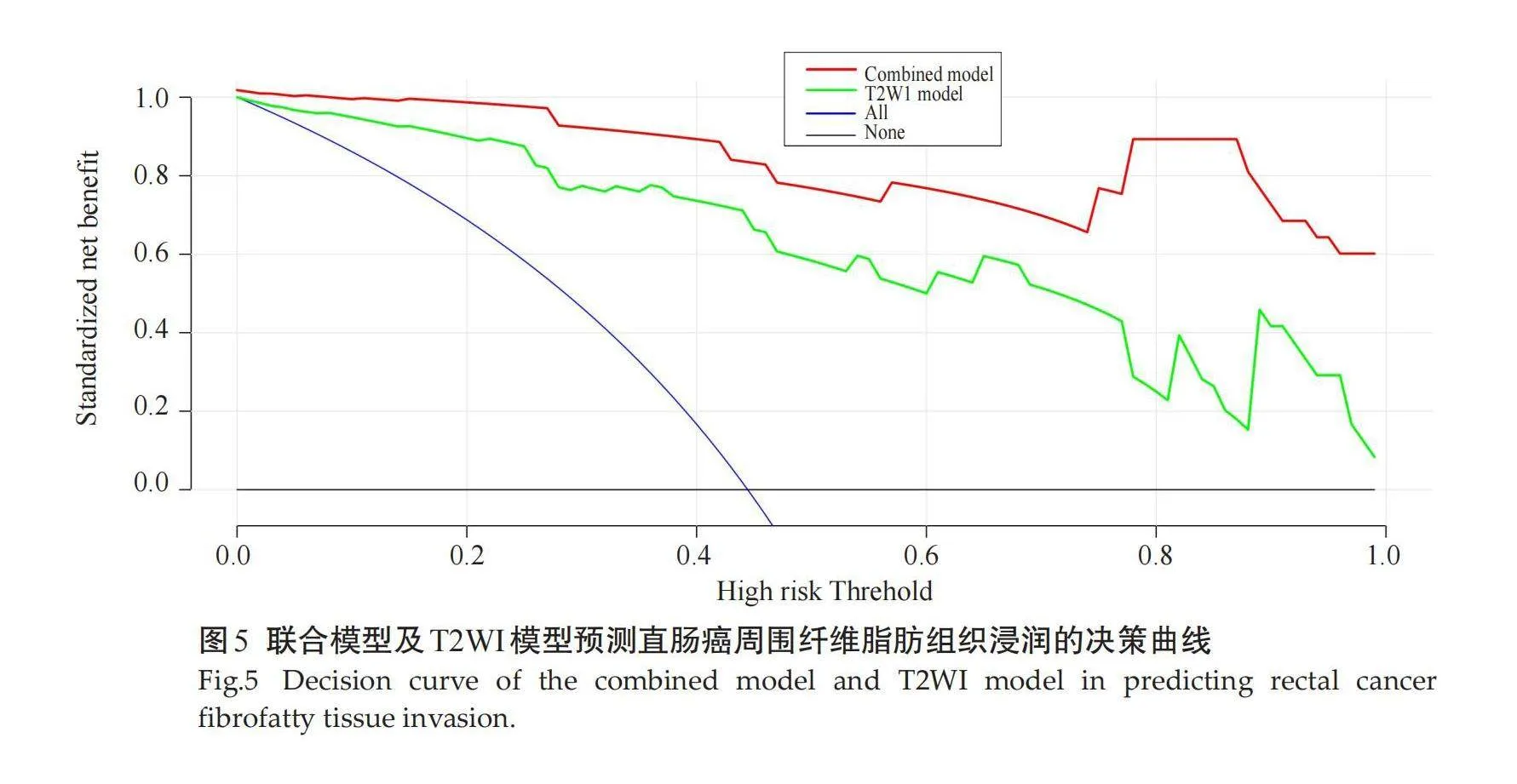
ROC曲线显示,T2WI模型在训练组的AUC为0.87(表2、图4A)高于CE-T1WI的AUC(0.82)及T2WI +CE-T1WI模型的AUC(0.84)。因此,将T2WI模型联合肿瘤上下径、肿瘤最厚径、肿瘤边界、肿瘤边缘、RCE-T1WI、RT2、RDWI及ADC值的MRI相关参数共同纳入多因素Logistic回归分析并建立联合模型。结果表明,形态学(OR=8.03),边界(OR=53.90)和联合序列影像组学评分(OR=3.75)为纤维脂肪组织浸润独立预测因子(Plt;0.05)。在训练组和验证组数据中,联合模型的AUC分别为0.91和0.8(表2、图4B)。DCA曲线显示,风险阈值为0~1时,联合模型的净收益高于T2WI模型(图5)。
3" 讨论
在诊断直肠癌T分期时,周边的纤维脂肪组织浸润是被认为是诊断直肠癌T3期的最重要因素,同时也是决定治疗策略和预后的决定性因素[12-16],当直肠癌周边纤维组织浸润出现时,应优先考虑进行新辅助治疗,而未发生纤维脂肪组织浸润,手术治疗可以被优先考虑。在进行直肠癌治疗前T分期的精确评估阶段,影像组学起到至关重要的作用。本研究利用T2WI、CE-T1WI序列勾化病灶,并从中提取影像特征,通过LASSO降维分析确定了原始图像和小波变换滤波后的最佳图像特征。小波变换滤波图像中提取的特征占最终Rad分数的大部分,这为诊断提供了重要依据,这与既往研究[17-20]结果一致。通过影像组学的方法,我们可以更加全面地评估肿瘤的异质性,从而提高影像诊断的效能,并减少影像科医生的主观因素的影响。
本研究采用T2WI模型、CE-T1WI模型及T2WI+CE-T1WI模型来进行影像组学分析,结果显示T2WI模型在训练组和验证组中的诊断效能最为出色,分析其原因可能是T2WI序列在软组织的分辨能力上超过其他序列,并且对肿瘤的主体和瘤周组织信号的变化非常敏感;与CE-T1WI后病灶由于肿瘤间皮细胞的脱落和肿瘤间质反应出现周边毛刷状纤维化样强化[21-22],从而导致直肠癌周边纤维脂肪组织浸润假阳性征象,此与真正脂肪纤维组织浸润存在着一定程度的重叠。通过影像组学的量化特征,对肿瘤的异质性进行了量化分析,证实T2WI模型在诊断直肠癌周边纤维脂肪组织浸润时,对肿瘤边缘的形态和灰度变化在纤维脂肪组织浸润具有更高的诊断价值;既往研究通过T2WI模型来分别预测直肠癌病理特征和直肠癌周围神经浸润,均认为T2WI模型相对于其他序列模型具有更高的诊断准确性[23-24]。
通过T2WI结合常规的MRI的其他相关参数,本研究建立了联合模型。其与T2WI模型相比,该模型显示出更高的预测准确性。DCA结果显示,T2WI及联合模型的预测曲线具有良好的临床获益,但是联合模型的表现要优于T2WI模型。因此,联合模型在评估直肠癌周边纤维脂肪组织浸润方面具有更高的实用性。探讨其高效性能的原因主要有:基于T2WI模型的出色稳定性,在整合MR相关参数时,联合模型展示出具有更高的敏感度和特异性;加入了其他MRI相关参数可以更深入全面地探测直肠癌的异质性,并反映肿瘤的复杂病理生理学信息,从而提高联合模型判定的准确性。因此,通过联合模型来预测直肠癌周边纤维脂肪组织浸润更具价值。
本研究纳入直肠癌MRI相关参数来分析直肠癌周边纤维脂肪组织浸润,其中,只有直肠癌边缘欠光整和边界模糊的特征差异有统计学意义,分析原因是因为与肠壁坏死、纤维化等良性变化相比,肿瘤细胞对周围组织的恶性浸润具有更高的侵蚀性[25],因此,在T2WI和CE-T1WI序列中更频繁地显现出肿瘤浸润纤维脂肪组织的可能性明显增多。然而,肿瘤的大小和单项相对信号强度比值差异均无统计学意义,这与既往研究[26-27]结果有所出入,分析其原因与本研究中病灶的大小基本相仿有关,另外如凭借单一的T2WI信号强度相关的肿瘤组织中T2值、单一的CE-T1WI信号强度相关的畸形肿瘤血管钆剂的渗透率以及单一的DWI信号强度相关的肿瘤细胞密实程度、细胞核浆比和细胞分化程度等因素来评价直肠癌肿瘤细胞对周边纤维脂肪组织均存在一定的局限性。本研究还发现单一的ADC值也无统计学意义,可能缘于本组病例中肿瘤细胞密度、细胞核浆比和细胞外基质状况之间无显著性差异。
本项研究的存在的主要局限性:缺少多中心的参与和多参数MRI设备的外在验证;为回顾性研究,样本量少,可能出现选择偏倚;另通过手工勾勒ROI和判断MRI相关参数,存在个人主观因素的影响。今后将进一步改善,并且将影像组学扩大研究方向,例如在直肠癌分子分型的预测、淋巴结转移的预测及直肠癌多学科联合会诊治疗后疗效的评估等方面的临床应用。
综上,本研究初步认为,MRI影像组学的联合模型在评估直肠癌周边纤维脂肪组织浸润具有最优的诊断效能,明显优于T2WI模型、CE-T1WI模型和T2WI+CE-T1WI模型。借助此项技术,在直肠癌术前T分期精准诊断方面必将发挥一定的作用,从而为临床医生对直肠癌治疗前决策的选择提供重要依据。
参考文献:
[1]" "Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[2]" "Rosén R, Nilsson E, Rahman M, et al. Accuracy of MRI in early rectal cancer: national cohort study[J]. Br J Surg, 2022, 109(7): 570-2.
[3]" "Fernandes MC, Gollub MJ, Brown G. The importance of MRI for rectal cancer evaluation[J]. Surg Oncol, 2022, 43: 101739.
[4]" "应海峰, 周樟伟, 叶妙清, 等. 基于Logistic回归探讨多参数MRI对T;期直肠癌亚分期的诊断价值[J]. 影像诊断与介入放射学, 2021, 7(6): 403-8.
[5]" " 王裴培, 王传彬, 吴瑶媛, 等. 体素内不相干运动扩散加权成像评估中低分化直肠腺癌的初步研究[J]. 影像诊断与介入放射学, 2019, 28(3): 175-80.
[6]" " 邱勇刚, 曾锦花, 汪鑫斌, 等. 基于T2WI及DWI影像特征鉴别T2期与T3期直肠癌[J]. 中国临床医学影像杂志, 2022, 33(8): 557-60.
[7]" "李雪莹, 倪" 响, 白辰光. 结直肠癌浆膜受累(pT4a)病理诊断的研究进展[J]. 临床与实验病理学杂志, 2022, 38(10): 1232-5.
[8]" " 郭晓霖, 薛良圆, 田春梅, 等. 多模态磁共振成像在评估直肠癌术前分期、放化疗后再分期、放化疗疗效中的应用研究进展[J]. 磁共振成像, 2023, 9(9): 181-5.
[9]" "Tibermacine H, Rouanet P, Sbarra M, et al. Radiomics modelling in rectal cancer to predict disease‑free survival: evaluation of different approaches[J]. Br J Surg, 2021, 108(10): 1243-50.
[10]" 范舒璇, 崔效楠, 史雨东, 等. 影像组学在结直肠癌预后风险分层中的研究进展[J]. 临床放射学杂志, 2023, 42(1): 149-52.
[11]" Lu HD, Yuan Y, Zhou Z, et al. Assessment of MRI-based radiomics in preoperative T staging of rectal cancer: comparison between minimum and maximum delineation methods[J]. Biomed Res Int, 2021, 2021: 5566885.
[12]" 张学勤, 张" 涛, 杨浩然. CT增强扫描与高分辨MRI在直肠癌术前分期评估中的应用[J]. 中国CT和MRI杂志, 2022, 8(11): 146-8.
[13]" Lu QY, Guan Z, Zhang XY, et al. Contrast-enhanced MRI for T Restaging of Locally Advanced Rectal Cancer Following Neoadjuvant Chemotherapy and Radiation Therapy[J]. Radiology, 2022, 305(2): 364-72.
[14] Petresc B, Lebovici A, Caraiani C, et al. Pre-treatment T2-WI based radiomics features for prediction of locally advanced rectal cancer non‑response to neoadjuvant chemoradiotherapy: a preliminary study[J]. Cancers, 2020, 12(7): 1894.
[15] Horvat N, Carlos Tavares Rocha C, Clemente Oliveira B, et al. MRI of rectal cancer: tumor staging, imaging techniques, and management[J]. Radiographics, 2019, 39(2): 367-87.
[16] Xu YY, Xu QY, Sun HL, et al. Could IVIM and ADC help in predicting the KRAS status in patients with rectal cancer?[J]. Eur Radiol, 2018, 28(7): 3059-65.
[17] Liang M, Cai ZT, Zhang HM, et al. Machine learning-based analysis of rectal cancer MRI radiomics for prediction of metachronous liver metastasis[J]. Acad Radiol, 2019, 26(11): 1495-504.
[18] Bates DDB, Homsi ME, Chang KJ, et al. MRI for rectal cancer: staging, mrCRM, EMVI, lymph node staging and post-treatment response[J]. Clin Colorectal Cancer, 2022, 21(1): 10-8.
[19] He B, Ji T, Zhang H, et al. MRI-based radiomics signature for tumor grading of rectal carcinoma using random forest model[J]. J Cell Physiol, 2019, 234(11): 20501-9.
[20]" "Hamerla G, Meyer HJ, Hambsch P, et al. Radiomics model based on non‑contrast CT shows No predictive power for complete pathological response in locally advanced rectal cancer[J]. Cancers, 2019, 11(11): 1680.
[21]Bae JS, Kim SH, Hur BY, et al. Prognostic value of MRI in assessing extramural venous invasion in rectal cancer: multi-readers' diagnostic performance[J]. Eur Radiol, 2019, 29(8): 4379-88.
[22]" Horvat N, Petkovska I, Gollub MJ. MR imaging of rectal cancer[J]. Radiol Clin North Am, 2018, 56(5): 751-74.
[23]" Ma XL, Shen F, Jia Y, et al. MRI-based radiomics of rectal cancer: preoperative assessment of the pathological features[J]. BMC Med Imaging, 2019, 19(1): 86.
[24]" Guo XF, Yang WQ, Yang Q, et al. Feasibility of MRI radiomics for predicting KRAS mutation in rectal cancer[J]. Curr Med Sci, 2020, 40(6): 1156-60.
[25]" Heo SH, Kim JW, Shin SS, et al. Multimodal imaging evaluation in staging of rectal cancer[J]. World J Gastroenterol, 2014, 20(15): 4244-55.
[26]" 裴笑月, 胡" 波, 吕" 玲, 等. 不同组织学类型结直肠腺癌的临床病理和免疫组织化学特征[J]. 临床与病理杂志, 2020, 40(8): 1941-8.
[27]" 陶" 莎, 钱" 振, 汤永祥.磁共振弥散加权成像信号特征在直肠癌浆膜层侵犯的应用研究[J/OL]. 吉林医药学院学报,2023. doi: 10.13845/j.cnki.issn1673-2995.20231007.013
(编辑:郎" 朗)
