影像组学在免疫治疗方面的应用现状
2024-10-30张丽菡王化陈永孜路红

摘要:影像组学在医学图像中挖掘信息,对癌症的诊断、预后和治疗疗效预测具有极为重要的地位。当前,免疫治疗成为癌症治疗的热点,极大地推动了肿瘤学领域的发展。影像组学特征具备无创、可重复、常规获取以及量化肿瘤异质性等优点,因此可作为免疫治疗疗效的生物标志物。本文将阐述影像组学的特征提取及其数据分析,将其作为生物标志物在免疫治疗中的研究进展,包括预测治疗反应和不良事件,为影像组学在个体化治疗中的应用提供了新的见解。
关键词:影像组学;癌症;免疫治疗;医学图像
Radiomics in immunotherapy: Current status and applications
ZHANG Lihan1,WANG Hua2, 3, 6, CHEN Yongzi4, 6, LU Hong5, 6
1CT/MRI Room Chifeng Songshan Hospital, Inner Mongolia, Chifeng 024000, China; 2Department of Diagnostic Radiology, Tianjin Cancer Hospital Airport Hospital, Tianjin 300308, China; 3Department of Radiology, 4Laboratory of Tumor Cell Biology, 5Department of Breast Imaging, Tianjin Medical University Cancer Institute and hospital, Tianjin 300060, China; 6Key Laboratory of Cancer Prevention and Therapy, Tianjin Clinical Research Center for Cancer, National Clinical Research Center for Cancer, Tianjin 300060, China
Abstract:" Radiomics plays a crucial role in extracting information from medical images, holding significant importance in the diagnosis, prognosis, and prediction of treatment efficacy in cancer. Currently, immunotherapy has emerged as a focal point in cancer treatment, greatly advancing the field of oncology. Radiomic features offer advantages such as non-invasiveness, repeatability, routine accessibility, and quantitative assessment of tumor heterogeneity. Consequently, these features serve as valuable biomarkers for evaluating the efficacy of immunotherapy. This review elucidates the extraction and analysis of radiomic features, highlighting their role as biomarkers in the study of immunotherapy. It explores advancements in predicting treatment responses and adverse events, providing novel insights into the application of radiomics in personalized cancer treatment.
Keywords: radiomics;cancer;immunotherapy;medical imaging
收稿日期:2023-10-11
基金项目:天津市卫生健康科技项目(TJWJ2022MS052);国家自然科学基金面上项目(82172025)
Supported by National Natural Science Foundation of China (82172025)
作者简介:张丽菡,主治医师,E-mail: lhanzhang@126.com
通信作者:路" 红,博士,主任医师,教授,博士生导师,E-mail: luhong77@163.com
随着计算机技术和机器学习算法的不断发展,医学图像中肉眼无法捕捉到的信息可以借助影像组学进行识别,即通过计算机手段从医学图像中高通量提取定量特征,将其与临床结果相结合,例如患者生存、肿瘤转移、分级分期、疗效评估以及预后预测等,从而优化临床决策。常用的影像组学特征包括一阶、二阶和高阶统计量,其中二阶统计量也被称为纹理特征,可提供肿瘤内异质性的信息。肿瘤内异质性与肿瘤的发生发展以及治疗效果息息相关,尤其在免疫治疗领域。因此,将影像学数据与患者的临床数据结合能够建立更加准确的免疫预测模型,从而加速个体化治疗的进程。
近年来,免疫治疗为癌症治疗带来了一线曙光。虽然它在临床应用中取得了很多成果,但由于肿瘤异质性的存在,即肿瘤内不仅含有致瘤细胞亚群,也有非致瘤细胞亚群,会导致肿瘤对免疫治疗的反应截然不同。因此,在研究肝癌[1, 2] 、肺癌[3] 以及前列腺癌[4] 等患者对免疫治疗敏感性的课题中,肿瘤异质性都是其中一个非常重要的因素。在精准治疗的大背景下,要确定哪些患者可以从免疫治疗中获益最大,哪些患者可以免于免疫治疗的附加毒性,肿瘤异质性是必须要面对的问题。鉴于影像组学可以从CT、PET或MRI等医学图像中高通量地获得大量影像学特征,从而全面、无创、定量地评估肿瘤的空间和时间异质性[5] ,从理论上来讲,影像组学特征有成为免疫治疗疗效标志物的潜力,因此被不断应用于免疫相关研究中。例如,研究表明肺癌患者免疫检查点抑制剂相关性肺炎的CT图像具有一定的特征[6] ;以及分子影像学在肿瘤过继性免疫治疗中也得到了广泛的应用[7] 。这些研究都表明了影像学与免疫治疗之间的关系。
相较于其他生物标志物,影像组学标志物有很多优点。例如影像学检查是常规检查,因此数据非常容易获取;此外,它具有无创性以及优先性,可以对于整个肿瘤进行全局评估。影像学特征不仅可以在早期通过肿瘤的异质性、纹理、形状和大小来反映肿瘤的表型和分期,亦可以发现肉眼看不到的独特的肿瘤表型以及由于基因表达变化所引发的表型变化[8] 。鉴于影像组学特征能够良好的反应肿瘤异质性和免疫微环境,对其深入挖掘可以增强我们对癌症诊断[9]、预后以及对疗效反应的理解。本综述将对影像组学在免疫治疗方面的应用进行归纳总结,包括其在预测治疗反应和毒性方面的应用,并对目前所存在的问题进行探讨,从而加强对免疫治疗的了解有助于实现癌症的精准化医疗。
1" 影像组学特征提取及其分析
随着人工智能技术的蓬勃发展,医学影像自动化处理及分析的水平也随之迅速提升。通过计算机技术从医学图像中自动提取定性和定量特征对肿瘤表型进行描述,该过程称为影像组学。影像学家Gillies[10] 曾指出 “医学图像不仅仅是图像,他们更是数据”。由于从图像中提取的数据是发生在遗传和分子水平上的产物,所以与组织的基因型和表型特征密切相关,通过深层次的数据挖掘,可作为生物标志物来预测病人的治疗反应并辅助临床医生做出更为准确的诊断。
影像组学分析首先从医学图像中选择感兴趣的区域进行分割;而后,从中提取与病灶有关的高通量的影像学特征,包括形状、一阶(图像强度)和二阶(纹理)特征[10] 。特征提取可以使用PyRadiomic[11] ,HeterogeneityCAD[12],Quantitative Image Feature Engine[13] 以及Imaging Biomarker Explorer[14] 等方法;随后可利用统计学方法筛选与研究终点有关的特征,例如可先单变量分析、后多变量分析,也可以使用最小绝对值收敛和选择算子算法等方法;最终使用逻辑回归、随机森林或支持向量机等方法建立预测模型。
2" 影像组学在预测免疫疗效中的应用
2.1" 免疫疗效评价标准的改进
评估治疗反应的最经典方法是“实体瘤反应评价标准”(RECIST)[15] ,该方法主要使用肿瘤大小来对疗效进行评价。然而,一些接受免疫治疗的患者可能会出现非典型反应,如假性进展,即肿瘤最初增大,随后出现延迟反应和肿瘤缩小。这种模式会被RECIST错误地评估为进展性疾病,从而导致过早停止治疗。为了更好地解释免疫治疗后的反应差异,研究者们进而研发了实体瘤免疫疗效评价标准,即iRECIST[16] ,它的主要特点是对肿瘤免疫治疗的延迟效应进行界定;随后,更符合临床实践的评价标准被制定出来,如免疫相关疗效标准(irRC)、实体瘤的免疫修饰疗效评估标准(imRECIST)和实体瘤的免疫相关疗效评估标准(irRECIST)。
这些新的免疫相关评估标准在免疫治疗中的应用中需要密切结合影像学方法。通过使用各种影像学技术,如CT、MRI、PET等,医生和影像学家可以周期性地监测患者的肿瘤状态,包括肿瘤大小、形状、密度等。通过结合免疫治疗的影像学监测和新的免疫相关评估标准,医生可以更全面地识别虚假进展。这有助于医生在个体化治疗决策方面更具信心,确保患者获得最佳的照顾。影像学的角色在这一过程中至关重要,它为医生提供了可视化的信息,以支持治疗决策的制定。
2.2" 预测免疫治疗反应
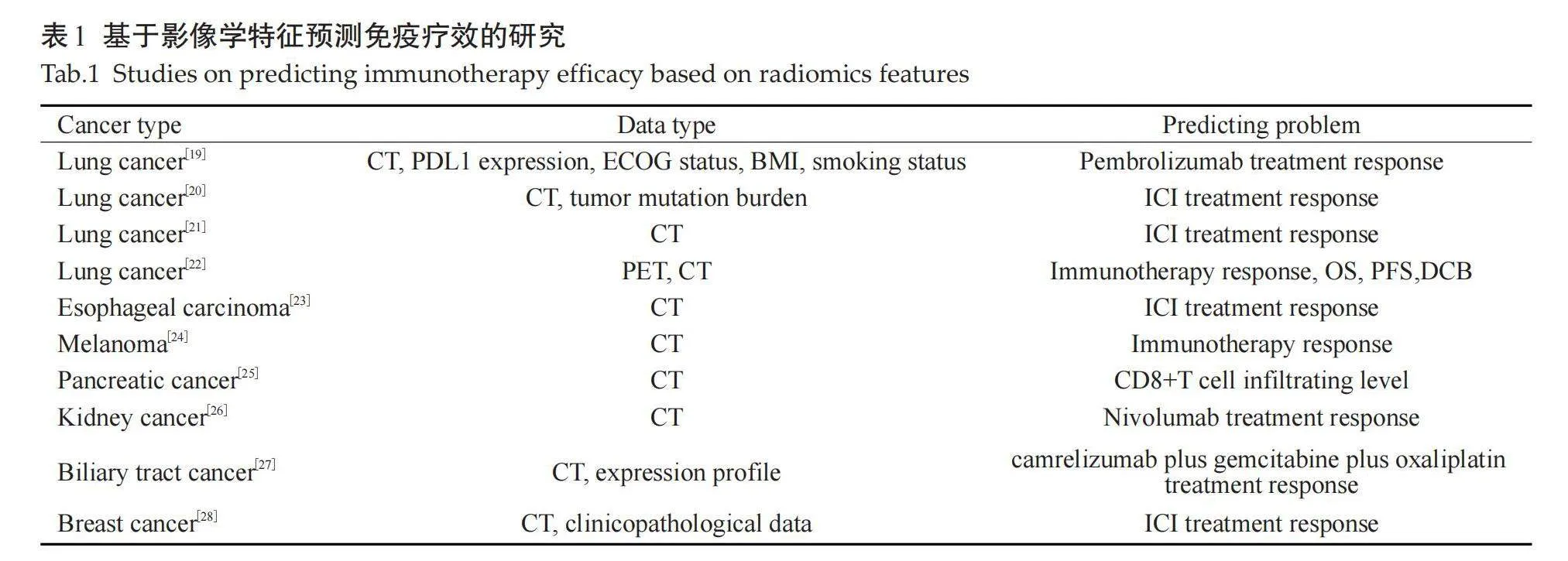
Sun等[17] 最早开展了影像组学特征预测免疫疗效的研究。该研究对MOSCATO临床试验中的135例计划接受抗PD-1或PD-L1免疫疗法的患者进行分析,每例患者都有完整的CT和RNAseq数据。通过分析影像学特征与肿瘤活检中CD8浸润水平以及治疗反应之间的关系,他们成功开发了一个基于8个影像组学特征的预测模型,并使用TCGA中119例患者对该模型进行外部验证(C=0.67,95% CI:0.57~0.77)。另一项针对194例接受PET/CT检查的晚期肺癌患者的研究也鉴定了一组与肿瘤免疫疗法反应有关的影像组学特征[18] 。此外还涌现了很多类似的影像组学研究,印证其在不同癌症中预测免疫疗效的能力,例如肺癌、头颈癌、食管癌、黑色素瘤、胰腺癌、胆道癌、乳腺癌及肾癌等(表1)。
3" 影像组学在预测免疫相关不良事件中的应用
除了预测免疫治疗反应,影像组学还被应用到预测免疫相关严重不良事件(irSAEs)中。irSAEs是接受PD-L1或PD-1抑制剂的患者非常关注的问题,涉及到多个器官系统,包括内分泌、肌肉皮肤、胃肠道、肺部和风湿病等。这些不良事件会导致治疗的提前终止和对身体器官的永久性损伤,因此预测irSAEs可以帮助改善临床治疗结果。为了可重复比较治疗相关的并发症,美国国家癌症研究所对不良事件的严重程度进行了分类,制定了《不良事件通用术语标准》(CTCAE)版本6.0(表2)。 CTCAE有助于在临床试验中比较不同研究之间毒副作用,也可用于评估接受免疫治疗的患者中的免疫相关不良事件[29] 。
影像学在irSAEs的预测方面同样发挥了重要作用。有研究通过对接受免疫治疗的原发非小细胞肺癌患者的FDG-PET/CT特征进行训练和验证,预测irSAEs的风险[30] 。该研究最终使用5个影像组学特征来拟合风险评分,并结合免疫检查点抑制剂及其使用剂量来建立诺莫图,使用测试和前瞻性验证队列对诺莫图进行验证。虽然该研究有一定的局限性,例如对于提取影像组学特征的细节缺乏描述,样本量较少和低事件率,但是在预测免疫治疗不良反应的研究中非常具有代表性。此外,也有研究报道了FDG-PET/CT可以在早期检测到免疫治疗的不良反应[31, 32] 。而Colen等[33] 基于1860个影像组学特征来预测接受免疫疗法的患者是否会引起肺炎。他们根据正常肺部的CT特征建立了一个影像组学模型来预测肺炎的风险。虽然准确率为100%,但是研究的患者数量非常少,而且32例患者中只有2例出现了肺炎,且没有验证队列,所以该研究有很大的局限性。有学者使用了影像组学技术,针对接受免疫治疗的非小细胞肺癌患者,开发了一种高度准确的预测模型,用于区分免疫治疗诱导的肺炎和其他类型的肺炎[34] 。研究涉及556例患者,其中31例患有免疫治疗诱导的肺炎,41例患有其他类型的肺炎。这一模型使用影像数据,特别是基于胸部计算机断层扫描图像提取的影像特征来进行诊断。研究表明,该模型具有出色的预测性能,其面积下曲线高达0.83。此外,模型还在那些影像学评估结果不明确的情况下提供了正确的诊断。这意味着影像组学在提高免疫治疗患者的肺炎诊断精度方面具有潜在的临床应用前景。
4" 总结与展望
经过广泛的文献研究,本综述详细探讨了影像组学在免疫治疗领域的应用。我们发现大多数影像组学研究的主要焦点是评估患者的生存情况或免疫治疗反应,尤其是在肺癌患者中。然而,与免疫治疗不良反应相关的研究相对较少。
由于影像组学特征,尤其是纹理特征,可以帮助描述肿瘤的异质性,而肿瘤的异质性是导致患者对免疫治疗反应不同的主要原因之一。因此,通过使用影像组学来早期识别对治疗不敏感的患者,可以在治疗开始时调整治疗方案,甚至考虑多模式治疗,从而提高患者的治愈率。此外,影像组学可以在肿瘤发展的不同时间点对其进行评估,而不仅仅依赖于单一时间点的活检数据,因此提供了更全面的信息。
总之,影像组学有望通过无创方式监测肿瘤异质性的动态变化,从而帮助调整临床治疗方案,提高癌症治疗效果。然而,影像组学研究仍面临一些挑战,如扫描设备的差异、数据集的不一致性、有限的公开数据集和缺乏参数和编码的标准化等。此外,研究需要更深入地探讨模型背后的生物学机制,以提高其在临床中的应用。虽然影像组学已被证明可以用于预测免疫治疗的疗效,并改善患者的预后,但仍需进一步确定稳定的生物标志物,以更准确地识别最有可能受益于免疫治疗的患者。为此,可以采用新的免疫反应评估标准(如irRECIST)、制定标准验证方法和规范数据集等策略,以提高预测模型的精度。如果希望将影像组学模型更广泛地应用于临床实践,就需要深入了解模型背后的生物学机制,以开发出更出色的预测模型,帮助临床医生更好地选择最适合患者的免疫治疗方案。
参考文献:
[1]" " Losic B, Craig AJ, Villacorta‑Martin C, et alIntratumoral heterogeneity and clonal evolution in liver cancer[J]. Nat Commun, 2020, 11(1): 291.
[2]" "Xu FQ, Dong MM, Wang ZF, et al. Metabolic rearrangements and intratumoral heterogeneity for immune response in hepatocellular carcinoma[J]. Front Immunol, 2023, 14: 1083069.
[3]" Trefzer TB, Schneider MA, Jechow K, et al. Intratumoral heterogeneity and immune modulation in lung adenocarcinoma in female smokers and never smokers[J]. Cancer Res, 2022, 82(17): 3116-29.
[4]" Han JP, Zhou Y, Zhang CD, et al. Intratumoral immune heterogeneity of prostate cancer characterized by typing and hub genes[J]. J Cell Mol Med, 2023, 27(1): 101-12.
[5]" "Lambin P, Rios-Velazquez E, Leijenaar R, et al. Radiomics: extracting more information from medical images using advanced feature analysis[J]. Eur J Cancer, 2012, 48(4): 441-6.
[6]" " 杜永浩, 张丹丹, Julien MP, 等. 肺癌免疫检查点抑制剂相关性肺炎的临床特征及 CT 征象分析[J]. 实用放射学杂志, 2022, 38(10): 1590-3.
[7]" " 唐" 兴, 康晓伟, 刘先平, 等. 分子影像学在肿瘤过继性免疫治疗中的应用进展[J]. 实用放射学杂志, 2015(1): 140-2.
[8]" "Panth KM, Leijenaar RTH, Carvalho S, et al. Is there a causal relationship between genetic changes and radiomics-based image features? An in vivo preclinical experiment with doxycycline inducible GADD34 tumor cells[J]. Radiother Oncol, 2015, 116(3): 462-6.
[9]" " 孔" 梅, 夏好成, 朱付立. 自身免疫性胰腺炎和胰腺导管腺癌影像学鉴别[J]. 实用放射学杂志, 2023, 39(1): 75-8.
[10] Gillies RJ, Kinahan PE, Hricak H. Radiomics: images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563-77.
[11]" van Griethuysen JJM, Fedorov A, Parmar C, et al. Computational radiomics system to decode the radiographic phenotype[J]. Cancer Res, 2017, 77(21): e104-7.
[12] Aerts HJWL, Velazquez ER, Leijenaar RTH, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach[J]. Nat Commun, 2014, 5: 4006.
[13]" Echegaray S, Bakr S, Rubin DL, et al. Quantitative image feature engine (QIFE): an open-source, modular engine for 3D quantitative feature extraction from volumetric medical images[J]. J Digit Imag, 2018, 31(4): 403-14.
[14]" Zhang LF, Fried DV, Fave XJ, et al. IBEX: an open infrastructure software platform to facilitate collaborative work in radiomics[J]. Med Phys, 2015, 42(3): 1341-53.
[15] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-47.
[16]" Seymour L, Bogaerts J, Perrone A, et al. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics[J]. Lancet Oncol, 2017, 18(3): e143-52.
[17]" Sun R, Limkin EJ, Vakalopoulou M, et al. A radiomics approach to assess tumour-infiltrating CD8 cells and response to anti-PD-1 or anti-PD-L1 immunotherapy: an imaging biomarker, retrospective multicohort study[J]. Lancet Oncol, 2018, 19(9): 1180-91.
[18] Mu W, Tunali I, Gray JE, et al. Radiomics of 18F-FDG PET/CT images predicts clinical benefit of advanced NSCLC patients to checkpoint blockade immunotherapy[J]. Eur J Nucl Med Mol Imaging, 2020, 47(5): 1168-82.
[19] Singh A, Horng H, Roshkovan L, et al. Development of a robust radiomic biomarker of progression-free survival in advanced non-small cell lung cancer patients treated with first-line immunotherapy[J]. Sci Rep, 2022, 12(1): 9993.
[20]He BX, Dong D, She YL, et al. Predicting response to immunotherapy in advanced non-small-cell lung cancer using tumor mutational burden radiomic biomarker[J]. J Immunother Cancer, 2020, 8(2): e000550.
[21]" Khorrami M, Prasanna P, Gupta A, et al. Changes in CT radiomic features associated with lymphocyte distribution predict overall survival and response to immunotherapy in non-small cell lung cancer[J]. Cancer Immunol Res, 2020, 8(1): 108-19.
[22] Tankyevych O, Trousset F, Latappy C, et al. Development of radiomic-based model to predict clinical outcomes in non-small cell lung cancer patients treated with immunotherapy[J]. Cancers, 2022, 14(23): 5931.
[23] Zhu Y, Yao W, Xu BC, et al. Predicting response to immunotherapy plus chemotherapy in patients with esophageal squamous cell carcinoma using non-invasive Radiomic biomarkers[J]. BMC Cancer, 2021, 21(1): 1167.
[24]" 常" 燃, 侯芳婧, 朱海涛, 等. 基于增强CT影像组学特征预测难治性恶性黑色素瘤肺转移患者的免疫治疗疗效[J]. 中国医学影像技术, 2021, 37(2): 225-9.
[25]" 解添淞, 翁微微, 刘" 伟, 等. 基于CT图像影像组学的机器学习模型预测胰腺癌免疫细胞浸润及预后的初步研究[J]. 中华放射学杂志, 2022, 56(4): 425-30.
[26]" Khene ZE, Mathieu R, Peyronnet B, et al. Radiomics can predict tumour response in patients treated with Nivolumab for a metastatic renal cell carcinoma: an artificial intelligence concept[J]. World J Urol, 2021, 39(9): 3707-9.
[27] Liu QP, Tang J, Chen YZ, et al. Immuno-genomic-radiomics to predict response of biliary tract cancer to camrelizumab plus GEMOX in a single-arm phase II trial[J]. JHEP Rep, 2023, 5(7): 100763.
[28] Zhao JL, Sun ZX, Yu YF, et al. Radiomic and clinical data integration using machine learning predict the efficacy of anti-PD-1 antibodies-based combinational treatment in advanced breast cancer: a multicentered study[J]. J Immunother Cancer, 2023, 11(5): e006514.
[29]" Berz AM, Boughdad S, Vietti-Violi N, et al. Imaging assessment of toxicity related to immune checkpoint inhibitors[J]. Front Immunol, 2023, 14: 1133207.
[30]" Mu W, Tunali I, Qi J, et al. Radiomics of 18F fluorodeoxyglucose PET/CT images predicts severe immune-related adverse events in patients with NSCLC[J]. Radiol Artif Intell, 2020, 2(1): e190063.
[31] Prigent K, Aide N. 18F‑fludeoxyglucose PET/computed tomography for assessing tumor response to immunotherapy and detecting immune-related side effects: a checklist for the PET reader[J]. PET Clin, 2020, 15(1): 1-10.
[32] Gandy N, Arshad MA, Wallitt KL, et al. Immunotherapy‑related adverse effects on 18F-FDG PET/CT imaging[J]. Br J Radiol, 2020, 93(1111): 20190832.
[33]Colen RR, Fujii T, Bilen MA, et al. Radiomics to predict immunotherapy‑induced pneumonitis: proof of concept[J]. Invest New Drugs, 2018, 36(4): 601-7.
[34]Tohidinezhad F, Bontempi D, Zhang Z, et al. Computed tomography‑based radiomics for the differential diagnosis of pneumonitis in stage IV non‑small cell lung cancer patients treated with immune checkpoint inhibitors[J]. Eur J Cancer, 2023, 183: 142-51.
(编辑:郎" 朗)
