刺激响应型纳米探针的制备及其对卵巢癌细胞的磁共振成像与药物输运研究
2024-10-30窦宾茹王永韩翠平


摘要:目的" 构建基于肿瘤微环境下刺激响应型纳米探针介孔二氧化硅@阿霉素@二氧化锰纳米片(mSiO2@DOX@MnO2),探索其在卵巢癌细胞的特异性MRI与药物释放性能。方法" 以转铁蛋白为稳定剂和靶向分子,通过超声分散法制备MnO2纳米片,以MnO2纳米片为门控,通过静电相互作用构建mSiO2@DOX@MnO2纳米探针。检测其Zeta电位、微观形貌、药物控释、光学性质及MRI性能。采用细胞增殖/毒性检测试剂盒检测纳米复合物对HO-8910卵巢癌细胞和CHO仓鼠卵巢细胞的细胞毒性。检验其在肿瘤细胞内的药物释放情况及细胞水平的MRI成像效果。结果" mSiO2@DOX@MnO2纳米探针在正常生理环境下几乎无MR信号,药物释放率小于10%。在肿瘤微环境高谷胱甘肽(GSH)浓度下产生较强的T1加权信号,其T1弛豫效率r1为5.86 mmol/(L·s)。在pH=5.0的酸性环境中,DOX的释放率在15 h左右开始维持在相对稳定水平,释放率约为33%。相同pH=7.4条件下,GSH高浓度组较低浓度组释放率明显增高,约为55%。当pH=5.0时,GSH浓度为10 mmol/L时,释放率最高,高达80%。mSiO2@DOX@MnO2纳米探针在实验浓度内对肿瘤细胞毒性较强,对正常CHO细胞毒性较弱,当mSiO2@DOX@MnO2纳米复合物中DOX含量约为100 μg/mL,HO-8910细胞存活率仅为24%,CHO细胞的存活率约为86%。HO-8910细胞、CHO 细胞在不同质量浓度mSiO2@DOX@MnO2作用下存活率差异均有统计学意义(Plt;0.05)。当锰离子浓度为1.12 mmol/L时,HO-8910细胞组的T1驰豫时间为467.60±4.45 ms,CHO细胞组的T1驰豫时间为1681.47±1.88 ms。同一浓度下的纳米探针对HO-8910细胞和CHO细胞MRI 的T1弛豫时间两两比较差异均有统计学意义(Plt;0.05)。结论" 构建的mSiO2@DOX@MnO2纳米探针可靶向识别卵巢癌细胞,在肿瘤细胞酸性环境下及高水平GSH刺激响应下实现T1加权成像、药物的精准释放,可实现卵巢癌细胞水平的靶向磁共振成像及治疗。
关键词:二氧化锰纳米片;介孔二氧化硅;盐酸阿霉素;肿瘤微环境;谷胱甘肽
Development of stimuli‑responsive nanoprobes with the aim of enabling targeted magnetic resonance imaging and drug delivery for ovarian cancer cells
DOU Binru1, WANG Yong2, HAN Cuiping2
1Department of Radiology, Xuzhou First People's Hospital Xuzhou 221000, China; 2School of Imaging, Xuzhou Medical University, Xuzhou 221002, China
Abstract: Objective To fabricate nanoprobes consisting of tumor microenvironment stimuli-responsive mesoporous silicon dioxide@doxorubicin@manganese dioxide (mSiO2@DOX@MnO2) and assess their efficacy in terms of MRI and drug release in ovarian cancer cells. Methods The preparation of MnO2 involved ultrasonic disperion with transferrin serving as both a stabilizer and a targeted agent. The mSiO2@DOX@MnO2 nanoprobes were synthesized through electrostatic interaction utilizing MnO2 nanosheets as a gate. The nanoprobes were subsequently characterized for zeta potential, morphology, drug release kinetics, optical properties, and MRI properties. The cytotoxicity of the nanocomplexes was assessed against HO-8910 ovarian cancer cells and CHO hamster ovarian cells using the cell counting Kit-8 (CCK-8) assay. The drug release within tumor cells was investigated using a confocal laser scanning microscope. Furthermore, the MRI imaging effect of the nanoprobes on HO-8910 cells was evaluated. Statistical analysis was performed using one-way analysis of variance and the LSD test. Results The mSiO2@DOX@MnO2 nanoprobes exhibited minimal magnetic resonance signal and a low drug release rate (less than 10%) in a normal physiological microenvironment. However, in the presence of glutathione (GSH), a strong T1 weighted signal was obseved, with a T1 relaxation efficiency of 5.86 mmol/(L·s). It could be observed that in an acidic environment with a pH of 5.0, the release rate of DOX reaches a relatively stable level at approximately 15 h, maintaining around 33%. Under the same condition with a pH of 7.4, the high concentration group exhibits significantly higher GSH release rate compared to the low concentration group, reaching about 55%. The highest release rate is achieved when both pH and GSH concentration are set at 5.0 and 10 mmol/L respectively, reaching up to 80%. The mSiO2@DOX@MnO2 nanoprobe demonstrates potent toxicity against tumor cells while exhibiting minimal toxicity towards normal CHO cells at experimental concentrations. When the DOX content in the mSiO2@DOX@MnO2 nanocomplex was about 100 μg/mL, HO-8910 cell survival rate is only about 24%, whereas CHO cell survival rate remains around 86%. Cell cytotoxicity tests demonstrated significant differences in the survival rates of HO-8910 cells and CHO cells when treated with varying concentrations of mSiO2@DOX@MnO2 (Plt;0.05). When the concentration of manganese ions was 1.12 mmol/L, the T1 relaxation time of the HO-8910 cell group was 467.60±4.45 ms, while that of the CHO cell group was 1681.47±1.88 ms. The T1 values of the HO-8910 cells and CHO cells groups showed significant differences when treated with equivalent concentrations of mSiO2@DOX@MnO2 (Plt;0.05). Conclusion The developed mSiO2@DOX@MnO2 nanoprobe exhibits targeted identification and localization capabilities towards ovarian cancer cells, enabling T1‑weighted imaging and precise drug release in acidic tumor microenvironments with high levels of GSH stimulation response, thereby facilitating targeted magnetic resonance imaging and treatment at the cellular level for ovarian cancer.
Keywords: manganese dioxide nanosheets; mesoporous silicon dioxide; doxorubicin hydrochloride; tumor microenvironment; glutathione
收稿日期:2023-11-18
作者简介:窦宾茹,住院医师,E-mail: 1367232521@qq.com
通信作者:韩翠平,博士,副教授,硕士生导师,Email: hancp@xzhmu.edu.cn
卵巢癌的临床症状隐匿,早期不易发现。传统单一的化疗药物不能正确分辨出癌细胞及正常细胞,对正常组织造成的毒副作用不容忽视[1] 。纳米技术的发展为卵巢癌的早期发现及治疗带来了福音[2] 。目前临床上已经将聚乙二醇脂质体阿霉素作为卵巢癌的化疗方案之一[3] 。纳米技术的引入促进了各种纳米药物的发展,这些药物比传统的癌症治疗方法更有效、更安全,但实际疗效仍受到乏氧、免疫逃逸等因素的影响[4] 。因此只针对癌细胞的治疗方法还不够,因为癌细胞可以从肿瘤微环境中获得强大的支持。近年来随着对肿瘤研究的不断深入,研究者发现肿瘤具有不同于正常组织的独特的肿瘤微环境,主要表现为氢离子浓度升高,某些酶过度表达,例如基质金属蛋白酶、透明质酸酶、β-葡萄糖醛酸酶、酯酶等[5] ,谷胱甘肽(GSH)浓度及活性氧浓度升高等[6] 。基于肿瘤微环境与正常组织之间的差异性,设计了一系列刺激响应型纳米材料,有望提高纳米载体的靶向递送、药物定位释放等,增强药物的抗肿瘤效果。既往有研究采用模板辅助合成方法合成了蜂窝状二氧化锰纳米载体hMnO2-DOX纳米探针,在谷胱甘肽存在的情况下,通过硫醇介导的还原作用,hMnO2-DOX会迅速分解,从而释放负载的DOX,从而特异性杀伤癌细胞[7] 。但受到装载率低、刺激因素单一导致释放速度慢、释放率低及缺乏靶向性等多重因素限制。本研究采用的多重刺激响应有利于提高释放速度和释放率;另外选取中空介孔硅作为载体以提高载药率[8] ,选取二氧化锰纳米片封堵孔隙,既减少药物泄漏,又有利于药物精准释放[9] ;并在其表面修饰转铁蛋白可提高靶向性。介孔硅中载入阿霉素,既可以达到治疗效果,还可以实现荧光成像。本研究以阿霉素为药物模型,介孔二氧化硅为药物载体,二氧化锰纳米片封堵,构建肿瘤微环境下刺激响应性的诊疗一体化纳米探针,初步探索其在卵巢癌细胞内的响应特性及成像效果,旨在初步实现针对卵巢癌的靶向治疗和磁共振、荧光双重成像,提高诊疗效果。
1" 材料与方法
1.1" 主要试剂及细胞
四甲基氢氧化铵、氯化锰四水合物、四乙氧基硅烷(Sigma),谷胱甘肽还原型、甲醇、30%过氧化氢、无水乙醇、三乙胺、环乙烷(上海国药集团化学试剂有限公司)。盐酸阿霉素、细胞增殖及毒性检测试剂盒(CCK-8)、4,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)、丁硫氨酸-亚砜亚胺(BSO)(大连美仑生物技术有限公司)。HO-8910人卵巢癌细胞、CHO中华仓鼠卵巢细胞(中国科学院上海生命科学研究院)。
1.2" 主要仪器
透射电子显微镜(TECNAI G2,FEI);酶标仪(Multiskon MK3,Thermo);Zeta电位仪(Nano ZS90,英国马尔文仪器有限公司);紫外可见分光光度计(HITACHI UH4150,日立高新技术公司);真空冷冻干燥机(Thermo);3.0T MRI系统(Discovery 750W,GE)。
1.3" 材料的制备
将称取的2.2420 g四甲基氢氧化铵和2 mL 30%过氧化氢在15 s内加入到10 mL的0.3 mol氯化锰四水合物水溶液中。室温下剧烈搅拌12 h后,离心去上清并反复洗涤,真空冷冻干燥后,按质量比1:1溶于转铁蛋白水溶液中超声12 h,离心后上清液即MnO2纳米片溶液。参考文献[10] 方法,制备得mSiO2,将已制备的mSiO2与DOX避光搅拌24 h后,再与MnO2反应2 h,离心去除未反应物后得到终产物mSiO2@DOX@MnO2。
1.4" 载药率和包封率
将DOX分别配置成0.01、0.02、0.025、0.05、0.0625、0.08、0.1 g/L不同浓度溶液,紫外分光光度计测定其在480 nm处的吸收值,得到DOX的标准曲线。对材料进行了载药率和包封率的优化,取1 mL、1 g/L的mSiO2分别与1 mL不同浓度的DOX(1、2、3、4、5、6、8、10 g/L)室温、避光条件下搅拌24 h(600 r/min),随后加入1 mL MnO2原液(4 mmol/L)在相同条件下反应2 h。代入公式计算得到载药率和包封率:载药率=(投入DOX的质量-上清液中DOX的质量)/载了DOX的载体的质量×100%;包封率=(投入DOX的质量-上清液中DOX的质量)/投入DOX的质量×100%。
1.5" 体外模拟药物释放实验
采用透析袋扩散法在不同pH值、不同GSH含量的缓冲液中模拟DOX的体外释放。将负载DOX的样品mSiO2@DOX@MnO2(1 mL)转移到透析袋(MWCO 7000)中,并将透析袋分别置于不同pH(分别为pH 5.0、6.5、7.4)、不同GSH(5、10 mmol/L)和混合型(pH5.0,GSH含量为10 mmol/L)的缓冲液中。另将装有等体积mSiO2@DOX反应液的透析袋置于pH=7.4的缓冲液中作为对照。分别按选定的时间间隔取出200 µL样品,然后加入等体积的新鲜缓冲液,保持总体积不变。
1.6" 材料的表征分析
用透射电子显微镜(TEM)观察纳米材料的微观形貌,通过Zeta电位测试材料的表面电荷,通过紫外-可见吸收光谱进行光学性质表征分析。采用电感耦合等离子体质谱仪测材料中锰离子浓度,用MRI成像系统测量不同浓度组的T1值,计算T1弛豫率。扫描参数:重复时间425 ms,回波时间Min Full,反转时间为200~800 ms,矩阵384×224,视野18 cm×18 cm,层厚3.0 mm,层距1.5 mm。T1-map原始图像经过GE Aw4.6工作站处理,得到不同样品的T1弛豫时间。
1.7" 细胞毒性实验
采用CCK-8法检测了单纯DOX、mSiO2@DOX和mSiO2@DOX@MnO2对HO-8910细胞的毒性,选择CHO细胞作为对照。细胞种于96孔板孵育24 h后,将培养液更换为不同浓度的DOX、mSiO2@DOX及mSiO2@DOX@MnO2的完全培养基(以DOX浓度计算:0、1、10、25、50、75、100 mg/L),孵育24 h后弃去培养液,加入90 μL不完全培养基,然后加入10 μLCCK-8溶液,继续在37℃孵育2 h后,在多功能酶标仪测量每孔的吸光度值A450 nm。按公式计算各组细胞存活率:细胞存活率(%)=(实验孔A -空白孔A)/(对照孔A-空白孔A)×100%。每组设置6个平行样本。
1.8" 细胞MRI成像及细胞摄取实验
利用HO-8910及CHO细胞进行细胞水平的磁共振成像研究。分别向每个孔内加入600 µL不同浓度的mSiO2@DOX@MnO2混合物培养液(锰含量分别为0.37、0.56、1.12 mmol/L),每组设置3个平行样本。在37℃细胞培养箱中孵育4 h后取出,弃去混合物培养液,PBS清洗3次。然后,向每个孔内加入100 µL胰蛋白酶消化,轻轻吹打孔壁细胞,使之脱离形成细胞悬液后离心去上清液,留下细胞沉淀。用 MRI系统测量各组的T1值。利用GSH抑制剂BSO与HO-8910细胞孵育24 h后,再与材料孵育,评价肿瘤细胞GSH的表达量对MR信号变化的影响。扫描参数:冠状位 T1WI:TE 12 ms,TR 400 ms,FOV 8 cm×8 cm,层厚2.0 mm,层间距0.2 mm。通过DOX的荧光显微镜监测药物在细胞内摄取及释放情况,设置材料组和单纯DOX组。
1.9" 统计学分析
采用SPSS24.0软件进行统计分析。计量资料以均数±标准差表示,多组比较采用单因素方差分析,当总体差异有统计学意义时,两两比较采用LSD法。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 材料的表征分析
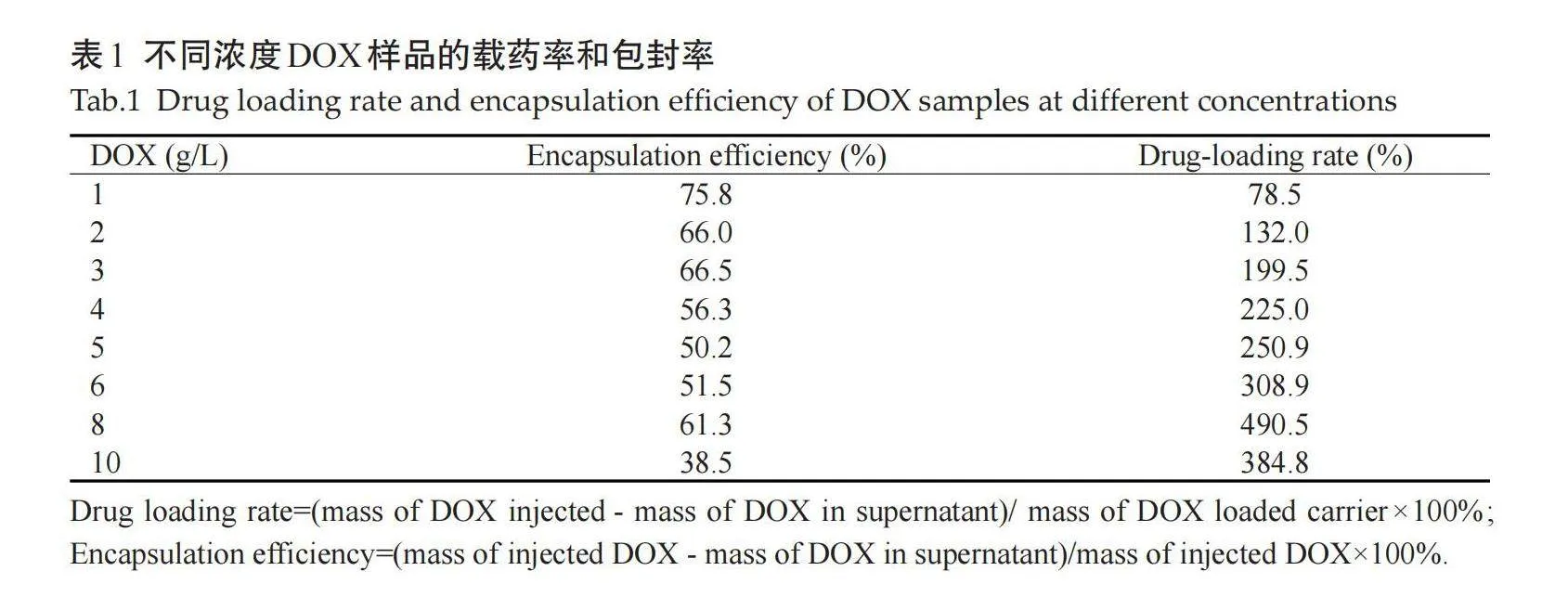
TEM图显示,mSiO2呈球形,大小比较均一,可见到较大的孔隙结构(图1A)。MnO2纳米片层溶液在常态下呈棕色透明均一的液体,TEM下可见MnO2纳米片呈片层样结构,分散性较好,局部可见部分重叠(图1B)。mSiO2@DOX@MnO2透射电镜结果显示二氧化硅孔隙结构被DOX填满,外层有片层状结构覆盖(图1C)。Zeta电位图显示,mSiO2的Zeta电位为-26.17±0.21 mV,DOX的Zeta电位为40.63±1.78 mV,反应后mSiO2@DOX的Zeta电位变为8.64±0.75 mV;DOX过静电相互作用成功负载在介孔硅孔隙内;MnO2的Zeta电位为-24.70±0.75 mV,终产物mSiO2@DOX@MnO2的Zeta电位为-4.92±0.25 mV;MnO2纳米片的成功包裹在介孔硅表面(图1D);通过Zeta电位正负变化和电荷大小变化可初步判断纳米复合物成功组装到一起。紫外-可见吸收光谱所示,DOX在480 nm处有特征性的吸收峰,MnO2纳米片层在360 nm处存在特征性吸收峰,合成的mSiO2@DOX@MnO2终产物仍然可以见到2个特征峰,且发生部分红移,mSiO2、DOX和MnO2成功相连(图1E)。
2.2" 材料的优化
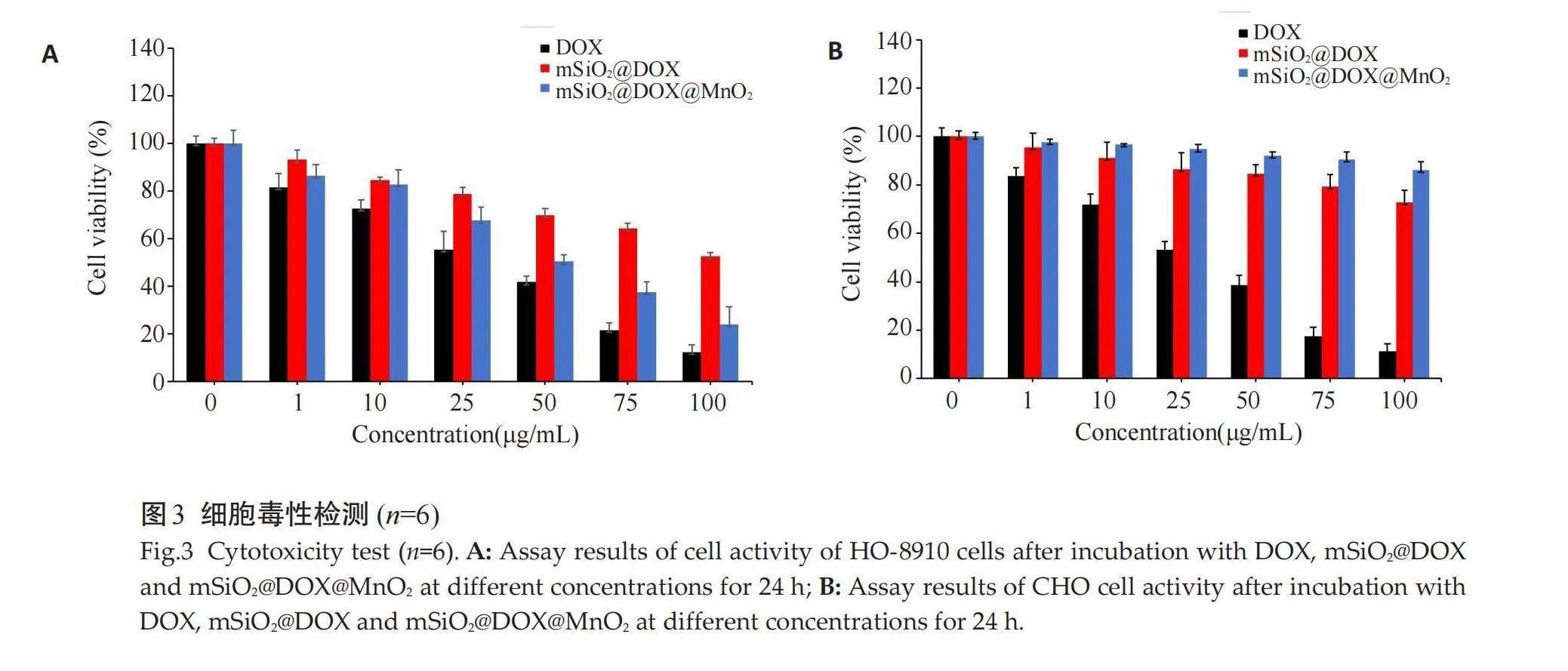
阿霉素的标准曲线方程为:Y=15.818X+0.0989。不同浓度DOX所制备的样品的载药率、包封率结果示,当DOX浓度为8 mg/mL时,有较高的载药率和包封率,分别约为490.5%、61.3%(表1)。
2.3" mSiO2@DOX@MnO2的药物释放实验
外层无MnO2纳米片层封堵组mSiO2@DOX与mSiO2@DOX@MnO2相比较,mSiO2@DOX在pH=7.4中性环境中DOX的释放量较多,而mSiO2@DOX@MnO2在pH=7.4中性环境中相对较稳定,在长达50 h时,药物的释放率仍小于10%,不同pH条件下的DOX释放曲线显示,在pH=5.0的酸性环境中,DOX的释放率在15 h左右开始维持在相对稳定水平,释放率约33%。相同pH=7.4条件下,GSH高浓度组较低浓度组释放率明显增高,约55%。当pH=5.0时,GSH浓度为10 mmol/L时,释放率最高,达80%(图2)。
2.4" mSiO2@DOX@MnO2的细胞毒性实验
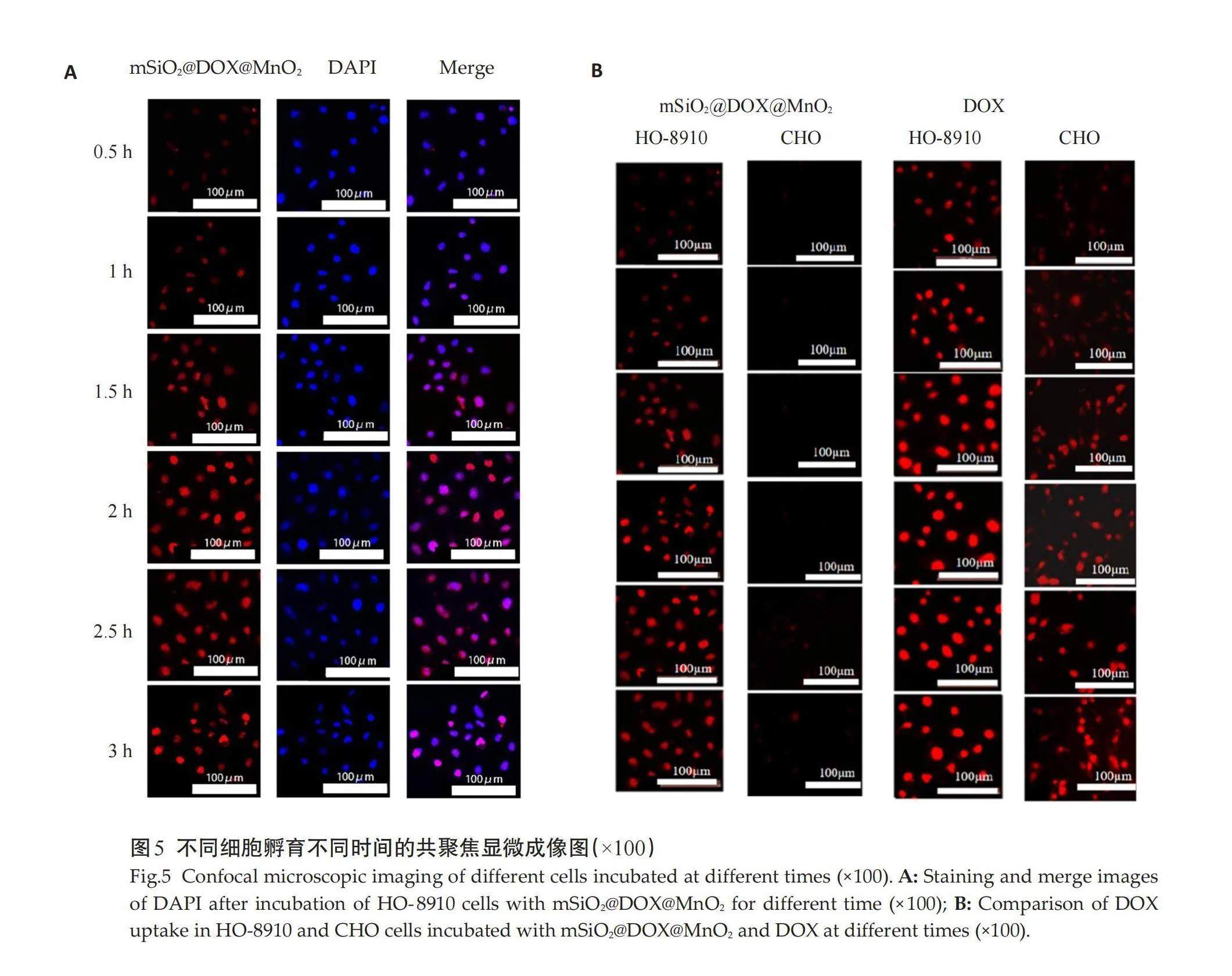
CCK-8法研究单纯DOX、mSiO2@DOX和mSiO2@DOX@MnO2对HO-8910细胞的毒性,选择CHO细胞作为对照。HO-8910 细胞、CHO 细胞在不同质量浓度mSiO2@DOX@MnO2作用下存活率差异均有统计学意义(F=203.63、28.05,Plt;0.05)。同一DOX浓度下采用单因素方差分析比较3种不同材料分别与HO-8910细胞孵育24 h后的细胞存活率,当DOX浓度为25、50、75、100 mg/L时组间差异有统计学意义(F=24.75、165.21、251.16、90.41,Plt;0.05),LSD法两两比较显示,差异有统计学意义(Plt;0.01)。同一DOX浓度下采用单因素方差分析比较3种不同材料分别与CHO细胞孵育24 h后的细胞存活率,当DOX浓度为1、10、25、50、75、100 mg/L时,组间差异均有统计学意义(F=21.12、47.42、140.53、432.90、557.21、641.30,Plt;0.05),两两比较差异均有统计学意义(Plt;0.01,图3)。
2.5" mSiO2@DOX@MnO2的MRI成像性能
无GSH存在下,mSiO2@DOX@MnO2组的T1加权信号较弱,T1弛豫效率r1值为0.17 mmol/(L·s)。加入GSH后,mSiO2@DOX@MnO2组的r1值为5.86 mmol/(L·s),有较好GSH激活的T1成像效果(图4A~B)。MRI结果显示,在相同的锰离子浓度下,HO-8910组的信号强度明显高于CHO组和经BSO处理组。BSO处理后HO-8910细胞MRI信号明显减低,CHO组在不同浓度的MRI信号值均较低,类似背景信号(图4C)。HO-8910细胞组Mn含量为1.12 mmol/L时,HO-8910细胞组、CHO细胞组及经BSO处理后的HO-8910细胞组的T1弛豫时间分别为467.60±4.45、1681.47±1.88、1200.74±16.56 ms,差异有统计学意义(F=11298.171,Plt;0.05);Mn含量为0.56 mmol/L时,HO-8910细胞组、CHO细胞组及经BSO处理后的HO-8910细胞组的T1弛豫时间分别为793.34±26.65、1680.88±2.43、1311.52±15.45 ms,差异有统计学意义(F=1873.551,Plt;0.05);Mn含量为0.37 mmol/L时,HO-8910细胞组、CHO细胞组及经BSO处理后的HO-8910细胞组的T1弛豫时间分别为988.48±4.15、1699.85±5.15、1501.30±11.77 ms,差异有统计学意义(F=6657.994,Plt;0.05)。
2.6" 细胞摄取实验
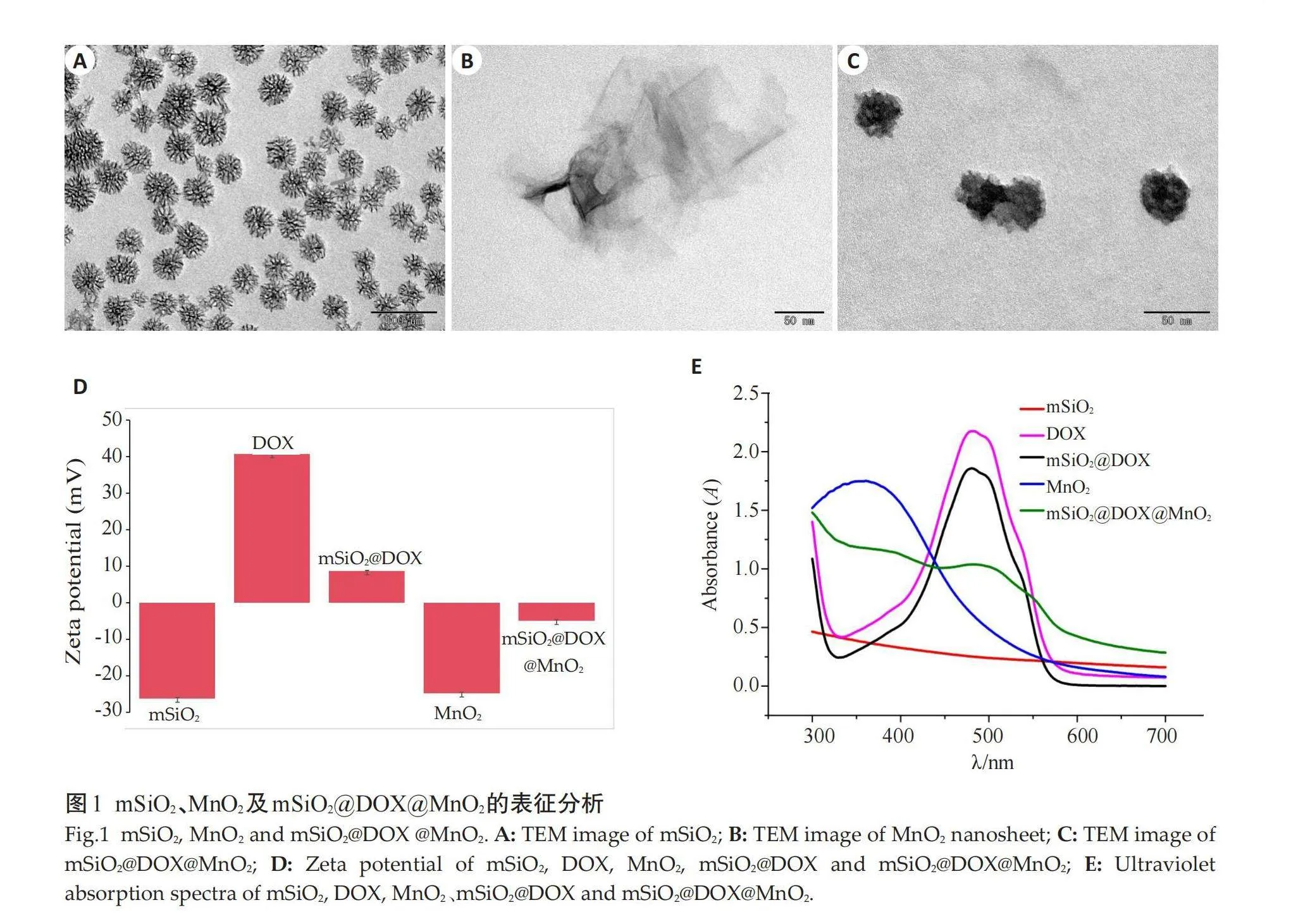
与mSiO2@DOX@MnO2共孵育1 h后,HO-8910细胞中即可观察到DOX的红色荧光,且DOX的红色荧光与细胞核的蓝色荧光重叠(图5A);同时随着孵育时间的延长,荧光强度不断增强。在相同孵育时间内,CHO细胞内未显示明显红色荧光,而单纯的DOX组在HO-8910细胞和CHO细胞内均可观察到DOX荧光(图5B)。
3" 讨论
传统的治疗方法主要针对肿瘤本身,随着对肿瘤学研究的不断深入,发现肿瘤相关的血管、淋巴管、成纤维细胞、免疫细胞和细胞外基质共同创造了一个复杂的肿瘤微环境[11] 。肿瘤具有不同于正常组织的独特的肿瘤微环境,主要表现为弱酸性、高GSH水平、特征性的酶的过表达等[12] 。基于此,本研究以肿瘤独特的微环境为着手点,采用介孔二氧化硅作为纳米载体,DOX作为化疗药物和荧光染料,外层包裹的转铁蛋白修饰二氧化锰纳米片层作为具有刺激响应特性的介孔硅封堵剂和磁共振造影剂,构建具有靶向性的诊疗一体化的纳米探针,初步探索其对卵巢癌细胞成像及化疗的可行性。
二氧化硅因毒性小、粒径小、载药量大、表面易修饰、生物相容性好等特点[8],被广泛用于构建高度可控的纳米药物传递系统。介孔二氧化硅的孔隙结构既可以容纳抗癌药等多种小分子药物,又可以被设计成具有开关效应的纳米复合物,可在特定条件下从纳米粒子上分离并释放药物[13] 。本研究参照文献[10] 的方法,调整制备出大小基本均一、孔隙较大、载药率较高的中空介孔硅纳米颗粒。另外,在其表面修饰二氧化锰纳米片作为特定的响应型材料封堵孔隙,使其可以在特定的内部或外部刺激下被移除,从而控制化疗药的精准释放、避免孔隙内容物的泄漏。二氧化锰纳米片层是一种典型的二维金属氧化物纳米材料,具有生物催化、荧光传感、磁共振成像和装载等多种功能[9, 14-16] 。MnO2中的四价态锰原子以八面体几何形状与6个氧原子配位,并且与水环境隔离,对质子的纵向或横向弛豫没有贡献。在还原性物质(如还原性谷胱甘肽)存在或酸性条件下,MnO2分解为可用作MRI 的Mn2+。Mn2+外层有5个未成对电子,具有很强的顺磁弛豫增强能力。因此,MnO2可用于激活式 MRI 分子探针的构建[17] 。本实验选择将二氧化锰纳米片层包裹在介孔二氧化硅表面,不仅可以有效封堵介孔孔隙,还可以作为T1阳性磁共振对比剂和控制药物释放的智能的“看门人”,在肿瘤酸性或高GSH等特征性环境下发生裂解实现药物准确释放。转铁蛋白是一种重要的铁转运跨膜蛋白,研究表明某些情况下,特别是在肺癌、卵巢癌、结肠癌等肿瘤中转铁蛋白受体水平升高[18-19] ,且有临床病理结果证实卵巢癌,特别是上皮性卵巢癌中转铁蛋白表达显著增高[20] 。因此转铁蛋白受体可选作主动靶向纳米材料的重要分子靶点。本实验用表面修饰有转铁蛋白的二氧化锰纳米片封堵孔隙,一方面提高靶向性,另一方面二氧化锰纳米片层在特定环境下解离,可以选择性的释放药物,并产生磁共振信号[21] 。实验所制备的mSiO2@DOX@MnO2纳米复合物在无GSH存在下的T1弛豫效率为0.17 mmol/(L·s),模拟肿瘤微环境加入GSH后的T1弛豫效率为5.86 mmol/(L·s),有较好的成像效果。细胞MRI成像显示HO-8910细胞产生的MRI信号明显高于CHO细胞及经谷胱甘肽抑制剂BSO处理后的HO-8910细胞,可能是因为HO-8910肿瘤细胞内GSH含量高,且呈弱酸性环境,可刺激外层二氧化锰纳米片层发生氧化还原反应产生Mn2+,用于T1成像[22] 。
DOX是一种广谱抗癌药物,直接作用于细胞核,抑制RNA和DNA的合成。单纯的DOX无法区分正常细胞和癌细胞,导致副作用较大。解决该问题的一种办法是构建多功能纳米载体实现药物靶向输运[23] 。本实验采用相对简单的CCK-8法进行细胞毒性验证。与单纯DOX组和未封堵组mSiO2@DOX比较,mSiO2@DOX@MnO2组对HO-8910卵巢癌细胞呈现较强的杀伤作用,而对CHO正常卵巢细胞显示出低毒性。这可能因为mSiO2@DOX@MnO2外层二氧化锰的有效封堵和强还原响应能力,以及表面修饰的转铁蛋白的靶向作用,使得该纳米复合物可以通过主动靶向到达肿瘤细胞内释放药物,既可以保护正常细胞,又可以强有力的杀伤癌细胞,达到理想的治疗效果。
DOX作为一种常规化疗药物,本身还具有荧光特性,有利于细胞内定位,监测细胞内的药物释放[24-25] 。本实验证实mSiO2@DOX@MnO2组在2 h左右几乎全部显像,可观察到释放的DOX的红色荧光与核染料DAPI的蓝色荧光相重合,说明纳米复合物mSiO2@DOX@MnO2可以较快的进入肿瘤细胞内发生刺激响应释放所装载药物并运载到细胞核,与文献结果相符[26] 。相较于DOX组,mSiO2@DOX@MnO2组进入肿瘤细胞内的时间稍有延长,这可能是因为纳米复合物进入细胞需要经过内吞、刺激响应等过程[27-28] 。而mSiO2@DOX@MnO2与CHO细胞共孵育相同时间,未见明显的DOX的释放。这一结果表明所合成纳米材料可在HO-8910肿瘤细胞内发生特异性响应,实现药物的精准释放。
综上,本研究成功制备刺激响应型mSiO2@DOX@MnO2纳米复合物,初步实现在卵巢癌细胞的磁共振成像和精确化疗。但尚存在一些不足之处,首先电镜结果显示复合物存在一定的团聚现象;二氧化锰纳米片层是否完全封堵每一个孔隙有待进一步验证。另外,本研究的体外细胞实验只选取了卵巢癌细胞作为显像细胞,未选取更多的肿瘤细胞系进一步验证,也没有验证纳米探针在活体的治疗效果。由于人体结构及环境复杂,GSH分布广泛,定量困难,酸性环境可受多种因素影响,因此实现人体内精准成像及治疗还需要应对诸多挑战。但是基于肿瘤微环境的激活的纳米探针利用肿瘤组织独特的微环境,进而能有效实现纳米载体的靶向递送、药物定位释放等功能,有效增强药物的抗肿瘤效果,减少对正常组织的副作用,为肿瘤的早期诊断、监测甚至治疗提供了新的思路。
参考文献:
[1]" "Chen HB, Gu ZJ, An HW, et al. Precise nanomedicine for intelligent therapy of cancer[J]. Sci China Chem, 2018, 61(12): 1503-52
[2]" "Xu HT, Ni JM, Han CP, et al. Ovarian cancer cells targeting fluorescent‑magnetic imaging dual‑modal nanoprobe: from synthesis to imaging in vitro[J]. Chin J Nucl Med Mol Imag, 2019, 39: 222-6.
[3]" "中华医学会妇科肿瘤学分会. 聚乙二醇化脂质体阿霉素治疗卵巢癌的中国专家共识(2018年)[J]. 现代妇产科进展, 2018, 27(9): 641-4.
[4]" Whiteside TL. The tumor microenvironment and its role in promoting tumor growth[J]. Oncogene, 2008, 27(45): 5904-12.
[5]" "Wu JY, Chen J, Feng YJ, et al. Tumor microenvironment as the \"regulator\"and \"target\" for gene therapy[J]. J Gene Med, 2019, 21(7): e3088.
[6]" "Xiao Y, Yu DH. Tumor microenvironment as a therapeutic target in cancer[J]. Pharmacol Ther, 2021, 221: 107753.
[7]" "He DG, He XX, Wang KM, et al. Redox-responsive degradable honeycomb manganese oxide nanostructures as effective nanocarriers for intracellular glutathione-triggered drug release[J]. Chem Commun, 2015, 51(4): 776-9.
[8]" "Hong SH, Choi Y. Mesoporous silica-based nanoplatforms for the delivery of photodynamic therapy agents[J]. J Pharm Investig, 2018, 48(1): 3-17.
[9]" "Wu MY, Hou PF, Dong LN, et al. Manganese dioxide nanosheets: from preparation to biomedical applications[J]. Int J Nanomedicine, 2019, 14: 4781-800.
[10]" Li F, Xu X, Liang Y, et al. Nuclear-targeted nanocarriers based on pH-sensitive amphiphiles for enhanced GNA002 delivery and chemotherapy[J]. Nanoscale, 2021, 13(9): 4774-84.
[11] Peng SJ, Xiao FF, Chen MW, et al. Tumor-microenvironment-responsive nanomedicine for enhanced cancer immunotherapy[J]. Adv Sci, 2022, 9(1): e2103836.
[12]" Li X, Yang WD. Tumor acidic microenvironment and targeted pH molecular imaging[J]. Chin J Nucl Med Mol Imag, 2019, 39: 300-3.
[13]" Sia CS, Lim HP, Tey BT, et al. Stimuli-responsive nanoassemblies for targeted delivery against tumor and its microenvironment[J]. Biochim Biophys Acta Rev Cancer, 2022, 1877(5): 188779.
[14] Hao YW, Wang L, Zhang BX, et al. Manganese dioxide nanosheets-based redox/pH‑responsive drug delivery system for cancer theranostic application[J]. Int J Nanomedicine, 2016, 11: 1759-78.
[15] Halawa MI, Wu FX, Zafar MN, et al. Turn‑on fluorescent glutathione detection based on lucigenin and MnO2 nanosheets[J]. J Mater Chem B, 2020, 8(16): 3542-9.
[16] Liu Z, Zhang SJ, Lin H, et al. Theranostic 2D ultrathin MnO2 nanosheets with fast responsibility to endogenous tumor microenvironment and exogenous NIR irradiation[J]. Biomaterials, 2018, 155: 54-63.
[17] Li Q, Ren JJ, Chen QB, et al. A HMCuS@MnO2 nano complex responsive to multiple tumor environmental clues for photoacoustic/fluorescence/magnetic resonance trimodal imaging-guided and enhanced photothermal/photodynamic therapy[J]. Nanoscale, 2020, 12(23): 12508-21.
[18] Daniels TR, Bernabeu E, Rodríguez JA, et al. The transferrin receptor and the targeted delivery of therapeutic agents against cancer[J]. Biochim Biophys Acta, 2012, 1820(3): 291-317.
[19] Li LH, Zhang Q, Li JY, et al. Targeted delivery of doxorubicin using transferrin-conjugated carbon dots for cancer therapy[J]. ACS Appl Bio Mater, 2021, 4(9): 7280-9.
[20]" Ivanova TI, Klabukov ID, Krikunova LI, et al. Prognostic value of serum transferrin analysis in patients with ovarian cancer and cancer-related functional iron deficiency: a retrospective case-control study[J]. J Clin Med, 2022, 11(24): 7377.
[21]" Zhang M, Xing L, Ke H, et al. MnO2-based nanoplatform serves as drug vehicle and MRI contrast agent for cancer theranostics[J]. ACS Appl Mater Interfaces, 2017, 9(13): 11337-44.
[22] Fan HH, Yan GB, Zhao ZL, et al. A smart photosensitizer-manganese dioxide nanosystem for enhanced photodynamic therapy by reducing glutathione levels in cancer cells[J]. Angew Chem Int Ed Engl, 2016, 55(18): 5477-82.
[23]" Carvalho C, Santos RX, Cardoso S, et al. Doxorubicin: the good, the bad and the ugly effect[J]. Curr Med Chem, 2009, 16(25): 3267-85.
[24]" Yu J, Wang CX, Kong Q, et al. Recent progress in doxorubicin-induced cardiotoxicity and protective potential of natural products[J]. Phytomedicine, 2018, 40: 125-39.
[25]" Makwana V, Karanjia J, Haselhorst T, et al. Liposomal doxorubicin as targeted delivery platform: current trends in surface functionalization[J]. Int J Pharm, 2021, 593: 120117.
[26] Li X, He G, Jin H, et al. Dual-therapeutics-loaded mesoporous silica nanoparticles applied for breast tumor therapy[J]. ACS Appl Mater Interfaces, 2019, 11(50): 46497-503.
[27] Su C, Liu YZ, Li RZ, et al. Absorption, distribution, metabolism and excretion of the biomaterials used in Nanocarrier drug delivery systems[J]. Adv Drug Deliv Rev, 2019, 143: 97-114.
[28] Jain AK, Thareja S. In vitro and in vivo characterization of pharmaceutical nanocarriers used for drug delivery[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 524-39.
(编辑:郎" 朗)
