安罗替尼联合同步放化疗治疗局部晚期食管鳞状细胞癌的效果观察
2024-07-30王丽菲张洪菊郑英慧谢华

【摘要】 目的:探讨安罗替尼与同步放化疗(CCRT)治疗局部晚期食管鳞状细胞癌的临床效果。方法:回顾性分析2021年6月1日—2022年6月1日于聊城市传染病医院接受治疗的80例局部晚期食管鳞状细胞癌患者的临床资料,根据治疗方案分为对照组(n=38)和观察组(n=42)。对照组接受CCRT治疗,观察组接受CCRT和安罗替尼联合治疗。评估两组无进展生存期(PFS)、总生存期(OS)、疾病控制率(DCR)、客观缓解率(ORR)和不良事件(AE)。结果:观察组ORR、DCR分别为69.05%、90.48%,明显高于对照组的47.39%、63.16%,差异均有统计学意义(P<0.05)。对照组中位OS为16个月[95%CI(14.484,17.516)],观察组为20个月[95%CI(15.585,24.415)],两组差异有统计学意义(字2=7.341,P=0.007),对照组中位PFS为15个月[(95%CI(9.523,20.477)],观察组为20个月[95%CI(15.581,24.419)],两组差异有统计学意义(字2=12.844,P<0.001)。两组白细胞减少症、血小板减少症、贫血、胃肠道反应、放射性食管炎、皮肤反应发生率比较,差异均无统计学意义(P>0.05);观察组Ⅰ、Ⅱ级高血压发生率明显高于对照组(P<0.05)。结论:安罗替尼联合CCRT治疗局部晚期食管鳞状细胞癌可提高临床疗效,延长患者生存时间。
【关键词】 安罗替尼 同步放化疗 食管鳞状细胞癌 无进展生存期 总生存期
Observation on the Effect of Anlotinib Combined with Concomitant Radiochemotherapy in the Treatment of Locally Advanced Esophageal Squamous Cell Carcinoma/WANG Lifei, ZHANG Hongju, ZHENG Yinghui, XIE Hua. //Medical Innovation of China, 2024, 21(20): 0-052
[Abstract] Objective: To explore the clinical effect of Anlotinib combined with concomitant radiochemotherapy (CCRT) in the treatment of locally advanced esophageal squamous cell carcinoma. Method: Clinical data of 80 patients with locally advanced esophageal squamous cell carcinoma treated in Liaocheng Infectious Disease Hospital from June 1, 2021 to June 1, 2022 were retrospectively analyzed, and divided into control group (n=38) and observation group (n=42) according to treatment regimen. The control group was treated with CCRT, and the observation group was treated with CCRT combined with Anlotinib. Progression free survival (PFS), overall survival (OS), disease control rate (DCR), objective response rate (ORR) and adverse events (AE) of the two groups were evaluated. Result: The ORR and DCR of observation group were 69.05% and 90.48%, respectively, which were significantly higher than 47.39% and 63.16% of control group, the differences were statistically significant (P<0.05). The median OS was 16 months [95%CI (14.484, 17.516)] in the control group and 20 months [95%CI (15.585, 24.415)] in the observation group, the difference between the two groups was statistically significant
(字2=7.341, P=0.007). The median PFS was 15 months [95%CI (9.523, 20.477)] in the control group and 20 months [95%CI (15.581, 24.419)] in the observation group, the difference between the two groups was statistically significant (字2=12.844, P<0.001). There were no significant differences in the incidence of leucocytopenia, thrombocytopenia, anemia, gastrointestinal reaction, radiation esophagitis and cutaneous reaction between the two groups (P>0.05). The incidence of Ⅰ and Ⅱ grade hypertensive in observation group was significantly higher than that in control group (P<0.05). Conclusion: Anlotinib combined with CCRT in the treatment of locally advanced esophageal squamous cell carcinoma can improve the clinical efficacy, and prolong the survival time of patients.
[Key words] Anlotinib Concomitant radiochemotherapy Esophageal squamous cell carcinoma Progression free survival Overall survival
First-author's address: Department of Oncology, Liaocheng Infectious Disease Hospital, Liaocheng 252000, China
doi:10.3969/j.issn.1674-4985.2024.20.012
食管癌(EC)是全球第六大致死癌症,每年有近59万人死亡。食管鳞状细胞癌(ESCC)是EC的主要组织学亚型,约占90%以上,多见于40岁以上中老年人,通常,近一半的ESCC患者在诊断时已为晚期或出现转移。铂加紫杉醇或5-氟尿嘧啶(5-FU)同步联合放疗仍然是不可切除的局部晚期、晚期复发性或转移性ESCC的一线治疗方案,但客观缓解率(ORR)仅20%~60%,5年生存率较低[1-3]。因此,迫切需要开发更安全、更有效的治疗方案,以打破这一人群的治疗僵局,提高他们的生活质量并延长生存期。肿瘤的发展和转移与新生血管的形成密切相关,因此有效抑制新血管的生成是增强抗肿瘤效果的关键。安罗替尼是我国研发的抗血管生成新药,是一种多靶点受体酪氨酸激酶抑制剂,可高度筛选血管内皮生长因子(VEGF)受体2,抑制VEGF受体2激酶活性,阻断血管生成。同时,它还可以抑制血小板衍生生长因子受体、成纤维细胞生长因子受体和酪氨酸激酶受体等激酶发挥抗血管生成作用[4]。安罗替尼已被中国食品药品监督管理局批准用于晚期非小细胞肺癌的三线或进一步治疗,难治性转移性软组织肉瘤的二线或进一步治疗,局部晚期或转移性甲状腺髓样癌一线治疗。既往研究证实,安罗替尼单药作为ESCC二线治疗方案有效,因此,安罗替尼联合同步放化疗(CCRT)可能是一种具有潜力的治疗策略[5-6]。本研究回顾性分析了安罗替尼联合CCRT治疗局部晚期食管癌症患者的效果和安全性。
1 资料与方法
1.1 一般资料
回顾性分析2021年6月1日—2022年6月1日在聊城市传染病医院接受治疗的80例局部晚期ESCC患者的临床资料。纳入标准:(1)年龄18~85岁;(2)组织学或细胞学证实的局部晚期ESCC,美国癌症联合委员会第8版临床分期Ⅲ期,至少有一处不可切除且可测量的病变;(3)美国东部肿瘤协作组(ECOG)体能状态(PS)为0、1分。排除标准:(1)心肝肾功能障碍、骨髓抑制;(2)合并其他恶性肿瘤;(3)食道完全阻塞、食道深部溃疡、原发性病变活动性出血;(4)放疗、化疗或手术治疗史;(5)临床资料不完整。按照患者接受的治疗方案将患者分为对照组(n=38)和观察组(n=42)。本研究经聊城市传染病医院医学伦理委员会批准。
1.2 方法
对照组接受CCRT治疗。(1)放疗:患者仰卧位,手臂向两侧伸展或将肘部放在前额前方。从头顶到肋弓下缘进行增强CT扫描,图像传输至三维放疗计划系统VARIAN工作站。治疗方案为95%计划靶区(PTV) 60~64 Gy/1.8~2.0 Gy,或95%PTV 50 Gy/1.8~2.0 Gy、95%靶区外扩区(PGTV)10~
14 Gy/1.8~2.0 Gy,均是1次/d,5次/周。放射治疗方案制订后,放射肿瘤学家和技术人员对靶区方案进行了验证、确认和审查。(2)化疗:注射用紫杉醇(白蛋白结合型)(生产厂家:石药集团欧意药业有限公司,批准文号:国药准字H20183044,规格:100 mg)50 mg/m2,d1;顺铂[生产厂家:齐鲁制药(海南)有限公司,批准文号:国药准字H20073653,规格:20 mg] 20~25 mg/m2,d1~3,21 d为1个周期,共治疗2个周期。
观察组在对照组的基础上联合应用安罗替尼(生产厂家:正大天晴药业集团股份有限公司,批准文号:国药准字H20180004,规格:12 mg),在早餐前口服,12 mg/次,1次/d,在每个化疗周期的第1~14天治疗。
1.3 观察指标及判定标准
1.3.1 临床疗效 治疗后1个月,根据实体瘤临床疗效评价标准(RECIST)1.1评估近期疗效,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。ORR和疾病控制率(DCR)分别为达到CR、PR及CR、PR和SD患者占总例数的比例。
1.3.2 生存情况 根据随访记录,最后一次随访日期是2023年8月1日。无进展生存期(PFS)为从接受治疗开始到放射学进展或任何原因死亡的时间。总生存期(OS)为从随机化开始到因任何原因死亡的时间。
1.3.3 不良事件 根据美国国家癌症研究所制订的不良事件通用术语标准(CTCAE)5.0版对所有不良事件(AE)严重程度进行分级。不良事件包括骨髓抑制、放射性食管炎、胃肠道反应、高血压和皮肤反应。
1.4 统计学处理
将所有信息输入数据库,并使用SPSS 26.0进行分析。计数资料以率(%)表示,使用字2检验或Fisher精确检验进行组间比较,使用Kaplan-Meier法计算PFS和OS的中位数和95%CI,对数秩检验用于比较两个亚组的生存情况;计量资料用(x±s)表示,组间比较采用独立样本t检验。所有统计检验均采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较
对照组男24例,女14例;年龄42~83岁,平均(62.40±10.12)岁;肿瘤位置:颈部和上胸部
9例,中胸部20例,下胸部9例。观察组男25例,女17例;年龄40~85岁,平均(63.79±11.15)岁;肿瘤位置:颈部和上胸部11例,中胸部21例,下胸部10例。两组基线资料对比,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组临床疗效比较
观察组ORR、DCR均明显高于对照组,差异均有统计学意义(P<0.05),见表1。
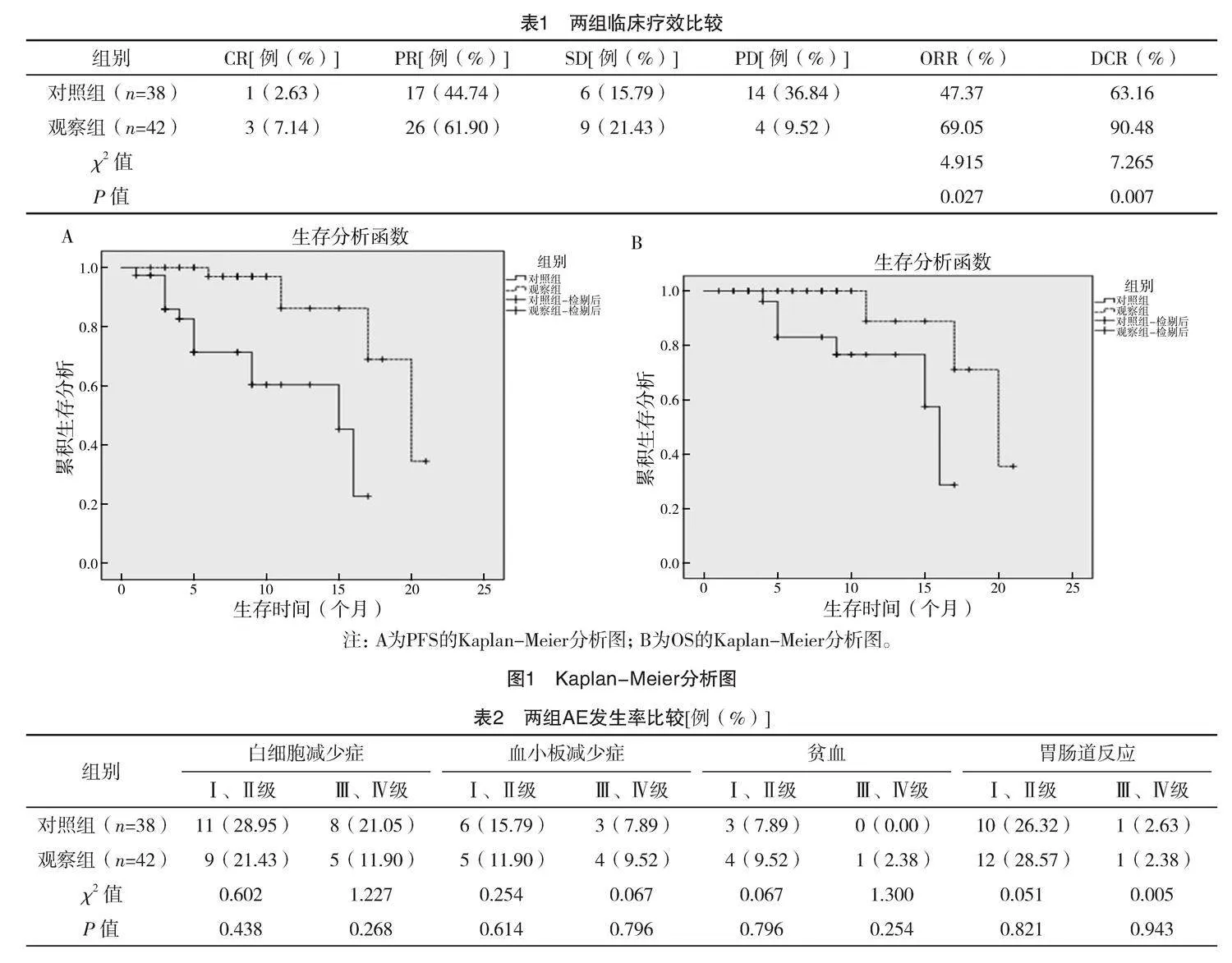
2.3 两组生存情况比较
对照组中位OS为16个月[95%CI(14.484,17.516)],观察组为20个月[95%CI(15.585,24.415)],两组差异有统计学意义(字2=7.341,P=0.007);对照组中位PFS为15个月[95%CI(9.523,20.477)],观察组为20个月[95%CI(15.581,24.419)],两组差异有统计学意义(字2=12.844,P<0.001)。见图1。
2.4 两组AE比较
两组白细胞减少症、血小板减少症、贫血、胃肠道反应、放射性食管炎、皮肤反应发生率比较,差异均无统计学意义(P>0.05);观察组Ⅰ、Ⅱ级高血压发生率明显高于对照组(P<0.05)。见表2。
3 讨论
ESCC起病隐匿、侵袭性强,多数ESCC患者初诊时已为晚期,已出现淋巴结或远处器官转移,预后较差,以铂类为基础的化疗联合放疗是我国局部晚期或转移性ESCC患者的标准一线治疗,然而,总体生存率仍然较低[7-8]。一项针对晚期ESCC患者的放化疗Ⅱ期试验报道,中位生存时间仅为10个月,2年生存率为31.5%[9]。因此,采用靶向治疗联合CCRT来提高局部晚期ESCC患者的疗效并减少复发和转移至关重要。
近年来,靶向抗血管生成药物引起了高度关注。病理性血管生成是肿瘤增殖和转移的重要因素[10-12]。
肿瘤血管生成过程受到多种因素的调控,其中VEGF是最关键的介质之一[13],安罗替尼已被证明可有效对抗肺癌、晚期软组织肉瘤、甲状腺癌、转移性肾细胞癌[14-16]。一项多中心Ⅱ期试验表明,与接受安慰剂治疗的患者相比,接受安罗替尼治疗的Ⅳ期ESCC患者通常表现出更好的PFS(3.02个月vs 1.41个月)、OS(6.11个月vs 7.20个月)及DCR(64% vs 18%)[17]。Wang等[18]研究表明,与单一CCRT相比,安罗替尼联合CCRT患者的PFS(5个月vs 2个月)、OS(9个月vs 5个月)均明显延长。本研究评估了安罗替尼作为局部晚期ESCC患者CCRT的补充药物的有效性,结果显示,观察组ORR、DCR均明显高于对照组,差异均有统计学意义(P<0.05),观察组PFS、OS均明显优于对照组(PFS:20个月vs 15个月;OS:20个月vs 16个月),这说明安罗替尼可以显著改善生存时间,与上述研究大体一致。
治疗期间不良事件的发生率被认为是诱导患者依从性的关键因素,本研究结果显示,除Ⅰ、Ⅱ级高血压外,两组患者其余不良事件发生率比较,差异均无统计学意义(P>0.05)。高血压被普遍认为是血管生成抑制剂,特别是VEGF受体酪氨酸激酶抑制剂的常见AE[19-20]。临床数据表明,接受安罗替尼治疗的晚期癌症患者中有42%~55%出现高血压,其中4.80%~13.60%的患者出现3级及以上高血压[21-22]。但由于各组中没有出现与不良事件相关的死亡率,与对照组相比,接受安罗替尼联合CCRT治愈患者的其他不良事件并未增加。因此,安罗替尼被认为是可控和可耐受的。
综上所述,安罗替尼联合CCRT方案显著提高了临床疗效,有利于局部晚期ESCC患者的治疗。
参考文献
[1]宋春涛,于永洋,高振,等.局部晚期食管癌免疫治疗的现状及前景[J].实用肿瘤杂志,2023,38(2):195-201.
[2]杨雄涛.食管癌综合治疗新进展[J].中国肿瘤临床,2023,50(2):98-103.
[3]冯国杰.食管癌放疗剂量及照射范围相关研究进展[J].中国肿瘤临床,2023,50(13):695-700.
[4]吴计松.安罗替尼联合紫杉醇对食管癌ECA-109细胞抑制作用及机制探讨[D].蚌埠:蚌埠医学院,2022.
[5]刘霜.安罗替尼联合化疗对非小细胞肺癌疗效与安全性的Meta分析[D].重庆:重庆医科大学,2022.
[6] ZENG H,CHEN W, ZHENG R,et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J/OL].Lancet Glob Health,2018,6(5):e555-e567.https://pubmed.ncbi.nlm.nih.gov/29653628/.
[7] JANMAAT M L,GALLEGOS-RUIZ M I,RODRIGUEZ J A,et al.
Predictive factors for outcome in a phase Ⅱ study of Gefitinib in second-line treatment of advanced esophageal cancer patients[J].
J Clin Oncol,2006,24(10):1612-1619.
[8] LORENZEN S,SCHUSTER T,PORSCHEN R,et al.Cetuximab plus Cisplatin-5-Fluorouracil versus Cisplatin-5-Fluorouracil alone in first-line metastatic squamous cell carcinoma of the esophagus: a randomized phase Ⅱ study of the Arbeitsgemeinschaft Internistische Onkologie[J].Ann Oncol,2009,20(10):1667-1673.
[9] ISHIDA K,ANDO N,YAMAMOTO S,et al.Phase Ⅱ study of Cisplatin and 5-Fluorouracil with concurrent radiotherapy in advanced squamous cell carcinoma of the esophagus: a Japan esophageal oncology group (JEOG)/Japan clinical oncology group trial (JCOG9516)[J].Jpn J Clin Oncol,2004,34(10):615-619.
[10] KATO K,CHO B C,TAKAHASHI M,et al. Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy (ATTRACTION-3): a multicentre, randomised, open-label, phase 3 trial[J].Lancet Oncol,2019,20(11):1506-1517.
[11]王文然,郭瑞,张华.HIF-1α靶向SP1促进食管鳞状细胞癌转移及血管生成的机制研究[J].现代肿瘤医学,2022,30(10):1734-1741.
[12]华月帆,何珂瑶,杨海军,等.肿瘤血管生成与食管癌研究进展[J].食管疾病,2023,5(3):214-219.
[13] LEE W S,YANG H, CHON H J, et al.Combination of anti-angiogenic therapy and immune checkpoint blockade normalizes vascular-immune crosstalk to potentiate cancer immunity[J].Exp Mol Med,2020,52(9):1475-1485.
[14] GAO Y,LIU P,SHI R.Anlotinib as a molecular targeted therapy for tumors[J].Oncol Lett,2020 ,20(2):1001-1014.
[15] HUANG J,XIAO J,FANG W,et al.Anlotinib in chemotherapy-refractory metastatic esophageal squamous cell carcinoma (ESCC): a randomized, double-blind, multicenter phase Ⅱ trial[J].J Clin Oncol,2019,37(4 Suppl):S95.
[16]董起杭,万里新,张凯,等.安罗替尼联合放射治疗对食管鳞状细胞癌细胞增殖、凋亡及放射治疗敏感性的影响[J].新乡医学院学报,2022,39(2):106-112.
[17]葛青青,石变,高启龙,等.PD-1抑制剂联合安罗替尼治疗化疗后进展的晚期食管鳞状细胞癌的回顾性研究[J].中国肿瘤临床,2022,49(10):519-523.
[18] WANG G,BEERAKA N M,XIAO W,et al.Comparative clinical efficacy of concurrent chemoradiotherapy (CCRT) and Anlotinib than CCRT in patients with locally advanced ESCC[J].Technol Cancer Res Treat,2022,21:15330338221080939.
[19]廖小兰,葛佳琪,朱海斌,等.基于FAERS数据库的VEGFR-TKIs相关高血压不良事件数据挖掘研究[J].药物流行病学杂志,2023,32(11):1201-1208.
[20]魏安华,丁玉峰,彭金兰.血管内皮生长因子受体酪氨酸激酶抑制剂致非小细胞肺癌患者高血压风险Meta分析[J].药物不良反应杂志,2018,20(1):30-37.
[21] DOBBIN S J H,CAMERON A C,PETRIE M C,et al. Toxicity of cancer therapy: what the cardiologist needs to know about angiogenesis inhibitors[J].Heart,2018,104:1995-2002.
[22] HAN B, LI K, WANG Q,et al. Effect of Anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer: the ALTER 0303 phase 3 randomized clinical trial[J].JAMA Oncol,2018,4:1569-1575.
(收稿日期:2024-05-13) (本文编辑:陈韵)
