Th2及Th17相关细胞因子在新生儿急性呼吸窘迫综合征中的表达及临床意义
2024-07-30尹冬琴李欢徐文慧温晓芳

【摘要】 目的:探究辅助性T细胞(Th)2及Th17相关细胞因子在新生儿急性呼吸窘迫综合征(ARDS)中的表达及临床意义。方法:回顾性分析2022年11月—2023年11月在上饶市人民医院出生的80例ARDS患儿纳入研究组,将同期80例健康新生儿纳入对照组。比较研究组和对照组血清Th2及Th17相关细胞因子[白细胞介素(IL)-4、IL-6、IL-10、IL-17]差异;将研究组根据氧合指数(OI)分为轻度组(4≤OI<8,n=30)、中度组(8≤OI<16,n=26)、重度组(OI≥16,n=24),比较血清IL-4、IL-6、IL-10、IL-17差异,并与OI进行相关性分析;将研究组根据28 d生存状态分为存活组(n=57)和死亡组(n=23),比较IL-4、IL-6、IL-10、IL-17差异并使用logistic回归分析验证对预后的影响,使用受试者操作特征(ROC)曲线分析对预后的效能。结果:研究组IL-4、IL-6、IL-10、IL-17水平均高于对照组,差异均有统计学意义(P<0.05),不同OI水平ARDS患儿急性生理学和慢性健康状况评估Ⅱ(APACHEⅡ)评分、序贯器官衰竭评估(SOFA)评分及IL-4、IL-6、IL-10、IL-17比较,差异均有统计学意义(P<0.05);ARDS患儿OI与IL-4、IL-6、IL-10、IL-17均呈正相关(P<0.05);死亡组IL-4、IL-6、IL-10、IL-17水平均高于存活组,差异均有统计学意义(P<0.05),IL-4、IL-6、IL-10、IL-17均为ARDS患儿死亡的危险因素(P<0.05);IL-4、IL-6、IL-10、IL-17及联合检测预测ARDS患儿死亡的AUC分别为0.806、0.879、0.801、0.862、0.991。结论:Th2及Th17相关细胞因子在ARDS患儿中异常升高,与OI明显相关,检测ARDS患儿Th2及Th17相关细胞因子有助于诊疗评估。
【关键词】 辅助性T细胞 Th2 Th17 新生儿急性呼吸窘迫综合征
Expression and Clinical Significance of Th2 and Th17 Related Cytokines in Neonatal Acute Respiratory Distress Syndrome/YIN Dongqin, LI Huan, XU Wenhui, WEN Xiaofang. //Medical Innovation of China, 2024, 21(20): -167
[Abstract] Objective: To explore the expression and clinical significance of helper T cell (Th) 2 and Th17 related cytokines in neonatal acute respiratory distress syndrome (ARDS). Method: A total of 80 children with ARDS born in Shangrao People's Hospital from November 2022 to November 2023 were retrospectively analyzed and included in study group, and 80 healthy neonates during the same period were included in control group. The differences in serum Th2 and Th17 related cytokines (IL-4, IL-6, IL-10, IL-17) were compared between study group and control group. According to the oxygenation index (OI), the children in study group were classified into mild group (4≤OI<8, n=30), moderate group (8≤OI<16, n=26) and severe group (OI≥16, n=24). The differences in serum IL-4, IL-6, IL-10 and IL-17 were compared and the correlation with OI was analyzed. The children in study group were divided into survival group (n=57) and death group (n=23) by means of the 28-day survival status, and the IL-4, IL-6, IL-10 and IL-17 were compared. logistic regression analysis was used to verify the influence on prognosis, and ROC curve was applied to analyze the efficiency on prognosis. Result: The levels of IL-4, IL-6, IL-10 and IL-17 in study group were higher than those in control group, the differences were statistically significant (P<0.05). There were statistically significant differences in acute physiology and chronic health evaluation Ⅱ (APACHEⅡ) score, sequential organ failure assessment (SOFA) score, IL-4, IL-6, IL-10
and IL-17 among ARDS children with different OI levels (P<0.05). OI in children with ARDS was positively correlated with IL-4, IL-6, IL-10 and IL-17 (P<0.05). The levels of IL-4, IL-6, IL-10 and IL-17 in death group were higher than those in survival group, the differences were statistically significant (P<0.05). IL-4, IL-6, IL-10
and IL-17 were risk factors for death in ARDS children (P<0.05). The AUC of IL-4, IL-6, IL-10, IL-17 and combined detection for predicting death of ARDS children were 0.806, 0.879, 0.801, 0.862 and 0.991, respectively. Conclusion: Th2 and Th17 related cytokines are abnormally elevated in ARDS children, which is significantly correlated with OI, detection of Th2 and Th17-related cytokines in ARDS children is helpful for diagnosis and treatment evaluation.
[Key words] Helper T cell Th2 Th17 Neonatal acute respiratory distress syndrome
First-author's address: Department of Neonatology, Shangrao People's Hospital, Shangrao 334000, China
doi:10.3969/j.issn.1674-4985.2024.20.038
急性呼吸窘迫综合征(ARDS)是新生儿常见危重症,是出生1个月内婴儿的重要死亡原因[1-2]。ARDS是急性肺损伤的严重阶段,患儿以进行性呼吸窘迫和难治性低氧血症为特征,可由感染、误吸等多种原因导致[3]。新生儿ARDS由于免疫功能低下、肺功能发育不完全等原因,较儿童和成人ARDS病情更凶险,预后更差,寻找一个简单、安全性高的实验室检查来评估新生儿ARDS的病情严重程度及预后存在必要性[4-5]。ARDS发病机制复杂,其与患儿肺内异常炎症水平密不可分,有学者认为免疫功能失调,引起肺内炎症是ARDS病理基础[6]。Tan等[7]研究发现调节脂多糖诱导的ARDS动物模型体内辅助性T细胞(Th)免疫反应可促进肺修复,提醒Th在ARDS诊疗过程中的研究价值。Th2、Th17是目前临床研究较为熟悉的Th类型,被认为在人体免疫调节中发挥重要作用,其可释放多种细胞因子广泛参与免疫炎症反应,与多种疾病发病机制相关[8-9]。基于此,本研究探讨Th2及Th17相关细胞因子在ARDS新生儿中的表达及临床意义,为今后临床诊断与预后评估提供参考。
1 资料与方法
1.1 一般资料
选取2022年11月—2023年11月在上饶市人民医院出生的80例ARDS患儿纳入研究组,纳入标准:符合ARDS诊断标准[10];性别不限;胎龄>24周;发病至确诊时间<7 d;临床资料完整。排除标准:呼吸系统先天发育不全;呼吸系统及其他器官或系统先天畸形等;恶性肿瘤;多器官衰竭;羊水吸入综合征;脑性过度换气。将同期80例健康新生儿纳入对照组,纳入标准:性别不限;足月,单胎;临床资料完整。排除标准:遗传性疾病;器官或系统功能障碍;恶性消耗性疾病;严重新生儿并发症。本研究经上饶市人民医院医学伦理委员会批准。
1.2 方法
收集两组新生儿临床资料及血清Th2及Th17相关细胞因子检测结果。检测方法:取ARDS患儿及健康新生儿静脉血5 mL,经离心(转速3 000 r/min,半径16 cm,时间10 min)分离血清样本,使用酶联免疫吸附试验(ELISA)测定血清Th2及Th17相关细胞因子IL-4、IL-6、IL-10、IL-17浓度。
研究组患儿入新生儿重症监护病房(NICU)后24 h内首次机械通气时计算氧合指数(OI)=(平均气道压×吸入氧浓度/动脉血氧分压)×100,将患儿根据OI分为轻度组(4≤OI<8,n=30)、中度组(8≤OI<16,n=26)、重度组(OI≥16,n=24),比较急性生理学和慢性健康状况评估Ⅱ(APACHEⅡ)评分、序贯器官衰竭评估(SOFA)评分及血清Th2、Th17相关细胞因子,使用Pearson相关系数分析上述指标与OI相关性。APACHEⅡ评分范围0~71分,SOFA评分范围0~24分,二者均与病情严重程度呈正相关[11]。
研究组患儿根据28 d内生存状态分为存活组(n=57)和死亡组(n=23),比较血清Th2及Th17相关细胞因子差异,使用logistic回归分析上述指标验证对预后的影响,使用受试者操作特征(ROC)曲线分析上述指标对预后的效能。
1.3 统计学处理
采用SPSS 24.0处理数据,定量指标、定性指标分别用(x±s)及率(%)表示,定量指标组间比较使用独立样本t检验或单因素方差分析,多组间两两比较采用SNK-q法;定性指标组间比较使用字2检验;相关性分析使用Pearson相关系数;影响因素分析使用logistic回归分析;预后预测效能分析使用ROC曲线。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 研究组和对照组基线资料比较
研究组男女分别为45、35例,日龄1~29 d,平均(18.02±2.31)d,早产43例,剖宫产46例,病因:肺炎23例,误吸27例,脓毒症30例;对照组男女分别为43、37例,日龄2~26 d,平均(17.14±2.34)d,剖宫产21例。两组性别、日龄比较差异均无统计学意义(P>0.05),具有可比性。
2.2 研究组和对照组血清Th2及Th17相关细胞因子比较
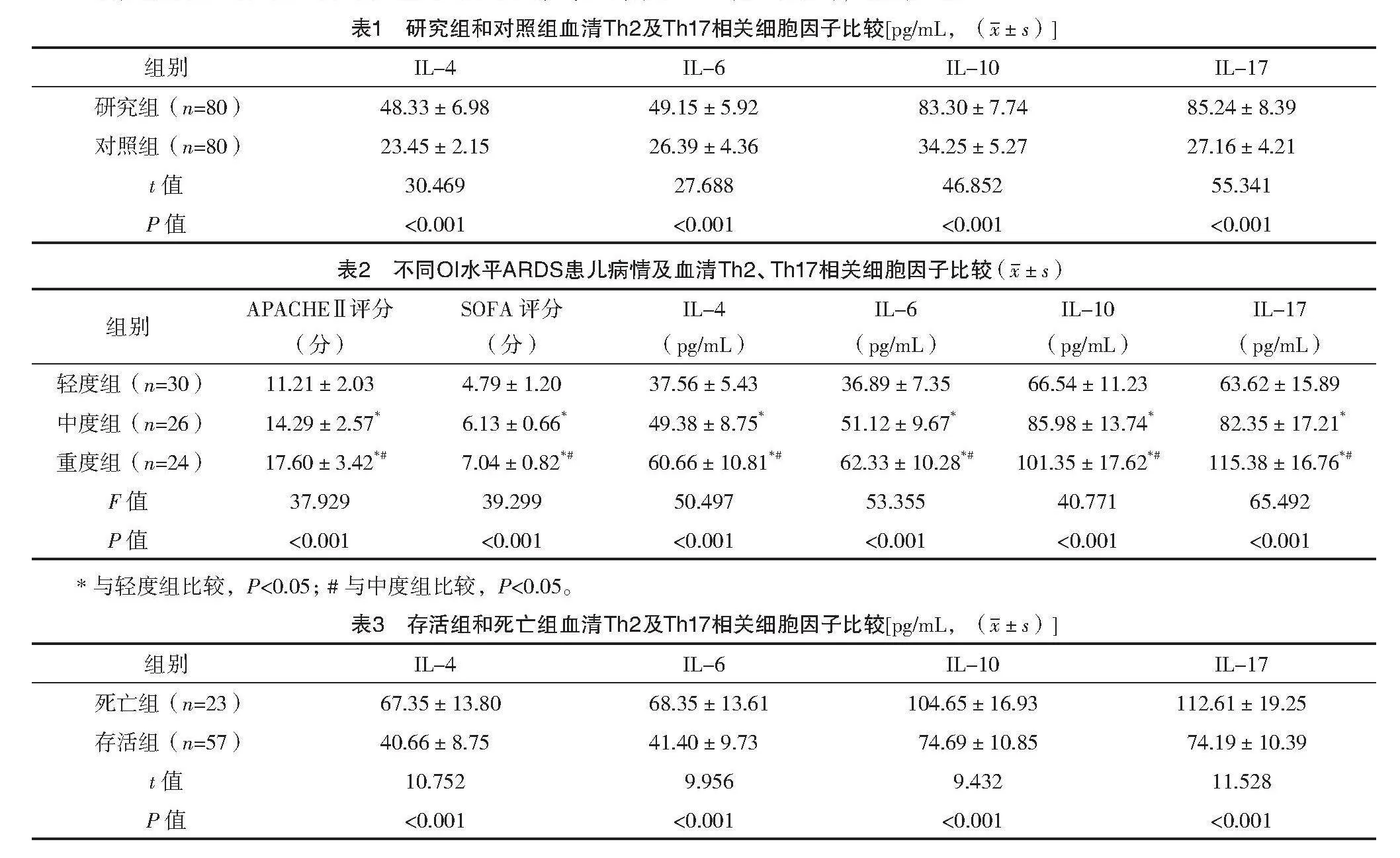
研究组IL-4、IL-6、IL-10、IL-17水平均高于对照组,差异均有统计学意义(P<0.05),见表1。
2.3 不同OI水平ARDS患儿病情及血清Th2、Th17相关细胞因子比较
不同OI水平ARDS患儿APACHEⅡ评分、SOFA评分、IL-4、IL-6、IL-10、IL-17比较,差异均有统计学意义(P<0.05);上述指标比较,重度组>中度组>轻度组,差异均有统计学意义(P<0.05)。见表2。
2.4 ARDS患儿OI与血清Th2、Th17相关细胞因子相关性
Pearson相关系数分析显示,ARDS患儿OI与IL-4、IL-6、IL-10、IL-17均呈正相关(r=0.485、0.392、0.423、0.529,P<0.001)。
2.5 存活组和死亡组血清Th2及Th17相关细胞因子比较
死亡组IL-4、IL-6、IL-10、IL-17水平均高于存活组,差异均有统计学意义(P<0.05),见表3。
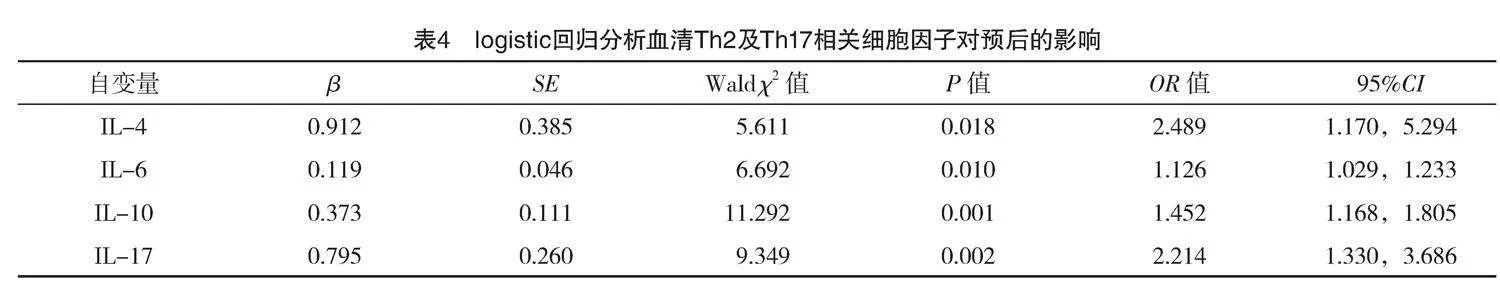
2.6 logistic回归分析血清Th2及Th17相关细胞因子对预后的影响
以ARDS患儿预后为应变量(死亡=1,存活=0),IL-4、IL-6、IL-10、IL-17为自变量(连续变量不赋值),logistic回归分析显示,IL-4、IL-6、IL-10、IL-17均为ARDS患儿死亡的危险因素(P<0.05),见表4。
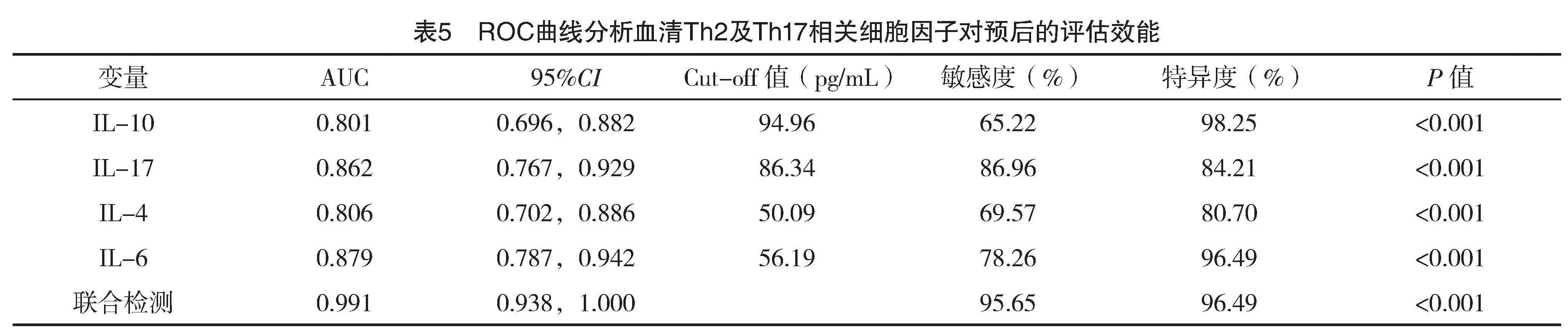
2.7 ROC曲线分析血清Th2及Th17相关细胞因子对预后的评估效能
ROC曲线分析显示,IL-4、IL-6、IL-10、IL-17及联合检测均可有效预测ARDS患儿预后(P<0.05),见表5、图1。
3 讨论
ARDS是新生儿中常见的严重肺部疾病,尤其是早产儿死亡率较高。在目前精准医疗背景下识别ARDS并不困难,但分辨其疾病来源,预测预后以指导诊疗方案制订方向仍需探索[12]。有研究认为免疫功能损害是提升ARDS死亡风险的危险因素,提醒从免疫相关指标预测ARDS患儿预后的可行性[13]。
本研究结果显示较健康新生儿,ARDS患儿体内各项血清Th2及Th17相关细胞因子水平异常升高。Th2是CD4+T细胞亚群,通过产生IL-4、IL-6、IL-10等细胞因子参与免疫炎症反应,在宿主防御病原体和过敏原方面发挥重要作用。同时有研究表明Th2细胞可促进炎症反应后受伤组织的修复,但其代谢异常时会诱发病理性纤维化,导致器官衰竭和死亡[14]。ARDS由急性肺损伤进展而来,可由感染、创伤、休克等疾病引起,机体感知刺激后可促使Th细胞分化为Th1、Th2两个亚群进行免疫调节,其中Th1参与细胞免疫,Th2参与体液免疫,二者动态平衡发挥免疫功能[15]。而ARDS患儿体内广泛的炎症提醒Th1/Th2失衡,Th2异常过合成相关细胞因子,其中IL-4、IL-10等抗炎因子过度分泌可导致免疫抑制,而IL-6等促炎因子可扩大疾病。Th17同属CD4+T细胞,其主要细胞因子为IL-17,目前研究认为其在多种炎症相关疾病及自身免疫性疾病患者中异常分泌,Th17反应受损与慢性皮肤黏膜念珠菌病及肺部和皮肤中的细菌感染有关[16]。
ARDS患儿由于缺乏肺表面活性物质难以维持气体交换时肺泡形态,血氧水平明显下降,病情进展常通过缺氧程度判断,常见量化指标为OI,是临床广泛使用的病情及预后评估工具[17]。结果显示不同OI水平的ARDS患儿血清Th2及Th17相关细胞因子水平存在差异,随病情严重而升高,且经Pearson相关系数验证存在相关性。ARDS患儿呈现广泛的炎症反应,提示体内免疫功能严重紊乱,未及时纠正免疫功能使体内炎症细胞因子和趋化因子水平持续升高,从细胞层面来看,增加肺泡-毛细血管膜通透性,促进肺纤维化形成,从组织层面看,炎症介质的持续产生导致组织损伤、血管内和血管外凝血及间充质细胞增殖,可阻碍肺修复和加重其他器官功能障碍,促使ARDS病情进展[18]。值得注意的是,ARDS新生儿获取OI计算相关指标(平均气道压、动脉血氧分压)较为困难,Th2及Th17相关细胞因子作为血清学检验,样本易得,有助于减少临床工作负担。
ARDS有高度异质性的特点,临床实践过程中不同患儿接受同一治疗方案预后表现差异较大,明显增加患儿家庭疾病负担,因此针对患儿预后探寻有效评估指标具有重要临床价值[19]。结果显示不同生存状态ARDS患儿各项血清Th2及Th17相关细胞因子水平存在差异,死亡组水平明显更高,经logistic回归分析验证均为患儿死亡的危险因素,分析原因:ARDS患儿病情随炎症扩大恶化,严重可引发全身多器官衰竭,明显提高病死风险[20]。ROC曲线结果显示Th2及Th17相关细胞因子均有作为预后预测指标的价值。值得关注的是IL-4、IL-6、IL-10、IL-17普遍敏感度较特异度低,可见存在一定假阴性概率,考虑是因为Th2及Th17广泛参与人体免疫炎症调节过程中,对ARDS的针对性不足,而且ARDS存在高度异质性,可导致临床预后误判。但结果中联合检测敏感度、特异度均较高,这提醒ARDS患儿预后评估中不能以单一免疫指标作为决定性参考,联合检测有更好预后预测效能。
综上所述,ARDS患儿与健康新生儿间Th2及Th17相关细胞因子水平存在明显差异,ARDS患儿随病情严重Th2及Th17相关细胞因子水平同步上升,检测ARDS患儿Th2及Th17相关细胞因子可用于预后评估,联合检测较单一检测预测效能明显提高。
参考文献
[1]迟明,梅亚波,封志纯.新生儿急性呼吸窘迫综合征研究进展[J].中国当代儿科杂志,2018,20(9):724-728.
[2]王鑫鑫,童玲,张舒,等.早产儿急性呼吸窘迫综合征血清1,25-(OH)2D3、PGRN、SIRT1、CTRP3水平与炎症反应和预后的关系研究[J].现代生物医学进展,2023,23(6):1169-1174.
[3]程旺松,苏小智,陈鼎瑞.新生儿急性呼吸窘迫综合征患儿血清miR-877-5p表达变化及其与病情严重程度和预后的关系[J].山东医药,2023,63(25):5-8.
[4] DE LUCA D,VAN KAAM A H,TINGAY D G,et al.The montreux definition of neonatal ARDS: biological and clinical background behind the description of a new entity[J].Lancet Respir Med,2017,5(8):657-666.
[5]张琴,顾伟,陈俊,等.氧合指标及呼吸机参数对机械通气治疗儿童ARDS的预后评价[J].南京医科大学学报(自然科学版),2022,42(12):1734-1740.
[6] NING L,SHISHI Z,BO W,et al.Targeting immunometabolism against acute lung injury[J].Clin Immunol,2023,249:109289.
[7] TAN W,ZHANG C,LIU J,et al.Regulatory T-cells promote pulmonary repair by modulating T helper cell immune responses in lipopolysaccharide-induced acute respiratory distress syndrome[J].Immunology,2019,157(2):151-162.
[8]杨柳,蔡涛.Th2及Th17相关细胞因子在慢性自发性荨麻疹发病机制中的作用研究进展[J].重庆医科大学学报,2022,47(12):1436-1440.
[9]高海兵,赵志宏,霍小琴,等.Th1/Th2/Th17细胞因子在黑热病中的变化分析[J].山西医药杂志,2022,51(10):1162-1164,封3.
[10]中国医师协会新生儿科医师分会.“新生儿急性呼吸窘迫综合征”蒙特勒标准(2017年版)[J].中华实用儿科临床杂志,2017,32(19):1456-1458.
[11]江浩,郑贸根,朱超男,等.APACHEⅡ、ISS、SOFA评分对创伤继发ARDS严重程度及预后的预测价值比较[J].临床肺科杂志,2018,23(11):2074-2078.
[12] LIU J.Ultrasound diagnosis and grading criteria of neonatal respiratory distress syndrome[J].J Matern Fetal Neonatal Med,2023,36(1):2206943.
[13] WANG Z,XING L,CUI H,et al.A nomogram for predicting the mortality of patients with acute respiratory distress syndrome[J].J Healthc Eng,2022,2022:5940900.
[14] KOKUBO K,ONODERA A,KIUCHI M,et al.Conventional and pathogenic Th2 cells in inflammation, tissue repair, and fibrosis[J].Front Immunol,2022,13:945063.
[15]金载璇,吴斌.儿童急性呼吸窘迫综合征CD4+T细胞亚群格局及其影响研究[J].蚌埠医学院学报,2021,46(4):521-524.
[16] CERBONI S,GEHRMANN U,PREITE S,et al.Cytokine-regulated Th17 plasticity in human health and diseases[J].Immunology,2021,163(1):3-18.
[17] DESPREZ K,MCNEIL J B,WANG C,et al.Oxygenation saturation index predicts clinical outcomes in ARDS[J].Chest,2017,152(6):1151-1158.
[18] MEDURI G U,ANNANE D,CHROUSOS G P,et al.
Activation and regulation of systemic inflammation in ARDS: rationale for prolonged glucocorticoid therapy[J].Chest,2009,136(6):1631-1643.
[19]石颖,左祥荣,曹权.急性呼吸窘迫综合征的表型及内型研究进展[J/OL].中华重症医学电子杂志,2020,6(2):215-222.https://icu.cma-cmc.com.cn/CN/10.3877/cma.j.issn.2096-1537.2020.02.022.
[20]周杰,温晓芳,李俊,等.血清25-(OH)D3、IL-6、IL-17在新生儿急性呼吸窘迫综合征中的临床意义[J].中国医学创新,2023,20(22):147-151.
(收稿日期:2024-05-16) (本文编辑:张爽)
