原理和思维是数字化实验教学的根基
2024-07-18朱成东杨涛徐泓


摘要:结合“压强对化学平衡的影响”“对比二氧化碳在等体积饱和碳酸氢钠溶液和水中的溶解量”“探究镁与氯化铵溶液的反应”3个典型案例,阐述了压强传感器在中学化学实验教学起重要的辅助作用,如要充分发挥数字化实验效能,准确测量和科学解释,师生必须明确传感器工作原理、规范使用仪器,理解实验原理、正确解读数据。高效数字化实验不仅需要技术支持,而且需要实验者理解原理,打破惯性,创新思维。
关键词:数字化实验;压强传感器;创新实验
数字化实验教学体现了信息技术与实验教学的深度融合。数字化实验载入不同版本的普通高中化学教材,引发了新一轮探讨实验教学的高潮。压强传感器是常用的测量气压且相对稳定的仪器。为便于教师更加科学、准确地使用技术工具开展数字化实验,服务课堂教学,笔者结合典型案例剖析实验现象背后的原理或成因,指出压强传感器实验教学中依赖技术而忽视原理和思维的误区,并在分析、解读、评价的基础上给出对策与建议。
一、掌握压强传感器工作原理是实验的前提
掌握实验原理是教师开展实验研究与教学的前提。目前,一些教师开展数字化实验教学,只关注诸多传感器的应用,忽略了传感器的工作原理。笔者针对所在区域内高中化学教师进行调查,发现90%以上的教师并不清楚用于测定pH、温度、压强、氧气的传感器的工作原理,也未能充分重视不同传感器在使用过程中的注意事项,导致误读实验数据,影响实验结果的可信度。甚至有学者称“传感器不好用,也会‘骗人’”[1]。压强传感器是中学教学中常用的数字化仪器,在物理、化学等学科教学中应用较为普遍。在高中化学教学中,压强传感器常被用于探究压强对化学平衡的影响、镁与盐酸反应的速率等气体相关性质和变化实验。准确了解其工作原理,不仅有利于教师在教学中更好地根据原理设计实验、解读数据,而且有利于学生跨学科学习,综合运用知识解决实际问题,提高创新思维能力。
在化学教学中,压强传感器多用于测量绝对压力。压强传感器关键部件是压力转换器,它有一块可伸缩变化的薄膜,薄膜一边是真空,另一边开放(连通大气)。压强传感器工作原理:当薄膜受到压力时会产生形变,根据形变量传感器产生输出电压,输出电压与绝对压力呈线性关系,从而输出压强值。此外,压强传感器中还包含两个特别电路,一个特别电路用来减小温度变化可能导致的误差;另一个提供放大电路调整压力转换器信号,使输出电压与压力保持线性关系。
二、基于典型案例评析压强传感器实验教学
(一)压强对化学平衡的影响
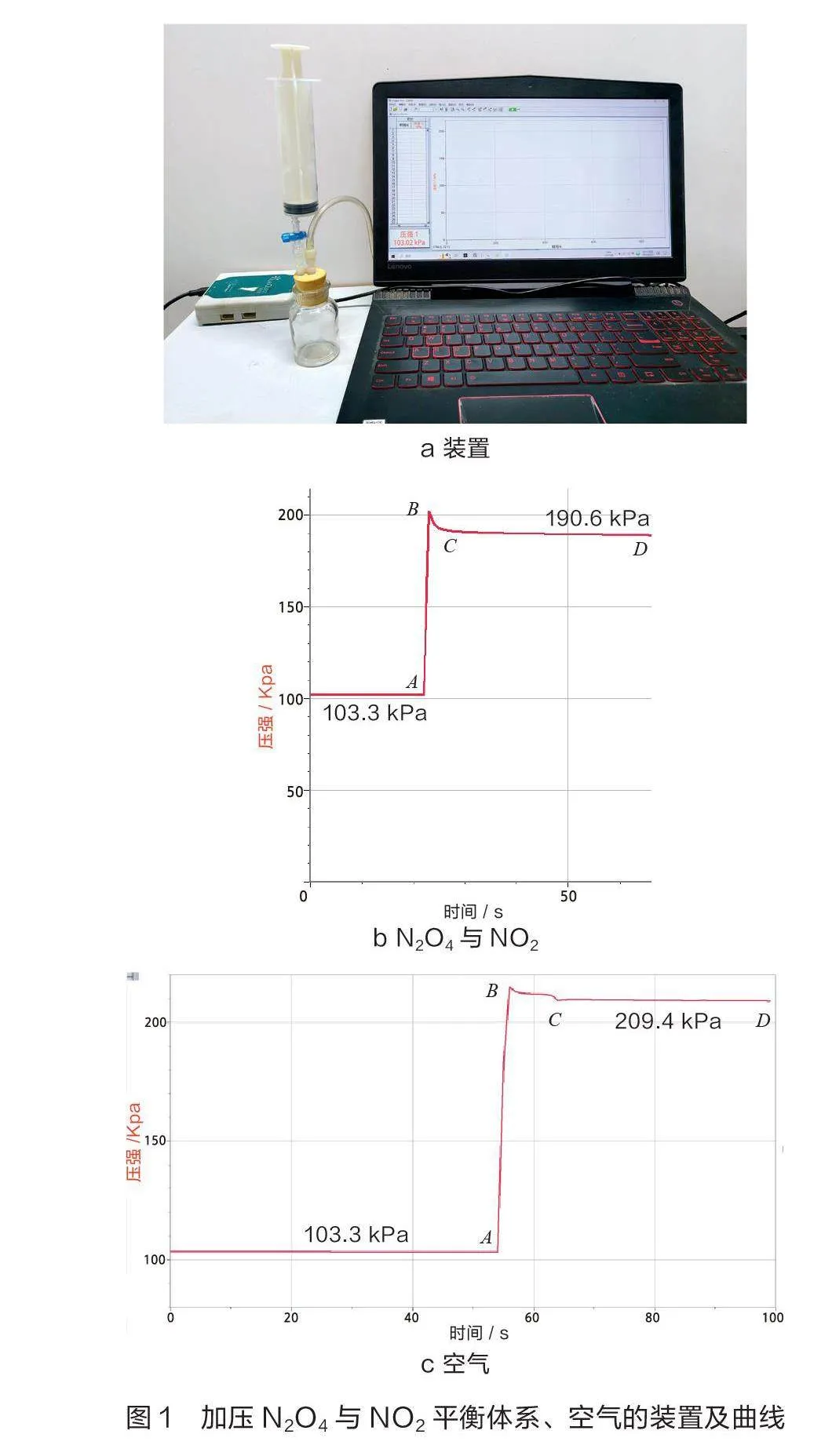
利用二氧化氮与四氧化二氮相互转化探究压强对化学平衡的影响是中学化学教学中的经典实验,也是化学教师讨论较多的实验之一。随着数字化实验的普及,部分教师已经开始运用数字化实验对其进行深度研究。孟茂[2]、张玉娟[3]、王春[4]均以“二氧化氮与四氧化二氮相互转化”为例,用压强传感器探究压强对化学平衡的影响,并将曲线解读为“迅速改变压强后,压强的微小变化是平衡移动过程”。笔者用图1a装置分别对二氧化氮与四氧化二氮平衡体系、空气进行加压,使其体积缩小为原来的1/2,测其压强变化量,得到曲线如图1b、图1c所示。由于二氧化氮与四氧化二氮相互转化的速率极大,改变压强,再次达到平衡的时间是微秒(1微秒=10-6秒)级别[5][6],所以BC段的出现并非平衡移动所致。根据压强传感器的工作原理,BC段的变化是迅速加压时,气体对压强传感器薄膜的冲击后恢复至稳定状态过程中产生的,而缓慢加压未出现类似BC段的尖角。
教师借助针管开展传统实验,让学生观察颜色变化情况理解化学平衡的移动,但效果不理想。数字化实验则可以让学生定量分析加压对化学平衡的影响。由图1c可知,压缩空气使其体积缩小1/2时,由于体系没有化学平衡,故压强从103.3 kPa增至209.4 kPa,压强增大约一倍;压缩二氧化氮与四氧化二氮平衡体系,使其体积缩小1/2。由图1b可知压强从103.3 kPa只增加到190.6 kPa,比103.3 kPa的两倍相差16 kPa。对比两组实验数据可知,压强减小16 kPa,这印证了加压时平衡向气体体积减小的方向移动。
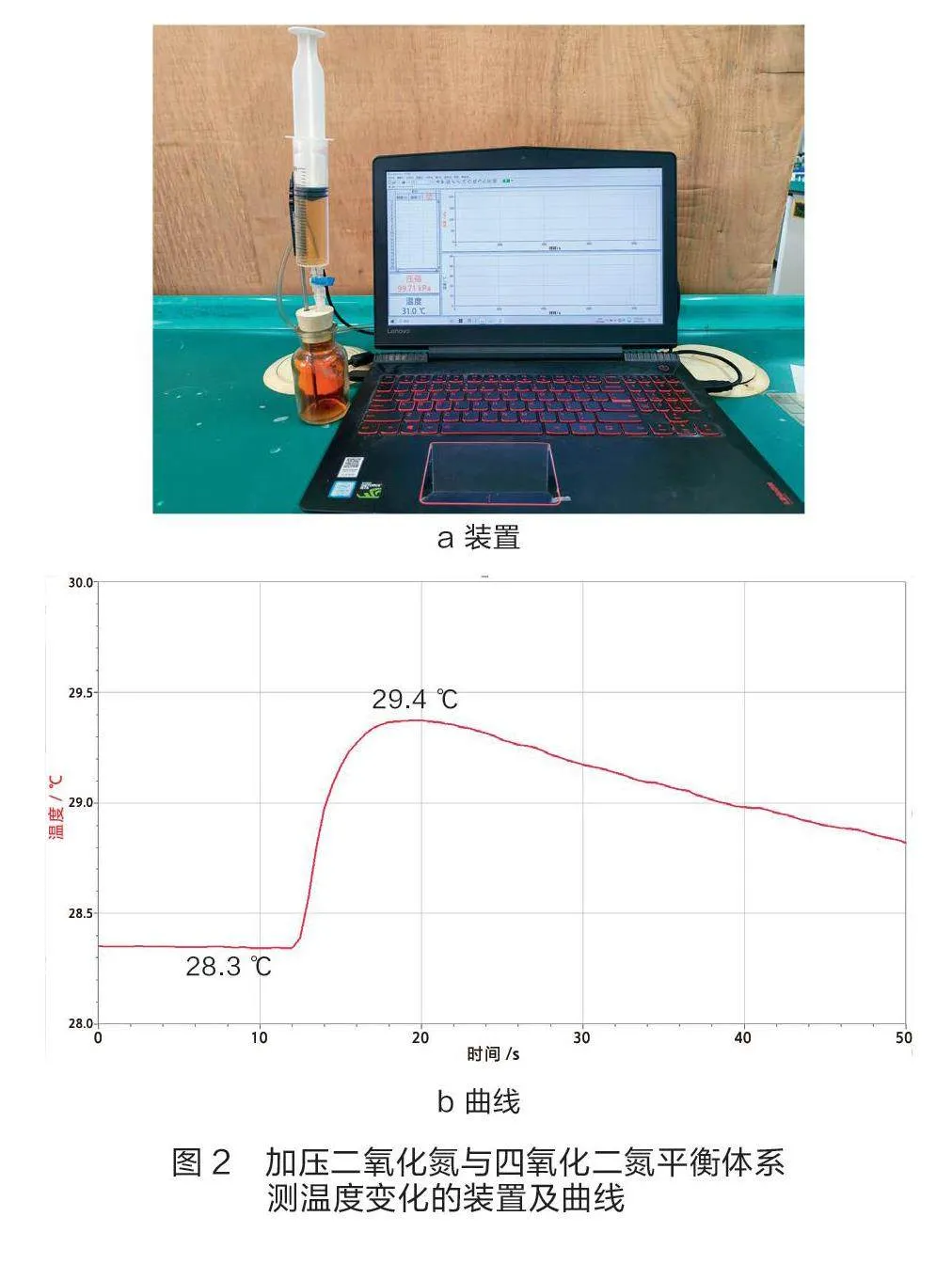
有学者认为,加压过程是外界对体系做功,会使体系温度升高,在降温过程中平衡发生移动,使压强稍有下降[7][8]。笔者用温度传感器测量加压使其体积减小1/2时温度的变化情况,装置如图2a所示,温度变化曲线如图2b所示。
迅速加压使体积缩小1/2,理论上可使其体系温度上升16 K[9]。由图2b可知,在非绝热体系中其温度仅上升1.1 K,且温度达到最高所需时间远比压强达到最大的时间要短。根据压强传感器的工作原理(传感器中包含一个特别电路,用来减小温度变化可能导致的误差),温度上升或下降1.1 K对压强的影响或对平衡常数的影响均可忽略不计。
综上所述,利用压强传感器研究压强对化学平衡的影响时,当体积缩小1/2时,可忽略因体积功而使温度升高对实验的影响,应重视定量分析,即通过定量对比加压后其压强的变化量来判断化学平衡移动的方向。
(二)对比二氧化碳在等体积饱和碳酸氢钠溶液和水中的溶解量
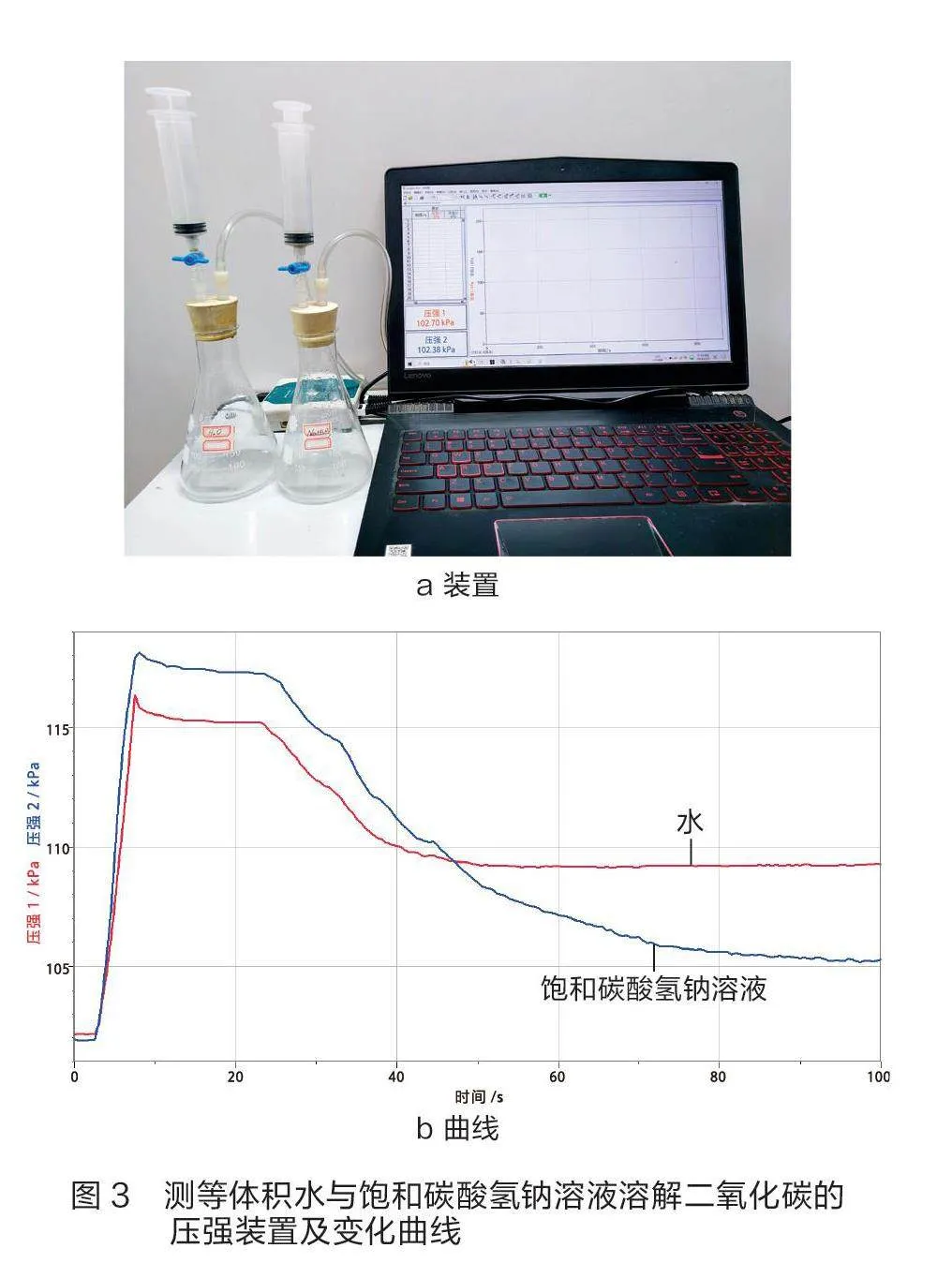
用饱和碳酸氢钠溶液除去二氧化碳中混有的氯化氢是化学教学中的常见方案。对用饱和碳酸氢钠溶液除去二氧化碳中混有氯化氢的解释,常见的共识性解释为:首先,二氧化碳与水反应生成碳酸,碳酸电离出氢离子与碳酸氢根离子,在饱和碳酸氢钠溶液中,碳酸氢根离子浓度大,抑制碳酸的电离,从而降低其在饱和碳酸氢钠溶液中的溶解度,减少二氧化碳的损耗;其次,碳酸氢钠与氯化氢反应生成二氧化碳,会增加二氧化碳的量。根据以上解释不难看出,用饱和碳酸氢钠溶液相比用水除去二氧化碳中混有氯化氢的优势要明显。为对比二氧化碳在等体积饱和碳酸氢钠溶液和水中溶解的量,笔者设计了如图3a所示的实验装置。两个锥形瓶中收集满干燥的二氧化碳气体,两个针筒分别加入等体积的饱和碳酸氢钠溶液和蒸馏水,两个压强传感器分别连在两个锥形瓶中,再通过数据采集器与计算机相连。
实验时,笔者将等体积的饱和碳酸氢钠溶液与蒸馏水同时压入锥形瓶中,关闭阀门,一段时间后得到压强变化曲线,如图3b所示。观察曲线可知,相同条件下,相同体积的饱和碳酸氢钠溶液与蒸馏水对比,二氧化碳在饱和碳酸氢钠溶液中溶解的量比在等体积的水中多,即相同条件下用水除二氧化碳中的氯化氢比用等体积的饱和碳酸氢钠溶液损耗的二氧化碳要少。如何解释其原因?不妨换个角度思考:蒸馏水是中性,而饱和碳酸氢钠溶液呈碱性,二氧化碳是酸性气体,所以二氧化碳在饱和碳酸氢钠中的溶解度大一些。
二氧化碳在饱和碳酸氢钠溶液中的溶解问题是复杂体系中的多因素问题。学生解决这类问题需要有证据意识,要用实验事实说话,而不是从单一角度推理得到结论。笔者借助压强传感器开展“对比二氧化碳在等体积饱和碳酸氢钠溶液和水中溶解量”实验证明,信息技术对化学实验有推动作用,数字化仅是实验手段,创新关键是深入实践与转变思维,增强质疑和批判意识,打破思维定式。
(三)探究镁与氯化铵溶液的反应
镁与氯化铵溶液的反应也是中学化学教学中常见的实验,对其反应过程存在不同看法:一般认为是铵根离子水解呈酸性,金属镁与氢离子反应生成氢气,同时促使铵根离子继续水解;也有学者认为是镁直接与铵根离子反应生成氢气;还有学者认为是镁与水反应生成氢气和氢氧化镁,氢氧化镁附着在镁表面阻止了反应,铵根离子与氢氧化镁反应,消耗镁表面的氢氧化镁,从而镁再与水反应。为探讨镁与氯化铵溶液的反应,笔者用图4a装置测量5 cm长的镁条(打磨除去表面的薄膜)与10 mL 0.1 mol/L 氯化铵溶液反应的pH变化量,其变化曲线如图4b所示。
由图4b可知,镁与氯化铵溶液反应开始时,溶液pH迅速升高,然后稳定在9左右(形成氯化铵与氨水的缓冲溶液),整个过程中溶液始终产生大量气泡,可持续24小时,最终溶液的pH升到10。笔者引导学生从热力学的视角通过计算判断铵根离子、不同浓度的氢离子与镁反应的可能性。
查得相关物质的标准吉布斯(Gibbs)生成自由能Δf G mθ如下[10]:NH4+、NH3和H2的Δf G mθ的值分别为-79、-16.4和0,单位为kJ·mol-1。
求得电极反应2NH4++2e-=2NH3+H2的Δr G mθ=125.2 kJ·mol-1。
根据Δr G mθ=-zE θF,求得电对NH4+/H2的E θ= -0.65 V。
已知NH3·H2O的Kb=1.77×10-5。0.1 mol·L-1氯化铵溶液中铵根离子发生水解:
NH4++H2ONH3·H2O+H+
则 ,解得[H+]=
7.52×10-6 mol·L-1。
假设气体均处于标准状态,根据能斯特方程可求0.1 mol·L-1氯化铵溶液中氢离子和铵根离子的电极电势:
lg(7.52×10-6)2=-0.303 (V)
×lg0.01=-0.71 (V)
随后计算pH=9时的电极电势:
×lg(1×10-9)2=-0.533 (V)
Mg2++2e-=Mg的电极电势为-2.372 V。
计算可知,pH=9时,氢离子也可以氧化镁,而0.1 mol/L氯化铵溶液中铵根离子也可以氧化镁生成氢气。为了进一步证明铵根离子可以氧化镁,笔者用乙醇作溶剂,用打磨后的镁条与氯化铵乙醇溶液反应,用压强传感器测气压变化量,得到压强逐渐增大的变化曲线。
再做一组对比实验,将打磨后的镁条加入乙醇中,无明显现象,由此可知,镁与氯化铵乙醇溶液的反应是镁直接与铵根离子反应。因此,镁与氯化铵溶液反应的三种观点均无法反驳。此实验可能是在不同阶段主导的因素不同,如起始阶段镁与氯化铵溶液反应主要是铵根离子水解生成的氢离子与镁反应,当溶液为碱性时,铵根离子与镁反应可能是主导因素。
三、化学数字化实验教学思考
(一)明确传感器工作原理,严格规范仪器使用
教师借助数字化工具开展实验可以直观、实时监控反应过程中的微观变化,并以曲线的形式表征其变化过程,相对于传统实验,更易固化证据反映变化过程,聚焦复杂情境中的关键问题,促进学生对概念、原理的理解[11]。笔者列举的案例证明,在使用技术工具开展化学实验前,要理解传感器的工作原理,即要了解通过测量什么物理量并将其怎么转化为输出信号的过程与原理,才能有效减小实验测量误差,对实验测量值进行正确解读。除文中提到的压强传感器外,常用的还有滴数传感器。它有一个光学通道槽孔,滴加的液体从该槽孔通过,当红外线发射器与探测器之间被一滴液体阻拦时,就记录一个信号,再根据一滴液体的体积求出滴加溶液的总体积。因此,实验前校准一滴液体的体积是使用滴数传感器精确测量滴加液体体积的关键。又如,氧气传感器的工作原理是根据电化学反应来测量氧气浓度,即利用氧气的氧化性,通过电化学反应的数据来表征氧气的含量。如果测量对象中混有其他氧化性气体,测量就可能存在误差。此外,有些传感器同时使用时会相互干扰。例如,一般有线的离子浓度传感器与pH传感器不能同时使用。
(二)深度理解实验原理,准确解读实验数据
教师要正确解读实验曲线,必须深度理解实验原理,否则难以正确取舍和解释实验曲线。数字化实验不仅能表征其反应过程,而且比较精确和灵敏,因此外界环境对其实验结果影响较大。目前部分传感器技术不成熟,也会影响实验结果的精准性。对此,教师除开展多组重复实验外,还需要对实验原理有深刻理解,这样才能更好选择应用曲线变化的趋势还是测量的数据。例如,在使用电导率传感器测溶液电导率时,就要理解在一定范围内的稀溶液,电导率随溶液浓度增大而增大,但浓溶液的电导率是随着浓度增大而减小的。电导率随溶液浓度的增大一般是先增大后减小。电导率的大小不仅取决于离子浓度,还与其活度有关,对于浓溶液其离子活度减小占主导因素,所以电导率不升反降。总之数字化实验仅是化学实验的有益补充,不能忽视实验原理和仪器工作原理,同时要基于原理正确解读数据,敢于质疑,挖掘实验数据隐含的科学思维培养功能,这样才能充分发挥数字化实验的功能和价值。
注:本文系2022年安徽省教育科学研究项目“基于‘教、学、评’一体化的高中化学数字化实验教学实践研究”(项目编号:JK22142)研究成果之一。
参考文献
[1] 唐增富.传感器有时也会“骗人”[J].中学化学教学参考, 2020(11):60-62.
[2][9]孟茂.用压强传感器展示压强对二氧化氮与四氧化二氮平衡体系的影响[J].化学教育(中英文),2018(17):66-67.
[3] 张玉娟.传感技术应用于压强对化学平衡影响的研究[J].中学化学教学参考,2011(7):50.
[4] 王春.借助数字化实验探究压强对化学平衡移动影响[J].教学考试,2023(50):56-57.
[5][8]戴建良.对压强影响N2O4(g)2NO2(g)平衡实验结果的重新解释[J].中学化学教学参考,2020(7):41-43.
[6][7]王磊,信欣,孙影.压强对化学平衡影响的再探究:以N2O4(g)2NO2(g)为例[J].化学教与学,2023(14):86-91.
[10]张祖德.无机化学[M].2版.合肥:中国科学技术大学出版社,2014:572-579.
[11]朱成东.手持技术数字化实验促进模型建构的化学教学:沉淀溶解平衡[J].化学教育(中英文),2023(19):41-45.
(作者朱成东系安徽省教育科学研究院化学教研员;杨涛系安徽省蚌埠第二中学教师;徐泓系安徽省宣城市教学研究室化学教研员)
责任编辑:祝元志
