溃疡性结肠炎患者结肠黏膜组织微小RNA-155和细胞因子信号转导抑制因子1表达与疾病严重程度的相关性
2024-07-08张霞贾慧宇宋维轩赵汉清
张霞 贾慧宇 宋维轩 赵汉清

摘要:目的 探讨溃疡性结肠炎(UC)患者结肠黏膜组织微小RNA-155(miR-155)、细胞因子信号转导抑制因子1(SOCS1)表达水平与疾病严重程度的关系。方法 选取2021年9月至2023年6月河北北方学院附属第二医院收治的UC患者130例。按照改良Mayo评分系统将患者分为活动期组(n=85)和缓解期组(n=45);根据改良Truelove和Witts分型标准将UC活动期患者分为轻度组(n=35)、中度组(n=30)和重度组(n=20)。同时选取健康体检行结肠镜检查或结肠单发息肉切除术后复查结肠镜结果正常并排除其他疾病者共90例作为对照组。收集UC患者病变显著的结肠段黏膜组织和对照组距肛门20 cm处正常结肠黏膜组织。采用荧光定量PCR法测定组织中miR-155、SOCS1 mRNA表达水平,免疫组织化学法测定组织中SOCS1蛋白表达情况,分析UC患者结肠黏膜组织miR-155、SOCS1 mRNA和改良Mayo评分的相关性,评价miR-155、SOCS1 mRNA表达水平对UC活动期患者发生重度病情的预测价值。结果 与对照组和缓解期组比较,活动期组结肠黏膜组织miR-155表达水平显著升高,SOCS1 mRNA表达水平、SOCS1蛋白阳性表达率显著降低(P均<0.001)。轻、中、重度组UC活动期患者结肠黏膜组织miR-155表达水平和改良Mayo评分依次升高,SOCS1 mRNA表达水平依次降低(P均<0.001)。UC患者结肠黏膜组织miR-155与改良Mayo评分呈正相关,SOCS1 mRNA与改良Mayo评分呈负相关(P均<0.001)。miR-155高表达(OR=2.762,95%CI=1.284~5.944,P=0.009)、SOCS1 mRNA低表达(OR=2.617,95%CI=1.302~5.258,P=0.007)、改良Mayo评分≥12分(OR=3.232,95%CI=1.450~7.204,P=0.004)是影响UC活动期患者发生重度病情的危险因素。miR-155和SOCS1 mRNA联合预测UC活动期患者发生重度病情的曲线下面积为0.920。结论 miR-155、SOCS1 mRNA的表达水平与UC活动期患者的病情严重程度存在相关性,两者联合对UC活动期患者发生重度病情的预测效能较高。
关键词:溃疡性结肠炎;微小RNA-155;细胞因子信号转导抑制因子1;疾病严重程度;重度病情
中图分类号: R574.62 文献标识码: A 文章编号:1000-503X(2024)03-0334-07
DOI:10.3881/j.issn.1000-503X.15863
Correlations Between the Expression of MicroRNA-155 and Suppressor of Cytokine Signaling 1 in Colonic Mucosal Tissue and Disease Severity in Patients With Ulcerative Colitis
ZHANG Xia JIA Huiyu2,SONG Weixuan3,ZHAO Hanqing4
1Department of Gastroenterology,2Department of Clinical Laboratory,The Second Affiliated Hospital of Hebei North University,Zhangjiakou,Hebei 075100,China
3Department of Radiology,Zhangjiakou Xuangang Hospital,Zhangjiakou,Hebei 075100,China
4Department of Traditional Chinese Medicine,The Second Affiliated Hospital of Hebei North University,Zhangjiakou,Hebei 075100,China
Corresponding author:ZHANG Xia Tel:0313-3042343,E-mail:xiaxiazhang637@163.com
ABSTRACT:Objective To explore the relationship between the expression levels of microRNA-155 (miR-155) and suppressor of cytokine signaling 1 (SOCS1) in the colonic mucosal tissue of patients with ulcerative colitis (UC) and the severity of the disease.Methods A total of 130 UC patients admitted to the Second Affiliated Hospital of Hebei North University from September 2021 to June 2023 were selected.According to the modified Mayo score system,the patients were assigned into an active stage group (n=85) and a remission stage group (n=45).According to the modified Truelove and Witts classification criteria,the UC patients at the active stage were assigned into a mild group (n=35),a moderate group (n=30),and a severe group (n=20).A total of 90 healthy individuals who underwent colonoscopy for physical examination or those who had normal colonoscopy results after single polypectomy and excluded other diseases were selected as the control group.The colonic mucosal tissues of UC patients with obvious lesions and the colonic mucosal tissue 20 cm away from the anus of the control group were collected.The levels of miR-155 and SOCS1 mRNA in tissues were determined by fluorescence quantitative PCR,and the expression of SOCS1 protein in tissues was determined by immunohistochemistry.The correlations of the levels of miR-155 and SOCS1 mRNA in the colonic mucosal tissue with the modified Mayo score of UC patients were analyzed.The values of the levels of miR-155 and SOCS1 mRNA in predicting the occurrence of severe illness in the UC patients at the active stage were evaluated.Results Compared with the control group and the remission stage group,the active stage group showed up-regulated expression level of miR-155,down-regulated level of SOCS1 mRNA,and decreased positive rate of SOCS1 protein in the colonic mucosal tissue (all P<0.001).The expression level of miR-155 and modified Mayo score in colonic mucosal tissues of UC patients at the active stage increased,while the mRNA level of SOCS1 was down-regulated as the disease evolved from being mild to severe (all P<0.001).The modified Mayo score was positively correlated with the miR-155 level and negative correlated with the mRNA level of SOCS1 in colonic mucosal tissues of UC patients (all P<0.001).The high miR-155 level (OR=2.762,95%CI=1.284-5.944,P=0.009),low mRNA level of SOCS1 (OR=2.617,95%CI=1.302-5.258,P=0.007),and modified Mayo score≥12 points (OR=3.232,95%CI=1.450-7.204,P=0.004) were all risk factors for severe disease in the UC patients at the active stage.The area under curve of miR-155 combined with SOCS1 mRNA in predicting severe illness in the UC patients at the active stage was 0.920.Conclusions The expression levels of miR-155 and SOCS1 mRNA were correlated with the disease severity in the UC patients at the active stage.The combination of the two indicators demonstrates good performance in predicting the occurrence of severe illness in UC patients at the active stage.
Key words:ulcerative colitis;microRNA-155;suppressor of cytokine signaling 1;disease severity;severe illness
Acta Acad Med Sin,2024,46(3):334-340
溃疡性结肠炎(ulcerative colitis,UC)是一种非特异性肠道炎症性疾病,其发病率呈逐年上升趋势[1]。目前UC发病机制尚未明确,可能是遗传、机体免疫、环境等多种因素共同作用的结果,其中,免疫因素是主要原因之一[2]。微小RNA(microRNA,miRNA)是一类高度保守、内源性、非编码核苷酸,能够与mRNA的3非翻译区结合调控基因表达,与机体免疫功能异常存在密切关系[3]。miR-155位于人类第21号染色体非编码转录区第3个外显子内,与B、T细胞分化,巨噬细胞介导的免疫应答反应等生理病理过程有关[4]。Yang等[5]研究显示,UC小鼠结肠组织中miR-155呈高表达,抑制miR-155活性可改善UC小鼠结肠损伤。细胞因子信号转导抑制因子(suppressor of cytokine signaling,SOCS)是新发现的一类新型免疫分子,能够抑制炎症因子大量表达,减轻炎症反应,当其表达不足时对炎症因子的抑制作用减弱,进而促进炎性疾病的发生[6]。SOCS1是SOCS家族中的一员,Xia等[7]研究发现,SOCS1活性升高可以减弱UC患者结肠组织炎症反应。据报道,下调miR-155表达可激活SOCS1活性,从而抑制炎症反应,减轻白色念珠菌诱导的急性肺损伤,提示miR-155可能负向调控SOCS1基因表达参与急性肺损伤病情进展[8]。因此,本研究分析UC患者结肠黏膜组织中miR-155和SOCS1的表达情况及与疾病严重程度的关系,以期为临床深入探讨UC病理机制并有效诊治UC提供参考。
1 资料和方法
1.1 资料
选取2021年9月至2023年6月河北北方学院附属第二医院收治的UC患者130例,纳入标准:(1)符合共识意见中UC的诊断标准[9];(2)经病理学检查确诊;(3)临床资料完整。排除标准:(1)诊断不明确的其他肠炎患者;(2)严重的脏器功能不全者;(3)患血液系统疾病;(4)合并其他自身免疫性疾病如类风湿性关节炎、系统性红斑狼疮等;(5)恶性肿瘤患者。另同期选取健康体检行结肠镜检查或结肠单发息肉切除术后复查结肠镜结果正常并排除其他疾病者共90例作为对照组。按照改良Mayo评分系统[9]将UC患者分为活动期组(改良Mayo评分≥3分,n=85)和缓解期组(改良Mayo评分≤2分且无单个分项评分>1分,n=45)。根据改良Truelove和Witts分型标准[9]将UC活动期患者分为轻度组(n=35)、中度组(n=30)和重度组(n=20),其中重度病情的诊断标准为:排便次数每天在6次及以上,重度便血,脉搏>90次/min,体温>37.8 ℃,血红蛋白<75%的正常值,红细胞沉降率>30 mm/h。本研究经河北北方学院附属第二医院伦理委员会批准(伦理审查编号:2021-二附院LS-039),受试者均签署知情同意书。
1.2 方法
1.2.1 组织标本采集及保存
在结肠镜检查时,UC患者选取病变显著的结肠段黏膜组织标本;对照组选取距肛门20 cm处正常结肠黏膜组织。部分组织标本放入液氮中快速冷冻并于-70 ℃保存,用于RNA提取。剩余组织标本于中性福尔马林液中固定、包埋、制成蜡块,用于免疫组织化学分析。
1.2.2 荧光定量PCR法测定miR-155、SOCS1 mRNA表达
从液氮中取出组织样本,按照Trizol试剂(货号MN562J2,苏州泓迅生物科技股份有限公司)说明书提取总RNA,参照反转录试剂盒(货号J6547M,苏州泓迅生物科技股份有限公司)说明将RNA反转录为cDNA。参照荧光定量PCR试剂盒(货号N5643MJ,美国Sigma公司)说明进行PCR反应,反应程序:95 ℃预处理120 s;95 ℃ 18 s,63 ℃ 22 s,72 ℃ 17 s,共40个循环。U6、GAPDH分别作为miR-155、SOCS1的内参,采用2-ΔΔCt法计算组织样本miR-155、SOCS1 mRNA的相对表达水平。所有引物均由福州迈新生物技术开发有限公司合成,引物序列见表1。
1.2.3 免疫组织化学法测定SOCS1蛋白表达
取组织标本,经脱蜡复水,PBS冲洗3次,每次3 min;滴加0.3%过氧化氢甲醇液以阻断内源性过氧化酶活性,室温孵育10 min;滴加5%牛血清白蛋白进行封闭,室温孵育10 min。滴加1∶500兔源SOCS1抗体(货号ND4672-8,北京中衫金桥生物技术有限公司),室温孵育4 h,滴加1∶1000山羊抗兔二抗(货号O6721D,福州迈新生物技术开发有限公司),室温孵育2 h,滴加链霉菌抗生物素蛋白-过氧化物酶溶液,室温孵育45 min,DAB显色,苏木素复染2 min,梯度酒精脱水,二甲苯透明,中性树胶封片,采用日本尼康NIS Elements F 3.0图像采集软件和NIS Elements BR 3.0图像分析软件进行图像处理。
图像判读:由3名病理科医生在双盲条件下对所有图像独立进行判断和评定。在高倍视野下随机选取5个观测清晰的区域,共计数1000个细胞,采用半定量计分法分别对阳性细胞百分比(1分:≤10%;2分:11%~50%;3分:51%~75%;4分:>75%)、染色强度(0分:未着色;1分:淡黄色;2分:棕黄色;3分:棕褐色)进行评分[10]。两者评分乘积<3分为阴性(-)表达,≥3分为阳性(+)表达。
1.3 统计学处理
采用SPSS 26.0统计软件,符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验;计数资料以n(%)表示,组间比较采用χ2检验;采用Pearson相关系数分析UC患者结肠黏膜组织miR-155、SOCS1 mRNA与改良Mayo评分的相关性,采用多因素Logistic回归分析影响UC活动期患者发生重度病情的因素,采用受试者工作特征(receiver operating characteristic,ROC)曲线评价miR-155、SOCS1 mRNA表达水平对UC活动期患者发生重度病情的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
130例UC患者中男68例,女62例,年龄21~58岁,平均(43.7±11.3)岁,其中活动期组男44例,女41例,平均年龄(43.8±11.6)岁(21~57岁),缓解期组男24例,女21例,平均年龄(43.4±10.6)岁(22~58岁);对照组男48例,女42例,年龄22~57岁,平均(43.1±11.0)岁。活动期组、缓解期组和对照组性别(P=0.975)、年龄(P=0.917)差异均无统计学意义。
2.2 各组miR-155、SOCS1 mRNA表达水平比较
与对照组和缓解期组比较,活动期组结肠黏膜组织miR-155表达水平显著升高(3.89±0.87比1.00±0.06,P<0.001和3.89±0.87比0.98±0.1 P<0.001),SOCS1 mRNA表达水平显著降低(0.45±0.11比1.00±0.04,P<0.001和0.45±0.11比1.06±0.09,P<0.001),而对照组和缓解期组结肠黏膜组织miR-155和SOCS1 mRNA表达水平差异无统计学意义(1.00±0.06比0.98±0.1 P=0.978和1.00±0.04比1.06±0.09,P=0.391)。轻、中、重度组UC活动期患者结肠黏膜组织miR-155表达水平分别为2.96±0.71、3.92±0.83、5.47±1.2 差异有统计学意义(F=50.655,P<0.001);SOCS1 mRNA表达水平分别为0.53±0.13、0.44±0.10、0.33±0.09,差异有统计学意义(F=20.727,P<0.001)。
2.3 各组SOCS1蛋白表达情况比较
SOCS1蛋白定位于细胞质或细胞膜(图1)。与对照组和缓解期组比较,活动期组结肠黏膜组织SOCS1蛋白阳性表达率显著降低(8.24%比91.11%,P<0.001和8.24%比88.89%,P<0.001),而对照组和缓解期组结肠黏膜组织SOCS1蛋白阳性表达率差异无统计学意义(91.11%比88.89%,P=0.680)。
2.4 UC患者结肠黏膜组织miR-155、SOCS1 mRNA、改良Mayo评分的相关性分析
轻、中、重度组UC活动期患者改良Mayo评分分别为4.09±0.46、8.12±1.53、11.54±0.3 差异有统计学意义(F=394.647,P<0.001)。Pearson法分析显示,UC患者结肠黏膜组织miR-155与SOCS1 mRNA表达水平呈负相关(r=-0.602,P<0.001),miR-155与改良Mayo评分呈正相关(r=0.516,P<0.001),SOCS1 mRNA与改良Mayo评分呈负相关(r=-0.497,P<0.001)。
2.5 影响UC活动期患者发生重度病情的因素分析
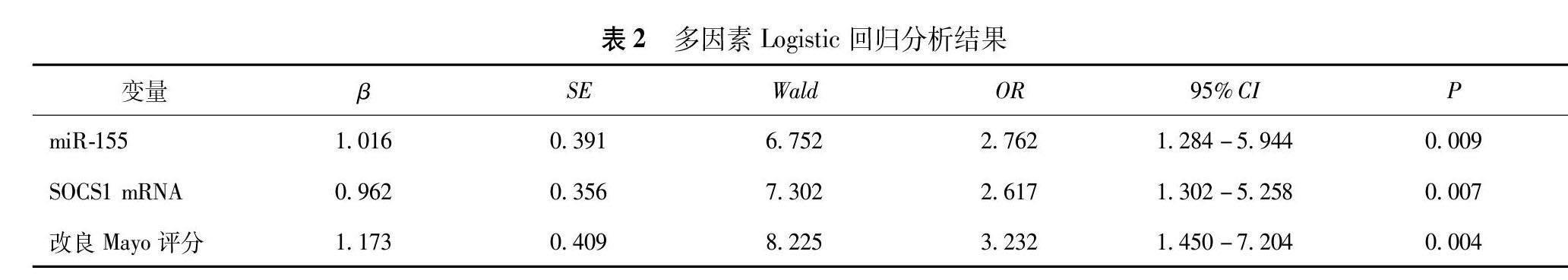
以UC活动期患者是否发生重度病情为因变量(0=未发生,1=发生),以miR-155(以4.61为截断值,≥4.61为高表达赋值为 <4.61为低表达赋值为0)、SOCS1 mRNA(以0.38为截断值,<0.38为低表达赋值为 ≥0.38为高表达赋值为0)、改良Mayo评分(≥12分为高表达赋值为 <12分为低表达赋值为0)为自变量行多因素Logistic回归分析,结果显示miR-155高表达(OR=2.762,95%CI=1.284~5.944,P=0.009)、SOCS1 mRNA低表达(OR=2.617,95%CI=1.302~5.258,P=0.007)、改良Mayo评分≥12分(OR=3.232,95%CI=1.450~7.204,P=0.004)是影响UC活动期患者发生重度病情的危险因素(表2)。
2.6 miR-155、SOCS1 mRNA对UC活动期患者发生重度病情的预测价值
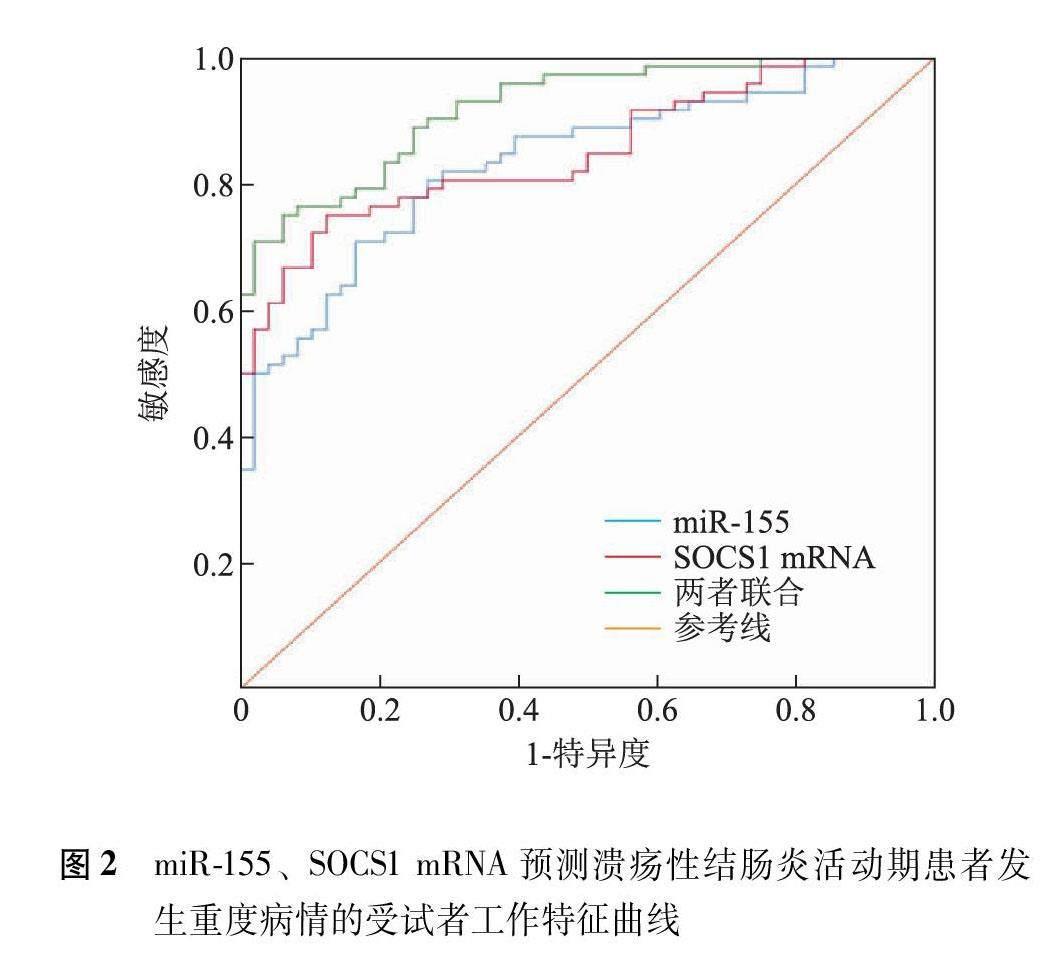
ROC曲线分析显示,miR-155预测UC活动期患者发生重度病情的AUC为0.834(95%CI=0.763~0.905),当截断值为4.61时,敏感度为70.81%,特异度为83.33%;SOCS1 mRNA预测UC活动期患者发生重度病情的AUC为0.851(95%CI=0.784~0.917),当截断值为0.38时,敏感度为75.04%,特异度为87.52%;两者联合预测UC活动期患者发生重度病情的AUC为0.920(95%CI=0.875~0.966),当截断值为0.42时,敏感度为93.16%,特异度为68.94%(图2)。
3 讨论
UC为结肠黏膜及黏膜下炎症疾病,该病常累及直肠,逐渐扩散至全结肠,因此UC的早期病情评估十分重要[11-12]。
相关研究表明miR-155可调节T、B细胞等分化,尤其在辅助性T细胞Th17细胞分化中发挥重要作用,从而参与免疫性疾病的发生发展[13]。Ke等[14]发现,miR-155过表达可促进缺氧缺血性脑损伤中炎症反应,促使神经元凋亡加速,而沉默miR-155能够减轻炎症和神经元凋亡。Malham等[15]研究显示,UC患者肠黏膜组织miR-155表达呈高水平,抑制miR-155表达有助于UC炎症的改善。本研究结果显示,活动期组结肠黏膜组织miR-155表达较对照组和缓解期组显著升高;与Ke等[14]和Malham等[15]研究结果一致,说明miR-155异常高表达可能与UC的进展有关,可能原因是miR-155高表达会促使Th17细胞活化,进而分泌促炎症因子,加重UC的病情程度,还可能与miR-155参与黏膜系统完整性及屏障功能调节有关,miR-155可破坏肠上皮细胞的紧密连接,增加黏膜通透性及黏膜组织损伤程度、炎性细胞浸润程度,也可改变肠道屏障功能,因此结肠黏膜中miR-155的异常表达与炎症性肠病的发生发展有着重要联系[16-17]。
SOCS是由细胞产生的负性调节因子,可反馈性阻断细胞因子信号的转导过程,SOCS1是其主要成员之一,参与多种细胞因子的信号转导及免疫细胞的形成与分化,进一步调节机体固有、获得性免疫[18-19]。Hu等[20]报道发现,SOCS1高表达会促进巨噬细胞活化进而使机体炎症得以控制。Yoon等[21]研究报道,SOCS1是促炎细胞因子表达的关键抑制因子,上调SOCS1表达可减轻结肠炎小鼠炎症和肠道损伤。本研究发现,活动期组结肠黏膜组织SOCS1 mRNA表达水平、SOCS1蛋白阳性表达率低于对照组和缓解期组,与既往相关研究结果相似[20-21],提示SOCS1异常低表达可能促使UC进一步发展,可能原因是低水平的SOCS1对促炎细胞因子的抑制效果减弱,促炎细胞因子的过量分泌加重了UC病情,使患者从缓解期进展到了活动期。
临床上常将改良Mayo评分用于UC患者病情程度的评估,其评分越高表示UC病情越严重[22]。本研究发现,随着UC活动期患者病情的加重,结肠黏膜组织miR-155表达水平和改良Mayo评分逐渐升高,SOCS1 mRNA表达水平逐渐降低,表明miR-155和SOCS1 mRNA水平可能与活动期患者病情的严重程度有关。进一步分析发现,UC患者结肠黏膜组织miR-155与SOCS1 mRNA呈负相关,两者均与改良Mayo评分存在相关性,提示miR-155和SOCS1 mRNA可能存在靶向调控关系参与UC的病情进展,但本研究受样本量限制,未进一步验证miR-155和SOCS1 mRNA表达调控机制,后续需结合分子和动物实验继续探讨。此外,Li等[23]发现白细胞介素-10/miR-155/Src同源性2结构域的肌醇5-磷酸酶1通路在共生细菌诱导的结肠炎中起关键作用,结合本研究结果,表明miR-155可能通过多种通路参与结肠炎相关疾病的病情进展过程,为UC的病情早期判断提供了更多的研究方向。本研究结果显示,miR-155高表达、SOCS1 mRNA低表达均是影响UC活动期患者发生重度病情的危险因素,且两者联合对UC活动期患者发生重度病情有较高的预测价值。因此,临床上可通过检测结肠黏膜组织miR-155和SOCS1 mRNA水平预测UC活动期重度进展的发生,miR-155和SOCS1 mRNA有望成为UC治疗的靶点。
综上,本研究结果表明,UC活动期患者结肠黏膜组织miR-155异常高表达,SOCS1 mRNA异常低表达,两者呈负相关,并可在一定程度上反映病情严重程度,有望成为评价UC患者病情活动性及严重程度的有效指标,为临床深入探讨UC病理机制及靶向治疗提供参考。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张霞:设计方案、实施研究及论文撰写;贾慧宇:提出研究思路、分析数据和论文审核;宋维轩:实施研究、资料搜集整理和论文修改;赵汉清:统计分析
参 考 文 献
[1]Du L,Ha C.Epidemiology and pathogenesis of ulcerative colitis[J].Gastroenterol Clin North Am,2020,49(4):643-654.DOI:10.1016/j.gtc.2020.07.005.
[2]Liu X,Zhou M,Dai Z,et al.Salidroside alleviates ulcerative colitis via inhibiting macrophage pyroptosis and repairing the dysbacteriosis-associated Th17/Treg imbalance[J].Phytother Res,2023,37(2):367-382.DOI:10.1002/ptr.7636.
[3]Chen Z,Gu Q,Chen R.Promotive role of IRF7 in ferroptosis of colonic epithelial cells in ulcerative colitis by the miR-375-3p/SLC11A2 axis[J].Biomol Biomed,2023,23(3):437-449.DOI:10.17305/bjbms.2022.8081.
[4]Sumiya K,Izumi H,Sakurai K.Enhanced therapeutic efficacy of immunostimulatory CpG-ODN by silencing SOCS-1 with polysaccharide/miR-155 complexes[J].ACS Appl Bio Mater,2023,6(2):774-783.DOI:10.1021/acsabm.2c00963.
[5]Yang ZB,Qiu LZ,Chen Q,et al.Artesunate alleviates the inflammatory response of ulcerative colitis by regulating the expression of miR-155[J].Pharm Biol,202 59(1):97-105.DOI:10.1080/13880209.2020.1867196.
[6]Lockwood KC,Lear TB,Rajbhandari S,et al.KIAA0317 regulates SOCS1 stability to ameliorate colonic inflammation[J].FEBS J,2023,290(15):3802-3811.DOI:10.1111/febs.16780.
[7]Xia F,Bo W,Ding J,et al.MiR-222-3p aggravates the inflammatory response by targeting SOCS1 to activate STAT3 signaling in ulcerative colitis[J].Turk J Gastroenterol,2022,33(11):934-944.DOI:10.5152/tjg.2022.21769.
[8]Li X,Gong Y,Lin X,et al.Down-regulation of microRNA-155 suppressed Candida albicans induced acute lung injury by activating SOCS1 and inhibiting inflammation response[J].J Microbiol,2022,60(4):402-410.DOI:10.1007/s12275-022-1663-5.
[9]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2018年·北京)[J].中国实用内科杂志,2018,38(9):796-813.DOI:10.19538/j.nk2018090106.
[10]郭立文,曹罗元,陈惠华,等.组织内PGK1、SOCS1、LAG-3水平与子宫内膜癌病理特征的相关性分析[J].临床和实验医学杂志,2022,21(24):2624-2628.DOI:10.3969/j.issn.1671-4695.2022.24.013.
[11]Wan Y,Yang L,Jiang S,et al.Excessive apoptosis in ulcerative colitis:crosstalk between apoptosis,ROS,ER stress,and intestinal homeostasis[J].Inflamm Bowel Dis,2022,28(4):639-648.DOI:10.1093/ibd/izab277.
[12]Singh S,Ananthakrishnan AN,Nguyen NH,et al.AGA clinical practice guideline on the role of biomarkers for the management of ulcerative colitis[J].Gastroenterology,2023,164(3):344-372.DOI:10.1053/j.gastro.2022.12.007.
[13]Thompson JW,Hu R,Huffaker TB,et al.MicroRNA-155 plays selective cell-intrinsic roles in brain-infiltrating immune cell populations during neuroinflammation[J].J Immunol,2023,210(7):926-934.DOI:10.4049/jimmunol.2200478.
[14]Ke F,Wang H,Geng J,et al.MiR-155 promotes inflammation and apoptosis via targeting SIRT1 in hypoxic-ischemic brain damage[J].Exp Neurol,2023,362(1):114317.DOI:10.1016/j.expneurol.2023.114317.
[15]Malham M,James JP,Jakobsen C,et al.Mucosal microRNAs relate to age and severity of disease in ulcerative colitis[J].Aging (Albany NY),202 13(5):6359-6374.DOI:10.18632/aging.202715.
[16]Gao Y,Han T,Han C,et al.Propofol regulates the TLR4/NF-κB pathway through miRNA-155 to protect colorectal cancer intestinal barrier[J].Inflammation,202 44(5):2078-2090.DOI:10.1007/s10753-021-01485-0.
[17]Cao YY,Wang Z,Wang ZH,et al.Inhibition of miR-155 alleviates sepsis-induced inflammation and intestinal barrier dysfunction by inactivating NF-κB signaling[J].Int Immunopharmacol,202 90:107218.DOI:10.1016/j.intimp.2020.107218.
[18]Sharma J,Collins TD,Roach T,et al.Suppressor of cytokine signaling-1 mimetic peptides attenuate lymphocyte activation in the MRL/lpr mouse autoimmune model[J].Sci Rep,202 11(1):6354-6366.DOI:10.1038/s41598-021-86017-4.
[19]Lv C,Li H,Cui H,et al.Solid lipid nanoparticle delivery of rhynchophylline enhanced the efficiency of allergic asthma treatment via the upregulation of suppressor of cytokine signaling 1 by repressing the p38 signaling pathway[J].Bioengineered,202 12(1):8635-8649.DOI:10.1080/21655979.2021.1988364.
[20]Hu Z,Li Y,Yuan W,et al.N6-methyladenosine of SOCS1 modulates macrophage inflammatory response in different stiffness environments[J].Int J Biol Sci,2022,18(15):5753-5769.DOI:10.7150/ijbs.74196.
[21]Yoon JI,Cho H,Jeon R,et al.Therapeutic efficacy of novel HDAC inhibitors SPA3052 and SPA3074 against intestinal inflammation in a murine model of colitis[J].Pharmaceuticals (Basel),2022,15(12):1515-1527.DOI:10.3390/ph15121515.
[22]Sandborn WJ,Sands BE,Vermeire S,et al.Modified Mayo score versus Mayo score for evaluation of treatment efficacy in patients with ulcerative colitis:data from the tofacitinib OCTAVE program[J].Therap Adv Gastroenterol,2022,15:17562848221136331.DOI:10.1177/17562848221136331.
[23]Li Y,Tian Y,Zhu W,et al.IL-10/microRNA-155/SHIP-1 signaling pathway is crucial for commensal bacteria induced spontaneous colitis[J].Biochem Pharmacol,2016,116(1):100-106.DOI:10.1016/j.bcp.2016.07.002.
(收稿日期:2023-09-22)
