硒蛋白基因在新型冠状病毒感染患者中的表达水平及调控作用
2024-07-08李晶张荣强张灵芝戚燕郝洁何傲月赵旭李秀芹
李晶 张荣强 张灵芝 戚燕 郝洁 何傲月 赵旭 李秀芹


摘要:目的 探讨硒蛋白基因在新型冠状病毒感染(COVID-19)患者中的表达水平及其可能的调控机制。方法 从基因表达综合数据库获取数据集GSE177477,样本由有症状组(n=11)、无症状组(n=18)和健康对照组(n=18)构成。对数据集进行预处理,筛选出与COVID-19相关的差异表达基因,并进行基因本体功能注释和京都基因与基因组百科全书富集分析,建立差异表达硒蛋白基因的蛋白质-蛋白质相互作用网络,采用多因素Logistic回归分析硒蛋白基因对COVID-19患者是否出现症状的影响。结果 与健康对照组比较,有症状的COVID-19患者中GPX1、GPX4、GPX6、DIO2、TXNRD1、SELENOF、SELENOK、SELENOS、SELENOT、SELENOW基因表达均升高,TXNRD2、SELENON基因表达均下降(P均<0.05);无症状的COVID-19患者中GPX2、SELENOI、SELENOO、SELENOS、SELENOT、SELENOW基因表达均升高,SELP基因表达下降(P均<0.05)。多因素Logistic回归分析结果显示,GPX1(OR=0.067,95%CI=0.005~0.904,P=0.042)、SELENON(OR=56.663,95%CI=3.114~856.999,P=0.006)基因的异常高表达是有症状COVID-19患者的影响因素,SELP基因的异常高表达是无症状COVID-19患者的危险因素(OR=15.000,95%CI=2.537~88.70 P=0.003)。结论 硒蛋白基因的差异表达参与调控COVID-19疾病的发生发展,为COVID-19的预防和治疗提供新的参考依据。
关键词:新型冠状病毒感染;硒蛋白;表达及调控;Logistic回归
中图分类号: R183.3 文献标识码: A 文章编号:1000-503X(2024)03-0316-08
DOI:10.3881/j.issn.1000-503X.15834
Expression Levels and Regulation of Selenoprotein Genes in Patients With Coronavirus Disease 2019
LI Jing ZHANG Rongqiang ZHANG Lingzhi2,QI Yan HAO Jie HE Aoyue ZHAO Xu LI Xiuqin3
1Department of Epidemiology and Health Statistics,School of Public Health,Shaanxi University of Chinese Medicine,Xianyang,Shaanxi 712046,China
2Department of Laboratory Medicine,The Second Hospital of Hanbin District,Ankang,Shaanxi 72502 China
3Department of Public Administration,School of Humanities and Management,Shaanxi University of Chinese Medicine,Xianyang,Shaanxi 712046,China
Corresponding author:LI Xiuqin Tel:029-38185218,E-mail:lixiuqin2000@163.com
ABSTRACT:Objective To investigate the expression levels of selenoprotein genes in the patients with coronavirus disease 2019 (COVID-19) and the possible regulatory mechanisms.Methods The dataset GSE177477 was obtained from the Gene Expression Omnibus,consisting of a symptomatic group (n=11),an asymptomatic group (n=18),and a healthy control group (n=18).The dataset was preprocessed to screen the differentially expressed genes (DEG) related to COVID-19,and gene ontology functional annotation and Kyoto encyclopedia of genes and genomes enrichment analysis were performed for the DEGs.The protein-protein interaction network of DEGs was established,and multivariate Logistic regression was employed to analyze the effects of selenoprotein genes on the presence/absence of symptoms in the patients with COVID-19.Results Compared with the healthy control,the symptomatic COVID-19 patients presented up-regulated expression of GPX GPX4,GPX6,DIO2,TXNRD SELENOF,SELENOK,SELENOS,SELENOT,and SELENOW and down-regulated expression of TXNRD2 and SELENON (all P<0.05).The asymptomatic patients showcased up-regulated expression of GPX2,SELENOI,SELENOO,SELENOS,SELENOT,and SELENOW and down-regulated expression of SELP (all P<0.05).The results of multivariate Logistic regression analysis showed that the abnormally high expression of GPX1 (OR=0.067,95%CI=0.005-0.904,P=0.042) and SELENON (OR=56.663,95%CI=3.114-856.999,P=0.006) was the risk factor for symptomatic COVID-19,and the abnormally high expression of SELP was a risk factor for asymptomatic COVID-19 (OR=15.000,95%CI=2.537-88.70 P=0.003).Conclusions Selenoprotein genes with differential expression are involved in the regulation of COVID-19 development.The findings provide a new reference for the prevention and treatment of COVID-19.
Key words:coronavirus disease 2019;selenoprotein;expression and regulation;Logistic regression
Acta Acad Med Sin,2024,46(3):316-323
新型冠状病毒感染(coronavirus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的一种传染病,可通过呼吸道飞沫和气溶胶途径传播,人群普遍易感,传播速度较快。2023年1月7日我国发布的《新型冠状病毒感染防控方案(第十版)》将COVID-19纳入按乙类管控的乙类传染病[1]。硒是人体所必需的一种微量元素,在体内主要以硒蛋白的形式发挥生物学作用。研究证实,硒蛋白与病毒感染之间存在一定的联系,其作用机制复杂,涉及宿主细胞和病毒本身硒蛋白的表达与功能、机体的免疫应答、氧化还原平衡及各种因素之间的交互作用[2]。目前,已从人类基因组中成功鉴定出25种硒蛋白[3],在肿瘤、心血管疾病、骨关节炎、地方病等多种疾病的发病机制及防治方面起着重要作用[4-5]。但关于硒蛋白对COVID-19影响的研究相对较少,有研究发现COVID-19病死率较高的国家与硒蛋白缺乏的国家呈现出一定的对应关系,并建议为COVID-19患者每日提供足够量的硒和其他微量元素[4,6-7]。此外,硒蛋白也与COVID-19患者的预后和康复有一定的相关性[8]。本研究从基因表达综合(Gene Expression Omnibus,GEO)数据库获取数据集GSE177477,探讨硒蛋白基因在COVID-19患者中的表达水平及其可能的调控机制,为COVID-19的预防和治疗提供新的临床参考依据。
1 资料和方法
1.1 资料来源
使用美国国立生物技术信息中心GEO公共数据库(https://www.ncbi.nlm.nih.gov/geo/),以“COVID-19”为关键词,检索后获取数据集GSE177477,共包含47例组织的芯片样本,分为有症状组(n=11)、无症状组(n=18)和健康对照组(n=18),并从该数据集中获得24 351个基因的表达数据。
1.2 数据预处理
将下载的数据集GSE177477上传至NetworkAnalyst在线软件(https://www.networkanalyst.ca)[9-10],删除错误值或可疑值;采用Log2-counts per million对测序数据进行归一化处理,确保后续分析结果的准确性和可靠性。
1.3 差异表达基因的筛选
利用R软件中的Limma包,将预处理后的数据以| Log2 FC | >2和校正后P<0.05为阈值,筛选差异表达基因。
1.4 功能富集分析
将差异表达基因上传至STRING 11.0(https://string-db.org)和Metascape(https://metascape.org)在线软件,进行基因本体(gene ontology,GO)功能注释和京都基因与基因组百科全书(Kyoto encycopedia of genes and genomes,KEGG)富集分析。GO包括生物学过程、分子功能和细胞组分,用于从多方面描述特定基因的功能。KEGG是一个整合了基因组、化学和系统功能信息的综合数据库,其中KEGG pathway专门存储不同物种基因信号通路的信息,使用最为广泛。采用累积的超几何分布计算P值,以P<0.01为阈值鉴定差异的功能和信号转导通路富集。
1.5 蛋白互作网络分析
与健康对照组比较,将差异表达的硒蛋白基因提交至STRING数据库进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析,筛选标准:置信度≥0.700、交互蛋白扩展数≤5,绘制直观PPI网络图。根据每个硒蛋白基因之间的交互作用情况,筛选核心硒蛋白基因。
1.6 统计学处理
采用SPSS 22.0统计软件,组间比较采用独立样本t检验;将筛选出的硒蛋白基因以中位数为截断值分为高表达组和低表达组,采用单因素Logistic回归分析差异表达的硒蛋白基因对COVID-19患者是否出现症状的影响;以差异表达的硒蛋白基因作自变量,将有症状和无症状COVID-19患者分别为因变量,进行多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 筛选差异表达基因
将数据进行标准化处理后,各样本基因表达数据均数基本稳定,分布密度基本一致,数据质量良好、可靠。聚类热图显示,有症状、无症状COVID-19患者和健康对照样本的多个基因的表达水平不同(图1)。
2.2 差异表达基因的富集分析
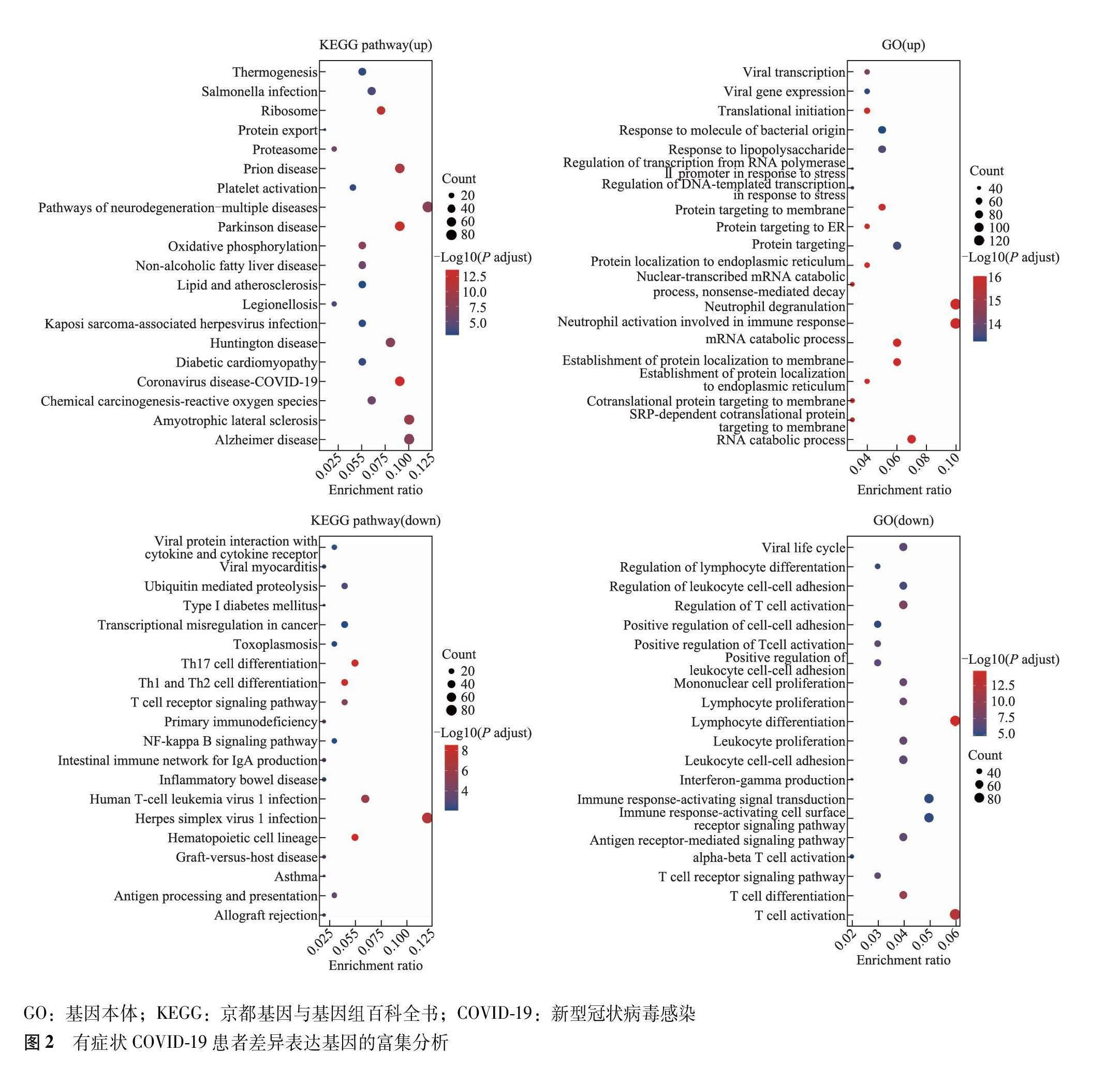
与健康对照组比较,有症状组COVID-19患者的差异表达基因主要参与COVID-19、沙门氏菌感染、化学致癌活性氧等信号通路或生物学过程(图2);无症状组COVID-19患者的差异表达基因主要参与COVID-19、甲型流感、丙型肝炎等信号通路或生物学过程(图3)。
2.3 硒蛋白基因的表达水平
与健康对照组比较,有症状组COVID-19患者12个硒蛋白基因的表达发生明显变化,其中GPX1(P<0.001)、GPX4(P=0.013)、GPX6(P=0.004)、DIO2(P=0.045)、TXNRD1(P<0.001)、SELENOF(P<0.001)、SELENOK(P<0.001)、SELENOS(P=0.001)、SELENOT(P=0.004)、SELENOW基因(P=0.044)表达升高,TXNRD2(P<0.001)、SELENON基因(P=0.001)表达下降。
与健康对照组比较,无症状组COVID-19患者7个硒蛋白基因的表达发生明显变化,其中GPX2(P=0.025)、SELENOI(P=0.009)、SELENOO(P=0.006)、SELENOS(P=0.002)、SELENOT(P=0.049)、SELENOW基因(P=0.023)表达升高,SELP基因表达下降(P=0.014)。
2.4 硒蛋白基因的PPI网络分析结果
有症状COVID-19患者差异表达硒蛋白基因相应的PPI网络包含21个节点和73条边,其中TXNRD1、TXNRD2、SELENOS为关键Hub基因,且与其他蛋白相互作用密切(图4)。无症状COVID-19患者差异表达硒蛋白基因相应的PPI网络包含17个节点和34条边,其中SELENOS与两个模块网络作用密切(图5)。
2.5 硒蛋白基因对COVID-19患者影响的单因素Logistic回归分析结果
以中位数为截断值把差异基因的表达水平分为高表达组和低表达组,将12个差异表达硒蛋白基因分别作自变量,是否患有有症状COVID-19患者为因变量,采用单因素Logistic回归,分析差异表达硒蛋白基因对发生有症状COVID-19患者的影响,结果显示GPX1(OR=0.11 95%CI=0.018~0.685,P=0.018)、GPX6(OR=0.085,95%CI=0.013~0.542,P=0.009)、SELENOK基因(OR=0.085,95%CI=0.013~0.542,P=0.009)表达异常升高是有症状COVID-19患者的保护因素,SELENON基因表达异常升高是有症状COVID-19患者的危险因素(OR=35.000,95%CI=3.382~362.16 P=0.003)(图6)。
采用单因素Logistic回归,分析差异表达硒蛋白基因对发生无症状COVID-19患者的影响,结果显示SELP基因(OR=12.250,95%CI=2.545~58.968,P=0.002)表达异常升高是无症状COVID-19患者的危险因素,SELENOI(OR=0.250,95%CI=0.063~1.000,P=0.049)、SELENOO基因(OR=0.148,95%CI=0.034~0.636,P=0.010)表达异常升高是无症状COVID-19患者的保护因素(图7)。
2.6 硒蛋白基因对COVID-19患者影响的多因素Logistic回归分析结果
将单因素Logistic回归结果中差异有统计学意义的自变量纳入多因素Logistic回归模型,分析差异表达硒蛋白基因对是否出现症状COVID-19患者的影响,结果显示GPX1(OR=0.067,95%CI=0.005~0.904,P=0.042)的异常高表达是有症状COVID-19患者的保护因素,SELENON基因(OR=56.663,95%CI=3.114~856.999,P=0.006)的异常高表达是有症状COVID-19患者的危险因素;SELP基因的异常高表达是无症状COVID-19患者的危险因素(OR=15.000,95%CI=2.537~88.70 P=0.003)。
3 讨论
硒元素具有提高机体免疫力、抗氧化和抗病毒突变的能力,在病毒性疾病的防治中被广泛研究和应用。有证据表明,动物和人类的低硒状态都会降低宿主对一些RNA病毒的反应,进而影响疾病的严重程度[11]。研究发现COVID-19治愈率与硒蛋白基因水平之间存在正相关,缺乏硒元素的地区可能与COVID-19患者死亡率升高有关[12]。本研究采用基因组学分析技术对11例有症状、18例无症状COVID-19患者和18例健康对照者的硒蛋白基因芯片数据集进行了深入的挖掘和分析,筛选出有症状和无症状COVID-19患者差异表达的硒蛋白基因,对于进一步理解COVID-19的发病机制和寻找潜在的治疗靶点具有重要意义。
硒防治病毒性疾病的机制可能涉及其参与调控病毒感染的相关分子通路[2]。据报道,冠状病毒可以干扰无义介导的RNA衰变[13],这种细胞机制也被认为在调节硒蛋白基因的合成模式方面发挥作用[14-15]。因此,SARS-CoV-2感染也可能会影响硒蛋白基因的代谢过程,从而改变硒对多种下游通路的调控作用,特别是在硒摄入量不足的情况下,这种影响可能会进一步加剧。Liu等[16]研究发现,硒蛋白尤其是谷胱甘肽过氧化物酶家族对于调节细胞内的生物氧化环境起到关键作用。在缺硒宿主环境中,这些抗氧化酶的活性降低导致氧化应激加重,从而诱导病毒突变率升高。通过对湖北(硒缺乏)和广东地区(硒充足)分离出的动物冠状病毒序列进行比较,发现湖北地区分离得到的病毒与人类COVID-19病毒呈现高度的相似性,这表明硒的状态可能在病毒感染新突变出现中发挥作用。Zhang等[17]研究显示硒代谢池中的硒蛋白和具有氧化还原活性的硒元素都可以通过其独特的机制来减弱病毒引发的氧化应激、过度炎症反应以及免疫系统功能障碍,从而改善SARS-CoV-2感染造成的影响。Ramanathan等[18]研究发现病毒硒蛋白的每个分子能消耗多个硒原子,这导致在蛋白质编码过程中受感染宿主细胞内硒元素的缺乏,从而削弱宿主细胞对脂质过氧化和细胞膜破坏的防御能力[19]。Tomo等[20]研究也提示硒蛋白在COVID-19发病机制中的作用,以及硒作为辅助治疗的可能性。本研究结果显示,有症状COVID-19患者的硒蛋白基因主要参与COVID-19、沙门氏菌感染、化学致癌活性氧等信号通路,无症状COVID-19患者的硒蛋白基因主要参与COVID-19、甲型流感、丙型肝炎等信号通路。
本研究单因素Logistic回归结果发现GPX1、GPX6、SELENOK基因表达异常升高是有症状COVID-19患者的保护因素,SELENON基因表达异常升高是有症状COVID-19患者的危险因素。SELP基因表达异常升高是无症状COVID-19患者的危险因素,SELENOI、SELENOO基因表达异常升高是无症状COVID-19患者的保护因素。多因素Logistic回归分析显示GPX1、SELENON基因是有症状COVID-19患者的独立影响因素,与张迪等[5]研究报道一致。Taylor等[21]和Seale等[22]采用蛋白酶裂解位点预测工具预测了SARS-CoV-2半胱氨酸蛋白酶对不同的硒蛋白的作用,也证实GPX1基因异常高表达是有症状COVID-19患者的保护因素,SELENON基因异常高表达是有症状COVID-19患者的危险因素。此外,本研究结果显示SELP是无症状COVID-19患者的独立影响因素,与Heller等[23]研究报道一致。
综上,本研究结果表明,COVID-19患者硒蛋白基因的表达发生明显改变,其中GPX1、SELENON、SELP基因的异常高表达是COVID-19患者是否出现症状的影响因素,参与调控COVID-19疾病的发生发展,这为COVID-19的预防和治疗提供了新的参考依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李晶:研究选题、分析数据、起草论文、按编辑部意见进行修改、对学术问题进行解答;张荣强:研究选题设计、对重要学术性内容做出关键性修订、对拟发表的文章做最后的审阅和定稿;张灵芝:数据搜集和解释工作;戚燕:数据搜集和整理工作;郝洁:数据搜集和解释工作;何傲月:数据搜集、整理和解释工作;赵旭:数据整理和解释工作;李秀芹:论题指导、统筹、提供经费资助
参 考 文 献
[1]国务院联防联控机制综合组.新型冠状病毒感染防控方案(第十版)[J].中国病毒病杂志,2023,13(2):108-110.DOI:10.16505/j.2095-0136.2023.2004.
[2]王超,黄娟,张仁利,等.硒与病毒性疾病的相关性[J].热带医学杂志,2018,18(1):114-117.DOI:10.3969/j.issn.1672-3619.2018.01.031.
[3]Kryukov GV,Castellano S,Novoselov SV,et al.Characterization of mammalian selenoproteomes[J].Science,2003,300:1439-1443.DOI:10.1126/science.1083516.
[4]鲜金利,童湖云,蔡正杰,等.硒与新型冠状病毒研究进展[J].保健医学研究与实践,2020,17(5):12-17.
[5]张迪,何娜,杨晓莉,等.硒蛋白对人体健康重要作用的研究进展[J].科学通报,2022,67(6):473-480.DOI:10.1360/TB-2021-1019.
[6]Winther KH,Rayman MP,Bonnema SJ,et al.Selenium in thyroid disorders-essential knowledge for clinicians[J].Nat Rev Endocrinol,2020,16(3):165-176.DOI:10.1038/s41574-019-0311-6.
[7]Stoffaneller R,Morse NL.A review of dietary selenium intake and selenium status in Europe and the Middle East[J].Nutrients,2015,7(3):1494-1537.DOI:10.3390/nu7031494.
[8]Moghaddam A,Heller RA,Sun Q,et al.Selenium deficiency is associated with mortality risk from COVID-19[J].Nutrients,2020,12(7):2098.DOI:10.3390/nu12072098.
[9]Zhou G,Soufan O,Ewald J,et al.NetworkAnalyst 3.0:a visual analytics platform for comprehensive gene expression profiling and meta-analysis[J].Nucleic Acids Res,2019,47(W1):W234-W241.DOI:10.1093/nar/gkz240.
[10]Xia J,Gill EE,Hancock REW.Network analyst for statistical,visual and network-based meta-analysis of gene expression data[J].Nat Protoc,2015,10(6):823-844.DOI:10.1038/nprot.2015.052.
[11]Bermano G,Meplan C,Mercer DK,et al.Selenium and viral infection:are there lessons for COVID-19[J].Br J Nutr,202 125(6):618-627.DOI:10.1017/S0007114520003128.
[12]Zhang HY,Zhang AR,Lu QB,et al.Association between fatality rate of COVID-19 and selenium deficiency in China[J].BMC Infect Dis,202 21:452.DOI:10.1186/s12879-021-06167-8.
[13]Wada M,Lokugamage KG,Nakagawa K,et al.Interplay between coronavirus,a cytoplasmic RNA virus,and nonsense-mediated mRNA decay pathway[J].Proc Natl Acad Sci USA,2018,115(43):E10157-E10166.DOI:10.1073/pnas.1811675115.
[14]Seyedali A,Berry MJ.Nonsense-mediated decay factors are involved in the regulation of selenoprotein mRNA levels during selenium deficiency[J].RNA,2014,20(8):1248-1256.DOI:10.1261/rna.043463.113.
[15]Zupanic A,Meplan C,Huguenin GV,et al.Modeling and gene knockdown to assess the contribution of nonsense-mediated decay,premature termination,and selenocysteine insertion to the selenoprotein hierarchy[J].RNA,2016,22(7):1076-1084.DOI:10.1261/rna.055749.115.
[16]Liu L,Fang Q,Deng F,et al.Natural mutations in the receptor binding domain of spike glycoprotein determine the reactivity of cross-neutralization between palm civet coronavirus and severe acute respiratory syndrome coronavirus[J].J Virol,2007,81:4694-4700.DOI:10.1128/JVI.02389-06.
[17]Zhang J,Saad R,Taylor EW,et al.Selenium and selenoproteins in viral infection with potential relevance to COVID-19[J].Redox Biol,2020,37:101715.DOI:10.1016/j.redox.2020.101715.
[18]Ramanathan CS,Taylor EW.Computational genomic analysis of hemorrhagic fever viruses:viral selenoproteins as a potential factor in pathogenesis[J].Biol Trace Elem Res,1997,56:93-106.DOI:10.1007/BF02778985.
[19]Zhang W,Ramanathan CS,Nadimpalli RG,et al.Selenium-dependent glutathione peroxidase modules encoded by RNA viruses[J].Biol Trace Elem Res,1999,70:97-116.DOI:10.1007/BF02783852.
[20]Tomo S,Saikiran G,Banerjee M,et al.Selenium to selenoproteins-role in COVID-19[J].EXCLI J,202 20:781-791.DOI:10.17179/excli2021-3530.
[21]Taylor EW,Radding W.Understanding selenium and glutathione as antiviral factors in COVID-19:does the viral Mpro protease target host selenoproteins and glutathione synthesis[J].Front Nutr,2020,7:143.DOI:10.3389/fnut.2020.00143.
[22]Seale LA,Torres DJ,Berry MJ,et al.A role for selenium-dependent GPX1 in SARS-CoV-2 virulence[J].Am J Clin Nutr,2020,112:447-448.DOI:10.1093/ajcn/nqaa177.
[23]Heller RA,Sun Q,Hackler J,et al.Prediction of survival odds in COVID-19 by zinc,age and selenoprotein P as composite biomarker[J].Redox Biol,202 38:101764.DOI:10.1016/j.redox.2020.101764.
(收稿日期:2023-09-07)
