富血小板血浆源性外泌体对肌腱干/祖细胞增殖及迁移能力的影响
2024-07-08李墨琳朱亚琼丁雨菲易丹葛乃侨陈思明王月香
李墨琳 朱亚琼 丁雨菲 易丹 葛乃侨 陈思明 王月香

摘要:目的 探究富血小板血浆源性外泌体(PRP-Exos)对肌腱干/祖细胞(TSPC)增殖及迁移能力的影响。方法 采用聚合沉淀结合超速离心法提取PRP-Exos,采用透射电镜和纳米颗粒跟踪分析技术鉴定其形态、浓度及粒径,采用蛋白免疫印迹法检测外泌体表面标志蛋白及血小板膜糖蛋白的表达水平。提取并培养大鼠TSPC,采用流式细胞术及免疫荧光染色检测TSPC表面标志分子的表达情况。CCK-8法及EdU实验评估PRP-Exos对TSPC增殖情况的影响。细胞划痕实验及Transwell实验评估PRP-Exos对TSPC迁移情况的影响。结果 提取的PRP-Exos呈典型茶托状结构,浓度为4.9×1011个/mL,平均粒径为(132.2±56.8)nm,PRP-Exos表面表达CD9、CD63及CD41。提取的TSPC表达CD44蛋白。PRP-Exos可被TSPC摄取,共培养48 h时,浓度为50、100 μg/mL的PRP-Exos可显著促进TSPC的增殖(P均<0.001),且两组之间差异无统计学意义(P=0.283);共培养24 h后,浓度为50 μg/mL的PRP-Exos可显著促进TSPC的迁移(P<0.001)。结论 体外培养条件下,PRP-Exos对大鼠TSPC的增殖及迁移具有显著促进作用。
关键词:富血小板血浆;外泌体;肌腱干/祖细胞;增殖;迁移;肩袖损伤
中图分类号: R459.9;R686.5 文献标识码: A 文章编号:1000-503X(2024)03-0307-09
DOI:10.3881/j.issn.1000-503X.15890
Effects of Platelet-Rich Plasma-Derived Exosomes on Proliferation and Migration of Tendon Stem/Progenitor Cell
LI Molin1,2,ZHU Yaqiong2,DING Yufei3,YI Dan2,GE Naiqiao1,4,CHEN Siming2,WANG Yuexiang2
1Chinese PLA Medical School,Beijing 100853,China
2Department of Ultrasound,The First Medical Center of Chinese PLA General Hospital,Beijing 100853,China
3Department of Orthopedics,Beijing Friendship Hospital,Capital Medical University,Beijing 100050,China
4Department of Radiology,Armed Police Corps Hospital of Jilin Province,Jilin,Jilin 130000,China
Corresponding author:WANG Yuexiang Tel:010-66935455,E-mail:wangyuexiang1999@sina.com
ABSTRACT:Objective To investigate the effects of platelet-rich plasma-derived exosomes (PRP-Exos) on the proliferation and migration of tendon stem/progenitor cell (TSPC).Methods PRP-Exos were extracted through the combination of polymer-based precipitation and ultracentrifugation.The morphology,concentration,and particle size of PRP-Exos were identified by transmission electron microscopy and nanoparticle tracking analysis.The expression levels of surface marker proteins on PRP-Exos and platelet membrane glycoproteins were determined by Western blot analysis.Rat TSPC was extracted and cultured,and the expression of surface marker molecules on TSPC was detected using flow cytometry and immunofluorescence staining.The proliferation of TSPC influenced by PRP-Exos was evaluated using CCK-8 assay and EdU assay.The effect of PRP-Exos on the migration of TSPC was evaluated by cell scratch assay and Transwell assay.Results The extracted PRP-Exos exhibit typical saucer-like structures,with a concentration of 4.9×1011 particles/mL,an average particle size of (132.2±56.8) nm,and surface expression of CD9,CD63 and CD41.The extracted TSPC expressed the CD44 protein.PRP-Exos can be taken up by TSPC,and after co-cultured for 48 h,concentrations of 50 and 100 μg/mL of PRP-Exos significantly promoted the proliferation of TSPC (both P<0.001),with no statistical difference between the two concentrations (P=0.283).Additionally,after co-cultured for 24 h,50 μg/mL of PRP-Exos significantly promoted the migration of TSPC (P<0.001).Conclusion Under in vitro culture conditions,PRP-Exos significantly promote the proliferation and migration of rat TSPC.
Key words:platelet-rich plasma;exosome;tendon stem/progenitor cell;proliferation;migration;rotator cuff injury
Acta Acad Med Sin,2024,46(3):307-315
肩袖撕裂是肩关节疼痛最常见的病因,常引发患者的慢性疼痛和功能受限,严重时甚至可能致残[1]。急性肩袖损伤后,及时有效的腱骨界面重塑是良好预后的关键环节。肌腱干/祖细胞(tendon stem/progenitor cell,TSPC)作为重要的内源性干细胞,在肌腱损伤后肌腱细胞的代谢及肌腱功能的维持中起着重要作用,但其增殖及迁移的效率较低[2]。近年研究发现干细胞外泌体可以在一定程度上影响TSPC的增殖及迁移[3]。外泌体是由各种类型细胞所分泌的双层膜囊泡,直径为20~150 nm,具有与亲本细胞相似的功能,通过携载大量生物效应分子发挥促组织再生及修复功能[4-5]。然而,干细胞外泌体受来源有限、体外扩增成本昂贵且易污染、干细胞老化等限制,临床转化存在困难[6]。因此,需要寻找合适的外泌体来源以解决干细胞来源外泌体的局限性。富血小板血浆(platelet-rich plasma,PRP)是将全血经过离心后得到的富含高浓度血小板的血浆,活化的血小板释放多种生长因子,是诱导内源性细胞活化并发挥修复功能的关键[7]。最新研究显示,PRP激活后可释放大量外泌体,因其富含比PRP更高水平的生长因子而受到关注。富血小板血浆源性外泌体(platelet-rich plasma-derived exosome,PRP-Exos)具有高稳定性和低免疫原性,能够保护其内多种生长因子(血小板衍生生长因子、血管内皮生长因子、转化生长因子-β等)及核酸、蛋白质等免于降解,突破生物屏障并实现跨物种信息传递[8]。重要的是,PRP-Exos的来源广泛,既可从自体血中提取,亦可从临床血液输注资源中过剩的血小板单位中获得,据报道,不同批次之间的外泌体具有较低变异性[9]。关于PRP-Exos对TSPC增殖及迁移的影响目前尚不清楚。因此,本研究探究PRP-Exos对TSPC增殖及迁移的潜在作用,以期为肩袖损伤疾病的治疗提供科学依据。
1 材料和方法
1.1 材料
4周龄SD大鼠8只购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010。低糖DMEM培养基及胎牛血清均购自美国Gibco公司,小鼠源抗CD9、抗CD63、抗CD41抗体及辣根过氧化物酶标记山羊抗小鼠IgG二抗、兔源抗CD44抗体及Alexa Fluor 594山羊抗兔IgG(H+L)二抗均购自美国Proteintech公司,ExoQuick试剂盒购自美国System Biosciences公司,CD34-PE抗体购自北京博奥森生物技术有限公司,CD44-APC抗体购自美国LifeSpan Biosciences公司,CD45-APC-Cy7抗体购自美国BioLegend公司,CD90-FITC抗体购自英国Abcam公司,BeyoClickTM EdU-488细胞增殖检测试剂盒、DAPI、鬼笔环肽抗体和抗荧光淬灭封片剂购自上海碧云天生物技术有限公司,PKH67荧光染料购自北京富百科生物技术有限公司,CCK-8试剂盒和结晶紫染料购自北京百瑞极生物科技有限公司,Transwell 6孔板购自美国Corning公司,Ⅰ型胶原酶、牛凝血酶及10%氯化钙溶液购自美国Sigma-Aldrich公司。本研究通过中国人民解放军总医院医学伦理委员会批准(伦理审批编号:2023-X19-32)。
1.2 PRP制备
6名健康志愿者签署知情同意书后每人采集8 mL新鲜全血,并置于含38 g/L柠檬酸钠的无菌管内。采用两步离心法提取PRP:第1次离心(400×g,10 min)去除底层的红细胞和白细胞,将富含血小板的上清液移至新的离心管;第2次离心(800×g,10 min),收集下1/3部分即为PRP[10],于-80 ℃冰箱内储存。
1.3 PRP上清液提取
采用牛凝血酶和10%氯化钙溶液的混合液激活PRP[10]。PRP形成凝块后回缩,并释放大量的生长因子。经离心后(2800×g,15 min)获得富含大量生长因子的上清液,储存于-80 ℃冰箱,用于后续细胞实验。
1.4 PRP-Exos制备
采用聚合沉淀结合超速离心法提取PRP-Exos[11]。首先采用ExoQuick试剂盒获得PRP-Exos:PRP经凝血酶处理并离心去除纤维蛋白后,将上清液移至新的无菌离心管内,再次离心去除细胞碎片;随后加入外泌体提取工作液,经沉淀、离心后,底部米黄色沉淀即为PRP-Exos。为进一步去除PRP-Exos中的脂蛋白,将米黄色沉淀经PBS重悬后,进行4 ℃超速离心(100 000×g,70 min),弃去上清液,得到的PRP-Exos沉淀储存于-80 ℃冰箱。
1.5 PRP-Exos鉴定
1.5.1 透射电镜观察PRP-Exos结构形态
使用PBS将PRP-Exos重悬后,吸取15 μL的外泌体样本滴加于铜网上静置沉淀1 min,用滤纸将铜网上多余液体吸干,滴加15 μL 2%醋酸双氧铀染色液,室温染色1 min,再次吸干多余液体,常温干燥,采用透射电镜在80 kV的加速电压下观察PRP-Exos形态。
1.5.2 纳米颗粒跟踪分析检测PRP-Exos浓度及粒径分布
采用ZetaView纳米颗粒跟踪分析仪检测外泌体的浓度及粒径分布。使用PBS将PRP-Exos重悬后,吸取1 mL加入样本检测池内,采用激光光束照射样本,收集纳米颗粒的散射光信号,计算粒子浓度,并对做布朗运动的粒子进行跟踪分析,通过二维Stokes-Einstein方程计算粒子流体力学半径,进而推算外泌体的粒径分布。
1.5.3 蛋白免疫印迹法检测PRP-Exos表面标志蛋白表达
分别向PRP和PRP-Exos内加入RIPA裂解液,超声下进行裂解,取上清液。经SDS-PAGE凝胶电泳将蛋白分离并转膜。使用5%脱脂牛奶室温封闭2 h,分别加入一抗CD9(1∶1000)、CD63(1∶5000)及CD41(1∶4000),4 ℃孵育过夜。孵育后TBST洗膜,加入辣根过氧化物酶标记的二抗(1∶5000)室温孵育2 h,再次洗膜,加入适量ECL化学发光液对条带进行曝光、显影。
1.6 TSPC提取与培养
选取4周龄SD大鼠,处死后浸入75%的酒精中消毒。切除跟腱并剥离肌腱鞘膜,将肌腱组织切成碎块,加入0.2%Ⅰ型胶原酶,于37 ℃下消化1 h。将消化后的悬浮液通过70 μm细胞过滤器,去除多余的细胞团、组织块及杂质,离心后用含10%胎牛血清的低糖DMEM培养基重悬,并接种于T25培养瓶中,置于37 ℃、5% CO2细胞培养箱中继续培养,每2~3 d更换1次培养基,选用第3~6代细胞用于后续相关实验。
1.7 流式细胞术检测TSPC表面标志分子表达
采用300 μL PBS重悬TSPC,制备浓度为1×107个/mL的细胞悬液,分别加入5 μL CD34-PE、CD44-APC、CD45-APC-Cy7、CD90-FITC抗体,充分混匀后避光孵育30 min,采用流式细胞仪检测TSPC表面标志分子的表达情况。
1.8 免疫荧光染色鉴定TSPC
将TSPC以2×104个/孔的密度接种于24孔板内,待细胞贴壁生长后吸出培养基,加入4%多聚甲醛于4 ℃固定30 min,经0.25% Triton X-100透化及10%山羊血清封闭处理2 h后,滴加100 μL抗CD44(1∶100),4 ℃孵育过夜;滴加荧光二抗(1∶500)室温避光孵育2 h,DAPI染核3~5 min,置于荧光显微镜下观察。
1.9 TSPC对PRP-Exos的摄取
将TSPC以1×104个/孔的密度接种于12孔板内。将PRP-Exos沉淀使用100 μL含0.4 μL原液的PKH67荧光染色液重悬,37 ℃避光孵育5 min,4 ℃避光孵育15 min,4 ℃超速离心(100 000×g,70 min),去除未结合染料。将PKH67荧光标记的PRP-Exos与TSPC共培养24 h后,加入4%多聚甲醛4 ℃固定15 min,对照组采用等体积PBS替代PRP-Exos。滴加100 μL鬼笔环肽抗体(1∶100),室温避光标记细胞骨架30 min,滴加DAPI染核3~5 min,使用激光共聚焦显微镜观察TSPC摄取外泌体情况。
1.10 CCK-8法检测细胞增殖
将TSPC以4×103个/孔的密度接种于96孔板内,加入100 μL含有0、10、50、100 μg/mL PRP-Exos的完全培养基,分别于24、48 h更换为含10% CCK-8溶液的培养基孵育4 h,使用TECAN酶标仪检测每孔在450 nm的吸光度值。
1.11 EdU实验检测细胞增殖
将TSPC以2×104个/孔的密度均匀接种于24孔板内,待细胞贴壁后,分别加入1 mL含有50 μg/mL PRP上清液或PRP-Exos的完全培养基以及等体积PBS,培养48 h,加入终浓度为10 μmol/L的EdU工作液,继续培养6 h,弃去培养基,4%多聚甲醛固定15 min,0.3% Triton-X100透化15 min,每孔加入100 μL Click反应液,室温避光孵育30 min,DAPI标记细胞核后,使用荧光显微镜观察细胞的增殖情况。采用Image J软件分别计算EdU阳性细胞的数量及DAPI标记的总细胞数量,其比值为EdU阳性增殖细胞百分率。
1.12 细胞划痕实验评估细胞迁移
将TSPC以5×104个/孔的密度接种于6孔板中,当贴壁细胞达90%时,使用200 μL无菌枪头在细胞生长的中央区域划直线,以去除部分细胞。PRP-Exos组更换含50 μg/mL PRP-Exos的新鲜无血清培养基,PRP组更换含相同浓度PRP上清液的无血清培养基,对照组为含等体积PBS的无血清培养基,分别于0、24 h采用倒置显微镜进行拍照,观察划痕区细胞的迁移情况。
1.13 Transwell实验评估细胞迁移
将500 μL含TSPC细胞悬液(5×104个/孔)的无血清培养基均匀接种于Transwell孔板上室,另将600 μL含50 μg/mL的PRP上清液或PRP-Exos的完全培养基加入下室,孵育24 h后,弃去上室培养基,使用棉签轻轻擦去上室上层未迁移的细胞,4%多聚甲醛固定渗透膜上的迁移细胞15 min,0.1%结晶紫溶液染色20 min,采用倒置显微镜观察细胞迁移情况,采用Image J软件计数并计算细胞相对迁移比值。
1.14 统计学处理
采用SPSS 22.0统计软件,采用Shapiro-Wilk法进行正态性检验,符合正态分布的计量资料以均数±标准差表示,多组间不同时间点的比较采用重复测量的方差分析,采用Turkey法进行组间的事后多重比较。双侧P<0.05为差异有统计学意义。
2 结果
2.1 PRP-Exos鉴定
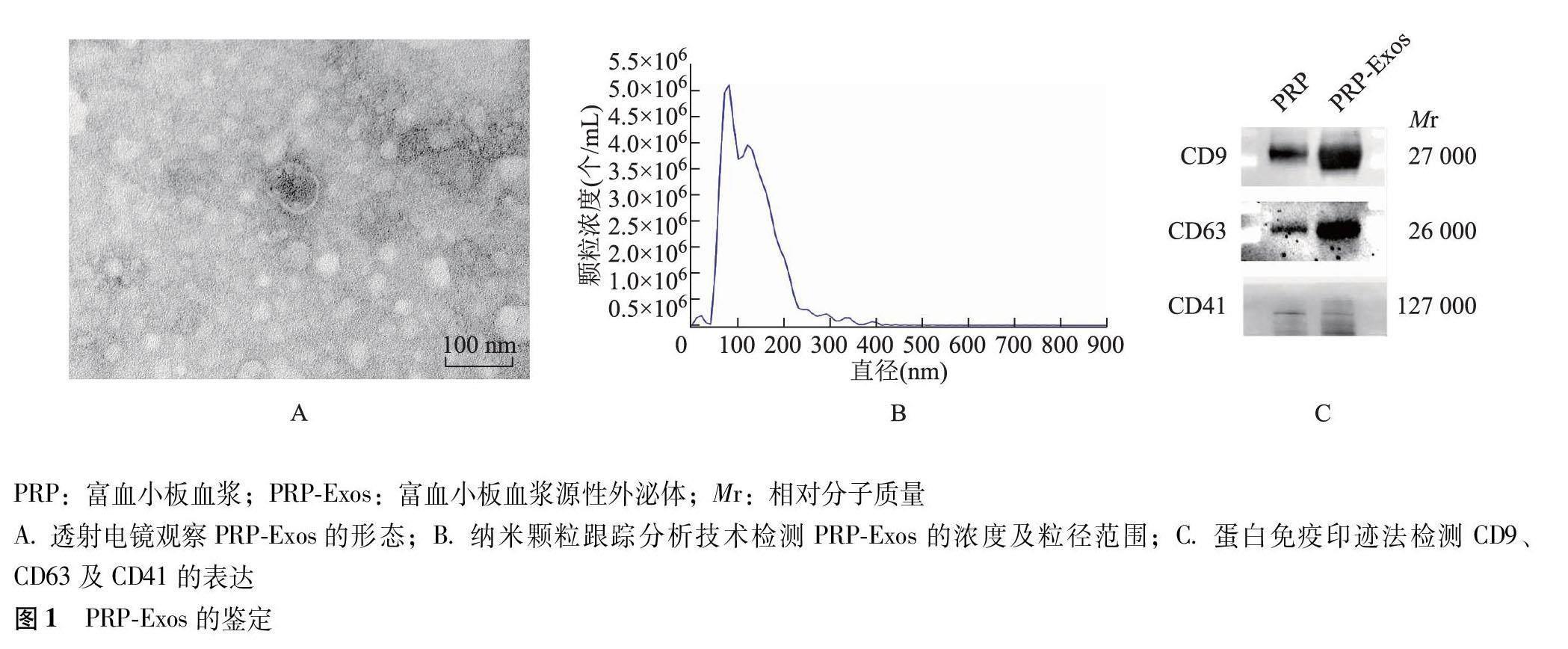
透射电镜观察显示,PRP-Exos颗粒为圆形囊泡,呈现外泌体典型的茶托状结构特征(图1A)。纳米颗粒跟踪分析技术显示,PRP-Exos浓度为4.9×1011个/mL,平均粒径(132.2±56.8)nm(图1B)。蛋白免疫印迹法结果显示,PRP-Exos表达外泌体特异标志蛋白CD9、CD63及血小板膜糖蛋白CD41(图1C)。
2.2 TSPC鉴定
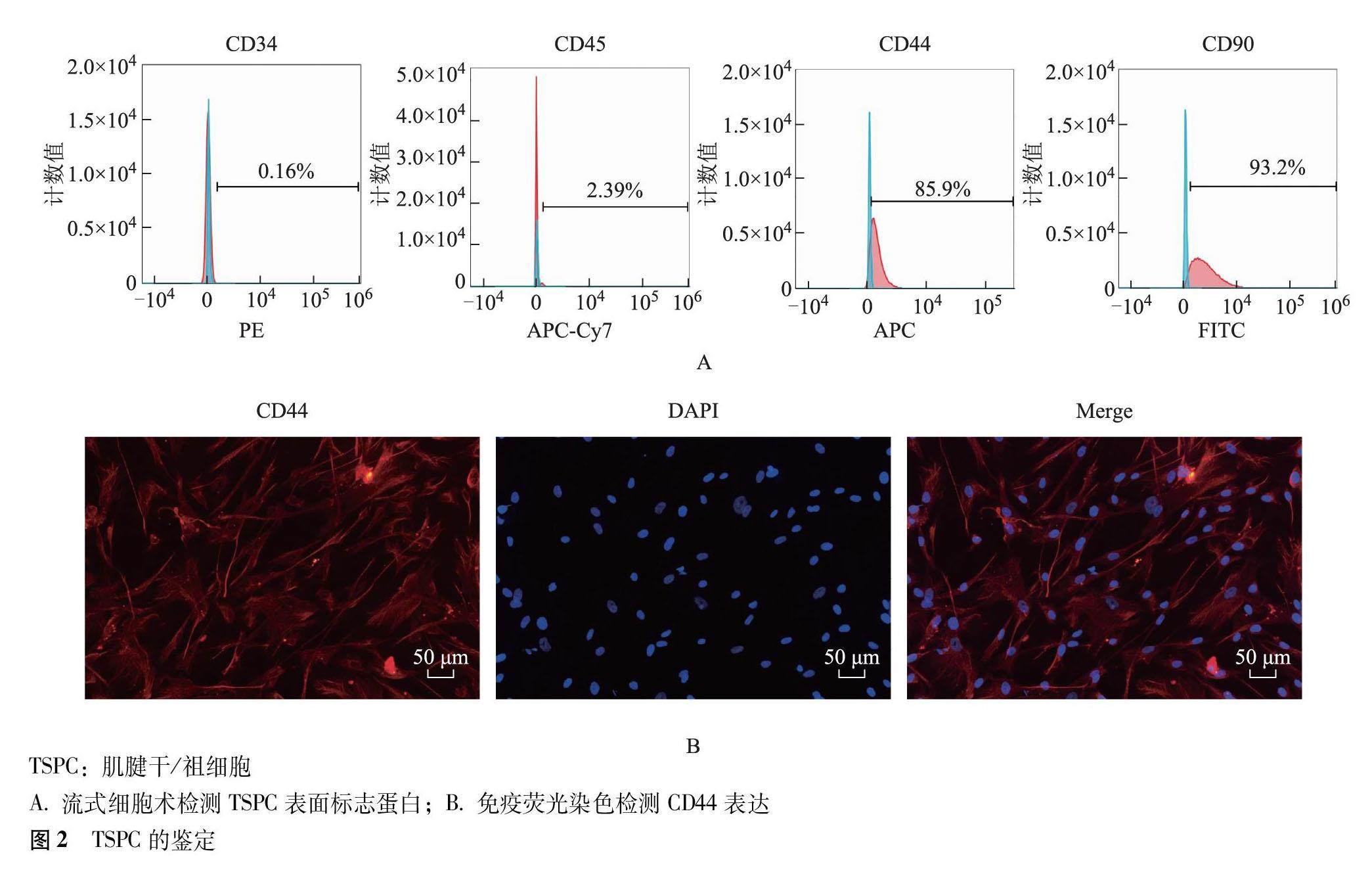
流式细胞术检测结果显示,TSPC表面CD44、CD90、CD34、CD45阳性表达率分别为85.9%、93.2%、0.16%、2.39%(图2A)。免疫荧光染色结果显示,提取的TSPC大小均一,呈梭形或多角形,可见大量表面标志蛋白CD44表达阳性(图2B)。
2.3 TSPC对PRP-Exos的摄取
激光共聚焦显微镜观察显示,PRP-Exos组观察到绿色荧光标记的PRP-Exos明显聚集在TSPC的细胞核周围,分布于呈红色荧光信号的细胞质内,而对照组未见绿色荧光信号(图3)。
2.4 PRP-Exos对TSPC增殖能力的影响
CCK-8法检测结果显示,共培养24 h后,100 μg/mL PRP-Exos组的TSPC增殖能力较0、10、50 μg/mL组增强(P<0.001,P<0.001,P=0.028);共培养48 h后,50 、100 μg/mL PRP-Exos组的TSPC增殖能力较0、10 μg/mL组明显增强(P均<0.001),而50 μg/mL和100 μg/mL PRP-Exos组比较差异无统计学意义(P=0.283)(图4A),后续选择50 μg/mL作为PRP-Exos组的最佳药物刺激浓度。EdU实验结果显示,与对照组比较,PRP组和PRP-Exos组的EdU阳性细胞率均明显增加[(27.00±2.93)%比(14.22±3.92)%,P=0.042和(40.01±9.60)%比(14.22±3.92)%,P<0.001];与PRP组比较,PRP-Exos组表现出更强的促细胞增殖作用[(40.01±9.60)%比(27.00±2.93)%,P=0.039](图4B)。
2.5 PRP-Exos对TSPC迁移能力的影响
细胞划痕实验检测结果显示,共培养24 h后,PRP、PRP-Exos、对照组的划痕区间隙均有不同程度的缩小(图5A)。PRP-Exos组的TSPC迁移能力较PRP组和对照组明显增加[(53.31±7.75)%比(40.52±5.99)%;P=0.045和(53.31±7.75)%比(26.76±4.92)%;P<0.001](图5B)。Transwell实验检测结果显示,PRP-Exos组的细胞迁移能力较PRP组和对照组明显增加(1.55±0.13比1.28±0.07;P=0.025和1.55±0.13比1.00±0.14;P<0.001)(图5C、5D)。
3 讨论
肩袖损伤是重要的肌肉骨骼系统疾病,常导致长期疼痛和预后不良,严重影响患者生活质量[12]。目前,以手术修复为主的对症治疗是临床常用且有效的治疗手段,但越来越多的证据表明,腱骨界面的愈合能力十分有限[13-14]。天然肌腱-纤维软骨-骨的梯度结构及功能往往很难仅通过手术修补重塑,主要原因之一是肌腱损伤部位TSPC的数量及迁移能力难以支撑肩袖的再生修复。本研究成功地从健康志愿者的PRP中提取出形态良好且浓度较高的PRP-Exos,经证实这些外泌体能够被TSPC细胞有效摄取。体外细胞实验结果显示,PRP-Exos可以显著增强TSPC的增殖及迁移能力。PRP-Exos作为一种新型的效应分子,有可能解决肩袖修复过程中TSPC功能不足的问题。
基于TSPC的干细胞疗法在运动医学领域具有独特的发展前景。相比于受到广泛关注的骨髓间充质干细胞,TSPC被证实具有更强大的克隆、增殖及特殊的肌腱分化能力[15],通过改善细胞基质、影响血管生成和胶原蛋白合成及调控肌腱代谢微环境来修复损伤肌腱[16]。许多研究将TSPC作为种子细胞,与基于3D打印材料[2]、纳米纤维材料[17]、多功能水凝胶[18]等组织工程技术相结合,在运动医学领域取得突破性进展。然而,随着内源性TSPC或体外扩增过程中的细胞衰老,其发挥修复功能的表型也随之改变,以转录因子Scleraxis为主的腱细胞谱系标志基因的表达逐渐降低[2]。细胞衰老不可避免地导致错误的干细胞分化和基质沉积改变,包括异位骨化和纤维化,最终导致干细胞耗竭和肌腱再生失败。因此,维持具有活性TSPC的数量及关键表型至关重要,亟待探索可适用于TSPC的生物活性分子。
关于PRP的临床疗效和用途目前仍存在一定的争议,其主要原因可能涉及以下几个方面:(1)PRP制备方法及质量控制尚缺乏统一标准,这导致对比评估不同研究中PRP的再生功能及治疗有效性十分困难[19];(2)PRP疗法具有个体局限性,其效果易受患者性别、年龄及自身机能水平的影响,在一定程度上限制了临床应用[7,20]。而PRP-Exos含有较PRP更高水平的生长因子及丰富的核酸信息,具有极高稳定性和低免疫原性,可以突破PRP自体疗法的限制,实现跨物种治疗的可能。近期研究已证实PRP-Exos具有止血、促血管生成、调节炎症反应的能力,在再生医学领域具有强大的潜能[9,21]。本研究探究PRP-Exos对大鼠TSPC增殖及迁移的促进作用,为肩袖疾病的治疗提供了理论基础。
组织损伤后,内源性细胞的活化、增殖并向损伤区域趋化是介导修复的关键环节,研究发现PRP-Exos发挥再生作用与其参与调节细胞生长及功能有关。Tao等[22]研究发现PRP-Exos可逆转糖皮质激素处理后人微血管内皮细胞、骨髓间充质干细胞、小鼠胚胎成骨细胞的抗增殖作用,从而改善股骨头坏死骨组织的维持与再生。Xu等[23]研究发现PRP-Exos可促进人永生化表皮细胞的增殖、迁移,并改善伤口愈合。此外,维持干细胞群并加强其在损伤区域的生物学行为对组织再生更为重要。现已证实PRP-Exos可促进骨髓间充质干细胞、内皮祖细胞等多种干细胞的增殖、存活及分化[24-25]。本研究结果显示,PRP-Exos能够显著促进TSPC的增殖及迁移能力,且作用效果受浓度和时间的影响。共培养24 h后,100 μg/mL PRP-Exos组出现明显的促增殖效果,而10、50 μg/mL PRP-Exos组的促增殖效果较0 μg/mL组差异无统计学意义;共培养48 h后,50、100 μg/mL PRP-Exos组较0 μg/mL组均有明显的促增殖效果。这可能是因为短时间PRP-Exos刺激TSPC需要较高的浓度阈值,随着培养时间的延长,稍低浓度的PRP-Exos也可能起到促增殖效果。此外,共培养48 h后,50 μg/mL和100 μg/mL两组浓度的促增殖效果差异无统计学意义,提示更高浓度的PRP-Exos并不一定介导更高效的促增殖效果。其原因可能为PRP-Exos刺激能力存在浓度饱和,亦或是外泌体内复杂的mRNA、微小RNA、蛋白质、活性分子等改变了TSPC表型,进而对增殖能力产生影响。本研究选取50 μg/mL浓度用于观察PRP-Exos对TSPC的促迁移能力,Transwell实验和细胞划痕实验均显示PRP-Exos组较PRP组表现出更强的促细胞迁移作用。
本研究存在一定的局限性。首先,50 μg/mL的PRP-Exos浓度仅为大致参考浓度,在后续实验中,需要详细设置浓度梯度来筛选最佳的刺激浓度。其次,随培养时间延长,更高浓度PRP-Exos并不能进一步增强细胞的增殖效果,其原因还需要进一步探讨。最后,由于外泌体内容物的复杂性,其对TSPC生物学行为影响的复杂机制通路同样值得探索。
综上,本研究结果表明,PRP-Exos可显著促进大鼠TSPC增殖及迁移能力。PRP-Exos的来源及制备极具优势,可为肩袖损伤的临床治疗提供新的方法。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李墨琳:研究设计、数据搜集、起草论文及修改;朱亚琼:研究选题、审阅文稿;丁雨菲:数据搜集和分析、对重要学术内容做出关键性修订;易丹:数据分析,修改论文;葛乃侨:数据收集及分析、对学术问题进行解答;陈思明:研究选题、论文定稿;王月香:对学术问题进行解答、同意对研究工作各方面的诚信问题负责
参 考 文 献
[1]Liu Q,Yu Y,Reisdorf RL,et al.Engineered tendon-fibrocartilage-bone composite and bone marrow-derived mesenchymal stem cell sheet augmentation promotes rotator cuff healing in a non-weight-bearing canine model[J].Biomaterials,2019,192:189-198.DOI:10.1016/j.biomaterials.2018.10.037.
[2]Zhang Y,Lei T,Tang C,et al.3D printing of chemical-empowered tendon stem/progenitor cells for functional tissue repair[J].Biomaterials,2021,271:120722.DOI:10.1016/j.biomaterials.2021.120722.
[3]Yu H,Cheng J,Shi W,et al.Bone marrow mesenchymal stem cell-derived exosomes promote tendon regeneration by facilitating the proliferation and migration of endogenous tendon stem/progenitor cells[J].Acta Biomater,2020,106:328-341.DOI:10.1016/j.actbio.2020.01.051.
[4]Barile L,Vassalli G.Exosomes:therapy delivery tools and biomarkers of diseases[J].Pharmacol Ther,2017,174:63-78.DOI:10.1016/j.pharmthera.2017.02.020.
[5]Kimiz-Gebologlu I,Oncel SS.Exosomes:large-scale production,isolation,drug loading efficiency,and biodistribution and uptake[J].J Control Release,2022,347:533-543.DOI:10.1016/j.jconrel.2022.05.027.
[6]Antich-Rosselló M,Forteza-Genestra MA,Monjo M,et al.Platelet-derived extracellular vesicles for regenerative medicine[J].Int J Mol Sci,2021,22(16):8580.DOI:10.3390/ijms22168580.
[7]Everts P,Onishi K,Jayaram P,et al.Platelet-rich plasma:new performance understandings and therapeutic considerations in 2020[J].Int J Mol Sci,2020,21(20):7794.DOI:10.3390/ijms21207794.
[8]Tao SC,Guo SC,Zhang CQ.Platelet-derived extracellular vesicles:an emerging therapeutic approach[J].Int J Biol Sci,2017,13(7):828-834.DOI:10.7150/ijbs.19776.
[9]Johnson J,Wu YW,Blyth C,et al.Prospective therapeutic applications of platelet extracellular vesicles[J].Trends Biotechnol,2021,39(6):598-612.DOI:10.1016/j.tibtech.2020.10.004.
[10]Zhu Y,Peng N,Wang J,et al.Peripheral nerve defects repaired with autogenous vein grafts filled with platelet-rich plasma and active nerve microtissues and evaluated by novel multimodal ultrasound techniques[J].Biomater Res,2022,26(1):24.DOI:10.1186/s40824-022-00264-8.
[11]Yi D,Zhang Y,Li M,et al.Ultrasound-targeted microbubble destruction assisted delivery of platelet-rich plasma-derived exosomes promoting peripheral nerve regeneration[J].Tissue Eng Part A,2023,29(23-24):645-662.DOI:10.1089/ten.TEA.2023.0133.
[12]Ren Y,Zhang S,Wang Y,et al.Effects of purified exosome product on rotator cuff tendon-bone healing in vitro and in vivo[J].Biomaterials,2021,276:121019.DOI:10.1016/j.biomaterials.2021.121019.
[13]Chae S,Yong U,Park W,et al.3D cell-printing of gradient multi-tissue interfaces for rotator cuff regeneration[J].Bioact Mater,2023,19:611-625.DOI:10.1016/j.bioactmat.2022.05.004.
[14]Bao D,Sun J,Gong M,et al.Combination of graphene oxide and platelet-rich plasma improves tendon-bone healing in a rabbit model of supraspinatus tendon reconstruction[J].Regen Biomater,2021,8(6):rbab045.DOI:10.1093/rb/rbab045.
[15]Zhang X,Lin YC,Rui YF,et al.Therapeutic roles of tendon stem/progenitor cells in tendinopathy[J].Stem Cells Int,2016,2016:4076578.DOI:10.1155/2016/4076578.
[16]Harvey T,Flamenco S,Fan CM.A tppp3(+)pdgfra(+) tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis[J].Nat Cell Biol,2019,21(12):1490-1503.DOI:10.1038/s41556-019-0417-z.
[17]Lin Y,Zhang L,Liu NQ,et al.In vitro behavior of tendon stem/progenitor cells on bioactive electrospun nanofiber membranes for tendon-bone tissue engineering applications[J].Int J Nanomedicine,2019,14:5831-5848.DOI:10.2147/IJN.S210509.
[18]Ge Z,Li W,Zhao R,et al.Programmable DNA hydrogel provides suitable microenvironment for enhancing TSPCS therapy in healing of tendinopathy[J].Small,2023,19(32):e2207231.DOI:10.1002/smll.202207231.
[19]Gentile P,Garcovich S.Systematic review-the potential implications of different platelet-rich plasma (PRP) concentrations in regenerative medicine for tissue repair[J].Int J Mol Sci,2020,21(16):5702.DOI:10.3390/ijms21165702.
[20]Wu J,Piao Y,Liu Q,et al.Platelet-rich plasma-derived extracellular vesicles:a superior alternative in regenerative medicine[J].Cell Prolif,2021,54(12):e13123.DOI:10.1111/cpr.13123.
[21]Miyazawa B,Trivedi A,Togarrati PP,et al.Regulation of endothelial cell permeability by platelet-derived extracellular vesicles[J].J Trauma Acute Care Surg,2019,86(6):931-942.DOI:10.1097/TA.0000000000002230.
[22]Tao SC,Yuan T,Rui BY,et al.Exosomes derived from human platelet-rich plasma prevent apoptosis induced by glucocorticoid-associated endoplasmic reticulum stress in rat osteonecrosis of the femoral head via the Akt/Bad/Bcl-2 signal pathway[J].Theranostics,2017,7(3):733-750.DOI:10.7150/thno.17450.
[23]Xu Y,Lin Z,He L,et al.Platelet-rich plasma-derived exosomal USP15 promotes cutaneous wound healing via deubiquitinating EIF4A1[J].Oxid Med Cell Longev,2021,2021:9674809.DOI:10.1155/2021/9674809.
[24]Zhang Y,Wang X,Chen J,et al.Exosomes derived from platelet-rich plasma administration in site mediate cartilage protection in subtalar osteoarthritis[J].J Nanobiotechnology,2022,20(1):56.DOI:10.1186/s12951-022-01245-8.
[25]Zheng G,Ma HW,Xiang GH,et al.Bone-targeting delivery of platelet lysate exosomes ameliorates glucocorticoid-induced osteoporosis by enhancing bone-vessel coupling[J].J Nanobiotechnology,2022,20(1):220.DOI:10.1186/s12951-022-01400-1.
(收稿日期:2023-10-19)
