成纤维细胞生长因子-23与慢性肾脏病患者矿物质代谢紊乱的相关性研究
2019-11-14胡志娟史亚男刘琼董春霞牛凯刘冰
胡志娟,史亚男,刘琼,董春霞,牛凯,刘冰
(河北省人民医院 肾内科,河北 石家庄 050051)
慢性肾脏病-矿物质和骨代谢紊乱(chroic kidney disease-mineral bone disorder, CKD-MBD)是 指 由 肾功能下降引起的矿物质和骨代谢异常的系统性病变。可表现为血清钙、磷、全段甲状旁腺激素(intact parathyroid hormone, iPTH)、维生素D 代谢异常,骨的转换、矿化、容量、线性生长或强度的异常,以及血管或其他软组织的钙化[1]。CKD-MBD 与心血管疾病和骨折风险增加相关,且伴有高病死率[2]。改善全球肾脏病预后组织(KDIGO)推荐从CKD 3 期开始监测血清钙磷、甲状旁腺激素(PTH)、碱性磷酸酶活性、25-羟维生素D[1]。在CKD 患者中,成纤维细胞生长因子 23(fibroblast growth factor 23, FGF-23)的升高先于血磷和PTH 升高。脉搏波传导速度(pulse wave velocity, PWV)能反映动脉顺应性僵硬度,比较常用的测量部位 是颈-股动脉、肱-踝动脉(Ba)、颈-踝动脉及颈-桡动脉[3]。本研究观察慢性肾脏病非透析患者的血清钙、磷、iPTH、25-羟维生素D、FGF-23 水平及baPWV,并探讨FGF-23 与上述指标的相关性。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年9月河北省人民医院肾内科CKD 1~5 期患者206 例。其中,男性125 例,女性81 例;年龄(43.67±11.32)岁。选取本院体检中心健康者35 例作为对照组。其中,男性19 例,女性16 例;年龄(42.36±12.01)岁。各组一般情况见表1。纳入标准:①肾损害>3个月,包括有或无肾小球滤过率(glomerular filtration rate, GFR)降低。而肾损害是指肾脏的结构或功能异常,包括肾脏影像学检查异常或 血、尿成分异常;②GFR<60ml/(min•1.73 m2)>3 个月,有或无肾损害现象。排除标准:①合并急性肾损伤;②各种自身免疫性肾损伤如狼疮性肾炎;③患有恶性肿瘤;④有严重的肝脏疾病,如肝硬化、急慢性肝炎等; ⑤原发性甲状旁腺功能亢进;⑥患有严重肺功能障碍 或肺功能不全;⑦严重感染,血常规白细胞计数>10× 109个/L;⑧妊娠期或哺乳期妇女;⑨既往3 个月内使用免疫抑制剂者;⑩已经开始进入肾脏替代治疗者。研究经本院医学伦理委员会批准。
1.2 观察项目及方法
估算肾小球滤过率(estimated glomerular filtration rate, eGFR)采用CKD 流行病合作工作组方程(chronic kidney disease epidemiology collaboration, CKD-EPI)计算[4]。男性≤62 eGFR=144×(Scr/0.7)-0.329×(0.993)Age;>62 eGFR=144×(Scr/0.7)-1.209×(0.993)Age;女性≤ 80 eGFR=141×(Scr/0.9)-0.411×(0.993)Age;>80 eGFR=141×(Scr/0.9)-1.209×(0.993)Age;CKD 分期是按照eGFR[ml/(min•1.73 m2)][5],≥90 为CKD 1 期(CKD 1期组),60~89 为CKD 2 期(CKD 2 期组),45~59为CKD 3a 期(CKD 3a 期组),30~44 为CKD 3b期(CKD 3b 期组),15~29 为CKD 4 期(CKD 4 期组),<15 或透析为CKD 5 期(CKD 5 期组)。血清25-羟维生素D<20 ng/ml 为缺乏,20.0~29.9ng/ml 为不足,30.0~60.0ng/ml 为正常[6]。血清钙、磷、肌酐、白蛋白的检测在Beckman 全自动生化分析仪完成(AU680,美国贝克曼库尔特公司);iPTH 及25-羟维生素D 的测定采用电化学发光法(美国罗氏公司);收集各组患者血清,酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA) 检测 FGF23 浓度(美国R &D Systems 公司),采用分离胶-促凝真空采血管收集所有受试者清晨空腹静脉血4ml,自然凝固20min 后以4000r/min 离心15min,所收集上清标本贮存于-80℃冰箱冷冻保存。采用日本欧姆龙BP-203PRE Ⅲ型全自动动脉硬化检测仪测量肱踝脉搏波传导速度(brachi al-to-ankle pulse wave velocity, baPWV)。
1.3 统计学方法
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差(±s)表示,两组间均数比较采用t检验(或t'检验),多组间差异比较采用单因素方差分析,进一步两两比较采用SNK-q检验;计数资料以例(%)表示,比较采用χ2检验;采用Spearman 或者Pearson双变量相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组一般临床资料的比较
各组的性别、年龄及体重指数(body mass index, BMI)比较,差异无统计学意义(P>0.05)。各组收缩压和舒张压比较,差异有统计学意义(P<0.05);与对照组比较,CKD 3a~5 期组患者的收缩压升高(P<0.05);与对照组比较,CKD 2~5 期组患者的舒张压升高(P<0.05);与CKD 1 期组比较,CKD 3b~5 期组患者的收缩压升高(P<0.05)。见表1。
2.2 各组生物化学指标的比较
与对照组比较,CKD 各期患者的24 h 尿白蛋白定量升高(P<0.05);CKD 3a~5 期组患者的血清肌酐水平升高(P<0.05);CKD 3a~5 期组患者的血清白蛋白下降,iPTH 水平升高,血钙水平下降,血磷水平升高(P<0.05)。与CKD 1 期组比较,CKD 2~5 期组患者的血清白蛋白变化差异无统计学意义(P>0.05);CKD 3a~5 期组患者的血清肌酐水平升高(P<0.05);CKD 3b~5 期组患者的血钙水平下降、血磷水平升高(P<0.05);CKD 4~5 期组患者的iPTH 水平升高(P<0.05);CKD 3a 期组患者的24h 尿白蛋白水平下降(P<0.05)。见表2。
2.3 各组25-羟维生素D 及FGF-23 水平的比较
与对照组比较,CKD 2~5 期组患者的25-羟维生素D 水平下降,CKD 3a~5 期组患者的FGF-23 水平升高(P<0.05);与CKD 1 期组比较,CKD 3b~5期组患者的25-羟维生素D水平下降(P>0.05);CKD 3a~5 期组患者的FGF-23 水平升高(P<0.05)(见表3)。各组不同水平25-羟维生素D 例数所占比例的比较,差异有统计学意义(χ2=55.370,P=0.000);25-羟维生素D 例数占比情况,在对照组及CKD 早期以20.0~29.9ng/ml 组占比最多,随着eGFR 水平下降,25-羟维生素D<20.0ng/ml 例数增加。见表4。
2.4 各组baPWV 的比较
各组baPWV 比较,差异有统计学意义(P<0.05),与对照组及CKD1 期组分别比较,CKD 2~5 期组患者的baPWV 加快。见表5。
2.5 CKD-MBD 参数与FGF-23 相关性分析
所有CKD 患者中血清FGF-23 与血钙、25-羟维生素D 呈负相关(r=-0.175 和-0.130,均P=0.000);与血磷、iPTH 呈正相关(r=0.236 和0.249,均P=0.000)。
表1 各组一般临床资料的比较 (±s)

表1 各组一般临床资料的比较 (±s)
注:①与对照组比较,P<0.05;②与CKD 1 期组比较,P <0.05。
收缩压/(mmHg,images/BZ_15_2036_993_2061_1049.png±s)舒张压/(mmHg,images/BZ_15_2036_993_2061_1049.png±s)年龄/(岁,images/BZ_15_2036_993_2061_1049.png±s)组别 n 男/女/例BMI/(kg/m2,images/BZ_15_2036_993_2061_1049.png±s)对照组 35 19/16 42.36±12.01 124.18±12.12 78.65±9.33 23.74±2.83 CKD 1 期组 34 22/12 40.56±12.32 125.10±13.51 82.36±10.32 24.71±3.32 CKD 2 期组 35 23/12 42.61±11.22 132.54±14.52 85.78±11.25① 24.39±3.38 CKD 3a 期组 34 21/13 43.80±11.90 137.75±15.15① 86.19±11.78① 24.70±3.24 CKD 3b 期组 33 20/13 43.93±10.25 141.26±14.27①② 87.27±12.36① 24.72±3.84 CKD 4 期组 38 21/17 45.35±11.75 144.43±16.39①② 88.96±11.99① 24.66±3.59 CKD 5 期组 32 18/14 49.37±13.11 147.34±25.63①② 89.82±16.54① 23.98±4.13 χ2/ F 值 1.848 1.860 10.710 3.610 0.450 P 值 0.933 0.089 0.000 0.002 0.842
表2 各组生物化学指标的比较 (±s)

表2 各组生物化学指标的比较 (±s)
注:①与对照组比较,P <0.05;②与CKD 1 期组比较,P <0.05。
24 h 尿白蛋白/ (g/24 h)对照组 35 43.15±2.18 67.96±10.36 20.15±10.23 2.35±0.13 1.02±0.12 0.06±0.03 CKD 1 期组 34 41.11±5.13 68.55±13.25 33.75±11.84 2.34±0.12 1.09±0.21 2.13±1.56①CKD 2 期组 35 40.96±6.72 101.42±16.75 38.67±13.26 2.30±0.11 1.10±0.20 1.15±1.26①CKD 3a 期组 34 39.68±5.96 129.68±17.538①② 57.28±18.37① 2.28±0.12 1.14±0.18 1.33±1.29①②CKD 3b 期组 33 38.73±5.87① 175.65±28.27①② 68.46±30.55① 2.24±0.09①② 1.24±0.24①② 1.69±1.42①CKD 4 期组 38 38.19±6.13① 253.88±55.34①② 90.83±56.37①② 2.20±0.15①② 1.32±0.29①② 2.75±2.13①CKD 5 期组 32 37.98±7.14① 562.97±215.38①② 195.63±140.56①② 2.13±0.20①② 1.61±0.33①② 2.86±1.51①F 值 3.660 146.520 34.410 11.500 24.400 15.890 P 值 0.002 0.000 0.000 0.000 0.000 0.000组别 n 血清白蛋白/ (g/L)血清肌酐/ (µmol/L)iPTH/(pg/ml)血钙/ (mmol/L)血磷/ (mmol/L)
表3 各组25-羟维生素D及FGF-23水平的比较 (±s)
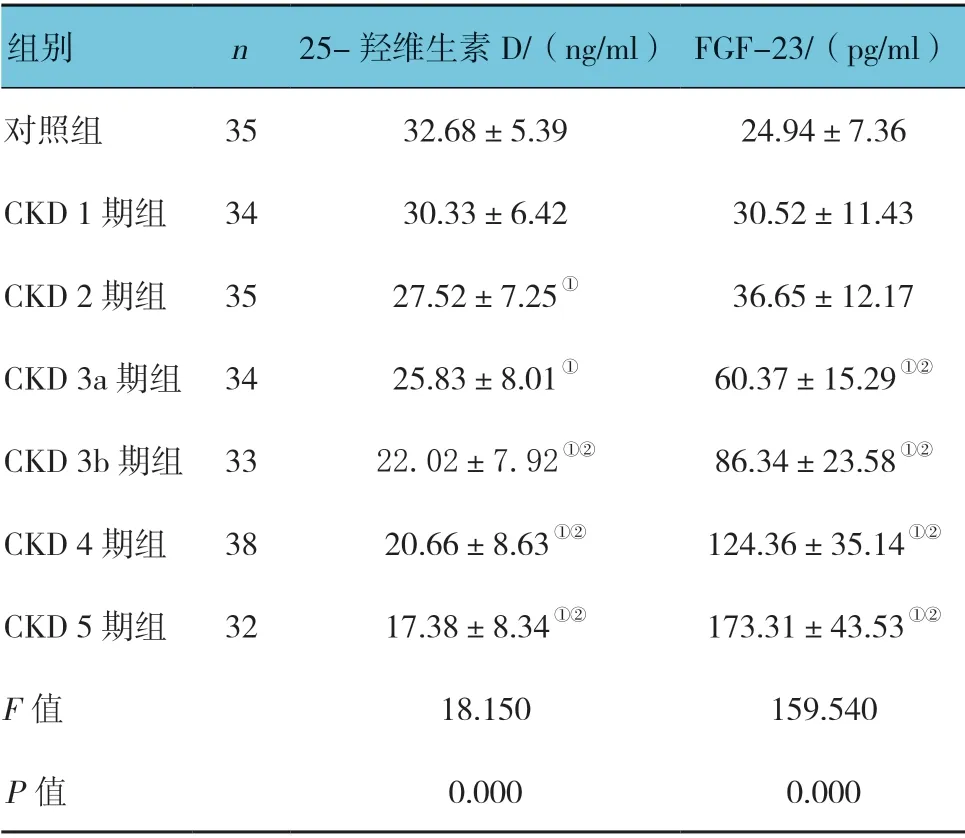
表3 各组25-羟维生素D及FGF-23水平的比较 (±s)
注:①与对照组比较,P <0.05;②与CKD 1 期组比较,P <0.05。
组别 n 25-羟维生素D/(ng/ml) FGF-23/(pg/ml)对照组 35 32.68±5.39 24.94±7.36 CKD 1 期组 34 30.33±6.42 30.52±11.43 CKD 2 期组 35 27.52±7.25① 36.65±12.17 CKD 3a 期组 34 25.83±8.01① 60.37±15.29①②CKD 3b 期组 33 22.02±7.92①② 86.34±23.58①②CKD 4 期组 38 20.66±8.63①② 124.36±35.14①②CKD 5 期组 32 17.38±8.34①② 173.31±43.53①②F 值 18.150 159.540 P 值 0.000 0.000

表4 各组不同水平25-羟维生素D 例数所占比例的比较 [ng/ml,例(%)]
表5 各组baPWV 的比较 (±s)
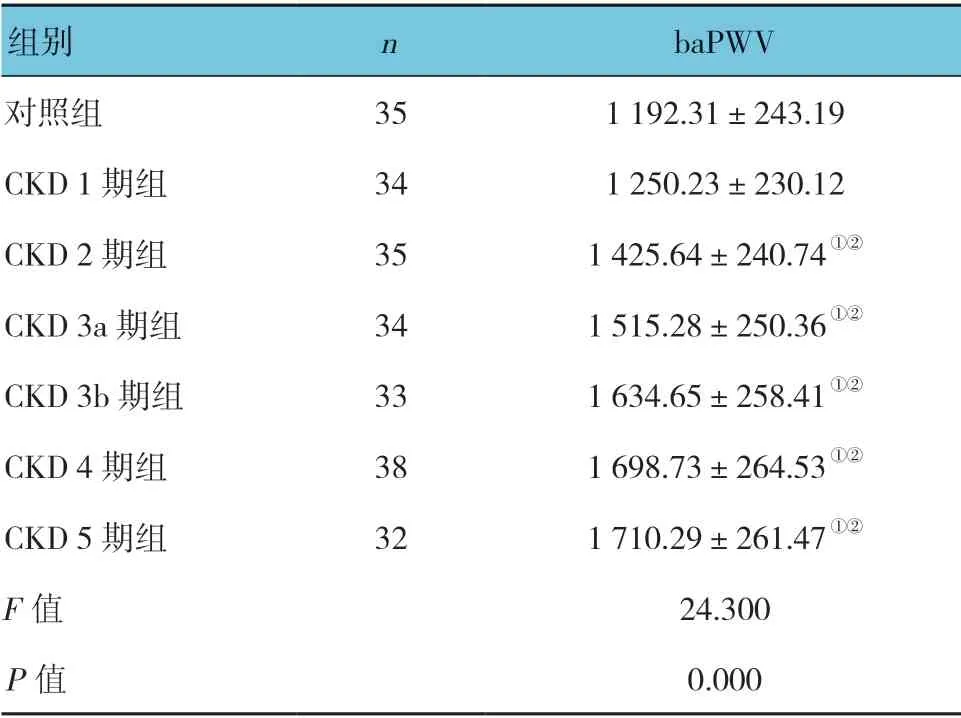
表5 各组baPWV 的比较 (±s)
注:①与对照组比较,P <0.05;②与CKD 1 期组比较,P <0.05。
组别 n baPWV对照组 35 1 192.31±243.19 CKD 1 期组 34 1 250.23±230.12 CKD 2 期组 35 1 425.64±240.74①②CKD 3a 期组 34 1 515.28±250.36①②CKD 3b 期组 33 1 634.65±258.41①②CKD 4 期组 38 1 698.73±264.53①②CKD 5 期组 32 1 710.29±261.47①②F 值 24.300 P 值 0.000
3 讨论
本研究发现在CKD 患者中,血清iPTH、FGF-23 水平的变化先于血钙、磷的变化。随着eGFR 的降低,25-羟维生素D 的下降早于iPTH、FGF-23 水平的升高。在CKD 的早期即出现血管僵硬度增加。血清FGF-23 与血钙、25-羟维生素D 呈负相关;与血磷、iPTH 呈正相关。
CKD 通过血钙、1,25-羟维生素D 水平下降,血磷、iPTH、FGF23 水平升高,影响骨和矿物质代谢,导致CKD-MBD。众所周知,大多数的CKD 早中期患者血磷水平正常,FGF-23 和iPTH 水平升高是维持血磷平衡的代偿反应[7]。美国一项研究发现,在eGFR 低于40 ml/(min•1.73m2)时血清钙磷水平的异常[8]。与此研究一致,本研究发现高磷血症出现在CKD 晚期。
血清FGF23 是CKD 患者矿物质和骨代谢紊乱的早期生物标志物。与既往的研究一致[9],CKD 患者随着eGFR 的降低,FGF-23 水平升高,同时伴有iPTH水平升高和25-羟维生素D 水平降低;FGF-23 水的升高早于iPTH 和血磷水平的升高。与西方人群比较,我国的CKD 患者普遍出现25-羟维生素D 不足和缺乏,比例分别为54.37%和41.26%,而且在eGFR 较高的水平既已出现,与西方国家有差异[7]。一项纳入133 例CKD3、CKD4 期患者的队列研究显示,东南亚人25-羟维生素D 水平低于高加索人[10]。亚裔人群由于饮食及缺乏日晒而导致维生素D 缺乏症[11]。不仅如此,1,25-羟维生素D 缺乏促使甲状旁腺增生,并由于维生素D 的负反馈缺失导致PTH 合成增加[12]。本研究发现在eGFR 的下降的过程中,25-羟维生素D 的降低早于iPTH 的升高。临床上尚需大规模的研究进一步调查不同种族人群和肾衰竭程度时维生素D的缺乏的情况,以及1,25-羟维生素D 在CKD-MBD中的作用。
心血管疾病是CKD 患者死亡的首要原因。其病理生理涉及多因素,但血管钙化是其主要因素之一。前瞻性研究显示,主动脉和冠状动脉钙化评分可以预测CKD 患者的全因死亡和心血管死亡[12]。在荷兰的一项CKD 伴有糖尿病患者的研究中,胸主动脉钙化评分的下降与动脉僵硬度独立相关,与eGFR 下降相关[13]。baPWV 是动脉僵硬度的检测指标之一,近来研究表明baPWV 也是动脉硬化性心血管疾病的独立危险因素[14]。
综上所述,CKD 患者应早期检测25-羟维生素D 水平,并监测血管僵硬度,积极干预处理危险因素,预防CKD-MBD 的发生、发展及心血管不良事件的出现。限于本研究只是一个时间点的观察,不能十分明确CKD-MBD 参数与心血管危险的因果关系。
