红果樫木叶木脂素类化学成分研究
2024-06-26闫慧娇陈雨洁宋祥云李恩霞耿岩玲
闫慧娇 陈雨洁 宋祥云 李恩霞 耿岩玲

DOI:10.3976/j.issn.1002-4026.20230094
收稿日期:2023-06-06
基金项目:国家自然科学基金(32200311);济南市高校20条(202228020);齐鲁工业大学(山东省科学院)科教产融合创新试点工程项目(2022PX029)
作者简介:闫慧娇(1984—),女,博士,副研究员,研究方向为天然产物分离纯化及活性。E-mail: yanhuijiao01@163.com
*通信作者,耿岩玲,女,副研究员,研究方向为中药与复方活性成分及标准样品研制。Tel:0531-82605319, E-mail: gengyanling@126.com
摘要:研究红果樫木叶的化学成分,运用大孔树脂、硅胶、Sephadex LH-20和半制备色谱等多种色谱技术从红果樫木叶70%乙醇提取物中分离得到4个木脂素类化合物。运用1H NMR(核磁共振)、13C NMR和MS(质谱)波谱学数据等分别鉴定为4,4′-dihydroxy-3,3′,5,5′-trtramethoxy-7,9′:7′,9-diepoxylignane(1),4′-hydroxy-3,4,5,3′-trtramethoxy-7,9′:7′,9-diepoxylignane(2),4′,4″-dihydroxy-3,3′,3″,5,5′,5″ -hexamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineolignan-7″,9″-diol(3)和4′,4″-dihydroxy-3,3′,3″,5,5′-pentamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineolignan-7″,9″-diol(4)。化合物1~4均首次从樫木属植物中分离得到。使用DPPH(1,1-二苯基-2-三硝基苯肼)自由基清除率测定化合物的抗氧化活性,结果显示木脂素类化合物1~4具有良好的DPPH自由基清除能力。
关键词:红果樫木;化学成分;结构鉴定
中图分类号:R284.1 文献标志码:A 文章编号:1002-4026(2024)03-0010-08
开放科学(资源服务)标志码(OSID):
Lignan constituents from the leaves of Dysoxylum gotadhora
YAN Huijiao1a,1b, CHEN Yujie2,SONG Xiangyun1a,1b, LI Enxia1a,1b, GENG Yanling1a,1b*
(1.a.Key Laboratory for Applied Technology of Sophisticated Analytical Instruments of Shandong Province, Shandong Analysis
and Test Center; b. Key Laboratory for Natural Active Pharmaceutical Constituents Research in Universities of Shandong
Province, School of Pharmaceutical Sciences, Qilu University of Technology (Shandong Academy of Sciences),
Jinan 250014, China; 2. Shandong Center for Food and Drug Evaluation and Inspection, Jinan 250014, China)
Abstract∶To study the constituents of the leaves of Dysoxylum gotadhora, the 70% ethanol extract was separated using macroporous resin column chromatography, silica gel column chromatography, Sephadex LH-20 gel column chromatography, combined with semi-preparative HPLC and other methods. Four compounds 4,4′-dihydroxy-3,3′,5,5′-trtramethoxy-7,9′:7′,9-diepoxylignane (1), 4′-hydroxy-3,4,5,3′-trtramethoxy-7,9′:7′,9-diepoxylignane (2), 4′,4″-dihydroxy-3,3′,3″,5,5′,5″ -hexamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineolignan-7″,9″-diol (3), 4′,4″-dihydroxy-3,3′,3″,5,5′-pentamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineo lignan -7″,9″-diol (4) were isolated. Their structures were established by 1H NMR, 13C NMR and MS spectroscopy techniques. Compounds 1 to 4 were obtained from the genus Dysoxylum for the first time. DPPH(1,1-diphenyl-2-picryhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl) radical scavenging rate were used to determine the antioxidant activity. The results show that lignans have significant DPPH free radical scavenging ability.
Key words∶Dysoxylum gotadhora; chemical constituents; structure identification
红果樫木(Dysoxylum gotadhora)为楝科(Meliaceae)樫木属(Dysoxylum)乔木,生于山地沟谷密林,海拔550~1 700 m,分布于我国海南及云南南部地区,以及南亚、东南亚的印度、斯里兰卡、中南半岛国家等[1]。楝科许多植物为我国传统用药,例如川楝(Melia toosendan Sieb.et Zucc.)及苦楝(Melia azedarach L.)等[2]。楝科植物中发现了丰富的次级代谢产物,主要包括柠檬苦素类[3]、三萜类[4-5]、二萜类[6]、倍半萜类[7]、甾体类[8]、生物碱类[9]等,其中一些具有较好的生物活性,如杀虫与抑制昆虫生长[10-11]、抑菌[12]及抗肿瘤[13]等。前期研究中我们从红果樫木中发现了结构新颖的甾体及三萜类化合物[14-15]。为进一步系统研究红果樫木的化学成分,本文应用多种色谱方法从其叶部位分离得到4个四氢呋喃型木脂素类化合物,并通过NMR(核磁共振)鉴定为4,4′-dihydroxy-3,3′,5,5′-trtramethoxy-7,9′:7′,9-diepoxylignane(1),4′-hydroxy-3,4,5,3′-trtramethoxy-7,9′:7′,9-diepoxylignane(2),4′,4″-dihydroxy-3,3′,3″,5,5′,5″ -hexamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineolignan-7″,9″-diol(3)和4′,4″-dihydroxy-3,3′,3″,5,5′-pentamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineolignan-7″,9″-diol(4)。化合物1~4均首次从樫木属植物中分离得到。采用DPPH(1,1-二苯基-2-三硝基苯肼)法对分离得到的单体化合物进行了抗氧化活性测定,发现其均具有良好的DPPH 自由基清除能力。四氢呋喃型木脂素类化合物具有多样的结构和广泛的生物活性,而对楝科植物中木脂素的研究相对较少。此次通过对红果樫木叶系统的分离,发现了木脂素类成分,丰富了楝科樫木属植物次级代谢产物类型,也为解释樫木属植物药用物质基础提供了参考。
1 仪器与材料
1.1 实验仪器
安捷伦Agilent 6520型质谱仪(Agilent公司);布鲁克Bruker AVIII HD 600 型核磁共振波谱仪(布鲁克公司);五丰LC-100型高效液相色谱仪(上海五丰公司);安捷伦Agilent 1160 型高效液相色谱仪(Agilent 公司,配有DAD检测器);FA1104 型电子天平(上海精天电子仪器厂);旋转蒸发仪(上海申生科技有限公司);Spark多功能酶标仪(美国TECAN公司)。
1.2 实验材料
红果樫木(D. gotadhora)叶,于2021年8月在斯里兰卡采集,并经过中国科学院西双版纳植物园张顺成研究员鉴定。标本存放于山东省分析测试中心中药资源可持续利用研究室,凭证号HG202108L。
D101大孔树脂(沧州宝恩树脂);硅胶(青岛海洋化工);Sephadex LH-20 (GE Healthcare, 美国);ODS(纳微);分析纯乙醇、二氯甲烷、乙酸乙酯(天津市化学试剂);色谱纯甲醇(山东禹王试剂)。
2 方法与结果
2.1 提取与分离
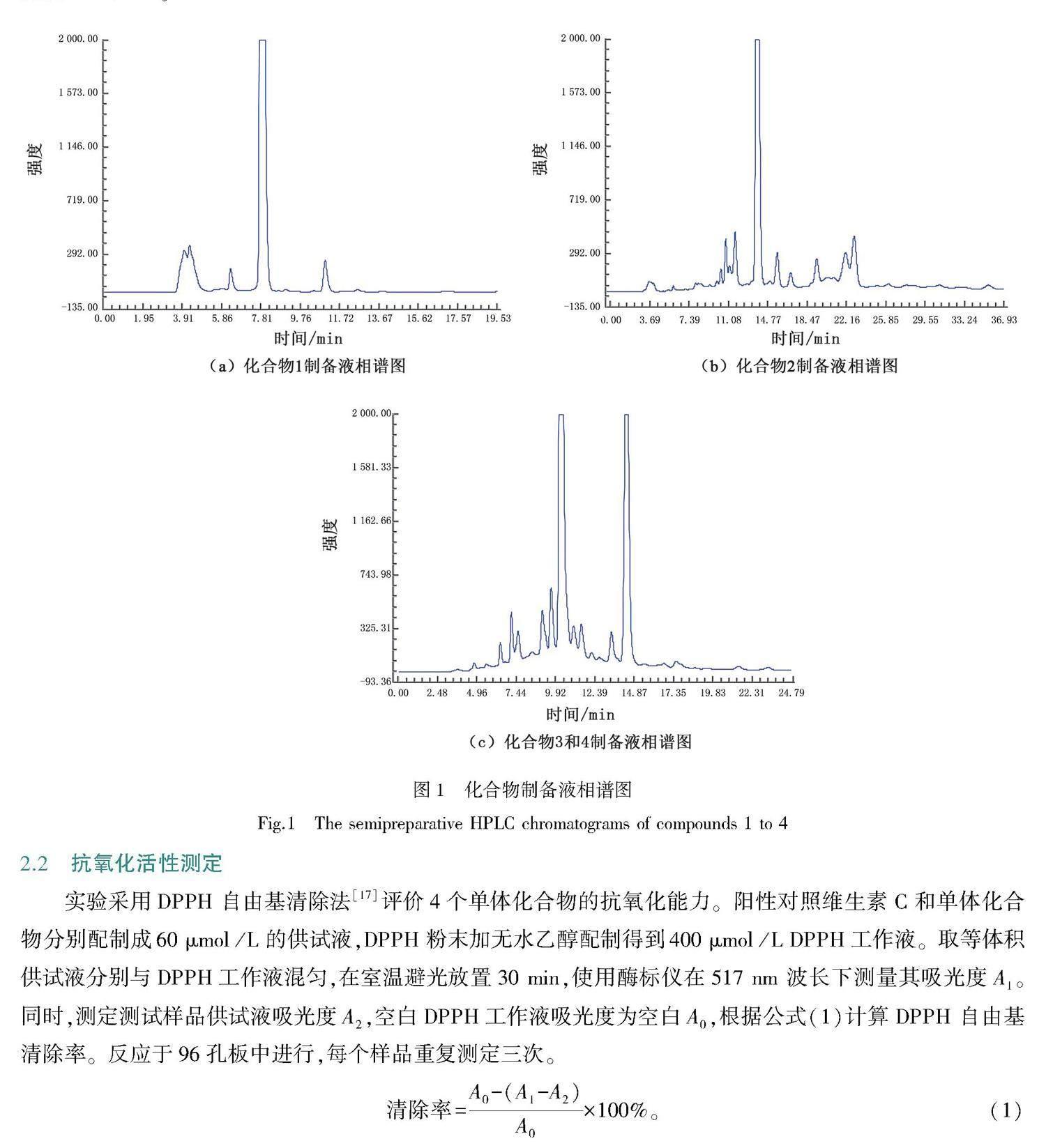
红果樫木叶干燥后称重,采用加热回流法以70%乙醇-水提取,料液比为1:5,共提取3次。提取液使用旋转蒸发仪减压回收,至无醇味,得粗浸膏。粗浸膏用水(4 L)混悬,依次以二氯甲烷、乙酸乙酯体积比1:1萃取,分别萃取3次[16]。乙酸乙酯部位经过D101大孔树脂层析,分别以(10%、30%、50%、70%、90%、100%乙醇)乙醇水洗脱,分段收集,得到6个不同极性部位(Fr.1~6)。主要对Fr.5部位进行分离和纯化。选择ODS柱色谱,采用甲醇-水(10%、30%、50%、70%、90%、100%甲醇)进行梯度洗脱,每个极性梯度洗脱体积为柱体积的5倍。结果得6个组分(D1~D6)。取D2组分,经Sephadex LH-20凝胶柱层析,分段得17个组分(D10~D26)。D16经制备高效液相色谱法(62%甲醇,等度洗脱)得到化合物1(3 mg,保留时间tR=7.8 min),D17经制备高效液相色谱法(55%甲醇,等度洗脱)得到化合物2(3 mg,tR=14.0 min),D20经制备高效液相色谱法(41%乙腈,等度洗脱)得到化合物3(2 mg,tR=10.4 min),化合物4(2 mg,tR=14.6 min)。制备液相谱图如图1所示,其中图1(a)色谱条件为甲醇-水体积比62:38,等度洗脱,流速4 mL/min;图1(b)色谱条件为甲醇-水体积比55:45,等度洗脱,流速4 mL/min;图1(c)色谱条件为乙腈-水体积比41:59,等度洗脱,流速4 mL/min。
2.2 抗氧化活性测定
实验采用DPPH 自由基清除法[17]评价4个单体化合物的抗氧化能力。阳性对照维生素C和单体化合物分别配制成60 μmol /L 的供试液,DPPH 粉末加无水乙醇配制得到400 μmol /L DPPH工作液。取等体积供试液分别与DPPH工作液混匀,在室温避光放置30 min,使用酶标仪在517 nm 波长下测量其吸光度A1。同时,测定测试样品供试液吸光度A2,空白DPPH工作液吸光度为空白A0,根据公式(1)计算DPPH 自由基清除率。反应于96孔板中进行,每个样品重复测定三次。
清除率=A0-(A1-A2)A0×100%。(1)
2.3 化合物结构鉴定
化合物1:白色无定型粉末。结合ESI-MS、1H NMR、13C NMR谱显示该化合物为对称结构,有22个碳信号(4×OCH3, 2×CH2, 8×CH, 8×C),且有2个苯环;4个连氧甲基信号:δH 3.76 (12H, s, 3, 5, 3′, 5′-OMe);δC 56.6 (3, 5, 3′, 5′-OMe);4个苯环氢质子信号:δH 6.60 (4H, s, H-2, 6, 2′, 6′);2个连氧碳氢质子信号:δH 4.62 (2H, d, J=4.2 Hz, H-7, 7′) ;2个连氧CH2信号:δH 4.16(2H, m, H-9b, 9′b), 3.77 (2H, dd, J=6.1, 3.1 Hz, H-9a, 9′a)和 2个CH信号δH 3.05 (2H, dd, J=6.4, 4.5 Hz, H-8, 8′)。提示化合物为对称取代的骈双四氢呋喃类木脂素。通过以上数据与文献[18]的报道比对,鉴定化合物1为4,4′-dihydroxy-3,3′,5,5′-trtramethoxy-7,9′:7′,9-diepoxylignane。
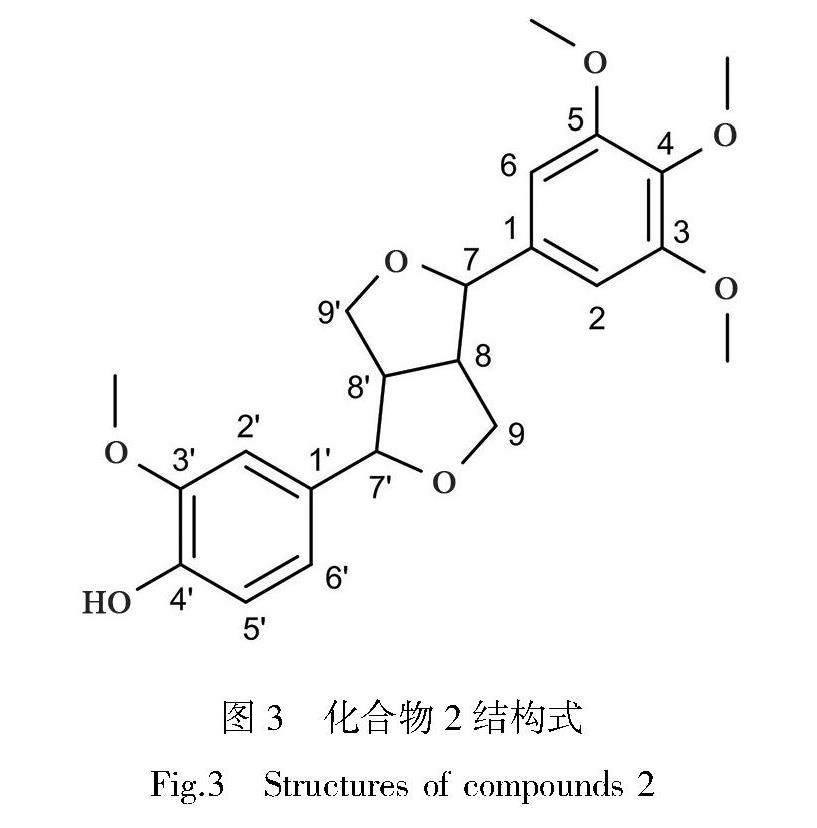
化合物2:白色无定型粉末。结合ESI-MS、1H NMR、13C NMR谱显示该化合物为骈双四氢呋喃类木脂素,有22个碳信号(4×OCH3, 2×CH2, 9×CH, 7×C),且有2个苯环;4个OCH3信号:δH 3.76 (6H, s, OMe), 3.74 (3H, s, OMe), 3.74 (3H, s, OMe);5个苯环氢质子信号:δH 6.92 (1H, d, J =1.6 Hz, H-2), 6.73 (1H, dd, J=8.0, 1.6 Hz, H-6), 6.69 (1H, d, J=8.0, H-5), 6.64 (2H, d, J=1.1, H-2′, 6′);2个连氧CH质子信号:δH 4.80, 4.67 (each 1H, m, H-7, 7′);2个连氧CH2信号:δH 4.20, 4.11 (each 1H, m, H-9b, 9′b), 3.83, 3.70 (each 1H, m, H-9a, 9′a)和2个CH信号δH 3.06 (2H, m, H-8, 8′)。通过以上数据与文献[19]的报道比对,鉴定化合物2为4′-hydroxy-3,4,5,3′-trtramethoxy-7,9′:7′,9-diepoxylignane。
化合物3:白色无定型粉末。结合ESI-MS、1H NMR、13C NMR谱显示该化合物为苯丙素三聚体,有33个碳信号(6×OCH3, 3×CH2, 12×CH, 12×C),且有3个苯环;通过核磁数据比对,化合物3比化合物1多了一组苯环三取代的苯丙素信号,包括2个连氧甲基信号:δH 3.73(6H, s, 3″, 5″-OMe);δC 56.3 (3″, 5″-OMe);2个苯环氢质子信号:δH 6.65(2H, s, H-2″, 6″);1个连氧碳氢信号:δH 4.81(1H, d, J=4.0 Hz, H-7″),δC 72.8 (C-7″);1个连氧CH2信号:δH 3.71(1H, m, H-9″a), 3.42(1H, m, H-9″b)和 1个CH信号δH 4.12 (1H, m, H-8″)。此苯丙素取代位置由与文献数据对比确定。通过以上数据与文献[20]的报道比对,鉴定化合物3为4′,4″-dihydroxy-3,3′,3″,5,5′,5″-hexamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineolignan-7″,9″-diol。
化合物4:白色无定型粉末。结合ESI-MS、1H NMR、13C NMR谱显示该化合物为苯丙素三聚体,有32个碳信号(5×OCH3, 3×CH2, 13×CH, 11×C),且有3个苯环;通过核磁数据比对,化合物3比化合物1多了一组二取代的苯丙素信号,包括1个连氧甲基信号;3个苯环氢质子信号:δH 6.96 (1H, d, J =1.8 Hz, H-2″), 6.79 (1H, d, J =8 Hz, H-5″), 6.73 (1H, d, J =8 Hz, H-6″);1个连氧碳氢信号:δH 4.80 (1H, brs, H-7″);1个连氧CH2信号:δH 3.63 (1H, m, H-9″a), 3.42 (1H, m, H-9″b)和 1个CH信号δH 4.11 (1H, m, H-8″)。此苯丙素取代位置由与文献数据对比确定。通过以上数据与文献[20]的报道进行比对,鉴定化合物4为4′,4″-dihydroxy-3,3′,3″,5,5′-pentamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineolignan-7″,9″-diol。
2.4 化合物波谱数据
化合物1:白色无定形粉末。ESI-MS m/z: 419.2 [M+H]+,结合1H、13C NMR 信息确定化合物分子式为C22H26O8。1H NMR (DMSO-d6, 600 MHz) δ: 6.60 (4H, s, H-2, 6, 2′, 6′), 4.62 (2H, d, J=4.2 Hz, H-7, 7′), 4.16 (2H, m, H-9b, 9′b), 3.77 (2H, dd, J=6.1, 3.1 Hz, H-9a, 9′a), 3.76 (12H, s, 3, 5, 3′, 5′-OMe), 3.05 (2H, dd, J=6.4, 4.5 Hz, H-8, 8′);13C NMR (DMSO-d6, 150 MHz) δ:148.5 (C-3, 5, 3′,5′), 135.5 (C-4, 4′), 132.0 (C-1, 1′), 104.2 (C-2, 2′, 6, 6′), 85.9 (C-7, 7′), 71.7 (C-9, 9′), 56.6 (3, 5, 3′, 5′-OMe), 54.2 (C-8, 8′)。
化合物2:白色无定形粉末。ESI-MS m/z: 403.2 [M+H]+,结合1H、13C NMR 信息确定化合物分子式为C22H26O7。1H-NMR (DMSO-d6, 600 MHz) δ: 6.92 (1H, d, J =1.6 Hz, H-2), 6.73 (1H, dd, J=8.0, 1.6 Hz, H-6), 6.69 (1H, d, J=8.0, H-5), 6.64 (2H, d, J=1.1, H-2′, 6′), 4.80, 4.67 (each 1H, m, H-7, 7′), 4.20, 4.11 (each 1H, m, H-9b, 9′b), 3.83, 3.70 (each 1H, m, H-9a, 9′a), 3.76 (6H, s, OMe), 3.74 (3H, s, OMe), 3.74 (3H, s, OMe), 3.06 (2H, m, H-8, 8′);13C NMR (DMSO-d6, 150 MHz) δ:137.3 (C-1′), 103.8 (C-2′, 6′), 153.1 (C-3′, 5′), 133.8 (C-1), 111.4 (C-2), 147.4 (C-3), 145.8 (C-4), 115.1 (C-5), 119.8 (C-6), 86.6, 85.7 (C-7, 7′), 56.0, 54.1 (C-8, 8′), 72.6, 71.8 (C-9, 9′), 56.6 (OMe)。
化合物3:白色无定形粉末。ESI-MS m/z: 645.3 [M+H]+,结合1H、13C NMR 信息确定化合物分子式为C33H40O13。1H NMR (DMSO-d6, 600 MHz) δ: 6.65 (2H, d, J =2.0 Hz, H-2″, 6″), 6.60 (4H, brs, H-2, 6, 2′, 6′), 4.81 (1H, d, J=4.0Hz, H-7″), 4.67, 4.63 (each 1H, d, J=4.0Hz, H-7, 7′), 4.18 (2H, m, H-9a, 9′a), 4.12 (1H, m, H-8″), 3.79 (2H, m, H-9b,9′b), 3.77 (6H, s, OMe), 3.76 (6H, s, OMe), 3.73 (6H, s, OMe), 3.71 (1H, m, H-9″a), 3.42 (1H, m, H-9″b), 3.06 (2H, m, H-8, 8′);13C NMR (DMSO-d6, 150 MHz) δ:137.3 (C-1), 103.7 (C-2, 6), 153.0 (C-3, 5), 132.9 (C-1′), 104.1 (C-2′, 6′), 148.3 (C-3′, 5′), 131.8 (C-1″), 104.7 (C-2″, 6″), 147.9 (C-3″, 5″), 86.7 (C-8″), 85.8 (C-7), 85.6 (C-7), 72.8 (C-7″), 71.7 (C-9), 71.6 (C-9′), 60.4 (C-9″), 54.2 (C-8′), 54.1 (C-8), 56.3, 56.6 (OMe)。
化合物4:白色无定形粉末。ESI-MS m/z: 615.2 [M+H]+,结合1H、13C NMR 信息确定化合物分子式为C32H38O12。1H NMR (DMSO-d6, 600 MHz) δ: 6.96 (1H, d, J =1.8 Hz, H-2″), 6.79 (1H, d, J =8.0 Hz, H-5″), 6.73 (1H, d, J =8.0 Hz, H-6″), 6.64 (4H, brs, H-2, 6, 2′, 6′), 4.80 (1H, brs, H-7″), 4.67 (2H, d, J=3.8 Hz, H-7, 7′), 4.20 (2H, m, H-9a, 9′a), 4.11 (1H, m, H-8″), 3.83 (2H, m, H-9b, 9′b), 3.76 (6H, s, OMe), 3.75 (6H, s, OMe), 3.72 (3H, s, OMe), 3.63 (1H, m, H-9″a), 3.42 (1H, m, H-9″b), 3.07 (2H, m, H-8, 8′);13C NMR(DMSO-d6, 150 MHz) δ:137.4 (C-1), 103.7 (C-2, 6), 153.1 (C-3, 5), 133.8 (C-1′), 103.7 (C-2′, 6′), 147.4 (C-3′, 5′), 133.4 (C-1″), 111.4 (C-2″), 147.3 (C-3″), 145.8 (C-4″), 115.1 (C-5″), 119.6 (C- 6″), 87.5 (C-8″), 85.6 (C-7), 85.5 (C-7), 72.5 (C-7″), 71.9 (C-9), 71.8 (C-9′), 60.7 (C-9″), 56.0 (C-8′), 54.1 (C-8), 56.5 (OMe)。
2.5 抗氧化活性结果
单体化合物的DPPH 清除能力实验结果显示,木脂素类化合物普遍具有一定的的DPPH 清除作用,其中化合物1~4的DPPH 清除率为(54.4±1.1)%、(45.3±1.7)%、(51.0±1.4)%、(51.7±1.4)%,与相同质量分数阳性对照(61.2±1.1)%效果接近,结果见图6。
3 讨论
富含高度氧化变形的三萜化合物为楝科植物的特征,本文通过对红果樫木系统地分离,发现了木脂素类成分,丰富了楝科樫木属植物次级代谢产物类型。化合物1~4均首次从樫木属植物中分离得到。对从该药材中分离得到的化合物进行抗氧化活性评价,发现其均具有良好的DPPH自由基清除能力。木脂素类化合物结构多样,其由苯丙素氧化聚合而成,大多数为二聚体,也有三聚体及四聚体。木脂素生物活性显著且广泛,其中著名的鬼臼毒素及其衍生物具有引人注目的抗肿瘤活性,其半合成药物依托泊苷现用于治疗淋巴癌、睾丸癌等[21]。五味子果实中的多种木脂素[22]都可以保护肝脏,如五味子酯甲、戈米辛J,在此基础结构修饰开发了治疗肝炎和肝损伤的新药联苯双酯。而在楝科植物中木脂素研究相对较少,川楝子中有木脂素报道[23],其类型包括四氢呋喃类、苯并呋喃类、双四氢呋喃类等,其中meliasendanin A及(+)-pinoresinol具有较好的抗氧化活性。此次发现的木脂素类化合物也为解释樫木属植物药用物质基础及天然抗氧化剂的发现提供了参考依据。
参考文献:
[1]中国科学院中国植物志编辑委员会. 中国植物志 第十卷 第二分册[M]. 北京: 科学出版社, 1997.
[2]侯宽昭, 陈德昭. 中国楝科志 [J].植物分类学报.1955, 4 (1):39-42.
[3]XU J B, NI G, YANG S P, et al. Dysoxylumasins A-F: six new limonoids from Dysoxylum mollissimum bl[J]. Chinese Journal of Chemistry, 2013, 31(1): 72-78. DOI: 10.1002/cjoc.201200838.
[4]HUANG H L, WANG C M, WANG Z H, et al. Tirucallane-type triterpenoids from Dysoxylum lenticellatum[J]. Journal of Natural Products, 2011, 74(10): 2235-2242. DOI: 10.1021/np2006296.
[5]HISHAM A, AJITHA BAI M D, JAYAKUMAR G, et al. Triterpenoids from Dysoxylum malabaricum[J]. Phytochemistry, 2001, 56(4): 331-334. DOI: 10.1016/S0031-9422(00)00413-1.
[6]DUH C Y, WANG S K, CHEN I S. Cytotoxic prenyleudesmane diterpenes from the fruits of Dysoxylum kuskusense[J]. Journal of Natural Products, 2000, 63(11): 1546-1547. DOI: 10.1021/np000264z.
[7]MULHOLLAND D A, IOURINE S, TAYLOR D A H. Sesquiterpenoids from Dysoxylum schiffneri[J]. Phytochemistry, 1998, 47(7): 1421-1422. DOI: 10.1016/S0031-9422(97)00705-X.
[8]WAH L K, ABAS F, CORDELL G A, et al. Steroids from Dysoxylum grande (Meliaceae) leaves[J]. Steroids, 2013, 78(2): 210-219. DOI: 10.1016/j.steroids.2012.09.011.
[9]ZHANG X Y, LI Y, WANG Y Y, et al. Tirucallane-type alkaloids from the bark of Dysoxylum laxiracemosum[J]. Journal of Natural Products, 2010, 73(8): 1385-1388. DOI: 10.1021/np100307f.
[10]LUO X D, WU S H, WU D G, et al. Novel antifeeding limonoids from Dysoxylum hainanense[J]. Tetrahedron, 2002, 58(39): 7797-7804. DOI: 10.1016/S0040-4020(02)00944-4.
[11]QI S H, WUB D G, ZHANG S, et al. A new tetranortriterpenoid from Dysoxylum lenticellatum[J]. Zeitschrift Für Naturforschung B, 2003, 58(11): 1128-1132. DOI: 10.1515/znb-2003-1116.
[12]WANG F, GUAN Y J. Cytotoxic nor-dammarane triterpenoids from Dysoxylum hainanense[J]. Fitoterapia, 2012, 83(1): 13-17. DOI: 10.1016/j.fitote.2011.08.006.
[13]KURIMOTO S I, KASHIWADA Y, MORRIS-NATSCHKE S L, et al. Dyscusins A-C, three new steroids from the leaves of Dysoxylum cumingianum[J]. Chemical and Pharmaceutical Bulletin, 2011, 59(10): 1303-1306. DOI: 10.1248/cpb.59.1303.
[14 ]YAN H J, WANG J S, KONG L Y. Cytotoxic dammarane-type triterpenoids from the stem bark of Dysoxylum binecteriferum [J]. Journal of Natural Products, 2014, 77 (2): 234-242. DOI: 10.1021/np400700g.
[15]YAN H J, WANG J S, KONG L Y. Cytotoxic steroids from the leaves of Dysoxylum binectariferum[J]. Steroids, 2014, 86: 26-31. DOI: 10.1016/j.steroids.2014.04.014.
[16]闫慧娇, 陈雨洁, 李兵, 等. 红果樫木叶化学成分研究[J]. 山东科学, 2019, 32(6): 15-19. DOI: 10.3976/j.issn.1002-4026.2019.06.003.
[17]何芷芸, 石松云, 魏雪娇, 等. 地枇杷的化学成分及抗氧化活性研究[J]. 天然产物研究与开发, 2022, 34(5): 810-817. DOI: 10.16333/j.1001-6880.2022.5.009.
[18]朱求方, 王永毅, 瞿海斌. 连钱草的化学成分研究[J]. 中草药, 2013, 44(4): 387-390. DOI: 10.7501/j.issn.0253-2670. 2013.04.003.
[19]ALBERTO MARCO J, SANZ-CERVERA J F, GARCA-LLISO V, et al. Sesquiterpene lactones and lignans from Artemisia arborescens[J]. Phytochemistry, 1997, 44(6): 1133-1137. DOI: 10.1016/S0031-9422(96)00720-0.
[20]XIONG L, ZHU C G, LI Y R, et al. Lignans and neolignans from Sinocalamus affinis and their absolute configurations[J]. Journal of Natural Products, 2011, 74(5): 1188-1200. DOI: 10.1021/np200117y.
[21]成伟华, 陈虹, 邹忠梅. 鬼臼毒素的结构修饰及抗肿瘤活性研究进展[J]. 中国医药工业杂志, 2017, 48(5): 644-650. DOI: 10.16522/j.cnki.cjph.2017.05.004.
[22]姜侃, 郭晔红. 华中五味子根部木脂素类化学成分及其抗氧化活性研究[J]. 中草药, 2022, 53(21): 6666-6673. DOI: 10.7501/j.issn.0253-2670.2022.21.003.
[23]李海波, 马森菊, 石丹枫, 等. 川楝子的化学成分、药理作用及其毒性研究进展[J]. 中草药, 2020, 51(15): 4059-4074. DOI: 10.7501/j.issn.0253-2670.2020.15.027.
