胶原蛋白神经酰胺脂质体的制备及质量评价
2024-06-26唐春慧张振博吴冬琴环飞张静姝王玉邦
唐春慧 张振博 吴冬琴 环飞 张静姝 王玉邦


DOI:10.3976/j.issn.1002-4026.20230144
收稿日期:2023-09-25
作者简介:唐春慧(1998—),女,硕士研究生,研究方向为胶原蛋白脂质体的制备工艺及性能研究。E-mail:2582600514@qq.com
*通信作者,王玉邦(1965—),男,教授,研究方向为生殖内分泌毒理学。E-mail:ncsa@njmu.edu.cn
摘要:以蛋黄卵磷脂、胆固醇和神经酰胺为成膜材料,采用薄膜分散法制备胶原蛋白神经酰胺脂质体(CO-CS)。以包封率为响应值,以药脂比、膜材比、超声时间和水合时间为影响因素对工艺进行优化。结果表明,当药脂比为1:16、超声时间为8.5 min、膜材比为4.3:1时,包封率可达90.73%。在此条件下,样品的粒径为(206.63±2.06) nm,聚合物分散性指数(polymer dispersity index,PDI)为0.187±0.010,Zeta电位为(-34.90±0.82) mV。避光保存60 d后,CO-CS的包封率为87.2%,粒径为(223.70±1.85) nm、PDI为0.174±0.013、Zeta电位为(-33.51±2.10) mV。结果表明,本研究制备的CO-CS包封率高,稳定性良好,制备工艺合理可行。
关键词:胶原蛋白;神经酰胺脂质体;响应面;包封率
中图分类号:TQ658.2 文献标志码:A 文章编号:1002-4026(2024)03-0018-09
开放科学(资源服务)标志码(OSID):
Preparation and quality evaluation of collagen ceramide liposomes
TANG Chunhui1,ZHANG Zhenbo1,WU Dongqin1,HUAN Fei1,2,ZHANG Jingshu1,2,WANG Yubang1,2*
(1.School of Public Health, Nanjing Medical University,Nanjing 211166,China;2.Jiangsu Pharmaceutical Pesticide
Veterinary Drug Safety Evaluation and Research Center, Nanjing 211166,China)
Abstract∶In this study, egg yolk lecithin, cholesterol,and ceramide were used as film-forming materials to prepare collagen ceramide liposomes (CO-CS) by the thin film dispersion method. To optimize the process, encapsulation efficiency was used as the response value, and it was evaluated by influencing factors such as drug-lipid ratio, film-material ratio, ultrasonic time, and hydration time. Results showed that encapsulation efficiency reached 90.73% when the drug-lipid ratio, film-material ratio, and ultrasonic time were 1:16, 4.3:1, and 8.5 min, respectively. Under these conditions, the particle size, polymer dispersity index (PDI), and zeta potential of CO-CS were(206.63±2.06) nm, 0.187±0.010, and (34.90±0.82
) mV, respectively. After 60 days of storage at room temperature in the dark, the encapsulation efficiency was 87.2 %. Furthermore, the particle size, PDI, and zeta potential of CO-CS changed to (223.70±1.85) nm, 0.174±0.013, and (33.51±2.10) mV, respectively. In summary, CO-CS produced in this study revealed high encapsulation efficiency and good stability, and the preparation process is reasonable and feasible.
Key words∶collagen; ceramide liposome; response surface; encapsulation efficiency
胶原蛋白(collagen,CO)是哺乳动物皮肤、肌腱、骨骼和软骨等结缔组织中含量最丰富的结构蛋白,占人体总蛋白质含量的30%以上[1]。胶原蛋白生物材料具有低免疫原性、可生物降解、生物相容性、亲水性以及促进细胞增殖分化等优良特性,应用于食品、化妆品、制药和生物医学等领域[2]。胶原蛋白作为化妆品原料的有效性已经确立,通常以原液的形式添加到乳液、面膜、保湿霜等中,用来改善皮肤的色泽、细纹及皱纹,但皮肤对胶原蛋白的吸收程度是影响其发挥功效的关键因素[3]。
从皮肤结构来看,物质透皮吸收的途径主要有三条:角质层、毛囊及汗管[4]。孙娅楠等[5]观察了分子量为58 kDa左右的重组人源胶原蛋白的透皮吸收情况,发现重组人源胶原蛋白可以沿着毛囊进入真皮层,并从毛囊中扩散至胶原纤维层从而补充皮肤中的胶原纤维[12];Sun等[6]研究发现,分子量为55 kDa的外源性重组人源胶原蛋白通过毛囊渗透表皮、皮脂腺到达真皮,形成网状结构。这些研究结果显示,胶原蛋白这种大分子物质主要通过毛囊途径进入皮肤真皮层中,然而毛囊及汗管等皮肤附属器官与整个皮肤表面积相比仅占1%以下,透皮效率低,因此,单纯体外涂敷胶原蛋白不能被良好地吸收,其利用率很低,需考虑促透皮的策略。
神经酰胺脂质体(cerosomes,CS)是由磷脂、神经酰胺、胆固醇等组成的具有类脂双分子层结构的脂质体,能够高效经皮递送包封在其中的活性成分,并具有优良的稳定性和皮肤耐受性,另因其中添加了神经酰胺,还能够更新皮肤的天然保护层并形成有效的屏障以防止水分流失[7]。
因此,为了提高胶原蛋白的生物利用度,将其制备成脂质体。目前常用制备脂质体的方法有薄膜分散法[8]、逆向蒸发法[9]、乙醇注入法[10]等。在我们前期的实验中,分别考察了乙醇注入法、薄膜分散法、逆向蒸发法制备胶原蛋白神经酰胺脂质体(CO-CS)。结果显示薄膜分散法制备的CO-CS包封率较高,粒径分散性良好,且制备工艺简单,故采用此方法制备CO-CS,以包封率为评价指标设计单因素实验和响应面实验优化其制备工艺,并测定了CO-CS平均粒径、粒径分布和电位等质量评价指标,考察CO-CS的最佳制备工艺,为胶原蛋白产品的进一步开发利用提供参考依据。
1 实验部分
1.1 材料与仪器
重组人源胶原蛋白(分子量为55 kDa,批号LA22007004,江苏江山聚源生物技术有限公司);蛋黄-卵磷脂(批号EK21009,上海艾伟拓医药科技有限公司);胆固醇(批号C10780,上海艾伟拓医药科技有限公司);油溶性神经酰胺3(批号CONA23,韩国斗山集团);无水乙醇(分析纯,批号20230412,国药集团化学试剂有限公司);吐温-80(化学纯,批号20200609,国药集团化学试剂有限公司);曲拉通(TritonX-100,批号9002-93-1,北京博奥拓达科技有限公司);BCA试剂盒(批号P0011-1,上海碧云天生物技术有限公司);透析袋(截留分子量300 kDa,批号SBJ131456-1M,南京森贝伽生物科技有限公司)。
ME503T型精密分析天平(梅特勒-托利多仪器有限公司);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);NANOZS-90型马尔文粒径分析仪(马尔文帕纳科公司);TP-350E型磁力搅拌器(杭州米欧有限公司);VORTEXX-5型涡旋振荡仪(海门其林贝尔仪器制造有限公司);FEI Tecnai G2型透射电子显微镜(FEI捷克有限公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司)。
1.2 方法
1.2.1 CO-CS的制备
CO-CS基本处方见表1。按处方量精密称取蛋黄卵磷脂、胆固醇、神经酰胺,加入无水乙醇,超声10 min溶解,转移至圆底烧瓶中,在旋转蒸发仪上40 ℃减压旋转蒸发40 min,去除无水乙醇,形成均匀脂质薄膜。加入处方量胶原蛋白原液和1%吐温-80至圆底烧瓶,旋转水合(水合温度40 ℃)1 h至薄膜完全脱离形成乳白色混悬液,超声处理10 min(功率60 W)。所得胶原蛋白混悬液经0.45 μm水性微孔滤膜过滤,即得CO-CS混悬液,室温避光保存[3,11]。
1.2.2 包封率的测定
本实验采用透析法分离游离胶原蛋白与CO-CS,采用BCA(二喹啉甲酸,Bicinchoninic acid) 方法测定CO-CS的包封率[3]。将0.5 mL新鲜制备的脂质体放入透析袋中,在200 mL、pH 7.4 PBS(磷酸缓冲盐溶液,phosphate buffer saline)透析液中4 ℃透析24 h以除去游离的胶原蛋白。分别采用2.0 mL 的0.3% Trition X-100溶液对透析前后的0.5 mL脂质体进行破乳,释放出包裹在脂质体中的胶原蛋白。采用BCA蛋白测定法,在562 nm 波长处测定胶原蛋白的质量浓度。包封率按公式(1)计算:
包封率=WW总×100%,(1)
其中,W总表示破乳前脂质体中胶原蛋白质量浓度;W表示破乳后脂质体中胶原蛋白质量浓度。
1.2.3 透射电镜观察
取10.0 μL 脂质体,加入990 μL 超纯水将其稀释,于干燥的铜网上滴加样品,红外灯源下一定距离进行烘干,待铜网完全干燥后,铜网上滴加一滴 1%的磷钨酸溶液进行负染,用滤纸吸干铜网多余的磷钨酸。完全干燥后,透射电镜下观察并拍照记录。
1.2.4 粒径、PDI和Zeta 电位的测定
采用动态光散射(dynamic light scattering,DLS)技术对CO-CS进行粒径、PDI(聚合物分散性指数,polymer dispersity index)和 Zeta电位的测定。取10.0 μL新鲜制备的CO-CS溶液,加入990 μL超纯水稀释至 1.0 mL 后,用马尔文粒径分析仪测定粒径、PDI 和 Zeta 电位。
1.2.5 单因素实验
(1)筛选药脂比。固定其他条件不变,考察胶原蛋白与蛋黄卵磷脂质量比分别1∶20、1∶16、1∶12、1∶8、1∶4时对CO-CS包封率的影响,每个水平平行实验3次,取平均值。
(2)筛选膜材比。固定其他条件不变,考察蛋黄卵磷脂和神经酰胺的量与胆固醇质量比分别为3∶1、5∶1、7∶1、9∶1、11∶1时对CO-CS包封率的影响,每个水平平行实验3次,取平均值。
(3)筛选超声时间。固定其他条件不变,考察超声时间分别为5、10、15、20、25 min时对CO-CS包封率的影响,每个水平平行实验3次,取平均值。
(4)筛选水合时间。固定其他条件不变,考察水合时间分别为15、30、45、60、75 min时对CO-CS包封率的影响,每个水平平行实验3次,取平均值。
1.2.6 响应面分析实验
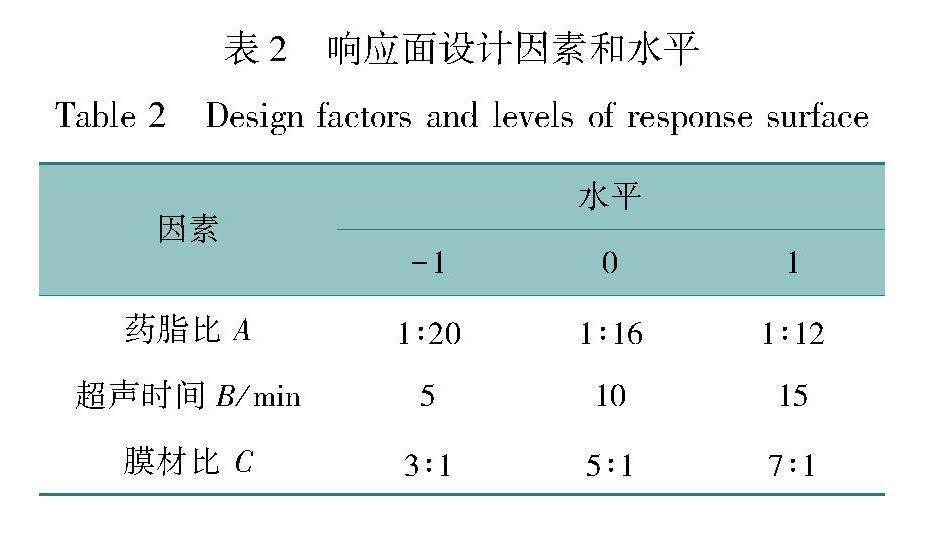
在单因素实验的基础上,选取出药脂比、超声时间、膜材比3个显著因素,以包封率为响应值,采用三因素三水平的响应面分析实验,通过 Design-Expert 8.0.6 软件对实验结果进行响应面分析,具体实验设计见表2。根据响应面分析结果预测CO-CS的最佳制备工艺,按照最佳制备工艺制得CO-CS 5组,将其包封率与预测值进行比较。
1.2.7 稳定性试验
将CO-CS置于室温下避光保存,分别于当天及7、14、21、28 、60 d取样,测其包封率、粒径、PDI及电位。
2 结果与讨论
2.1 单因素结果分析
不同因素对 CO-CS包封率的影响见图1。
由图1(a)可知,当胶原蛋白与蛋黄卵磷脂的质量比为1:16时包封率最大为89.04%。随着胶原蛋白用量的增加,包封率呈现先增加后降低的趋势,这是因为一定量的脂质体膜所能包封的胶原蛋白是有限的,在超过脂质体膜的饱和度后,胶原蛋白的质量再增加,脂质体膜不能继续包封,故其包封率下降[11]。综上所述,胶原蛋白与蛋黄卵磷脂质量比在1:16较为合适。
由图1 (b)可知,随着膜材比的增加,包封率呈现先上升后降低的趋势,在膜材比为5:1时其包封率最大为86.16%。由于单独磷脂形成的脂质膜不稳定,胆固醇具有调节膜流动性及稳定磷脂双分子层的作用,因此在制备时加入胆固醇[12]。当胆固醇加入量较少时,胆固醇的加入使脂质体膜变得越来越牢固;当胆固醇的量超过最佳添加量时,制成的脂质膜亲水性太强,容易被破坏。因此随着膜材比的逐渐增大,脂质体的包封率渐渐增大,在其质量比超过5:1 后,包封率随之减小。综上所述,膜材比应在5:1较为合适。
由图1 (c)可知,随着超声时间的延长,CO-CS包封率呈先上升再下降的趋势,当超声时间10 min时,脂质体包封率最大为87.40%;随着超声时间的延长,脂质体包封率反而减小。出现该结果可能是因为适当的超声可以使团聚的脂质体粒子逐渐分开,从而更好地包裹胶原蛋白,但是过长时间的超声,导致脂质体粒子被过度振荡碎裂而一定程度发生泄漏,包封率下降[13]。因此,最佳的超声时间在10 min。
由图1 (d)可知,为了避免脂质体制备过程中水合时间过久而被氧化,本实验考察了水合时间对脂质体包封率的影响,由实验结果可知,水合时间在15~75 min范围内,包封率受水合时间的影响并不明显,在水合时间为45 min时CO-CS包封率最大,之后缓慢下降,因此水合时间固定为45 min。
2.2 响应面试验结果分析
2.2.1 响应面分析试验方案及结果
为进一步优化CO-CS的制备条件,在单因素实验的基础上,选取出药脂比、超声时间、膜材比3个显著因素,以包封率为响应值,进行三因素三水平的响应面分析试验,响应面试验结果见表3。
利用 Design-Expert 8.0.6 软件对表3数据进行多元回归拟合,得到CO-CS包封率对药脂比A、超声时间B、膜材比C的二次多项回归模型为Y=89.29+2.31A-1.18B-4.22C-0.16AB-0.57AC+2.03BC-6.85A2-6.23B2-5.88C2,R2=0.991 6。对回归方程系数进行显著性检验见表4。
回归方程式描述了CO-CS包封率与各影响因素间的关系,由表4 的回归模型的显著性分析可知,一次项A、C,交互项BC和二次项A2、B2、C2对CO-CS包封率的影响极显著,一次项B对CO-CS包封率的影响显著,其他因素的影响不显著。F值的大小可以分析出CO-CS的包封率被单个因素所影响的程度。表中F值:FC>FA>FB,易得影响包封率的因素排序由大到小为膜材比、药脂比、超声时间。另外由该模型的显著性分析得F值为91.60,相应总模型的P<0.000 1,响应面回归模型达到了极显著水平(P<0.01),失拟项不显著(P=0.199 5>0.05),变异系数为1.21%(<10%),说明非试验因素对结果的影响不大,模型具有较好的试验稳性。总模型的相关系数R2为0.991 6,说明该模型的可信度为99.16%,试验模型与实际试验拟合较好,实际实验中约99.16%的结果可通过该拟合模型进行解释。校正后的决定系数R2adj为0.980 8,说明此模型有充分的准确性和通用性,可信度高,实验误差小,可用此模型对CO-CS的包封率进行分析预测。
2.2.2 响应面分析交互作用
在回归模型方差分析结果的基础上,通过Design-Expert 8.0.6软件依据回归方程式,绘制出各实验因素的响应面图及等高线图,分析药脂比、超声时间、膜材比对CO-CS包封率的影响。当固定药脂比、超声时间、膜材比三个因素中其中一个因素时,剩下的两个因素的交互作用及其对包封率的影响可用等高线和响应面图表示,响应面图和等高线图能够直观地看出显著实验因素及各实验因素之间的相互作用对响应值的影响程度,曲面越陡,等高线越密集,则该实验因素越显著,等高线越接近椭圆,则两个因素的交互作用越强[14-15]。根据CO-CS包封率的回归方程作出各实验因素的响应面图及等高线图,结果如图 2。
由图2可知,超声时间和膜材比的交互作用对脂质体包封率影响最大,药脂比和超声时间的交互作用及药脂比和膜材比的交互作用对脂质体包封率影响不显著。
图2(a)表示膜材比在中心水平时,药脂比和超声时间的交互作用对脂质体包封率的影响。如图所示,当超声时间一定时,脂质体包封率受药脂比的影响不大,随着药脂比的增大,制备的脂质体包封率先增大后减小;当药脂比一定时,超声时间对脂质体包封率的影响也不显著。
图2(b)表示超声时间在中心水平时,药脂比和膜材比的交互作用对脂质体包封率的影响。当药脂比一定时,脂质体包封率受膜材比的影响不大,随着膜材比的增加,脂质体包封率先增大后有所下降;当膜材比一定时,脂质体包封率与药脂比保持不变时有相同的变化趋势,则表示药脂比和膜材比的交互作用不显著。
图2(c)表示药脂比在中心水平时,超声时间和膜材比的交互作用对脂质体包封率的影响。在超声时间一定时,随着膜材比的增加,脂质体包封率先增大后逐渐减小;当膜材比一定时,随着超声时间的延长,脂质体包封率先增大后逐渐减小。响应面图形曲面较陡,等高线呈椭圆形且密集,表明超声时间和膜材比的交互作用极显著。
2.2.3 CO-CS优化工艺验证实验
将脂质体的包封率作为考察指标,通过软件Design-Expert 8.0.6得到CO-CS的最优制备条件为药脂比为1:16.37,超声时间为8.55 min,膜材比为4.29:1,此时得到的脂质体包封率为90.25%。根据实际操作的可能性,将最佳制备条件调整为:药脂比为1:16,超声时间8.5 min,膜材比为4.3:1,利用该条件制备CO-CS,验证包封率是否为预测的最大包封率值,进行5次重复实验,结果如表5。
据表5可知,在最优制备条件下制备的CO-CS与通过Design-Expert 8.0.6软件预测的脂质体最大包封率接近,CO-CS的平均包封率为90.73%,与理论预测值相差不大,相对标准偏差为2.29%,表明采用响应面法优化得到的CO-CS工艺可靠,具有一定的实际应用价值。
2.3 优化工艺制备的CO-CS的质量与稳定性评价结果
2.3.1 CO-CS的外观与电镜观察结果
CO-CS的外观如图3所示,外观呈乳白色的混悬液,流动性良好。图4为CO-CS的透射电镜观察结果,结果显示其为分散、单一的圆球形颗粒,无明显聚集现象,排列相对均匀,粒径在200 nm左右。
2.3.2 粒径分布及 Zeta 电位
CO-CS的粒径分布较为均匀,平均粒径为206.63 nm,电位为-34.9 mV,粒径分布及Zeta电位图见图 5。
2.3.3 储存稳定性
将制备的CO-CS放置在常温避光的储存条件下进行保存,考察其储存稳定性。在储存的第7、14、21、28及60 d后取样,测定其包封率、粒径、PDI 和Zeta 电位。
避光保存60 d后,CO-CS外观为白色溶液,色泽均匀,与刚制备的脂质体溶液外观无明显差异。在粒径、PDI、Zeta电位和包封率方面,粒径稍有增大,变化不明显;电位绝对值在30 mV以上,可认为是比较稳定的;包封率稍有下降,但都大于80% ,符合《中国药典》2020 年版要求[16],表明CO-CS避光储存60 d的稳定性较好。
3 结论与讨论
粒径大小被认为是与稳定性、生物利用度和包封率相关的一个重要因素。只有50~500 nm的颗粒才能渗透到皮肤中,较小的颗粒可以使药物更容易穿过角质层的屏障[17]。PDI 表明颗粒尺寸分布非均匀性的程度,范围为0~1.0,PDI 数值越小表明粒度分布的均匀性越高。对于脂质体纳米粒子而言,PDI 值在0~0.3,表明粒子分散均匀[18]。Zeta 电位是脂质体稳定性的属性之一,Zeta 电位是脂质体表面电荷的指标,绝对值越高,相互排斥作用越大,脂质体碰撞的频率就降低,从而体系越稳定,相对较高的 Zeta 电位对于脂质体的物理和化学稳定性非常重要。Zeta电位绝对值大于30 mV,表明脂质体具有较好的稳定性。本实验制备的CO-CS粒径为206.63 nm,PDI为0.187,Zeta 电位为-34.9 mV,可见试验所制备的脂质体符合预期要求。
本研究成功优化并建立起了一种简单高效的CO-CS制备工艺,制得脂质体粒径小、包封率高、分散性较好、较为稳定,但将其转化成产品进行实际应用时还需对其成本、货期等进行评价。目前关于CO-CS制备的文章较少,故本研究制备的CO-CS具有良好的应用推广前景,可为胶原蛋白产品进一步开发应用提供参考依据。
参考文献:
[1]GU L S, SHAN T T, MA Y X, et al. Novel biomedical applications of crosslinked collagen[J]. Trends in Biotechnology, 2019, 37(5): 464-491. DOI: 10.1016/j.tibtech.2018.10.007.
[2]AL-NIMRY S, DAYAH A A, HASAN I, et al. Cosmetic, biomedical and pharmaceutical applications of fish gelatin/hydrolysates[J]. Marine Drugs, 2021, 19(3): 145. DOI: 10.3390/md19030145.
[3]张燕. 鹿皮胶原蛋白多肽脂质体水凝胶的制备及其在小鼠光老化中的保护作用[D].长春:吉林大学, 2022.
[4]KOVCˇIK A, KOPECˇN M, VVROV K. Permeation enhancers in transdermal drug delivery: benefits and limitations[J]. Expert Opinion on Drug Delivery, 2020, 17(2): 145-155. DOI: 10.1080/17425247.2020.1713087.
[5]孙娅楠, 赵静, 李超华, 等. 二次谐波结合双光子荧光成像方法观察人源胶原蛋白透皮吸收情况[J]. 激光生物学报, 2017, 26(1): 24.
[6]SUN Y N, LI L S, MA S H, et al. In vivo visualization of collagen transdermal absorption by second-harmonic generation and two-photon excited fluorescence microscopy[J]. Frontiersin Chemistry, 2022, 10: 925931. DOI: 10.3389/fchem.2022.925931.
[7]ALBASH R, YOUSRY C, AL-MAHALLAWI A M, et al. Utilization of PEGylated cerosomes for effective topical delivery of fenticonazole nitrate: in-vitro characterization, statistical optimization, and in-vivo assessment[J]. Drug Delivery, 2021, 28(1): 1-9. DOI: 10.1080/10717544.2020.1859000.
[8]王玉真, 高爽, 孙越, 等. 菊苣酸脂质体制备工艺研究[J]. 山东科学, 2020, 33(1): 8-15. DOI: 10.3976/j.issn.1002-4026.2020.01.002.
[9]马永强, 王姿淇, 黎晨晨, 等. 番茄红素肝靶向脂质体制备工艺研究及肝靶向性评价[J]. 中国食品添加剂, 2023, 34(4): 106-115. DOI: 10.19804/j.issn1006-2513.2023.04.013.
[10]苏林豫, 朱效素, 张蓬, 等. 新型蛋白降解靶向嵌合体LC-2脂质体的制备和表征[J]. 中国医药工业杂志, 2022, 53(5): 679-687. DOI: 10.16522/j.cnki.cjph.2022.05.013.
[11]龚频, 方文静, 赵文婧, 等. 灵芝多糖脂质体制备工艺[J]. 食用菌学报, 2022, 29(5): 101-108. DOI: 10.16488/j.cnki.1005-9873.2022.05.011.
[12]CHEN W T, WU H T, CHANG I C, et al. Preparation of curcumin-loaded liposome with high bioavailability by a novel method of high pressure processing[J]. Chemistry and Physics of Lipids, 2022, 244: 105191. DOI: 10.1016/j.chemphyslip.2022.105191.
[13]张婷, 温鹤迪, 宋敬一, 等. 基于乙醇注入-高压均质的蛋清肽脂质体制备及体内外缓释效果[J]. 食品科学, 2021, 42(13): 79-86. DOI: 10.7506/spkx1002-6630-20200624-331.
[14]RAMLAN N, ZUBAIRI S I, MASKAT M Y. Response surface optimisation of polydimethylsiloxane (PDMS) on borosilicate glass and stainless steel (SS316) to increase hydrophobicity[J]. Molecules, 2022, 27(11): 3388. DOI: 10.3390/molecules27113388.
[15]马永强, 隋佳琦, 黎晨晨, 等. 响应面法优化高顺式虾青素的制备工艺研究[J]. 食品与发酵工业, 2023: 1-15.
[16]国家药典委员会. 中华人民共和国药典 四部2020年版[M]. 北京: 中国医药科技出版社, 2020.
[17]GULDIKEN B, GIBIS M, BOYACIOGLU D, et al. Physical and chemical stability of anthocyanin-rich black carrot extract-loaded liposomes during storage[J]. Food Research International, 2018, 108: 491-497. DOI: 10.1016/j.foodres.2018.03.071.
[18]ZHAO L S, TEMELLI F. Preparation of anthocyanin-loaded liposomes using an improved supercritical carbon dioxide method[J]. Innovative Food Science & Emerging Technologies, 2017, 39: 119-128. DOI: 10.1016/j.ifset.2016.11.013.
