基于高脂血症斑马鱼模型和网络药理学探讨黄鳝肽抗高脂血症的作用机制
2024-06-26马诗经何春艳关天竹姚雪霜张俊鹏
马诗经 何春艳 关天竹 姚雪霜 张俊鹏

DOI:10.3976/j.issn.1002-4026.20230120
收稿日期:2023-08-07
作者简介:马诗经(1989—),男,硕士,研究方向为健康营养品研发。E-mail:871990221@qq.com
*通信作者,何春艳(1982—),女,硕士,研究方向为健康营养品研发。E-mail:41397535@qq.com
摘要:采用高血脂症斑马鱼模型和网络药理学的方法探讨黄鳝肽抗高脂血症的物质基础及作用机制。构建高血脂斑马鱼模型及测试甘油三酯染色信号强度、胆固醇荧光强度指标,分析黄鳝肽对高血脂症的改善作用;利用BIOPEP-UWM、SwissTargetPrediction、GeneCards、STRING等数据库筛选黄鳝肽及疾病靶点,使用DAVID软件进行靶点GO功能富集分析和 KEGG 通路富集分析,并构建黄鳝肽-潜在靶点-信号通路网络和蛋白互作(PPI)网络。结果显示,质量浓度为62.5、125.0 μg/mL的黄鳝肽可显著降低高脂血症斑马鱼血管中的甘油三酯染色信号强度(p<0.01)、胆固醇荧光强度(p<0.001)。网络药理学结果显示黄鳝肽中有35个潜在活性肽段序列,通过蛋白互作分析得到21个核心靶点,GO和KEGG富集分析表明黄鳝肽主要涉及脂质代谢过程的调节等生物过程,通过调节炎症、胰岛素抵抗及脂质和动脉粥样硬化等通路发挥抗高脂血症的作用。研究结果初步证实了黄鳝肽具有抗高血脂症功效,揭示了黄鳝肽降血脂生物过程中多活性肽段、多靶点、多通路的作用特点,为进一步深入研究黄鳝肽物质基础及抗高脂血症作用与应用提供理论依据及参考。
关键词:黄鳝肽;高脂血症;斑马鱼;网络药理学;作用机制
中图分类号:R285 文献标志码:A 文章编号:1002-4026(2024)03-0027-12
开放科学(资源服务)标志码(OSID):
Exploration of antihyperlipidemia mechanism of Monopterus albus peptides
based on hyperlipidemic zebrafish model and network pharmacology
MA Shijing, HE Chunyan*, GUAN Tianzhu, YAO Xueshuang, ZHANG Junpeng
(Guangdong Archealth Health Industry Group Co., Ltd., Guangzhou 510385, China)
Abstract∶This study aimed to explore the material basis and mechanism of action of Monopterus albus peptides against hyperlipidemia using hyperlipidemic zebrafish model and network pharmacology. Analysis of the ameliorating effects of Monopterus albus peptides on hyperlipidemia was conducted by constructing a hyperlipidemic zebrafish model and measuring the dye staining signal intensity of triglyceride and cholesterol fluorescence intensity changes. Monopterus albus peptides and disease targets were filtered using BIOPEP-UWM, SwissTargetPrediction, GeneCards, STRING, and other databases. Target GO functional enrichment analysis and KEGG pathway enrichment analysis were performed using the DAVID bioinformatics software, and the Monopterus albus peptides-potential target-signaling pathway network and theprotein-protein interaction (PPI) network were constructed. The results showed that Monopterus albus peptides at mass concentrations of 62.5 μg/mL and 125.0 μg/mL significantly reduced the intensity of the triglyceride staining signal (p<0.01) and cholesterol fluorescence intensity (p<0.001) in the vasculature of hyperlipidemic zebrafish. The results of network pharmacology showed that there were 35 potentially active peptide sequences in Monopterus albus peptides, and 21 core targets were obtained by protein interaction analysis. GO and KEGG enrichment analyses indicated that Monopterus albus peptides
were mainly involved in biological processes such asregulation of lipid metabolic processes, and exertan antihyperlipidemia effect viainflammation regulation, insulin resistance, and lipid and atherosclerosis channels. Initially, this study confirmed that Monopterus albus peptides have an antihyperlipidemia effect, and revealed that Monopterus albus peptides have multiple active peptide fragments, multiple targets, and multiple channels in the biological process of reducing blood lipid levels, which will provide a theoretical basis and reference for further in-depth research on the material basis of Monopterus albus peptides and their role and application in countering hyperlipidemia.
Key words∶Monopterus albus peptides; hyperlipidemia; zebrafish; network pharmacology; mechanism of action
高脂血症(hyperlipoidemia)是指由于原发性或继发性原因导致的总胆固醇、甘油三酯水平异常升高为特征的疾病[1],也是诱发动脉粥样硬化、冠心病等心血管疾病重要的致病因素。近年来,高脂血症发病率显著提高,据《中国成人血脂异常防治指南(2016年修订版)》[2]报道,国内成人高脂血症患病率高达40. 4%,高脂血症已成为全世界范围高度关注的重要公共卫生问题之一。目前,临床用于高脂血症的药物包括他汀类、烟酸类及胆固醇吸收抑制剂等,长期使用上述药物存在肝损伤、胃痛、心律失常等不良反应[3]。基于药物的安全性问题,高脂血症的治疗干预方案或策略有待进一步研究。
黄鳝(Monopterus albus)又称为鳝鱼、田鳗、长鱼等,合鳃目合鳃科黄鳝属脊索动物。黄鳝是中国特有,盛产于湖北、江苏、浙江等地。黄鳝肉含有丰富的蛋白质、维生素等成分,具有治虚损、补中益血等药用功效[4]。近年来,研究证实了黄鳝骨硫酸软骨素多糖具有降血脂与减肥功效[5-6]。在黄鳝皮肤黏液获得的抗菌肽也证实了其可抑制微生物,同时可提高疼痛阈值及抑制溶血活性和丝氨酸蛋白酶活性[7]。目前,对于黄鳝在治疗高血脂症的作用机制研究比较欠缺。因此,本文结合高脂血症模型药效实验和网络药理学,初步探索了黄鳝肽对高血脂症的功效及相关作用机制,为深入研究黄鳝肽药效物质基础、作用机制以及在功能食品与临床应用提供理论与数据支持。
1 材料与方法
1.1 实验动物
野生型AB品系斑马鱼由杭州环特生物科技股份有限公司提供(实验动物使用许可证号为:SYXK(浙)2022-0004),在斑马鱼养殖系统中养殖,饲养符合国际实验动物评估和认可委员会认证(认证编号:001458)的要求,水温为28 ℃,pH 6.5~8.5,电导率为450~550 μS/cm,水质硬度为50~100 mg/L (以CaCO3计)。斑马鱼以自然成对交配繁殖方式获得,待受精卵孵育至受精后5 d,挑选出健康的个体进行后续实验。动物实验方案经杭州环特生物科技股份有限公司实验动物伦理委员会审查,IACUC伦理审查号为IACUC-2022-4199-01。
1.2 主要实验材料与试剂
黄鳝肽(批号20220701)由广东壹健康健康股份有限公司提供;阿托伐他汀钙片(批号202105219C)购自乐普制药科技有限公司,用二甲基亚砜配成质量浓度为11.6 mg/mL阿托伐他汀钙溶液,冷藏备用;CholesterlylBODIPYTM542/563 C11胆固醇探针(批号2291600),美国Invitrogen公司;纯蛋黄粉(批号20200809),浙江艾格生物科技股份有限公司,用养鱼水配成质量分数为0.15%高脂饲料;葡萄糖(批号L2108079)、甲基纤维素(批号C2004046),上海阿拉丁生化科技股份有限公司,用养鱼水配成葡萄糖质量分数为3%的高糖饲料;二甲基亚砜(DMSO,批号BCCD8942)、油红O(Oil Red O,批号SHBN4926),Sigma公司;4%组织细胞固定液(批号20210828),北京索莱宝有限公司;1,2-丙二醇(批号20211117),国药集团化学试剂有限公司。
1.3 实验仪器
SZX7解剖显微镜,日本OLYMPUS公司;VertA1CCD相机,上海土森视觉科技有限公司;IM300显微注射仪,PC-10拉针仪,日本Narishige公司;CP214精密电子天平,美国OHAUS公司;AZ100电动聚焦连续变倍荧光显微镜,日本Nikon公司。
1.4 实验方法
1.4.1 黄鳝肽最大耐受浓度测定
随机选取受精后2 d的黑色素等位基因突变型Albino品系斑马鱼,分别设正常对照组、黄鳝肽组(质量浓度为62.5、125、250、500、1 000 μg/mL,溶剂为水)共6个实验组。每实验组为一孔,每孔(实验组)放置斑马鱼30尾。每孔(实验组)容量为3 mL,28 ℃处理96 h,分别观察和记录斑马鱼在受试物溶液中的毒性表型和死亡情况,测定实验条件下不同质量浓度的黄鳝肽对斑马鱼的最大耐受浓度。
1.4.2 黄鳝肽辅助降甘油三酯的作用研究
取受精后5天的斑马鱼放置测试烧杯中,采用高脂高糖饲料喂饲斑马鱼,每天喂食8 h,建立高脂血症模型[8]。随机选取高脂血症模型斑马鱼置于六孔板中,每孔(实验组)3 mL,每孔处理斑马鱼30尾,分别设置模型对照组(model)、阳性对照组(阿托伐他汀钙,质量浓度为11.6 μg/mL)、黄鳝肽低剂量组(HSP-L,质量浓度为31.2 μg/mL)、黄鳝肽中剂量组(HSP-M,质量浓度为62.5 μg/mL)、黄鳝肽高剂量组(HSP-H,质量浓度为125 μg/mL)。同时设置正常对照组(control)斑马鱼30尾,给予养鱼用水。各实验组28 ℃处理2 d后将斑马鱼取出,使用0.3%油红O进行染色。脱色结束后,每孔(实验组)随机选取10尾斑马鱼,置于解剖显微镜下拍照及采集图片数据,以斑马鱼尾部血管染色强度为指标,统计分析黄鳝肽降甘油三酯的作用,并计算黄鳝肽对甘油三酯的抑制率:
甘油三酯抑制率=Q受试组-Q模型对照组Q模型对照组×100%,(1)
其中Q表示染色强度。
1.4.3 黄鳝肽辅助降胆固醇的作用研究
取受精后5 d的斑马鱼放置测试烧杯中,采用高脂高糖饲料喂饲斑马鱼,每天喂食8 h,建立高脂血症模型[8]。随机选取高脂血症模型斑马鱼置于六孔板中,每孔(实验组)3 mL,每孔处理斑马鱼30尾,分别设置模型对照组、阳性对照组(阿托伐他汀钙,质量浓度为11.6 μg/mL)、黄鳝肽低剂量组(质量浓度为31.2 μg/mL)、黄鳝肽中剂量组(质量浓度为62.5 μg/mL)、黄鳝肽高剂量组(质量浓度为125 μg/mL)。另取30尾斑马鱼,给予养鱼用水,作为正常对照组(control)。各实验组28 ℃处理1 d后将斑马鱼取出,注射胆固醇探针,继续处理1 d后,各实验组随机选取10尾斑马鱼,置于荧光显微镜下拍照及采集图片数据,以斑马鱼尾部血管胆固醇荧光强度为指标,统计分析黄鳝肽降胆固醇的作用,并计算黄鳝肽对胆固醇的抑制率:
黄鳝肽对胆固醇的抑制率=Q受试组-Q模型对照组Q模型对照组×100%,(2)
其中Q表示荧光强度。
1.5 网络药理学研究
1.5.1 所用数据库及分析软件
本文网络药理学研究部分所用的数据库及软件平台包括SwissTargetPrediction数据库(http://www. swisstargetprediction. ch/);PeptideRanker 数据库(http://distilldeep.ucd.ie/PeptideRanker/);BIOPEP-UWM 数据库(https://biochemia.uwm.edu.pl/biopep-uwm/);SwissADME数据库(http://www.swissadme.ch/);GeneCards 数据库(https://www.genecards.org/);STRING数据库(https://stringdb. org/);DAVID数据库(https://david.ncifcrf.gov/);Venny 2.1.0 平台(https://bioinfogp.cnb.csic.es/tools/venny/index. html);微生信平台(http://www.bioinformatics.com.cn/);Cytoscape 3.7.1软件。
1.5.2 黄鳝肽潜在活性肽段序列筛选
通过PeptideRanker数据库对黄鳝肽(Monopterus albus peptides,记为HSP)测试所得的肽段序列进行生物活性打分,筛选评分大于0.8的肽段序列,使用BIOPEP-UWM 数据库获得肽段序列的标准SMILE号,在SwissADME 网站中预测肽段的ADME性质,以血脑屏障透过性、疏水常数、生物可用性评分为指标,筛选潜在活性肽段序列。
1.5.3 黄鳝肽活性肽段序列靶点预测及高脂血症靶点筛选
将黄鳝肽有效肽段序列通过Swiss Target Prediction数据库,检索收集肽段序列所对应的靶点,剔除无法查询 SMILES 号的肽段序列及重复靶点,选取 Probability*≥0.1的活性靶点,合并所有肽段序列的有效靶点,待下一步分析。以“hyperlipidemia”为关键词,通过GeneCards在线数据库收集高脂血症相关疾病靶点。
1.5.4 核心靶点与蛋白质相互作用分析
使用 Veney 2.1.0在线工具将黄鳝肽有效肽段序列的靶点与疾病靶点进行交集处理,得出黄鳝肽的潜在活性肽段序列缓解高脂血症的潜在作用靶点,绘制韦恩图。通过STRING 数据库对获得的潜在作用靶点构建PPI 网络,将核心靶点TSV格式文件输入Cytoscape 3.7.1软件对PPI网络进行可视化。采用centiscape 2.2插件计算网络节点的Betweenness、Closenes、Degree值,以此为指标筛选出 PPI 网络中黄鳝肽肽段序列与高脂血症相关的核心靶点基因。
1.5.5 GO和KEGG功能富集分析
将筛选得到的核心靶点输入DAVID数据库,物种设置为“Homo sapiens”,对黄鳝肽有效肽段序列改善高脂血症的潜在靶点进行GO功能分析和 KEGG通路富集分析。根据P值升序排列,分别选取GO 分析中生物过程(biological process)、分子功能(molecular function)和细胞成分(cellular component)生物进程参数的前10条,通过微生信在线工具绘制柱状图,进行下一步分析。根据P值升序排列,选取P值前20条通路绘制 KEGG 通路富集分析,以阐述黄鳝肽发挥治疗高脂血症作用的生物过程、细胞成分、分子功能,以及黄鳝肽作用于高脂血症的信号通路。
1.5.6 黄鳝肽肽段序列-疾病靶点-信号通路网络图的构建
采用Cytoscape 3.7.1软件将黄鳝肽有效肽段、潜在作用靶点、信号通路及其靶点进行绘图,构建黄鳝肽-疾病靶点-信号通路图,进行网络可视化分析。
1.6 数据统计与分析
统计学处理结果采用均值±标准误差表示,用SPSS 26.0软件进行统计学分析,p< 0.05表明差异具有统计学意义。
2 结果与讨论
2.1 黄鳝肽最大耐受质量浓度与测试质量浓度确定
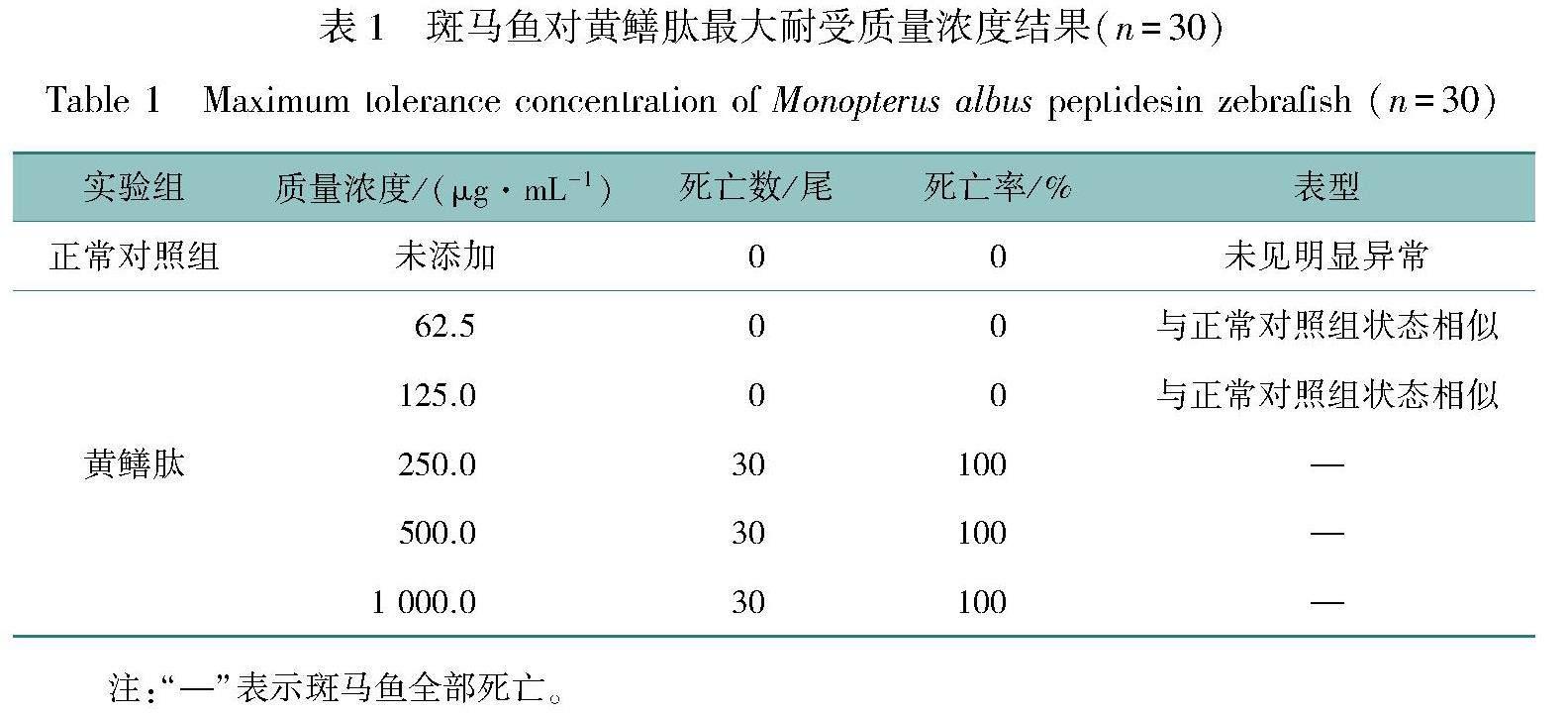
斑马鱼对黄鳝肽的最大耐受质量浓度结果见表1,结果显示:质量浓度为62.5、125.0 μg/mL黄鳝肽不诱发斑马鱼死亡和毒性表型,与正常对照组斑马鱼状态相似。在添加质量浓度≥250 μg/mL时,斑马鱼全部死亡,说明在本实验条件下斑马鱼对黄鳝肽的最大耐受质量浓度为125 μg/mL,后续将采用质量浓度为31.2、62.5、125.0 μg/mL 的黄鳝肽进行实验。
2.2 黄鳝肽对高脂血症斑马鱼甘油三酯的影响
黄鳝肽对高脂血症斑马鱼甘油三酯的测试结果见表2、图1,结果显示:与正常对照组相比,模型对照组斑马鱼尾部血管甘油三酯染色强度为13 464像素,极显著高于正常对照组(p<0.001),说明模型造模成功。与模型对照组相比,阿托伐他汀钙组斑马鱼甘油三酯染色强度显著降低(p<0.01),经计算其辅助降甘油三酯功效为69.9%。黄鳝肽质量浓度为62.5、125.0 μg/mL时,对应斑马鱼尾部血管甘油三酯染色强度分别为6 915、7 351像素,极显著低于模型对照组(p<0.001),上述质量浓度黄鳝肽对甘油三酯的抑制率分别为48.6%、45.4%,说明黄鳝肽具有显著降低高脂血症斑马鱼甘油三酯含量的功效。
2.3 黄鳝肽对高脂血症斑马鱼胆固醇的影响
黄鳝肽对高脂血症斑马鱼胆固醇的影响结果见表3、图2,结果显示:与正常对照组相比,模型对照组斑马鱼尾部血管胆固醇荧光强度显著增强(p<0.001),说明了高脂高糖饲料造成了斑马鱼胆固醇含量显著升高。与模型对照组相比,阿托伐他汀钙组斑马鱼尾部血管胆固醇荧光强度为33 087像素(p<0.01),对胆固醇的抑制率为30.4%。质量浓度为31.2、62.5、125.0 μg/mL黄鳝肽处理高脂血症斑马鱼后的尾部血管胆固醇荧光强度分别为35 188、29 848及28 914像素,与模型对照组比较p<0.05及p<0.001,抑制胆固醇功效分别为26.0%、37.2%、39.2%,并且在62.5、125.0 μg/mL质量浓度对胆固醇抑制效果优于阳性对照组,说明在本实验质量浓度条件下,黄鳝肽具有降低高脂血症斑马鱼胆固醇含量的功效。
2.4 黄鳝肽潜在活性肽段序列筛选
本研究所用黄鳝肽通过第三方检测机构测试,获得了442个黄鳝肽的肽段序列,使用 PeptideRanker数据库进行生物活性打分,获得241个有效多肽片段,设置Score≥0.8,获得符合要求的54个肽段序列,将筛选得到的肽段序列输入BIOPEP-UWM数据库,获得了54个肽段序列的SMILE。按不具有血脑屏障透过性(BBB permeant)、MLOGP≤0.5、Bioavailability Score≥0.10指标,筛选得到35个潜在活性肽段序列见表4。
2.5 黄鳝肽与高脂血症疾病靶点筛选分析
将表4所得35个黄鳝肽潜在活性肽段序列在SwissTargetPrediction数据库检索分析,获得对应的潜在作用靶点有254个。以“hyperlipidemia”为关键词,在GeneCards数据库检索获得高脂血症相关疾病靶点基因,经去重后获得高脂血症靶点基因共2 133个。
2.6 黄鳝肽核心靶点与蛋白质相互作用分析
将黄鳝肽肽段序列的潜在作用靶点与高脂血症(hyperlipidemia)疾病靶点输入Venny 2.1.0平台构建交集靶点韦恩图(见图3),共获得82个交集靶点。进一步在STRING数据库对交集靶点分析,获得交集靶点的PPI网络图,见OSID科学数据与内容附图4,包含82个节点,623条边。将交集靶点导出TSV文件,导入Cytoscape 3.7.1软件进行处理分析,采用Centiscape 2.2插件计算PPI网络节点的Betweenness、Closenes、Degree值,构建核心靶点的蛋白相互作用PPI网络,见OSID科学数据与内容附图5。以节点度值的阈值≥15.38筛选,获得21个核心靶点(见表5),包括TNF、EGFR、PPARA、ACE、REN、F2、APP、CCND1、HSP90AA1、MMP9等,在PPI网络中排序靠前,靶点蛋白的节点越大、颜色越深,说明相互作用越强。研究表明,肿瘤坏死因子(TNF,以TNF-α为主)家族蛋白表达水平可作为高脂血症及其相关疾病发程度的重要考察指标[9]。表皮生长因子受体(EGFR)被证实可抑制合成胆固醇,增强脂肪酸氧化进而减少脂肪积累及肝损伤,可能成为治疗血脂异常潜在作用靶点[10]。PPARA即过氧化物酶体增殖物激活受体-α对脂质调节、胆固醇稳态及高密度脂蛋白合成有着重要的影响[11]。血管紧张素Ⅰ转换酶(ACE)在动脉粥样硬化斑块的内皮细胞、平滑肌细胞和巨噬细胞中有大量表达,说明 ACE 可能成为抗动脉粥样硬化的重要因素之一[12]。金属基质蛋白酶-9(MMP9)可调节血脂且可作为高脂血症患者血清的重要指标之一[13]。上述核心靶点可能与黄鳝肽发挥降血脂作用的关系密切。
2.7 GO和KEGG富集分析
对核心靶点进行富集分析,以进一步阐明核心靶点的潜在作用,将核心靶点导入DAVID在线数据库,以通路中的基因数(count)和P值为条件进行生物过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)的GO功能富集分析,图4展示了每部分前10个 GO 条目的富集情况,其中圆圈大小表示基因富集数量,颜色代表基因P值大小。由结果可知,生物进程(BP)主要富集在凋亡过程的正调节(positive regulation of apoptotic process)、对外来生物刺激的反应(response to xenobiotic stimulus)、蛋白磷酸化的正调节(positive regulation of protein phosphorylation)、肽基丝氨酸磷酸化的正调节(positive regulation of peptidyl-serine phosphorylation)、蛋白水解作用(proteolysis)等;细胞组分(CC)主要富集在细胞外区(extracellular region)、细胞外空间(extracellular space)、细胞膜筏(membrane raft)、细胞表面(cell surface)、高分子复合物(macromolecular complex)等;分子功能(MF)主要富集在酶结合(enzyme binding)、肽酶活性(peptidase activity)、蛋白酶活性(protease binding)、丝氨酸型内肽酶活性(serine-type endopeptidase activity)、受体结合(receptor binding)等。通过GO富集分析发现,黄鳝肽活性肽段抗高脂血症的核心靶点主要参与细胞组成、信号调控以及蛋白结合等生命进程,进而发挥降血脂功效。
为阐明黄鳝肽降血脂的作用机制,将核心靶点KEGG 信号通路注释分析,按P值由小到大进行排序,共富集到94条相关信号通路,其中85条信号通路具有显著意义(p<0.05)。图5展示了前20条KEGG 条目的富集情况,包括癌症通路(pathways in cancer)、IL-17 信号通路(IL-17 signaling pathway)、胰岛素抵抗(endocrine resistance)、AGE-RAGE 信号通路(AGE-RAGE signaling pathway)、TNF 信号通路(TNF signaling pathway)及脂质和动脉粥样硬化(lipid and atherosclerosis)等,上述KEGG通路主要富集了PIK3CA、MAPK8、FOS、MMP9、CASP3、TNF、EGFR、CCND1、MMP2、HSP90AA1等多个关键靶点基因(图6),也说明了机体的高脂血症状态由多通路、多靶点调控。研究表明,TNF信号通路中TNF-α可抑制脂肪形成和分化,促进脂质分解并导致游离脂肪酸升高,进而抑制胰岛素信号通路[14]。TNF信号通路和IL-17 信号通路是促发炎症的关键信号通路,通过产生IL-17 的细胞介导高脂血症、动脉粥样硬化和免疫应答的交联[15-16]。脂血症、糖尿病等疾病与AGE-RAGE通路中的高晚期糖基化终末产物(AGEs)密切相关,高血脂可促进AGE受体的表达[17-18],并激活NF-κB信号通路,促进下游促炎性细胞因子(如IL-6)的过度表达。发生胰岛素抵抗时,促使脂肪细胞释放大量的游离脂肪酸进入血液循环,致使游离脂肪酸水平升高,从而导致肝脏中甘油三酯(TG)水平升高[19]。此外,脂质过度沉积可使脂质代谢异常,同时巨噬细胞吞噬沉积的脂质形成泡沫细胞,加剧高脂血症诱发动脉粥样硬化[20-21]。
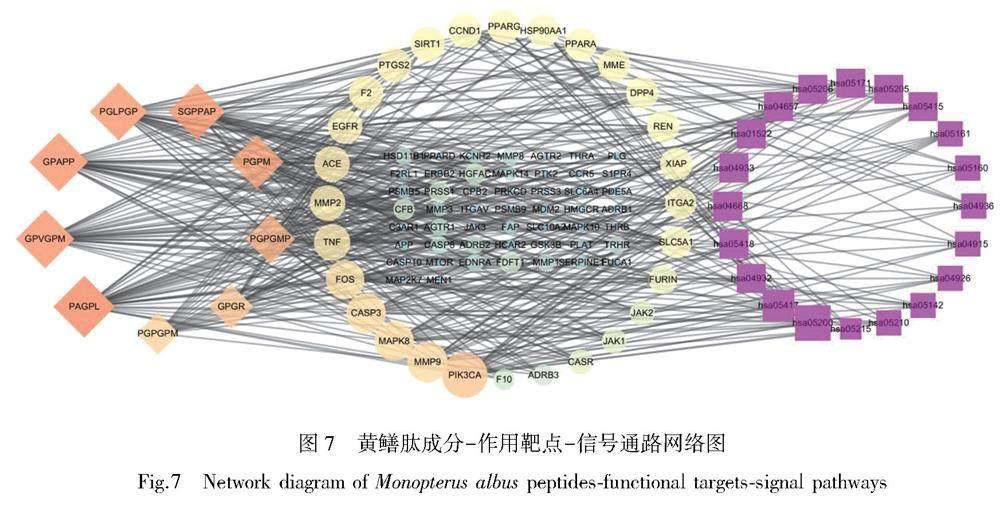
2.8 黄鳝肽成分-作用靶点-信号通路网络图构建分析
图7为探讨黄鳝肽降血脂的有效肽段、疾病靶点与信号通路三者之间的相互关系,采用Cytoscape 3.7.1构建黄鳝肽降血脂潜在活性肽段-作用靶点-通路网络,其中图中菱形为黄鳝肽有效肽段序列,成分作用与图形颜色呈正比关系;圆形为作用靶点,颜色越深即说明靶点交集越多;紫红色方形为信号通路,形状越大,信号通路作用越强。由图结果可知,黄鳝肽以PAGPL、GPAPP、GPVGPM、PGLPGP、SGPPAP、PGPM、PGPGMP、GPGR、PGPGPM为主要活性肽段序列,与PIK3CA、MMP9、MAPK8、CASP3、FOS、TNF、MMP2、ACE、EGFR等关键靶点及信号通路存在多重交互作用。因此,黄鳝肽可能通过多靶点调节细胞间信号、脂质代谢及特异性结合等信号表达,发挥防治高脂血症的作用。
3 结论
本研究通过体内斑马鱼模型实验、网络药理学探讨了黄鳝肽降血脂功效以及其活性肽段序列对高脂血症的作用机制。实验结果表明黄鳝肽在62.5~125 μg/mL浓度范围可显著降低高脂血症斑马鱼中血管的甘油三酯、胆固醇含量,初步证实黄鳝肽具有良好的降血脂作用。网络药理学分析结果表明,黄鳝肽中具有35个潜在活性肽段序列,其降血脂的核心靶点主要涉及细胞组成、细胞间信号调控和分子间蛋白结合等生命进程,并通过IL-17 信号通路、胰岛素抵抗、AGE-RAGE 信号通路、TNF 信号通路及脂质和动脉粥样硬化等信号通路调节高血脂症。综上所述,黄鳝肽可能通过多肽段序列、多靶点、多通路影响细胞凋亡、脂质合成与代谢、炎症以及癌症的产生等维度协同发挥降血脂作用。后续仍需分离纯化得到具体活性肽段序列的黄鳝肽成分,通过动物实验对网络药理学中预测的核心靶点、通路等结果进行验证,为黄鳝肽在生物医药、营养健康食品领域应用提供数据支持。
参考文献:
[1]CHEN H, MIAO H, FENG Y L, et al. Metabolomics in dyslipidemia[J]. Advances in Clinical Chemistry, 2014, (66):101-119.
[2]诸骏仁, 高润霖, 赵水平, 等. 中国成人血脂异常防治指南(2016年修订版)[J]. 中国循环杂志, 2016, 31(10): 937-953.
[3]吴敏, 冯玲, 沈冬. 高脂血症药物治疗研究进展[J]. 中国临床医生, 2012, 40(3): 35-37.
[4]韩林, 丁博, 王兆丹, 等. 黄鳝肉双酶水解产物的功能特性及其抗氧化活性[J]. 食品与发酵工业, 2014, 40(10): 151-155. DOI: 10.13995/j.cnki.11-1802/ts.2014.10.065.
[5]姚晓燕. 黄鳝骨硫酸软骨素多糖降血脂功能研究[J]. 中国医药导报, 2011, 8(30): 31-33. DOI: 10.3969/j.issn.1673-7210.2011.30.014.
[6]关天竹, 何春艳, 王涛, 等. 基于斑马鱼模型的黄鳝肽减肥作用研究[J]. 食品安全导刊, 2022, (33): 95-98. DOI: 10.16043/j.cnki.cfs.2022.33.020.
[7]李联泰, 安贤惠, 胡江, 等. 黄鳝皮肤黏液抗菌肽的分离纯化及其部分特性研究[J]. 渔业科学进展, 2011, 32(2): 27-33. DOI: 10.3969/j.issn.1000-7075.2011.02.005.
[8]李心怡, 陈荷清, 夏欢, 等. 蜂胶降脂方对高脂血症模型斑马鱼的降血脂作用研究[J]. 世界科学技术—中医药现代化, 2020, 22(5): 1629-1635.
[9]黄帅, 成鹏, 杨宇, 等. 基于网络药理学探究蒲参胶囊治疗高脂血症的作用机制[J]. 南京中医药大学学报, 2019, 35(3): 290-296. DOI: 10.14148/j.issn.1672-0482.2019.0290.
[10]CHOUNG S, KIM J M, JOUNG K H, et al. Epidermal growth factor receptor inhibition attenuates non-alcoholic fatty liver disease in diet-induced obese mice[J]. PLoS One. 2019, 14(2): e0210828. DOI: 10.1371/journal.pone.0210828.
[11]钟华, 仇静文, 吴鸿飞, 等. 基于网络药理学研究瓜蒌—薤白药对抗高脂血症作用机制[J]. 中国实验方剂学杂志, 2020, 26(18): 154-165. DOI: 10.13422/j.cnki.syfjx.20201603.
[12]OKWAN-DUODU D, WEISS D, PENG Z, et al. Overexpression of myeloid angiotensin-converting enzyme (ACE) reduces atherosclerosis[J]. Biochemical and Biophysical Research Communications,2019, 520(3): 573-579. DOI: 10.1016/j.bbrc.2019.10.078.
[13]邹振武, 李德忠, 彭绪东, 等. 单味中药鬼针草颗粒治疗高脂血症的疗效及其对血清MMP-9、TIMP-1水平的影响[J]. 心血管康复医学杂志, 2019, 28(5): 661-665. DOI: 10.3969/j.issn.1008-0074.2019.05.25.
[14]YAN H, WANG J, FU H, et al. Discussion on the potential target and mechanism of Dachaihu Decoction in treating hyperlipidemia based on network pharmacology[J]. Journal of Chinese Pharmaceutical Sciences, 2023, 32(6): 446-459.
[15]KIMY U, KEE P, DANILA D, et al. A critical role of PCSK9 in mediating IL-17-producing T cell responses in hyperlipidemia[J]. Immune Network, 2019, 19(6): e41. DOI: 10.4110/in.2019.19.e41.
[16]HE Y H, YANG G D, SUN L J, et al. SIRT6 inhibits inflammatory response through regulation of NRF2 in vascular endothelial cells[J]. International Immunopharmacology, 2021, 99: 107926. DOI: 10.1016/j.intimp.2021.107926.
[17]UEKITA H, ISHIBASHI T, SHIOMI M, et al. Integral role of receptor for advanced glycation end products (RAGE) in nondiabetic atherosclerosis[J]. Fukushima Journal of Medical Science, 2019, 65(3): 109-121. DOI: 10.5387/fms.2019-12.
[18]YE J H, LI L, HU Z X. Exploring the molecular mechanism of action of Yinchen Wuling Powder for the treatment of hyperlipidemia, using network pharmacology, molecular docking, and molecular dynamics simulation[J]. BioMed Research International, 2021, 2021: 1-14. DOI: 10.1155/2021/9965906.
[19]柴露露. 银杏叶制剂治疗高脂血症的疗效及作用机制研究[D]. 北京: 中国中医科学院, 2019.
[20]李文毅, 周春阳. 高脂血症与动脉粥样硬化和脂代谢研究进展[J]. 中国药理学与毒理学杂志, 2019, 33(10): 811.
[21]WU X Z, PAN J X, YU J, et al. DiDang decoction improves mitochondrial function and lipid metabolism via the HIF-1 signaling pathway to treat atherosclerosis and hyperlipidemia[J]. Journal of Ethnopharmacology, 2023, 308: 116289. DOI: 10.1016/j.jep.2023.116289.
